ХАООС Лекция 9.ppt
- Количество слайдов: 25
 Лекция № 9 Анализ компонентов почвы
Лекция № 9 Анализ компонентов почвы
 Почва, ее строение, виды Почва — поверхностный слой Земли, обладающий плодородием. Почва является полифункциональной четырёхфазной системой, образовавшейся в результате выветривания горных пород и жизнедеятельности организмов. Твердые частицы почвы: -минеральные частицы больших размеров(от камней до мелких песчинок); -чрезвычайно мелкие, пылеобразные частицы; -гумусовые вещества, образуются при распаде мертвых органических тел. Придают почве черную или бурую окраску. Скелет почвы - часть почвы, не проходящая через сетку с отверстиями 0, 3 мм(грубый песок, гравий, камни), остальные частицы называются мелкоземом. Смешение составных частей почвы, их относительные количественные отношения бывают весьма различны. Частицы почвы оставляют между собой небольшие пустые пространства(поры). Сумма таких незаполненных частицами пространств называется поровым объемом.
Почва, ее строение, виды Почва — поверхностный слой Земли, обладающий плодородием. Почва является полифункциональной четырёхфазной системой, образовавшейся в результате выветривания горных пород и жизнедеятельности организмов. Твердые частицы почвы: -минеральные частицы больших размеров(от камней до мелких песчинок); -чрезвычайно мелкие, пылеобразные частицы; -гумусовые вещества, образуются при распаде мертвых органических тел. Придают почве черную или бурую окраску. Скелет почвы - часть почвы, не проходящая через сетку с отверстиями 0, 3 мм(грубый песок, гравий, камни), остальные частицы называются мелкоземом. Смешение составных частей почвы, их относительные количественные отношения бывают весьма различны. Частицы почвы оставляют между собой небольшие пустые пространства(поры). Сумма таких незаполненных частицами пространств называется поровым объемом.
 Связность почвы - свойство сопротивляться внешним силам, направленным на механическое разъединение, разрыв или сжатие почвенной массы. Зависит от гранулометрического состава и влажности почвы. Чем больше в ней глинистых частиц, тем выше связность. 1)каменистая почва - состоит из горных пород (гранит, гнейс, известняк, доломит, песчаник и др. 2)песчаная почва - состоит из различных минералов: кварца, роговой обманки, полевого шпата, слюды, извести; 3)известковая почва – состоит из зерен углекислой извести(мергель). Содержит 8 -45% извести, известковый мергель 75% извести; 4)солончаковая почва - в верхних горизонтах присутствует легкорастворимые соли, 1 -15%. При высыхании на поверхности образуются солевые выцветы и корки. 5)глинистая почва обладает большой поглотительной способностью и гигроскопичностью(5 -6%водяных паров). Плотная, тяжелая, почти водонепроницаема, пластична. Неблагоприятные свойства можно устранить добавляя известь или песок.
Связность почвы - свойство сопротивляться внешним силам, направленным на механическое разъединение, разрыв или сжатие почвенной массы. Зависит от гранулометрического состава и влажности почвы. Чем больше в ней глинистых частиц, тем выше связность. 1)каменистая почва - состоит из горных пород (гранит, гнейс, известняк, доломит, песчаник и др. 2)песчаная почва - состоит из различных минералов: кварца, роговой обманки, полевого шпата, слюды, извести; 3)известковая почва – состоит из зерен углекислой извести(мергель). Содержит 8 -45% извести, известковый мергель 75% извести; 4)солончаковая почва - в верхних горизонтах присутствует легкорастворимые соли, 1 -15%. При высыхании на поверхности образуются солевые выцветы и корки. 5)глинистая почва обладает большой поглотительной способностью и гигроскопичностью(5 -6%водяных паров). Плотная, тяжелая, почти водонепроницаема, пластична. Неблагоприятные свойства можно устранить добавляя известь или песок.

 Химический состав почв Элементный состав - набор и количественное соотношение химических элементов в почве. Любые почвы содержат 92 химических элемента, в случае загрязнения также трансурановые элементы. Диапазон концентраций: 10 -10 -1012%. Часть элементов участвует в формировании почвенной массы (макроэлементы: фосфор, азот, калий, углерод), часть выступает как стимулятор физиологических и биохимических процессов (микроэлементы: бор, молибден, марганец, медь, цинк, кобальт, никель, железо, сера). Химические элементы в почвах представлены большим набором их соединений. Разнообразие соединений любого из элементов обеспечивает сравнительную устойчивость химического состояния почв. Группы органических соединений подразделяются на фракции по характеру связи с минеральными соединениями(н-р: гуминовые кислоты свободные, связанные с кальцием и железом, алюмосиликатами). Буферность почв - способность поддерживать постоянным состав почвенного раствора. Если в почвенный раствор попадают какие-либо твердые соединения, то твердые фазы почв связывают такие вещества, поддерживая постоянство состава почвенного раствора. Химическое разнообразие делает почву устойчивой в изменяющихся условиях природной среды или антропогенной деятельности.
Химический состав почв Элементный состав - набор и количественное соотношение химических элементов в почве. Любые почвы содержат 92 химических элемента, в случае загрязнения также трансурановые элементы. Диапазон концентраций: 10 -10 -1012%. Часть элементов участвует в формировании почвенной массы (макроэлементы: фосфор, азот, калий, углерод), часть выступает как стимулятор физиологических и биохимических процессов (микроэлементы: бор, молибден, марганец, медь, цинк, кобальт, никель, железо, сера). Химические элементы в почвах представлены большим набором их соединений. Разнообразие соединений любого из элементов обеспечивает сравнительную устойчивость химического состояния почв. Группы органических соединений подразделяются на фракции по характеру связи с минеральными соединениями(н-р: гуминовые кислоты свободные, связанные с кальцием и железом, алюмосиликатами). Буферность почв - способность поддерживать постоянным состав почвенного раствора. Если в почвенный раствор попадают какие-либо твердые соединения, то твердые фазы почв связывают такие вещества, поддерживая постоянство состава почвенного раствора. Химическое разнообразие делает почву устойчивой в изменяющихся условиях природной среды или антропогенной деятельности.
 Основные элементы почв и их соединения Название элемента Вид соединений в почве фосфор ортофосфаты, соединения с кальцием, магнием, цинком, железом, свинцом, алюминием. железо различные гидроксиды, гётит(Fe. OOH), гематит(Fe 2 O 3). кремний Si. O 2, кремневая кислота(H 4 Si. O 4) и ее полимерные формы, минералы группы алюмосиликатов (полевые шпаты, глинистые минералы и слюды). углерод СО 2, Н 2 СО 3, Са. СО 3, Na 2 CO 3, CH 4, аминокислоты, моносахариды, целлюлоза, лигнин, полипептиды.
Основные элементы почв и их соединения Название элемента Вид соединений в почве фосфор ортофосфаты, соединения с кальцием, магнием, цинком, железом, свинцом, алюминием. железо различные гидроксиды, гётит(Fe. OOH), гематит(Fe 2 O 3). кремний Si. O 2, кремневая кислота(H 4 Si. O 4) и ее полимерные формы, минералы группы алюмосиликатов (полевые шпаты, глинистые минералы и слюды). углерод СО 2, Н 2 СО 3, Са. СО 3, Na 2 CO 3, CH 4, аминокислоты, моносахариды, целлюлоза, лигнин, полипептиды.
 Особенности почвы как объекта химического исследования и показатели химического состояния почв Показатели химического анализа почв: 1) массовая доля гумуса в почве; 2) р. Н водной или солевой почвенных суспензий; 3) массовая доля подвижных соединений химических элементов в почве. Особенности почвы как химической системы: гетерогенность; полихимизм; дисперсность; неоднородность; изменение и динамика свойств; буферность.
Особенности почвы как объекта химического исследования и показатели химического состояния почв Показатели химического анализа почв: 1) массовая доля гумуса в почве; 2) р. Н водной или солевой почвенных суспензий; 3) массовая доля подвижных соединений химических элементов в почве. Особенности почвы как химической системы: гетерогенность; полихимизм; дисперсность; неоднородность; изменение и динамика свойств; буферность.
 Особенности почвы как химической системы Полихимизм почв: В почвах один и тот же химический элемент может входить в состав разнообразных соединений: легкорастворимых солей, сложных алюмосиликатов, органоминеральных веществ. Эти компоненты обладают разными свойствами, от которых, в частности, зависит способность химического элемента переходить из твердых фаз почвы в жидкую, мигрировать в профиле почвы и в ландшафте, потребляться растениями и т. п. Поэтому в химическом анализе почв определяют не только общее содержание химических элементов, но и показатели, характеризующие состав и содержание индивидуальных химических соединений или групп соединений, обладающих близкими свойствами. Гетерогенность: в составе почвы выделяют твердую, жидкую, газовую фазы. При исследовании химического состояния почвы и отдельных ее компонентов определяют показатели, характеризующие не только почву в целом, но и ее отдельные фазы.
Особенности почвы как химической системы Полихимизм почв: В почвах один и тот же химический элемент может входить в состав разнообразных соединений: легкорастворимых солей, сложных алюмосиликатов, органоминеральных веществ. Эти компоненты обладают разными свойствами, от которых, в частности, зависит способность химического элемента переходить из твердых фаз почвы в жидкую, мигрировать в профиле почвы и в ландшафте, потребляться растениями и т. п. Поэтому в химическом анализе почв определяют не только общее содержание химических элементов, но и показатели, характеризующие состав и содержание индивидуальных химических соединений или групп соединений, обладающих близкими свойствами. Гетерогенность: в составе почвы выделяют твердую, жидкую, газовую фазы. При исследовании химического состояния почвы и отдельных ее компонентов определяют показатели, характеризующие не только почву в целом, но и ее отдельные фазы.
 Полидисперсность почв: твердые фазы почвы состоят из частиц разного размера от крупинок песка до коллоидных частиц диаметром в несколько микрометров. Они неодинаковы по составу и обладают разными свойствами. При специальных исследованиях генезиса почв определяют показатели химического состава и других свойств отдельных гранулометрических фракций. С дисперсностью почв связана их способность к ионному обмену, которая в свою очередь характеризуется специфическим набором показателей: емкостью катионного и анионного обмена, составом обменных катионов и пр. От уровней этих показателей зависят многие химические и физические свойства почв. Кислотно-основные и окислительно-восстановительные свойства почв: в состав почв входят компоненты, проявляющие свойства кислот и оснований, окислителей и восстановителей. При решении разнообразных теоретических и прикладных проблем почвоведения, агрохимии, мелиорации определяют показатели, характеризующие кислотность и щелочность почв, их окислительно-восстановительное состояние.
Полидисперсность почв: твердые фазы почвы состоят из частиц разного размера от крупинок песка до коллоидных частиц диаметром в несколько микрометров. Они неодинаковы по составу и обладают разными свойствами. При специальных исследованиях генезиса почв определяют показатели химического состава и других свойств отдельных гранулометрических фракций. С дисперсностью почв связана их способность к ионному обмену, которая в свою очередь характеризуется специфическим набором показателей: емкостью катионного и анионного обмена, составом обменных катионов и пр. От уровней этих показателей зависят многие химические и физические свойства почв. Кислотно-основные и окислительно-восстановительные свойства почв: в состав почв входят компоненты, проявляющие свойства кислот и оснований, окислителей и восстановителей. При решении разнообразных теоретических и прикладных проблем почвоведения, агрохимии, мелиорации определяют показатели, характеризующие кислотность и щелочность почв, их окислительно-восстановительное состояние.
 Неоднородность, вариабельность, динамика, буферность химических свойств почв. Свойства почв неодинаковы даже в пределах одного и того же генетического горизонта. При исследовании процессов формирования почвенного профиля оценивают химические свойства отдельных элементов организации почвенной массы. Разнокачественностъ состава почв: разные типы и даже виды и разновидности почв могут иметь столь разные свойства, что для их химической характеристики используют не только разные аналитические приемы, но и разные наборы показателей. Например, в подзолистых, дерново-подзолистых, серых лесных почвах, как правило, определяют р. Н водных и солевых суспензий, обменную и гидролитическую кислотность, обменные основания вытесняют из почв водными растворами солей. В то же время при анализе засоленных почв определяют р. Н только водных суспензий, а вместо показателей кислотности - общую, карбонатную и другие виды щелочности. Перечисленные особенности почв во многом обусловливают принципиальные основы методов исследования химического состояния почв, номенклатуру и классификацию показателей химических свойств почв и химических почвенных процессов.
Неоднородность, вариабельность, динамика, буферность химических свойств почв. Свойства почв неодинаковы даже в пределах одного и того же генетического горизонта. При исследовании процессов формирования почвенного профиля оценивают химические свойства отдельных элементов организации почвенной массы. Разнокачественностъ состава почв: разные типы и даже виды и разновидности почв могут иметь столь разные свойства, что для их химической характеристики используют не только разные аналитические приемы, но и разные наборы показателей. Например, в подзолистых, дерново-подзолистых, серых лесных почвах, как правило, определяют р. Н водных и солевых суспензий, обменную и гидролитическую кислотность, обменные основания вытесняют из почв водными растворами солей. В то же время при анализе засоленных почв определяют р. Н только водных суспензий, а вместо показателей кислотности - общую, карбонатную и другие виды щелочности. Перечисленные особенности почв во многом обусловливают принципиальные основы методов исследования химического состояния почв, номенклатуру и классификацию показателей химических свойств почв и химических почвенных процессов.
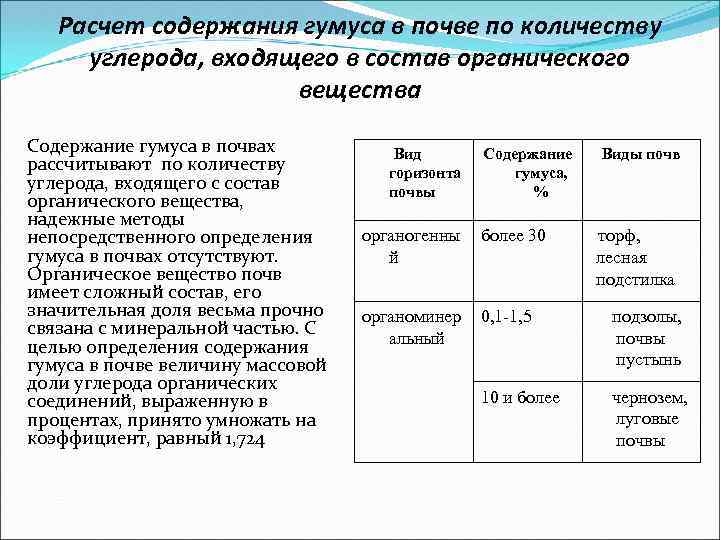 Расчет содержания гумуса в почве по количеству углерода, входящего в состав органического вещества Содержание гумуса в почвах рассчитывают по количеству углерода, входящего с состав органического вещества, надежные методы непосредственного определения гумуса в почвах отсутствуют. Органическое вещество почв имеет сложный состав, его значительная доля весьма прочно связана с минеральной частью. С целью определения содержания гумуса в почве величину массовой доли углерода органических соединений, выраженную в процентах, принято умножать на коэффициент, равный 1, 724 Вид горизонта почвы Содержание гумуса, % Виды почв органогенны й более 30 торф, лесная подстилка органоминер альный 0, 1 -1, 5 подзолы, почвы пустынь 10 и более чернозем, луговые почвы
Расчет содержания гумуса в почве по количеству углерода, входящего в состав органического вещества Содержание гумуса в почвах рассчитывают по количеству углерода, входящего с состав органического вещества, надежные методы непосредственного определения гумуса в почвах отсутствуют. Органическое вещество почв имеет сложный состав, его значительная доля весьма прочно связана с минеральной частью. С целью определения содержания гумуса в почве величину массовой доли углерода органических соединений, выраженную в процентах, принято умножать на коэффициент, равный 1, 724 Вид горизонта почвы Содержание гумуса, % Виды почв органогенны й более 30 торф, лесная подстилка органоминер альный 0, 1 -1, 5 подзолы, почвы пустынь 10 и более чернозем, луговые почвы
 Химические и инструментальные методы анализа почв Прямые метода анализа основаны на количественном определении СО 2, образующегося при окислении углерода органических соединений. Для этой цели используют гравиметрические, газоволюмометрические, кулонометрические и другие методы количественного анализа. Косвенные методы основаны на определении количества окислителя, пошедшего на перевод углерода органических соединений в СО 2 , или на определении количества восстановленной формы используемого окислителя, образовавшегося в процессе анализа. В химическом анализе почв может быть использован практи чески любой из методов, которыми располагают аналитики. При этом измеряется либо непосредственно искомая величина показателя, либо величина, функционально с ней связанная.
Химические и инструментальные методы анализа почв Прямые метода анализа основаны на количественном определении СО 2, образующегося при окислении углерода органических соединений. Для этой цели используют гравиметрические, газоволюмометрические, кулонометрические и другие методы количественного анализа. Косвенные методы основаны на определении количества окислителя, пошедшего на перевод углерода органических соединений в СО 2 , или на определении количества восстановленной формы используемого окислителя, образовавшегося в процессе анализа. В химическом анализе почв может быть использован практи чески любой из методов, которыми располагают аналитики. При этом измеряется либо непосредственно искомая величина показателя, либо величина, функционально с ней связанная.
 Виды анализа Классические: с их помощью получают наиболее точные результаты. Погрешность определения 0, 1 0, 2%. В настоящее время за редким исключением применяют для оценки правильности результатов определений, получаемых инструментальными методами. Инструментальные: электрохимические( потенциометрические, кондуктометрические, кулонометрические, вольтамперометрические, включают все современные разновидности полярографии, спектроскопические(спектроскопия испускания, поглощения, рассеяния, отражения, атомная, молекулярная). При выборе метода измерения учитываются особенности химических свойств анализируемой почвы, природа показателя, необходимая точность определения его уровня, возможности методов измерения и выполнимость требуемых измерений в условиях проведения эксперимента. В свою очередь, точность измерений обусловливается целью исследования и природной вариабельностью изучаемого свойства. Точность собирательная характеристика метода, оценивающая правильность и воспроизводимость получаемых результатов анализа.
Виды анализа Классические: с их помощью получают наиболее точные результаты. Погрешность определения 0, 1 0, 2%. В настоящее время за редким исключением применяют для оценки правильности результатов определений, получаемых инструментальными методами. Инструментальные: электрохимические( потенциометрические, кондуктометрические, кулонометрические, вольтамперометрические, включают все современные разновидности полярографии, спектроскопические(спектроскопия испускания, поглощения, рассеяния, отражения, атомная, молекулярная). При выборе метода измерения учитываются особенности химических свойств анализируемой почвы, природа показателя, необходимая точность определения его уровня, возможности методов измерения и выполнимость требуемых измерений в условиях проведения эксперимента. В свою очередь, точность измерений обусловливается целью исследования и природной вариабельностью изучаемого свойства. Точность собирательная характеристика метода, оценивающая правильность и воспроизводимость получаемых результатов анализа.
 Углерод в почвах и методы определения углерода органических соединений Углерод в почвах входит в состав как органических, так и неорганических соединений. Углерод, входящий в состав органического вещества, находится в специфических соединениях: гуминовых кислотах, фульвокислотах, гиматомелановых кислотах, гумине и в неспецифических соединениях — лигнине, аминокислотах, углеводах, жирных кислотах, спиртах, альдегидах, смолах, восках и пр. Минеральные соединения углерода представлены карбонатами, основная часть которых приходится на относительно труднорастворимые карбонаты кальция и магния. Незначительное количество углерода находится в форме легкорастворимых карбонатов и гидрокарбонатов щелочей. В газовых фазах почв углерод представлен СО 2, СН 4 и др.
Углерод в почвах и методы определения углерода органических соединений Углерод в почвах входит в состав как органических, так и неорганических соединений. Углерод, входящий в состав органического вещества, находится в специфических соединениях: гуминовых кислотах, фульвокислотах, гиматомелановых кислотах, гумине и в неспецифических соединениях — лигнине, аминокислотах, углеводах, жирных кислотах, спиртах, альдегидах, смолах, восках и пр. Минеральные соединения углерода представлены карбонатами, основная часть которых приходится на относительно труднорастворимые карбонаты кальция и магния. Незначительное количество углерода находится в форме легкорастворимых карбонатов и гидрокарбонатов щелочей. В газовых фазах почв углерод представлен СО 2, СН 4 и др.
 Методы определения углерода органических соединений Все методы определения углерода органических соединений основаны на его окислении до диоксида углерода. Предложены как прямые, так и косвенные методы анализа. Прямые методы основаны на определении количества СО 2, образующегося при окислении углерода органических соединений; косвенные методы — на определении количества окислителя, пошедшего на перевод углерода органических соединений в СО 2, или на определении количества восстановленной формы используемого окислителя, образовавшейся в процессе анализа.
Методы определения углерода органических соединений Все методы определения углерода органических соединений основаны на его окислении до диоксида углерода. Предложены как прямые, так и косвенные методы анализа. Прямые методы основаны на определении количества СО 2, образующегося при окислении углерода органических соединений; косвенные методы — на определении количества окислителя, пошедшего на перевод углерода органических соединений в СО 2, или на определении количества восстановленной формы используемого окислителя, образовавшейся в процессе анализа.
 Методы, основанные на отгонке диоксида углерода С помощью этих методов содержание углерода находят по количеству СО 2, выделившегося при разложении органического вещества почв. Разложение органического вещества до Н 2 О и СО 2 может быть проведено двумя способами: методом сухого озоления при нагревании почв и методом мокрого озоления растворами сильных окислителей. В процессе анализа количество диоксида углерода определяют разнообразными прямыми или косвенными методами. Для этой цели используют гравиметрические, титриметрические, газоволюмометрические, кулонометрические и другие методы количественного анализа.
Методы, основанные на отгонке диоксида углерода С помощью этих методов содержание углерода находят по количеству СО 2, выделившегося при разложении органического вещества почв. Разложение органического вещества до Н 2 О и СО 2 может быть проведено двумя способами: методом сухого озоления при нагревании почв и методом мокрого озоления растворами сильных окислителей. В процессе анализа количество диоксида углерода определяют разнообразными прямыми или косвенными методами. Для этой цели используют гравиметрические, титриметрические, газоволюмометрические, кулонометрические и другие методы количественного анализа.
 Гравиметрические методы При определении углерода органических соединений гравиметрическим методом применяют как сухое, так и мокрое озоление гумуса. На сухом озолении органического вещества почв при температуре 650— 750° основан метод Густавсона. Озоление почв проводят в тугоплавкой трубке, через которую непрерывно пропускают кислород или воздух, лишенный СО 2. Для более полного разложения гумуса озоление проводят в присутствии оксида меди. Оксид меди отдает кислород и, превращаясь сначала в Сu 2 О, а затем в металлическую медь, способствует более полному окислению компонентов органического вещества почв. Летучие компоненты почв и продукты окисления гумуса улавливают специальными поглотителями. Для поглощения воды, образующейся при окислении водорода, используют хлорид кальция или концентрированную серную кислоту, для поглощения диоксида серы — хромат свинца. Медную спираль применяют для восстановления азота оксидов до свободного азота, галогены поглощают с помощью серебряной спирали. Наконец, для поглощения СО 2 используют аскарит (асбест, пропитанный Na. OH). Аскарит помещают в U образные поглотительные трубки.
Гравиметрические методы При определении углерода органических соединений гравиметрическим методом применяют как сухое, так и мокрое озоление гумуса. На сухом озолении органического вещества почв при температуре 650— 750° основан метод Густавсона. Озоление почв проводят в тугоплавкой трубке, через которую непрерывно пропускают кислород или воздух, лишенный СО 2. Для более полного разложения гумуса озоление проводят в присутствии оксида меди. Оксид меди отдает кислород и, превращаясь сначала в Сu 2 О, а затем в металлическую медь, способствует более полному окислению компонентов органического вещества почв. Летучие компоненты почв и продукты окисления гумуса улавливают специальными поглотителями. Для поглощения воды, образующейся при окислении водорода, используют хлорид кальция или концентрированную серную кислоту, для поглощения диоксида серы — хромат свинца. Медную спираль применяют для восстановления азота оксидов до свободного азота, галогены поглощают с помощью серебряной спирали. Наконец, для поглощения СО 2 используют аскарит (асбест, пропитанный Na. OH). Аскарит помещают в U образные поглотительные трубки.
 Реакция протекает согласно уравнению: СО 2 + 2 Na. OH = Na 2 CO 3 + Н 2 О В связи с тем, что одним из продуктов реакции является Н 2 О, в поглотительную трубку помещают не только аскарит, но и хлорид кальция, который количественно поглощает воду: Са. Сl 2 + n. Н 2 О = Са. Сl 2 n. Н 2 О Поглотительные трубки взвешивают до и после озоления органического вещества и по увеличению массы, обусловленному поглощением СО 2, находят содержание углерода в почве. Методы, основанные на сухом озолении и гравиметрическом определении диоксида углерода, — наиболее точные из методов определения углерода органических соединении. При сухом озолении происходит полное окисление углерода независимо от типа органических соединений, а гравиметрический метод — наиболее точный из методов измерения массы СО 2.
Реакция протекает согласно уравнению: СО 2 + 2 Na. OH = Na 2 CO 3 + Н 2 О В связи с тем, что одним из продуктов реакции является Н 2 О, в поглотительную трубку помещают не только аскарит, но и хлорид кальция, который количественно поглощает воду: Са. Сl 2 + n. Н 2 О = Са. Сl 2 n. Н 2 О Поглотительные трубки взвешивают до и после озоления органического вещества и по увеличению массы, обусловленному поглощением СО 2, находят содержание углерода в почве. Методы, основанные на сухом озолении и гравиметрическом определении диоксида углерода, — наиболее точные из методов определения углерода органических соединении. При сухом озолении происходит полное окисление углерода независимо от типа органических соединений, а гравиметрический метод — наиболее точный из методов измерения массы СО 2.
 Газоволюмометрические методы Основаны на измерении объема диоксида углерода, выделившегося при озолении гумуса, и вычислении количества углерода по объему СО 2. Вычисления проводят с учетом температуры и давления, при которых проводился анализ. Газоволюмометрическое определение углерода в почвах может быть проведено с помощью газоанализаторов, в том числе предназначенных для определения углерода в чугуне и стали. Озоление анализируемого вещества проводят в термостойкой трубке в муфельной печи в токе кислорода. В процессе анализа измеряют объем смеси СО 2 и кислорода. Затем смесь газов пропускают через раствор с поглотителем диоксида углерода (СО 2 + 2 КОН = К 2 СО 3 + Н 2 О) и измеряют объем кислорода. Объем диоксида углерода, образовавшегося в результате озоления органического вещества, вычисляют по разности. Газовый анализатор
Газоволюмометрические методы Основаны на измерении объема диоксида углерода, выделившегося при озолении гумуса, и вычислении количества углерода по объему СО 2. Вычисления проводят с учетом температуры и давления, при которых проводился анализ. Газоволюмометрическое определение углерода в почвах может быть проведено с помощью газоанализаторов, в том числе предназначенных для определения углерода в чугуне и стали. Озоление анализируемого вещества проводят в термостойкой трубке в муфельной печи в токе кислорода. В процессе анализа измеряют объем смеси СО 2 и кислорода. Затем смесь газов пропускают через раствор с поглотителем диоксида углерода (СО 2 + 2 КОН = К 2 СО 3 + Н 2 О) и измеряют объем кислорода. Объем диоксида углерода, образовавшегося в результате озоления органического вещества, вычисляют по разности. Газовый анализатор
 Титриметрические и экспресс-методы Титриметрические методы также используются для определения диоксида углерода, выделяющегося при озолении гумуса. В этом случае диоксид углерода поглощают раствором КОН. В щелочной среде диоксид углерода трансформируется в CO 32. Ион CO 32 осаждают хлоридом бария. Осадок карбоната бария отфильтровывают, промывают водой и растворяют в титрованном растворе НСl. По количеству НСl, пошедшему на растворение карбоната бария, судят о количестве диоксида углерода, образовавшегося при озолении гумуса. Экспресс-методы. Один из методов основан на оценке скорости выделения СО 2. По мере нагревания навески почвы в токе кислорода до 700° растет скорость выделения СО 2 вследствие окисления углерода. органических соединений, достигает максимума и затем уменьшается. Скорость разложения карбонатов начинает увеличиваться при более высокой температуре. Анализатор автоматически регистрирует кривую скорости выделения диоксида углерода по мере нагревания почвы и позволяет раздельно определять диоксид углерода, образующийся в результате разложения гумуса и карбонатов.
Титриметрические и экспресс-методы Титриметрические методы также используются для определения диоксида углерода, выделяющегося при озолении гумуса. В этом случае диоксид углерода поглощают раствором КОН. В щелочной среде диоксид углерода трансформируется в CO 32. Ион CO 32 осаждают хлоридом бария. Осадок карбоната бария отфильтровывают, промывают водой и растворяют в титрованном растворе НСl. По количеству НСl, пошедшему на растворение карбоната бария, судят о количестве диоксида углерода, образовавшегося при озолении гумуса. Экспресс-методы. Один из методов основан на оценке скорости выделения СО 2. По мере нагревания навески почвы в токе кислорода до 700° растет скорость выделения СО 2 вследствие окисления углерода. органических соединений, достигает максимума и затем уменьшается. Скорость разложения карбонатов начинает увеличиваться при более высокой температуре. Анализатор автоматически регистрирует кривую скорости выделения диоксида углерода по мере нагревания почвы и позволяет раздельно определять диоксид углерода, образующийся в результате разложения гумуса и карбонатов.
 Фотометрические методы Фотометрический метод определения углерода органических соединений является косвенным методом. При использовании этого метода о содержании гумуса судят по количеству Cr 3+, образовавшемуся в процессе окисления углерода. При окислении гумуса раствором дихромата калия углерод органических соединений превращается в СО 2, a Cr(VI) восстанавливается до Сr (III). Количество образовавшегося в процессе реакции Cr 3+, эквивалентно содержанию углерода органических соединений (и других восстановителей) в навеске почвы. Поэтому углерод органических соединений можно определять по количеству образовавшегося в процессе анализа Cr 3+, Концентрацию Сr 3+ удобно определять в области длин волн 584 594 нм, так как в ней светопоглощение растворов Cr 3+ максимально, а оптическая плотность растворов К 2 Сг 207 практически равна нулю и К 2 Cr 207 не оказывает влияния на результаты определения Cr 3+. Возможность селективного измерения оптической плотности Cr 3+, лежит в основе фотометрического метода определения углерода органических соединений.
Фотометрические методы Фотометрический метод определения углерода органических соединений является косвенным методом. При использовании этого метода о содержании гумуса судят по количеству Cr 3+, образовавшемуся в процессе окисления углерода. При окислении гумуса раствором дихромата калия углерод органических соединений превращается в СО 2, a Cr(VI) восстанавливается до Сr (III). Количество образовавшегося в процессе реакции Cr 3+, эквивалентно содержанию углерода органических соединений (и других восстановителей) в навеске почвы. Поэтому углерод органических соединений можно определять по количеству образовавшегося в процессе анализа Cr 3+, Концентрацию Сr 3+ удобно определять в области длин волн 584 594 нм, так как в ней светопоглощение растворов Cr 3+ максимально, а оптическая плотность растворов К 2 Сг 207 практически равна нулю и К 2 Cr 207 не оказывает влияния на результаты определения Cr 3+. Возможность селективного измерения оптической плотности Cr 3+, лежит в основе фотометрического метода определения углерода органических соединений.
 После взаимодействия дихромата калия с почвой измеряют оптическую плотность раствора в области длин волн, соответствующей максимуму поглощения излучения Сг 3+ (590 нм), определяют количество Сг 3+ и рассчитывают эквивалентное ему количество углерода органических соединений. Применение фотометрического метода для определения органического углерода по количеству образовавшегося Сг 3+ позволяет не устанавливать точные концентрацию и объем, взятого для анализа навески почвы раствора дихромата калия. Объем добавляемого раствора можно измерять с помощью мерного цилиндра
После взаимодействия дихромата калия с почвой измеряют оптическую плотность раствора в области длин волн, соответствующей максимуму поглощения излучения Сг 3+ (590 нм), определяют количество Сг 3+ и рассчитывают эквивалентное ему количество углерода органических соединений. Применение фотометрического метода для определения органического углерода по количеству образовавшегося Сг 3+ позволяет не устанавливать точные концентрацию и объем, взятого для анализа навески почвы раствора дихромата калия. Объем добавляемого раствора можно измерять с помощью мерного цилиндра
 Косвенные методы определения углерода органических соединений При мокром озолении гумуса раствором дихромата калия углерод органических соединений можно определить не только по количеству образовавшегося диоксида углерода, но и косвенными титриметрическими и фотометрическим методами. При использовании этих методов о содержании углерода органических соединений судят по количеству Сr 2 О 72 , пошедшему на окисление углерода (титриметрический вариант метода), либо по количеству Cr 3+, образовавшемуся в процессе окисления углерода (фотометрический вариант метода). В основе титриметрического варианта метода И. В. Тюрина лежит окисление углерода органического вещества почвы дихроматом калия в Cr 3+, 3 С+2 К 2 Сr 2 O 7+8 Н 2 SO 4=3 CO 2+2 Cr 2(SO)3+2 К 2 SO 4+8 Н 2 О Избыток дихромата оттитровывают раствором соли Мора (NH 4)2 SO 4∙Fe. SO 4∙ 6 H 2 O К 2 Сr 2 O 7+6 Fe. SO 4+7 Н 2 SO 4=Cr 2(SO)3+ 3 Fe 2(SO 4)3+К 2 SO 4+7 Н 2 О
Косвенные методы определения углерода органических соединений При мокром озолении гумуса раствором дихромата калия углерод органических соединений можно определить не только по количеству образовавшегося диоксида углерода, но и косвенными титриметрическими и фотометрическим методами. При использовании этих методов о содержании углерода органических соединений судят по количеству Сr 2 О 72 , пошедшему на окисление углерода (титриметрический вариант метода), либо по количеству Cr 3+, образовавшемуся в процессе окисления углерода (фотометрический вариант метода). В основе титриметрического варианта метода И. В. Тюрина лежит окисление углерода органического вещества почвы дихроматом калия в Cr 3+, 3 С+2 К 2 Сr 2 O 7+8 Н 2 SO 4=3 CO 2+2 Cr 2(SO)3+2 К 2 SO 4+8 Н 2 О Избыток дихромата оттитровывают раствором соли Мора (NH 4)2 SO 4∙Fe. SO 4∙ 6 H 2 O К 2 Сr 2 O 7+6 Fe. SO 4+7 Н 2 SO 4=Cr 2(SO)3+ 3 Fe 2(SO 4)3+К 2 SO 4+7 Н 2 О
 Титрование избытка дихромата калия раствором Fe. SO 4 можно проводить, фиксируя точку эквивалентности потенциометрическим методом, измеряя окислительно восстановительный потенциал системы. Однако чаще конечную точку титрования фиксируют индикаторным методом, используя в качестве индикатора фенилантрониловую кислоту. Изменение окраски фенилантрониловой кислоты происходит при потенциале +1, 08 в пределах скачка на кривой окислительно восстановительного титрования. Окисленная форма индикатора – вишнево красная, восстановленная – бесцветная. Однако в процессе титрования раствор не обесцвечивается, а становится изумрудно зеленым. Зеленая окраска обусловлена появлением в растворе Cr 3+. При взаимодействии с гумусом дихромат ион реагирует не только с углеродом, но и с водородом, входящим в состав органических соединений. 12 Н + 2 К 2 Сr 2 O 7 + 8 Н 2 SO 4=2 Cr 2(SO)3 + 14 Н 2 О + 2 К 2 SO 4
Титрование избытка дихромата калия раствором Fe. SO 4 можно проводить, фиксируя точку эквивалентности потенциометрическим методом, измеряя окислительно восстановительный потенциал системы. Однако чаще конечную точку титрования фиксируют индикаторным методом, используя в качестве индикатора фенилантрониловую кислоту. Изменение окраски фенилантрониловой кислоты происходит при потенциале +1, 08 в пределах скачка на кривой окислительно восстановительного титрования. Окисленная форма индикатора – вишнево красная, восстановленная – бесцветная. Однако в процессе титрования раствор не обесцвечивается, а становится изумрудно зеленым. Зеленая окраска обусловлена появлением в растворе Cr 3+. При взаимодействии с гумусом дихромат ион реагирует не только с углеродом, но и с водородом, входящим в состав органических соединений. 12 Н + 2 К 2 Сr 2 O 7 + 8 Н 2 SO 4=2 Cr 2(SO)3 + 14 Н 2 О + 2 К 2 SO 4
 Дихромат калия реагирует не только с органическим веществом, но и с некоторыми минеральными компонентами. В присутствии двухвалентного железа получают завышенные результаты определения гумуса в почвах. Поэтому метод Тюрина не рекомендуется использовать при анализе гидроморфных почв, для которых характерно наличие двухвалентного железа. Метод применим при содержании гумуса более 15%, так как в этом случае не достигается полного окисления даже при минимально возможной навеске почвы. Для более полного окисления углерода органических соединений раствором дихромата калия И. В. Тюрин рекомендовал в качестве катализатора использовать Ag. SO 4. Применение катализатора позволяет определить 95 97% углерода органических соединений.
Дихромат калия реагирует не только с органическим веществом, но и с некоторыми минеральными компонентами. В присутствии двухвалентного железа получают завышенные результаты определения гумуса в почвах. Поэтому метод Тюрина не рекомендуется использовать при анализе гидроморфных почв, для которых характерно наличие двухвалентного железа. Метод применим при содержании гумуса более 15%, так как в этом случае не достигается полного окисления даже при минимально возможной навеске почвы. Для более полного окисления углерода органических соединений раствором дихромата калия И. В. Тюрин рекомендовал в качестве катализатора использовать Ag. SO 4. Применение катализатора позволяет определить 95 97% углерода органических соединений.


