Mekhanika_LK_9.pptx
- Количество слайдов: 45
 Лекция 9 1
Лекция 9 1
 Содержание предыдущей лекции Механические колебания • • Разложение и синтез колебаний. Понятие о спектре колебаний. Связанные колебания. Волновое движение. Уравнение волны в газах, жидкостях и твердых телах. Плоская механическая волна. Длина волны, волновое число, фазовая скорость. Одномерное волновое уравнение. 2
Содержание предыдущей лекции Механические колебания • • Разложение и синтез колебаний. Понятие о спектре колебаний. Связанные колебания. Волновое движение. Уравнение волны в газах, жидкостях и твердых телах. Плоская механическая волна. Длина волны, волновое число, фазовая скорость. Одномерное волновое уравнение. 2
 Контрольный вопрос Скорость поперечной волны в упругой среде при увеличении амплитуды волны: а) возрастает, б) убывает, в) не меняется, г) нельзя однозначно ответить. в) 3
Контрольный вопрос Скорость поперечной волны в упругой среде при увеличении амплитуды волны: а) возрастает, б) убывает, в) не меняется, г) нельзя однозначно ответить. в) 3
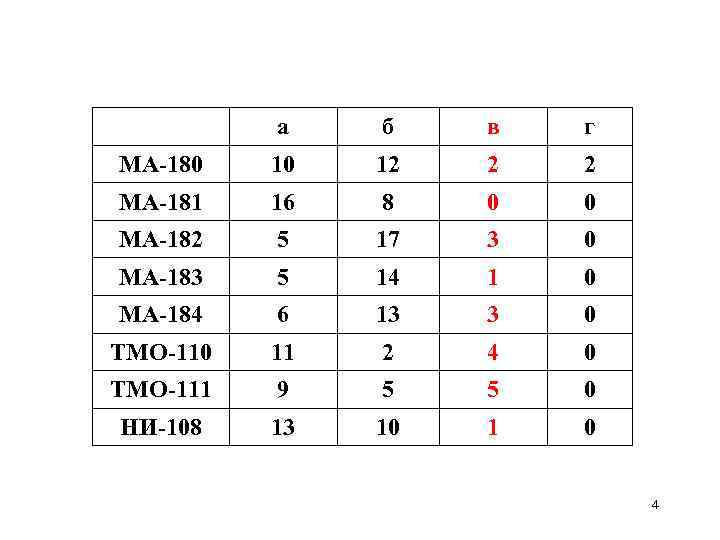 а б в г МА-180 10 12 2 2 МА-181 16 8 0 0 МА-182 5 17 3 0 МА-183 5 14 1 0 МА-184 6 13 3 0 ТМО-110 11 2 4 0 ТМО-111 9 5 5 0 НИ-108 13 10 1 0 4
а б в г МА-180 10 12 2 2 МА-181 16 8 0 0 МА-182 5 17 3 0 МА-183 5 14 1 0 МА-184 6 13 3 0 ТМО-110 11 2 4 0 ТМО-111 9 5 5 0 НИ-108 13 10 1 0 4
 Содержание сегодняшней лекции Статистическая физика и термодинамика • Статистический и термодинамический методы. Термодинамические параметры. Равновесные и неравновесные состояния и процессы. Молекулярно-кинетическая теория (МКТ) • Макроскопическое состояние. Макроскопические параметры как средние значения микроскопических. Модель идеального газа. • Законы идеального газа. • Уравнение состояния идеального газа. • Давление газа с точки зрения МКТ. • Основное уравнение МКТ. • Среднеквадратичная скорость молекул. • Распределение Максвелла для молекул и проекций скорости молекул идеального газа, экспериментальное обоснование распределения Максвелла. 5
Содержание сегодняшней лекции Статистическая физика и термодинамика • Статистический и термодинамический методы. Термодинамические параметры. Равновесные и неравновесные состояния и процессы. Молекулярно-кинетическая теория (МКТ) • Макроскопическое состояние. Макроскопические параметры как средние значения микроскопических. Модель идеального газа. • Законы идеального газа. • Уравнение состояния идеального газа. • Давление газа с точки зрения МКТ. • Основное уравнение МКТ. • Среднеквадратичная скорость молекул. • Распределение Максвелла для молекул и проекций скорости молекул идеального газа, экспериментальное обоснование распределения Максвелла. 5
 Статистическая физика и термодинамика Статистический и термодинамический способы описания процессов, происходящих в макроскопических телах, состоящих из большого количества атомов или молекул. 6
Статистическая физика и термодинамика Статистический и термодинамический способы описания процессов, происходящих в макроскопических телах, состоящих из большого количества атомов или молекул. 6
 Статистическая физика - раздел физики, задача которого выразить свойства макроскопических тел, т. е. систем, состоящих из очень большого числа одинаковых частиц (молекул, атомов, электронов и т. д. ), через свойства этих частиц и взаимодействие между ними. Молекулярная физика – раздел физики, изучающий строение и свойства вещества на основе так называемых молекулярно-кинетических представлений. 7
Статистическая физика - раздел физики, задача которого выразить свойства макроскопических тел, т. е. систем, состоящих из очень большого числа одинаковых частиц (молекул, атомов, электронов и т. д. ), через свойства этих частиц и взаимодействие между ними. Молекулярная физика – раздел физики, изучающий строение и свойства вещества на основе так называемых молекулярно-кинетических представлений. 7
 Статистическая физика Молекулы (маленькие обособленные частицы) – составная часть любого тела (твердого, жидкого или газообразного). 8
Статистическая физика Молекулы (маленькие обособленные частицы) – составная часть любого тела (твердого, жидкого или газообразного). 8
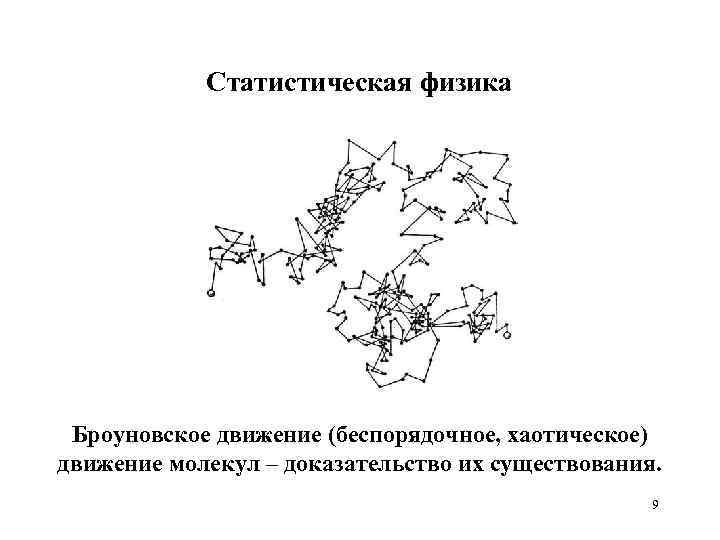 Статистическая физика Броуновское движение (беспорядочное, хаотическое) движение молекул – доказательство их существования. 9
Статистическая физика Броуновское движение (беспорядочное, хаотическое) движение молекул – доказательство их существования. 9
 Статистическая физика Сложность наблюдения молекул – не столь устойчивые как атом структуры – разрушение при воздействии пучка электронов в просвечивающем электронном микроскопе. 10
Статистическая физика Сложность наблюдения молекул – не столь устойчивые как атом структуры – разрушение при воздействии пучка электронов в просвечивающем электронном микроскопе. 10
 Статистическая физика Ограничения статистического подхода: 1 см 3 газа (комнатная температура) – 3 · 1019 молекул. Около 1020 уравнений (по 3 на каждую молекулу) для описания движения молекул. Соотношение неопределенностей Гейзенберга – невозможность абсолютно точного одновременного определения координат и скоростей молекул. 11
Статистическая физика Ограничения статистического подхода: 1 см 3 газа (комнатная температура) – 3 · 1019 молекул. Около 1020 уравнений (по 3 на каждую молекулу) для описания движения молекул. Соотношение неопределенностей Гейзенберга – невозможность абсолютно точного одновременного определения координат и скоростей молекул. 11
 Термодинамика – рассмотрение не отдельных молекул, а макроскопических тел, состоящих из огромного числа частиц. Термодинамика – описание тепловых явлений с помощью макроскопических величин (давление, температура, объем), которые не применимы к отдельным молекулам и атомам. Термодинамика - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. 12
Термодинамика – рассмотрение не отдельных молекул, а макроскопических тел, состоящих из огромного числа частиц. Термодинамика – описание тепловых явлений с помощью макроскопических величин (давление, температура, объем), которые не применимы к отдельным молекулам и атомам. Термодинамика - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. 12
 Термодинамика Термодинамическая система – совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. 13
Термодинамика Термодинамическая система – совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. 13
 Модель идеального газа Допущения: • число молекул в газе велико, среднее расстояние между ними велико по сравнению с их размерами, • хаотичное движение молекул, соответствующее законам Ньютона, • взаимодействие молекул посредством упругих короткодействующих сил, • упругое взаимодействие молекул со стенками сосуда, • все молекулы газа одинаковы – простое вещество. 14
Модель идеального газа Допущения: • число молекул в газе велико, среднее расстояние между ними велико по сравнению с их размерами, • хаотичное движение молекул, соответствующее законам Ньютона, • взаимодействие молекул посредством упругих короткодействующих сил, • упругое взаимодействие молекул со стенками сосуда, • все молекулы газа одинаковы – простое вещество. 14
 Модель идеального газа Соответствие модели поведению газа, состоящего из отдельных атомов при низких давлениях. Исключение из рассмотрения вращения и колебания молекул. 15
Модель идеального газа Соответствие модели поведению газа, состоящего из отдельных атомов при низких давлениях. Исключение из рассмотрения вращения и колебания молекул. 15
 Уравнение состояния идеального газа Эксперимент: параметры состояния идеального газа связаны между собой b – постоянная, пропорциональная массе газа. 16
Уравнение состояния идеального газа Эксперимент: параметры состояния идеального газа связаны между собой b – постоянная, пропорциональная массе газа. 16
 Уравнение состояния идеального газа 1 моль вещества – количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов или других структурных единиц), равное числу атомов в 0, 012 кг изотопа углерода 12 С. Равенство числа частиц, содержащихся в 1 моле вещества, числу Авогадро NA = 6, 02213× 1023 моль-1. Закон Авогадро: 1 моль любого газа при нормальных условиях, т. е. при температуре 0 °С (273, 15 К) и давлении 1 атм (1, 013× 105 Па), занимает объем Vm = 22, 4 л. 17
Уравнение состояния идеального газа 1 моль вещества – количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов или других структурных единиц), равное числу атомов в 0, 012 кг изотопа углерода 12 С. Равенство числа частиц, содержащихся в 1 моле вещества, числу Авогадро NA = 6, 02213× 1023 моль-1. Закон Авогадро: 1 моль любого газа при нормальных условиях, т. е. при температуре 0 °С (273, 15 К) и давлении 1 атм (1, 013× 105 Па), занимает объем Vm = 22, 4 л. 17
 Уравнение состояния идеального газа Относительная молекулярная масса вещества Mr – отношение массы молекулы этого вещества к 1/12 массы атома 12 С. Атомная единица массы mед – масса, равная 1/12 массы атома 12 С. Молярная масса (масса 1 моля) M = NAMrmед. 18
Уравнение состояния идеального газа Относительная молекулярная масса вещества Mr – отношение массы молекулы этого вещества к 1/12 массы атома 12 С. Атомная единица массы mед – масса, равная 1/12 массы атома 12 С. Молярная масса (масса 1 моля) M = NAMrmед. 18
 Уравнение состояния идеального газа Для 1 моля вещества: - молярная газовая постоянная или газовая постоянная. 19
Уравнение состояния идеального газа Для 1 моля вещества: - молярная газовая постоянная или газовая постоянная. 19
 Уравнение состояния идеального газа Для произвольного числа молей идеального газа 20
Уравнение состояния идеального газа Для произвольного числа молей идеального газа 20
 Давление газа с точки зрения МКТ Идеальный газ из N молекул в контейнере кубической формы с ребром d и объемом V. 21
Давление газа с точки зрения МКТ Идеальный газ из N молекул в контейнере кубической формы с ребром d и объемом V. 21
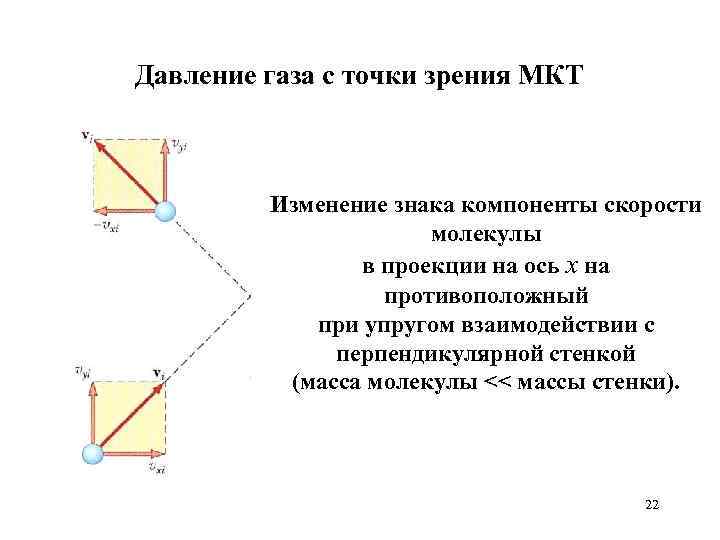 Давление газа с точки зрения МКТ Изменение знака компоненты скорости молекулы в проекции на ось x на противоположный при упругом взаимодействии с перпендикулярной стенкой (масса молекулы << массы стенки). 22
Давление газа с точки зрения МКТ Изменение знака компоненты скорости молекулы в проекции на ось x на противоположный при упругом взаимодействии с перпендикулярной стенкой (масса молекулы << массы стенки). 22
 Давление газа с точки зрения МКТ Модуль x - компоненты импульса молекулы: mvxi - до взаимодействия, mvxi - после взаимодействия. Изменение x - компоненты импульса молекулы в результате взаимодействия со стенкой Δpxi = mvxi (mvxi) = 2 mvxi. 23
Давление газа с точки зрения МКТ Модуль x - компоненты импульса молекулы: mvxi - до взаимодействия, mvxi - после взаимодействия. Изменение x - компоненты импульса молекулы в результате взаимодействия со стенкой Δpxi = mvxi (mvxi) = 2 mvxi. 23
 Δpxi = mvxi (mvxi)= 2 mvxi Давление газа с точки зрения МКТ Второй закон Ньютона: - модуль x - компоненты усредненной силы, действующей на молекулу со стороны стенки за время ее взаимодействия со стенкой, - время взаимодействия молекулы со стенкой. 24
Δpxi = mvxi (mvxi)= 2 mvxi Давление газа с точки зрения МКТ Второй закон Ньютона: - модуль x - компоненты усредненной силы, действующей на молекулу со стороны стенки за время ее взаимодействия со стенкой, - время взаимодействия молекулы со стенкой. 24
 Давление газа с точки зрения МКТ Интервал времени между двумя последовательными соударениями молекулы с одной и той же стенкой 2 d - расстояние, пройденное молекулой между столкновениями внутри куба (перпендикулярно к стенке в направлении от нее и к ней). 25
Давление газа с точки зрения МКТ Интервал времени между двумя последовательными соударениями молекулы с одной и той же стенкой 2 d - расстояние, пройденное молекулой между столкновениями внутри куба (перпендикулярно к стенке в направлении от нее и к ней). 25
 Давление газа с точки зрения МКТ Второй закон Ньютона − модуль x - компоненты силы, действующей на молекулу со стороны стенки, усредненный по времени между двумя последовательными столкновениями молекулы со стенкой. 26
Давление газа с точки зрения МКТ Второй закон Ньютона − модуль x - компоненты силы, действующей на молекулу со стороны стенки, усредненный по времени между двумя последовательными столкновениями молекулы со стенкой. 26
 Давление газа с точки зрения МКТ Модуль x - компоненты средней силы, действующей на молекулу со стороны стенки, Третий закон Ньютона: усредненная x - компонента силы, действующей на стенку со стороны молекулы, 27
Давление газа с точки зрения МКТ Модуль x - компоненты средней силы, действующей на молекулу со стороны стенки, Третий закон Ньютона: усредненная x - компонента силы, действующей на стенку со стороны молекулы, 27
 Давление газа с точки зрения МКТ Модуль средней силы, действующей на стенку, со стороны всех молекул газа, Большое количество молекул в газе – модуль средней силы, действующей на стенку, со стороны всех молекул газа, постоянен во времени. 28
Давление газа с точки зрения МКТ Модуль средней силы, действующей на стенку, со стороны всех молекул газа, Большое количество молекул в газе – модуль средней силы, действующей на стенку, со стороны всех молекул газа, постоянен во времени. 28
 Давление газа с точки зрения МКТ Cреднее значение квадрата скорости N молекул Сила, действующая на стенку со стороны всех молекул газа, 29
Давление газа с точки зрения МКТ Cреднее значение квадрата скорости N молекул Сила, действующая на стенку со стороны всех молекул газа, 29
 Давление газа с точки зрения МКТ Общий случай движения молекулы с проекциями компонентов вектора скорости vxi, vyi, vzi. Для молекул в целом: Движение молекул хаотичное: 30
Давление газа с точки зрения МКТ Общий случай движения молекулы с проекциями компонентов вектора скорости vxi, vyi, vzi. Для молекул в целом: Движение молекул хаотичное: 30
 Давление газа с точки зрения МКТ Сила, действующая на стенку, Давление, оказываемое на стенку молекулами газа, 31
Давление газа с точки зрения МКТ Сила, действующая на стенку, Давление, оказываемое на стенку молекулами газа, 31
 Давление газа с точки зрения МКТ - ключевое соотношение, связывающее макро (давление) и микро (среднеквадратичная скорость молекул) параметры – макро и микромир. Давление газа прямо пропорционально числу молекул в единице объема и средней кинетической энергии их поступательного движения. 32
Давление газа с точки зрения МКТ - ключевое соотношение, связывающее макро (давление) и микро (среднеквадратичная скорость молекул) параметры – макро и микромир. Давление газа прямо пропорционально числу молекул в единице объема и средней кинетической энергии их поступательного движения. 32
 Давление газа с точки зрения МКТ - давление газа прямо пропорционально концентрации молекул и температуре. 33
Давление газа с точки зрения МКТ - давление газа прямо пропорционально концентрации молекул и температуре. 33
 Основное уравнение МКТ - основное уравнение МКТ, связывающее макроскопические (давление, объем, температура) и микроскопические (масса молекул, средняя скорость их движения) параметры термодинамической системы. 34
Основное уравнение МКТ - основное уравнение МКТ, связывающее макроскопические (давление, объем, температура) и микроскопические (масса молекул, средняя скорость их движения) параметры термодинамической системы. 34
 Cреднеквадратическая скорость молекул - мера средней кинетической энергии молекул. 35
Cреднеквадратическая скорость молекул - мера средней кинетической энергии молекул. 35
 Cреднеквадратическая скорость молекул Каждая поступательная степень свободы дает вклад, равный в энергию системы вдобавок к вкладу, связанному с перемещениями, вызванными с вращением и колебанием молекул. 36
Cреднеквадратическая скорость молекул Каждая поступательная степень свободы дает вклад, равный в энергию системы вдобавок к вкладу, связанному с перемещениями, вызванными с вращением и колебанием молекул. 36
 Cреднеквадратическая скорость молекул Полная кинетическая энергия поступательного движения N молекул газа где k = R / NA – постоянная Больцмана, n = N / NA – число молей газа. Вывод: внутренняя энергия идеального газа зависит только от температуры. 37
Cреднеквадратическая скорость молекул Полная кинетическая энергия поступательного движения N молекул газа где k = R / NA – постоянная Больцмана, n = N / NA – число молей газа. Вывод: внутренняя энергия идеального газа зависит только от температуры. 37
 Cреднеквадратическая скорость молекул M – молярная масса, равная m. NA. 38
Cреднеквадратическая скорость молекул M – молярная масса, равная m. NA. 38
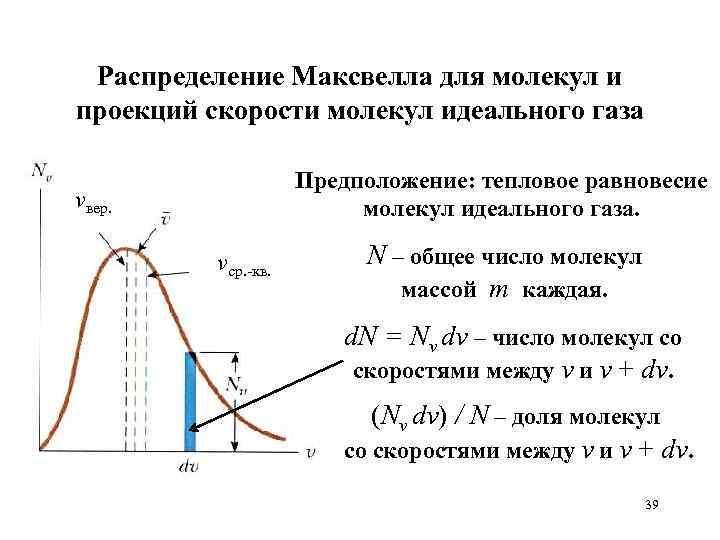 Распределение Максвелла для молекул и проекций скорости молекул идеального газа Предположение: тепловое равновесие молекул идеального газа. vвер. vср. -кв. N – общее число молекул массой m каждая. d. N = Nv dv – число молекул со скоростями между v и v + dv. (Nv dv) / N – доля молекул со скоростями между v и v + dv. 39
Распределение Максвелла для молекул и проекций скорости молекул идеального газа Предположение: тепловое равновесие молекул идеального газа. vвер. vср. -кв. N – общее число молекул массой m каждая. d. N = Nv dv – число молекул со скоростями между v и v + dv. (Nv dv) / N – доля молекул со скоростями между v и v + dv. 39
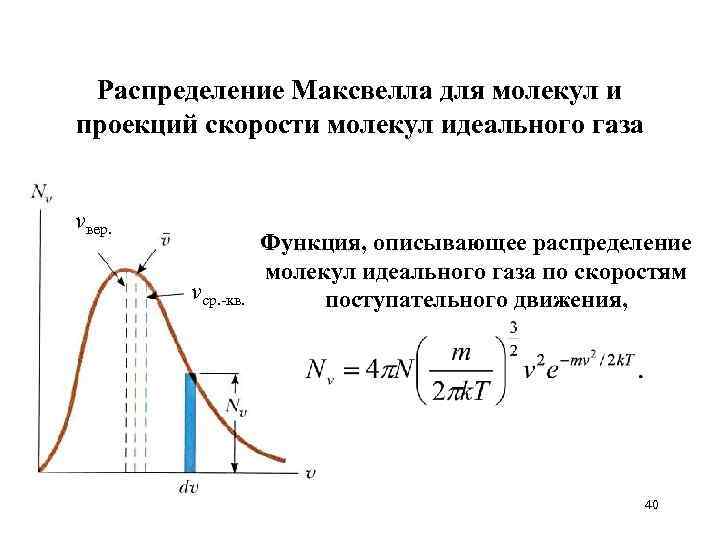 Распределение Максвелла для молекул и проекций скорости молекул идеального газа vвер. vср. -кв. Функция, описывающее распределение молекул идеального газа по скоростям поступательного движения, 40
Распределение Максвелла для молекул и проекций скорости молекул идеального газа vвер. vср. -кв. Функция, описывающее распределение молекул идеального газа по скоростям поступательного движения, 40
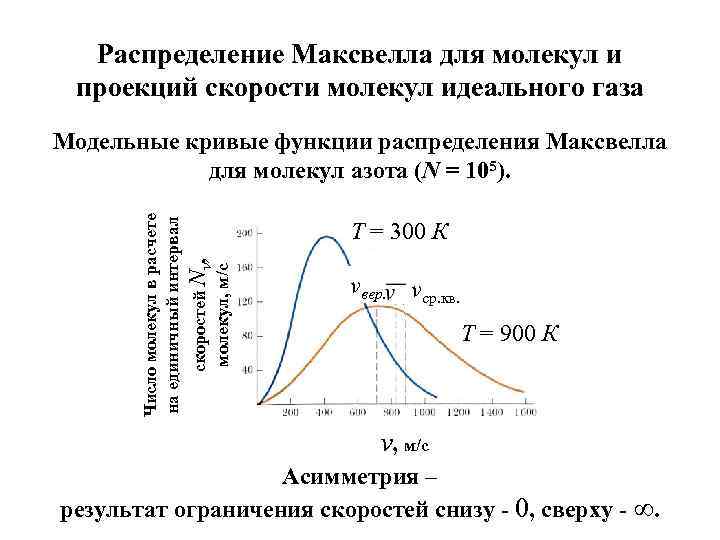 Распределение Максвелла для молекул и проекций скорости молекул идеального газа Т = 300 К скоростей Nv, молекул, м/с Число молекул в расчете на единичный интервал Модельные кривые функции распределения Максвелла для молекул азота (N = 105). vвер. vcр. кв. Т = 900 К v, м/с Асимметрия – результат ограничения скоростей снизу - 0, сверху - ∞.
Распределение Максвелла для молекул и проекций скорости молекул идеального газа Т = 300 К скоростей Nv, молекул, м/с Число молекул в расчете на единичный интервал Модельные кривые функции распределения Максвелла для молекул азота (N = 105). vвер. vcр. кв. Т = 900 К v, м/с Асимметрия – результат ограничения скоростей снизу - 0, сверху - ∞.
 Распределение Максвелла для молекул и проекций скорости молекул идеального газа Сдвиг кривой вправо для менее массивных молекул – молекулы водорода и гелия легче покидают атмосферу Земли, чем более массивные молекулы азота и кислорода. Охлаждение воды при испарении – уход более энергетических молекул в воздух. 42
Распределение Максвелла для молекул и проекций скорости молекул идеального газа Сдвиг кривой вправо для менее массивных молекул – молекулы водорода и гелия легче покидают атмосферу Земли, чем более массивные молекулы азота и кислорода. Охлаждение воды при испарении – уход более энергетических молекул в воздух. 42
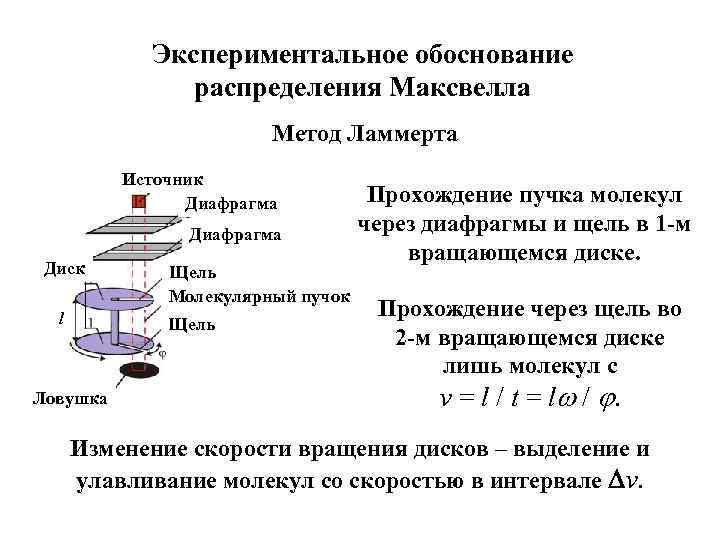 Экспериментальное обоснование распределения Максвелла Метод Ламмерта Источник Диафрагма Диск l Щель Молекулярный пучок Щель Ловушка Прохождение пучка молекул через диафрагмы и щель в 1 -м вращающемся диске. Прохождение через щель во 2 -м вращающемся диске лишь молекул с v = l / t = l / . Изменение скорости вращения дисков – выделение и улавливание молекул со скоростью в интервале v.
Экспериментальное обоснование распределения Максвелла Метод Ламмерта Источник Диафрагма Диск l Щель Молекулярный пучок Щель Ловушка Прохождение пучка молекул через диафрагмы и щель в 1 -м вращающемся диске. Прохождение через щель во 2 -м вращающемся диске лишь молекул с v = l / t = l / . Изменение скорости вращения дисков – выделение и улавливание молекул со скоростью в интервале v.
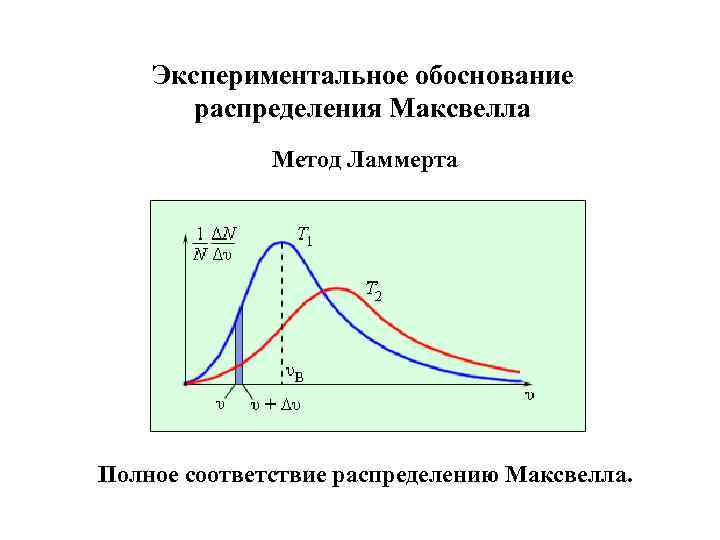 Экспериментальное обоснование распределения Максвелла Метод Ламмерта Полное соответствие распределению Максвелла.
Экспериментальное обоснование распределения Максвелла Метод Ламмерта Полное соответствие распределению Максвелла.
 Контрольный вопрос В контейнерах А и Б содержится при одной и той же температуре один и тот же идеальный газ одинаковой массы. Объем контейнера Б в 2 раза больше, чем объем контейнера А. Средняя кинетическая энергия поступательного движения в расчете на 1 молекулу газа в контейнере Б по сравнению с таковой в контейнере А: а) больше в 2 раза, б) такая же, в) меньше в 2 раза, г) нельзя однозначно определить. 45
Контрольный вопрос В контейнерах А и Б содержится при одной и той же температуре один и тот же идеальный газ одинаковой массы. Объем контейнера Б в 2 раза больше, чем объем контейнера А. Средняя кинетическая энергия поступательного движения в расчете на 1 молекулу газа в контейнере Б по сравнению с таковой в контейнере А: а) больше в 2 раза, б) такая же, в) меньше в 2 раза, г) нельзя однозначно определить. 45


