ЛЕКЦИЯ 8 ХИМИЯ ЭЛЕМЕНТОВ р















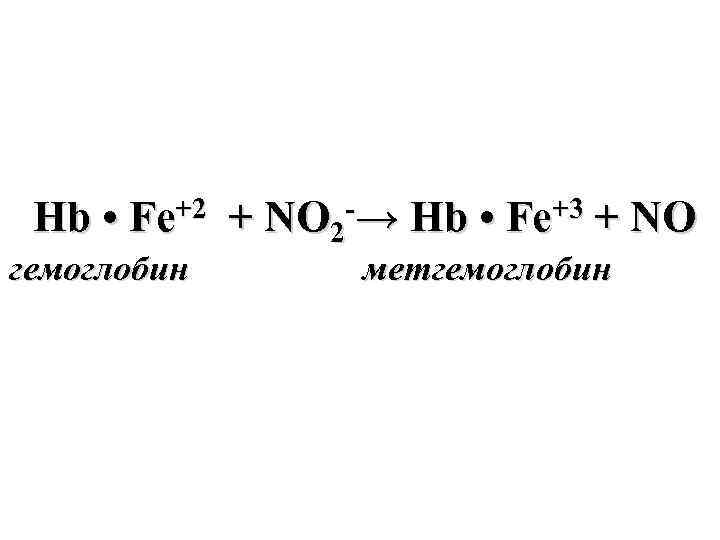








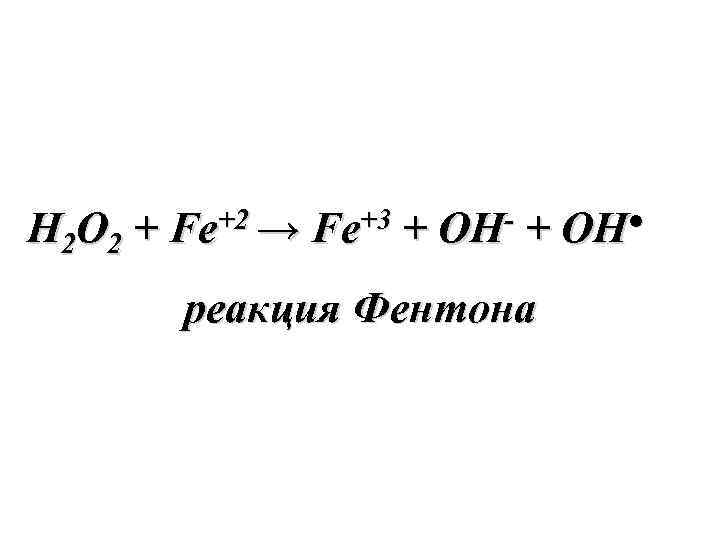







LEKTsIYa_8_Prezentatsia_Khimia_R-elem.ppt
- Количество слайдов: 38
 ЛЕКЦИЯ 8 ХИМИЯ ЭЛЕМЕНТОВ р - БЛОКА
ЛЕКЦИЯ 8 ХИМИЯ ЭЛЕМЕНТОВ р - БЛОКА
 Строение электронного уровня n S 2 n p a, a=1 ÷ 6
Строение электронного уровня n S 2 n p a, a=1 ÷ 6
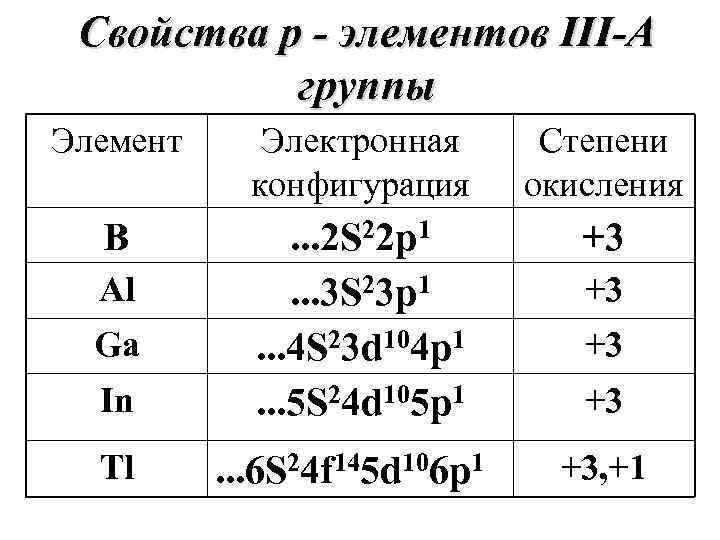
 Cвойства р - элементов III-А группы Элемент Электронная Степени конфигурация окисления В . . . 2 S 22 p 1 +3 Al . . . 3 S 23 p 1 +3 Ga . . . 4 S 23 d 104 p 1 +3 In . . . 5 S 24 d 105 p 1 +3 Tl . . . 6 S 24 f 145 d 106 p 1 +3, +1
Cвойства р - элементов III-А группы Элемент Электронная Степени конфигурация окисления В . . . 2 S 22 p 1 +3 Al . . . 3 S 23 p 1 +3 Ga . . . 4 S 23 d 104 p 1 +3 In . . . 5 S 24 d 105 p 1 +3 Tl . . . 6 S 24 f 145 d 106 p 1 +3, +1
 B (бор) – типичный неметалл (В 2 О 3) В 2 О 3 + Н 2 О = 2 НВО 2 – метаборная к-та НВО 2 + Н 2 О = Н 3 ВО 3 – ортоборная к-та В 2 О 3 + 3 Н 2 О = 2 Н 3 ВО 3 2 В 2 О 3 + Н 2 О = Н 2 В 4 О 7 -тетраборная кислота
B (бор) – типичный неметалл (В 2 О 3) В 2 О 3 + Н 2 О = 2 НВО 2 – метаборная к-та НВО 2 + Н 2 О = Н 3 ВО 3 – ортоборная к-та В 2 О 3 + 3 Н 2 О = 2 Н 3 ВО 3 2 В 2 О 3 + Н 2 О = Н 2 В 4 О 7 -тетраборная кислота
 Особенности Н 3 ВО 3 1)Кристаллическое вещество 2)Не растворяется в холодной воде 3)При нейтрализации щёлочью образуется соль тетраборной кислоты 4) 4 H 3 BO 3 + 2 Na. OH = Na 2 B 4 O 7 + 7 H 2 O 5) тетраборат натрия «бура»
Особенности Н 3 ВО 3 1)Кристаллическое вещество 2)Не растворяется в холодной воде 3)При нейтрализации щёлочью образуется соль тетраборной кислоты 4) 4 H 3 BO 3 + 2 Na. OH = Na 2 B 4 O 7 + 7 H 2 O 5) тетраборат натрия «бура»
 Al – типичный амфотерный элемент Al 2 O 3 проявляют амфотерные Al(OH)3 свойства
Al – типичный амфотерный элемент Al 2 O 3 проявляют амфотерные Al(OH)3 свойства
 Амфотерность алюминия 2 Al + 6 HCl +12 H 2 O= 2[Al(H 2 O)6]Cl 3 + 3 H 2 2 Al + 6 Na. OH + 6 H 2 O = 2 Na 3[Al(OH)6] + 3 H 2 3 Na 2 CO 3 + 2 Al. Cl 3+3 H 2 O =2 Al(OH)3↓+3 CO 2+ +6 Na. Cl
Амфотерность алюминия 2 Al + 6 HCl +12 H 2 O= 2[Al(H 2 O)6]Cl 3 + 3 H 2 2 Al + 6 Na. OH + 6 H 2 O = 2 Na 3[Al(OH)6] + 3 H 2 3 Na 2 CO 3 + 2 Al. Cl 3+3 H 2 O =2 Al(OH)3↓+3 CO 2+ +6 Na. Cl
 Применение соединений алюминия в медицине Al+3 + Pt = Al-Pt KAl(SO 4 ) 2 × 12 H 2 O – алюмокалиевые квас применяют наружно для промывания ран, для примочек, спринцеваний при воспалительных заболеваниях слизистых оболочек; (CH 3 COO) 3 Al – ацетат алюминия, (8%-ный раствор - жидкость Бурова), обладает вяжущим и противовоспалительным действием
Применение соединений алюминия в медицине Al+3 + Pt = Al-Pt KAl(SO 4 ) 2 × 12 H 2 O – алюмокалиевые квас применяют наружно для промывания ран, для примочек, спринцеваний при воспалительных заболеваниях слизистых оболочек; (CH 3 COO) 3 Al – ацетат алюминия, (8%-ный раствор - жидкость Бурова), обладает вяжущим и противовоспалительным действием
 Применение соединений алюминия в медицине Al 2 O 3 • Si. O 2 • 2 H 2 O – белая глина (каоли находит применение в стоматологии, входит в состав пломбировочного материала
Применение соединений алюминия в медицине Al 2 O 3 • Si. O 2 • 2 H 2 O – белая глина (каоли находит применение в стоматологии, входит в состав пломбировочного материала
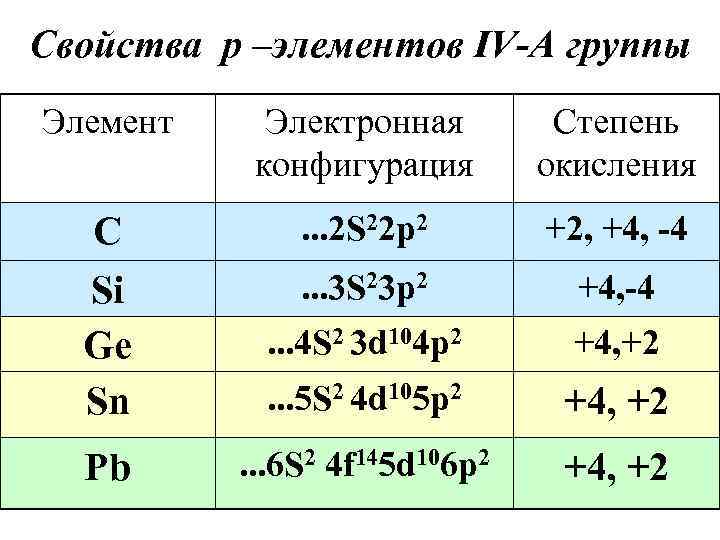
 Свойства р –элементов IV-А группы Элемент Электронная Степень конфигурация окисления С . . . 2 S 22 p 2 +2, +4, -4 Si . . . 3 S 23 p 2 +4, -4 Ge . . . 4 S 2 3 d 104 p 2 +4, +2 Sn . . . 5 S 2 4 d 105 p 2 +4, +2 Pb . . . 6 S 2 4 f 145 d 106 p 2 +4, +2
Свойства р –элементов IV-А группы Элемент Электронная Степень конфигурация окисления С . . . 2 S 22 p 2 +2, +4, -4 Si . . . 3 S 23 p 2 +4, -4 Ge . . . 4 S 2 3 d 104 p 2 +4, +2 Sn . . . 5 S 2 4 d 105 p 2 +4, +2 Pb . . . 6 S 2 4 f 145 d 106 p 2 +4, +2
 Hb. O 2 +CO ↔ Hb. CO + O 2 Hb + CO ↔ Hb. CO карбонил-гемоглобин
Hb. O 2 +CO ↔ Hb. CO + O 2 Hb + CO ↔ Hb. CO карбонил-гемоглобин
 Na 2 Si. O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 Si. O 3 Na 2 Si. O 3 + 2 H 2 O = 2 Na. OH +H 2 Si. O 3 K 2 O • Al 2 O 3 • 6 Si. O 2 – полевой шпат
Na 2 Si. O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 Si. O 3 Na 2 Si. O 3 + 2 H 2 O = 2 Na. OH +H 2 Si. O 3 K 2 O • Al 2 O 3 • 6 Si. O 2 – полевой шпат
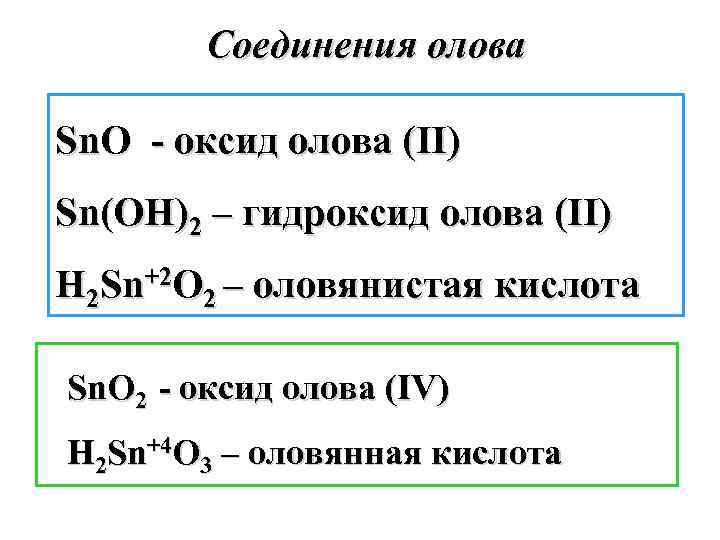
 Соединения олова Sn. O - оксид олова (II) Sn(OH)2 – гидроксид олова (II) H 2 Sn+2 O 2 – оловянистая кислота Sn. O 2 - оксид олова (IV) H 2 Sn+4 O 3 – оловянная кислота
Соединения олова Sn. O - оксид олова (II) Sn(OH)2 – гидроксид олова (II) H 2 Sn+2 O 2 – оловянистая кислота Sn. O 2 - оксид олова (IV) H 2 Sn+4 O 3 – оловянная кислота
 Соединения свинца Pb. O – оксид свинца (II) Pb(OH)2 – гидроксид свинца (II) H 2 Pb. O 2 – свинцовистая кислота Pb. O 2 – оксид свинца (IV) H 2 Pb. O 3 – свинцовая кислота
Соединения свинца Pb. O – оксид свинца (II) Pb(OH)2 – гидроксид свинца (II) H 2 Pb. O 2 – свинцовистая кислота Pb. O 2 – оксид свинца (IV) H 2 Pb. O 3 – свинцовая кислота
 Влияние свинца на организм Все соединения свинца (II) ядовиты Pb 3 O 4 – сурик Pb+2 Pb+4 O 3 – плюмбат свинца 3 Pb +2 + 2 PO 43 - → Pb 3(PO 4 )2 ↓
Влияние свинца на организм Все соединения свинца (II) ядовиты Pb 3 O 4 – сурик Pb+2 Pb+4 O 3 – плюмбат свинца 3 Pb +2 + 2 PO 43 - → Pb 3(PO 4 )2 ↓
 Влияние свинца на организм R-SH + Pb+2 +HS-R → R-S-Pb-S-R + 2 H+ E –Me+2 + Pb+2 → E×Pb+2 + Me+2 металлофермент
Влияние свинца на организм R-SH + Pb+2 +HS-R → R-S-Pb-S-R + 2 H+ E –Me+2 + Pb+2 → E×Pb+2 + Me+2 металлофермент
 Применение соединений свинца 1)(CH 3 COO)2 Pb× 3 H 2 O – ацетат свинца ( примочки) 2) Pb. O – входит в состав пластыря свинцового
Применение соединений свинца 1)(CH 3 COO)2 Pb× 3 H 2 O – ацетат свинца ( примочки) 2) Pb. O – входит в состав пластыря свинцового
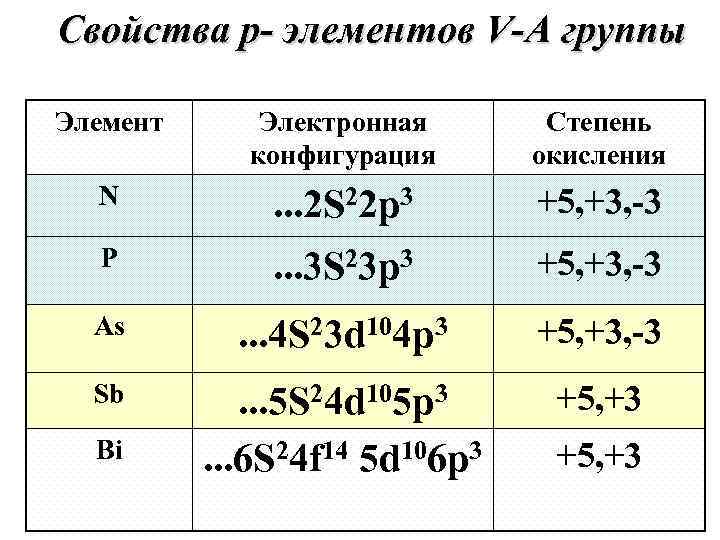
 Свойства p- элементов V-А группы Элемент Электронная Степень конфигурация окисления N . . . 2 S 22 p 3 +5, +3, -3 P . . . 3 S 23 p 3 +5, +3, -3 As . . . 4 S 23 d 104 p 3 +5, +3, -3 Sb . . . 5 S 24 d 105 p 3 +5, +3 Bi . . . 6 S 24 f 14 5 d 106 p 3 +5, +3
Свойства p- элементов V-А группы Элемент Электронная Степень конфигурация окисления N . . . 2 S 22 p 3 +5, +3, -3 P . . . 3 S 23 p 3 +5, +3, -3 As . . . 4 S 23 d 104 p 3 +5, +3, -3 Sb . . . 5 S 24 d 105 p 3 +5, +3 Bi . . . 6 S 24 f 14 5 d 106 p 3 +5, +3
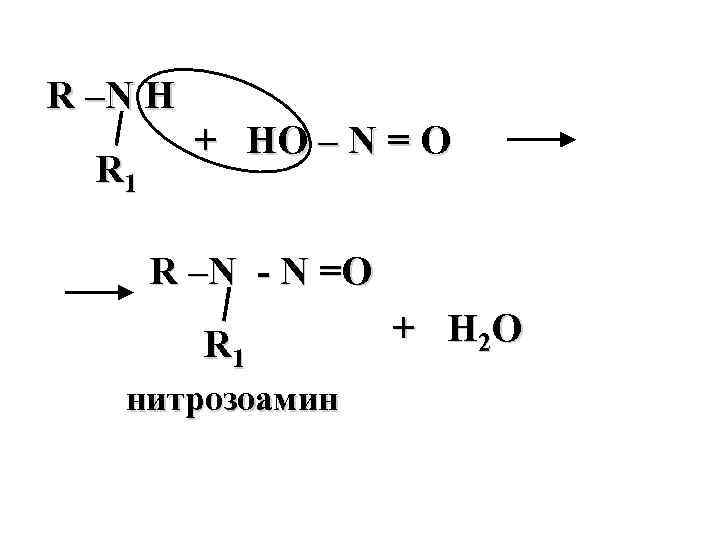
 R –N H + HO – N = O R 1 R –N - N =O R 1 + H 2 O нитрозоамин
R –N H + HO – N = O R 1 R –N - N =O R 1 + H 2 O нитрозоамин
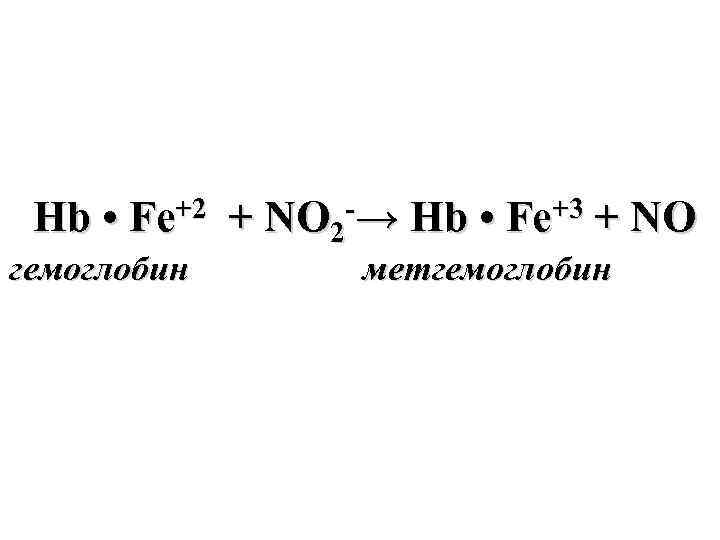 Hb • Fe+2 + NO 2 -→ Hb • Fe+3 + NO гемоглобин метгемоглобин
Hb • Fe+2 + NO 2 -→ Hb • Fe+3 + NO гемоглобин метгемоглобин
 СОЕДИНЕНИЯ ФОСФОРА Р+3–окислитель и восстановитель P 2 O 3 - оксид фосфора (III) P 2 O 3 + 3 H 2 O = 2 H 3 PO 3 фосфористая кислота (соли – фосфиты)
СОЕДИНЕНИЯ ФОСФОРА Р+3–окислитель и восстановитель P 2 O 3 - оксид фосфора (III) P 2 O 3 + 3 H 2 O = 2 H 3 PO 3 фосфористая кислота (соли – фосфиты)
 СОЕДИНЕНИЯ ФОСФОРА Р+5 – окислитель P 2 O 5 – оксид фосфора (V) P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 фосфорная к-та (соли – фосфаты) P 2 O 5 + 2 H 2 O=H 4 P 2 O 7 пирофосфорная кислота (соли – пирофосфаты)
СОЕДИНЕНИЯ ФОСФОРА Р+5 – окислитель P 2 O 5 – оксид фосфора (V) P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 фосфорная к-та (соли – фосфаты) P 2 O 5 + 2 H 2 O=H 4 P 2 O 7 пирофосфорная кислота (соли – пирофосфаты)
 СОЕДИНЕНИЯ МЫШЬЯКА As 2 O 3 – оксид мышьяка (амфотерный) H 3 As. O 3 – орто-мышьяковистая кислота (соли – арсениты) As 2 O 5 -оксид мышьяка (V) (кислотный) H 3 As. O 4 – ортомышьяковая кислот (соли - арсенаты)
СОЕДИНЕНИЯ МЫШЬЯКА As 2 O 3 – оксид мышьяка (амфотерный) H 3 As. O 3 – орто-мышьяковистая кислота (соли – арсениты) As 2 O 5 -оксид мышьяка (V) (кислотный) H 3 As. O 4 – ортомышьяковая кислот (соли - арсенаты)
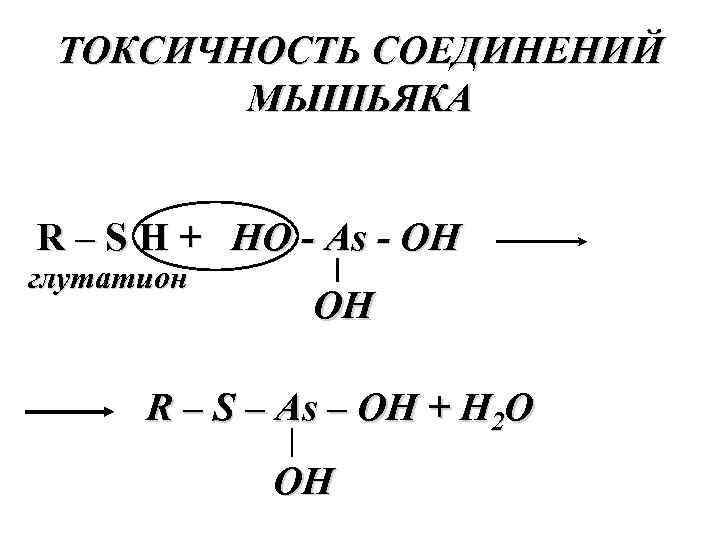
 ТОКСИЧНОСТЬ СОЕДИНЕНИЙ МЫШЬЯКА R – S H + HO - As - OH глутатион OH R – S – As – OH + H 2 O OH
ТОКСИЧНОСТЬ СОЕДИНЕНИЙ МЫШЬЯКА R – S H + HO - As - OH глутатион OH R – S – As – OH + H 2 O OH
 Определение мышьяка в биологическом материале проводят в приборе по реакции Марша As 2 O 3 + 6 Zn + 12 HCl = 2 As. H 3 + +6 Zn. Cl 2+ +3 H 2 O 2 As. H 3 = 2 As + 3 H 2 реакция Марша
Определение мышьяка в биологическом материале проводят в приборе по реакции Марша As 2 O 3 + 6 Zn + 12 HCl = 2 As. H 3 + +6 Zn. Cl 2+ +3 H 2 O 2 As. H 3 = 2 As + 3 H 2 реакция Марша
 СОЕИНЕНИЯ СУРЬМЫ И ВИСМУТА Sb 2 O 3 – амфотерный оксид H 3 Sb+3 O 3 –сурьмянистая кислота H 3 Sb+5 O 4 –сурьмяная кислота Bi 2 O 3 – основной оксид Bi(OH)3 - гидроксид висмута (III)
СОЕИНЕНИЯ СУРЬМЫ И ВИСМУТА Sb 2 O 3 – амфотерный оксид H 3 Sb+3 O 3 –сурьмянистая кислота H 3 Sb+5 O 4 –сурьмяная кислота Bi 2 O 3 – основной оксид Bi(OH)3 - гидроксид висмута (III)
 При гидролизе солей Sb+3 и Bi+3 образуются оксосоли: Sb. Cl 3 + H 2 O ↔ Sb. OCl + 2 HCl Bi(NO 3)3 + H 2 O ↔ Bi. ONO 3 + 2 HNO 3
При гидролизе солей Sb+3 и Bi+3 образуются оксосоли: Sb. Cl 3 + H 2 O ↔ Sb. OCl + 2 HCl Bi(NO 3)3 + H 2 O ↔ Bi. ONO 3 + 2 HNO 3
 Свойства p – элементов VI-А группы Элемент Электронная конфиурация Степень окисления О . . . 2 S 22 p 4 -2, +2 S . . . 3 S 23 p 4 -2, +4, +6 Se . . . 4 S 23 d 104 p 4 -2, +4, +6 Te . . . 5 S 24 d 105 p 4 -2, +4, +6 Po . . . 6 S 24 f 145 d 106 p 4
Свойства p – элементов VI-А группы Элемент Электронная конфиурация Степень окисления О . . . 2 S 22 p 4 -2, +2 S . . . 3 S 23 p 4 -2, +4, +6 Se . . . 4 S 23 d 104 p 4 -2, +4, +6 Te . . . 5 S 24 d 105 p 4 -2, +4, +6 Po . . . 6 S 24 f 145 d 106 p 4
 Активные формы кислорода Fe+2 -1 e- → Fe+3 O 2+e- → O 2 • - (супероксидный анион- радикал O 2 • - + 2 H+ → H 2 O 2 + O 2 • - → 2 OH● + O 2 • - → O 2* + OH- СИНГЛЕНТНЫЙ кислород
Активные формы кислорода Fe+2 -1 e- → Fe+3 O 2+e- → O 2 • - (супероксидный анион- радикал O 2 • - + 2 H+ → H 2 O 2 + O 2 • - → 2 OH● + O 2 • - → O 2* + OH- СИНГЛЕНТНЫЙ кислород
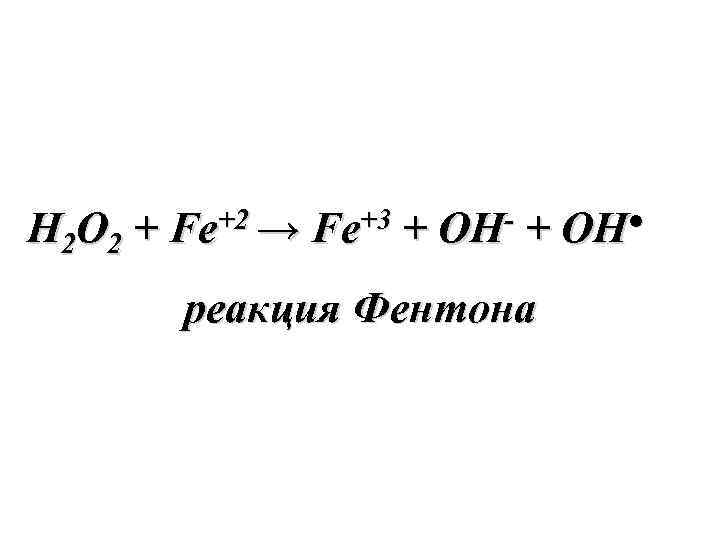 H 2 O 2 + Fe+2 → Fe+3 + OH- + OH● реакция Фентона
H 2 O 2 + Fe+2 → Fe+3 + OH- + OH● реакция Фентона
 СИСТЕМЫ ЗАЩИТЫ Супероксиддисмутаза (СОД) СОД O 2 • - + 2 H+ → H 2 O 2 + O 2 каталаза 2 H 2 O 2 → 2 H 2 O + O 2 глутатионпероксидаза R-S-H +H 2 O 2 → 2 H 2 O + R-S-S-R
СИСТЕМЫ ЗАЩИТЫ Супероксиддисмутаза (СОД) СОД O 2 • - + 2 H+ → H 2 O 2 + O 2 каталаза 2 H 2 O 2 → 2 H 2 O + O 2 глутатионпероксидаза R-S-H +H 2 O 2 → 2 H 2 O + R-S-S-R
 Применение соединений серы в медицине Na 2 S 2 O 3× 2 H 2 O - тиосульфат натрия S 2 O 32 - → SO 32 - + S 0 Pb 2+ + SO 32 - → Pb. SO 3↓ CN- + S 0 → NCS-
Применение соединений серы в медицине Na 2 S 2 O 3× 2 H 2 O - тиосульфат натрия S 2 O 32 - → SO 32 - + S 0 Pb 2+ + SO 32 - → Pb. SO 3↓ CN- + S 0 → NCS-
 СВОЙСТВА Р-ЭЛЕМЕНТОВ VII-А ГРУППЫ Элемент Электронная Степень конфигурация окисления F . . . 2 S 22 p 5 -1 Cl . . . 3 S 23 p 5 -1, +3, +5, +7 Br . . . 4 S 23 d 10 4 p 5 ― “ ― J . . . 5 S 24 d 10 5 p 5 -1, +3, +5 At . . . 6 S 24 f 145 d 10 6 p 5
СВОЙСТВА Р-ЭЛЕМЕНТОВ VII-А ГРУППЫ Элемент Электронная Степень конфигурация окисления F . . . 2 S 22 p 5 -1 Cl . . . 3 S 23 p 5 -1, +3, +5, +7 Br . . . 4 S 23 d 10 4 p 5 ― “ ― J . . . 5 S 24 d 10 5 p 5 -1, +3, +5 At . . . 6 S 24 f 145 d 10 6 p 5
 HF < HCl < HBr < HJ кислотность возрастает Cl 2 + H 2 O = HCl + HCl. O хлорноватистая (гипохлористая) кислота HCl. O + hν = HCl + [O]
HF < HCl < HBr < HJ кислотность возрастает Cl 2 + H 2 O = HCl + HCl. O хлорноватистая (гипохлористая) кислота HCl. O + hν = HCl + [O]
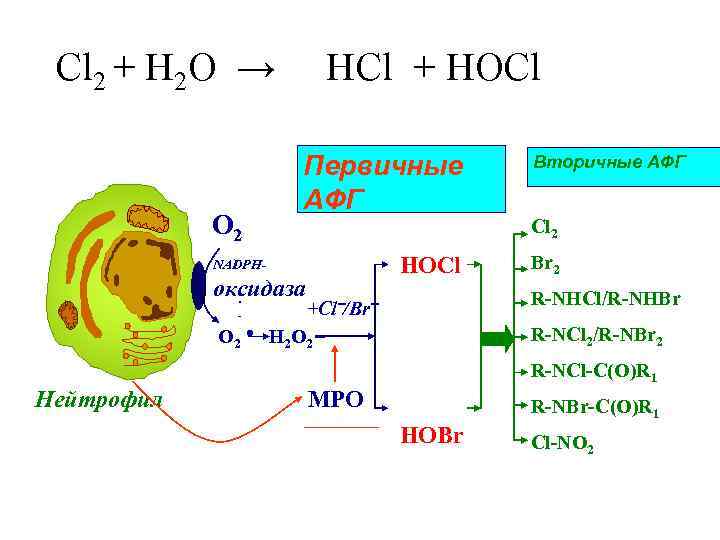
 Cl 2 + H 2 O → HСl + HOCl Первичные Вторичные АФГ O 2 Cl 2 NADPH- HOCl Br 2 оксидаза . R-NHCl/R-NHBr - +Cl‾/Br‾ O 2 ● H 2 O 2 R-NCl 2/R-NBr 2 R-NCl-C(O)R 1 Нейтрофил MPO R-NBr-C(O)R 1 HOBr Cl-NO 2
Cl 2 + H 2 O → HСl + HOCl Первичные Вторичные АФГ O 2 Cl 2 NADPH- HOCl Br 2 оксидаза . R-NHCl/R-NHBr - +Cl‾/Br‾ O 2 ● H 2 O 2 R-NCl 2/R-NBr 2 R-NCl-C(O)R 1 Нейтрофил MPO R-NBr-C(O)R 1 HOBr Cl-NO 2
 Применение галогенов в медицине 1) Na. F –употребляют в качестве местно действующего наружного средства (зубная паста) Na. F + Ca 5(PO 4)3 OH=Na. OH+ Ca 5(PO 4)3 F
Применение галогенов в медицине 1) Na. F –употребляют в качестве местно действующего наружного средства (зубная паста) Na. F + Ca 5(PO 4)3 OH=Na. OH+ Ca 5(PO 4)3 F
 Применение галогенов в медицине 2) J 2 – в виде 5% спиртового раствора для стерилизации ран; 3) Na. J – для лечения зоба, щитовидной железы; 4) KJ – для лечения глазных заболеваний, катаракты, глаукомы
Применение галогенов в медицине 2) J 2 – в виде 5% спиртового раствора для стерилизации ран; 3) Na. J – для лечения зоба, щитовидной железы; 4) KJ – для лечения глазных заболеваний, катаракты, глаукомы
 Применение галогенов в медицине 5) Cl 2 – для обеззараживания питьевой воды; 6) HCl - применяется внутрь при недостаточной кислотности желудочного сока; 7) Na. Br – в качестве успокаивающего средства при нервных расстройствах
Применение галогенов в медицине 5) Cl 2 – для обеззараживания питьевой воды; 6) HCl - применяется внутрь при недостаточной кислотности желудочного сока; 7) Na. Br – в качестве успокаивающего средства при нервных расстройствах

