lection_8_Yanukovich.ppt
- Количество слайдов: 19
 Лекция 8. Термодинамика. Реальные газы 1. 2. 3. 4. 5. 6. Циклические процессы. Энтропия. II и III начала термодинамики. Силы молекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Адиабатический процесс. Уравнение Пуассона
Лекция 8. Термодинамика. Реальные газы 1. 2. 3. 4. 5. 6. Циклические процессы. Энтропия. II и III начала термодинамики. Силы молекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Адиабатический процесс. Уравнение Пуассона
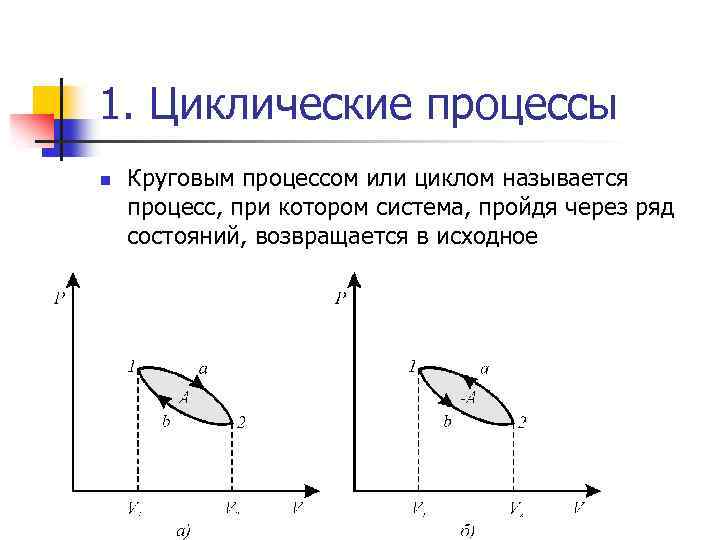 1. Циклические процессы n Круговым процессом или циклом называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное
1. Циклические процессы n Круговым процессом или циклом называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное
 Первое начало термодинамики для кругового процесса n n система может как отдавать, так и получать энергию количество теплоты, полученное системой количество теплоты, отданное системой Термический коэффициент полезного действия для кругового процесса
Первое начало термодинамики для кругового процесса n n система может как отдавать, так и получать энергию количество теплоты, полученное системой количество теплоты, отданное системой Термический коэффициент полезного действия для кругового процесса
 Обратимые и необратимые процессы n n Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлениях. Причём такой процесс происходит сначала в прямом, а затем в обратном направлении, и система возвращается в исходное состояние. Всякий процесс, не удовлетворяющий этим условиям – необратимый.
Обратимые и необратимые процессы n n Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлениях. Причём такой процесс происходит сначала в прямом, а затем в обратном направлении, и система возвращается в исходное состояние. Всякий процесс, не удовлетворяющий этим условиям – необратимый.
 2. Энтропия n n n Приведенным количеством теплоты называется отношение теплоты , полученной телом в изотермическом процессе, к температуре теплоотдающего тела. Приведённое количество теплоты, сообщённое телу в любом обратимом круговом процессе, равно 0 Функция состояния называется энтропией и обозначается S
2. Энтропия n n n Приведенным количеством теплоты называется отношение теплоты , полученной телом в изотермическом процессе, к температуре теплоотдающего тела. Приведённое количество теплоты, сообщённое телу в любом обратимом круговом процессе, равно 0 Функция состояния называется энтропией и обозначается S
 n n Для обратимых процессов Энтропия системы, совершающей необратимый цикл, возрастает Неравенство Клаузиуса Физический смысл имеет не сама энтропия, а ее изменение при переходе из одного состояния в другое
n n Для обратимых процессов Энтропия системы, совершающей необратимый цикл, возрастает Неравенство Клаузиуса Физический смысл имеет не сама энтропия, а ее изменение при переходе из одного состояния в другое
 Адиабатический процесс n n Для адиабатического процесса (процесс, при котором отсутствует теплообмен между системой и окружающей средой) d. Q=0, то изменение энтропии DS=0 и, следовательно, S=const, т. е. адиабатический процесс протекает при постоянной энтропии. Адиабатический процесс называют изоэнтропийным.
Адиабатический процесс n n Для адиабатического процесса (процесс, при котором отсутствует теплообмен между системой и окружающей средой) d. Q=0, то изменение энтропии DS=0 и, следовательно, S=const, т. е. адиабатический процесс протекает при постоянной энтропии. Адиабатический процесс называют изоэнтропийным.
 Энтропия при изопроцессах n Изотермический процесс n Изохорный процесс n n n Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Энтропия связывается с термодинамической вероятностью состояния системы согласно Больцману термодинамическая вероятность состояния системы
Энтропия при изопроцессах n Изотермический процесс n Изохорный процесс n n n Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Энтропия связывается с термодинамической вероятностью состояния системы согласно Больцману термодинамическая вероятность состояния системы
 Термодинамическая вероятность n n число способов, которыми может быть реализовано данное состояние макроскопической физической системы, или число микросостояний, осуществляющих данное макросостояние. статистическое толкование энтропии : является мерой неупорядоченности системы. Чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
Термодинамическая вероятность n n число способов, которыми может быть реализовано данное состояние макроскопической физической системы, или число микросостояний, осуществляющих данное макросостояние. статистическое толкование энтропии : является мерой неупорядоченности системы. Чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
 3. Второе и третье начало термодинамики n n n II начало термодинамики гласит: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает. Возрастание энтропии означает переход из менее вероятных в более вероятные состояния. III начало термодинамики: энтропия всех тел в состоянии равновесия стремится к 0 по мере приближения температуры к нулю Кельвина
3. Второе и третье начало термодинамики n n n II начало термодинамики гласит: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает. Возрастание энтропии означает переход из менее вероятных в более вероятные состояния. III начало термодинамики: энтропия всех тел в состоянии равновесия стремится к 0 по мере приближения температуры к нулю Кельвина
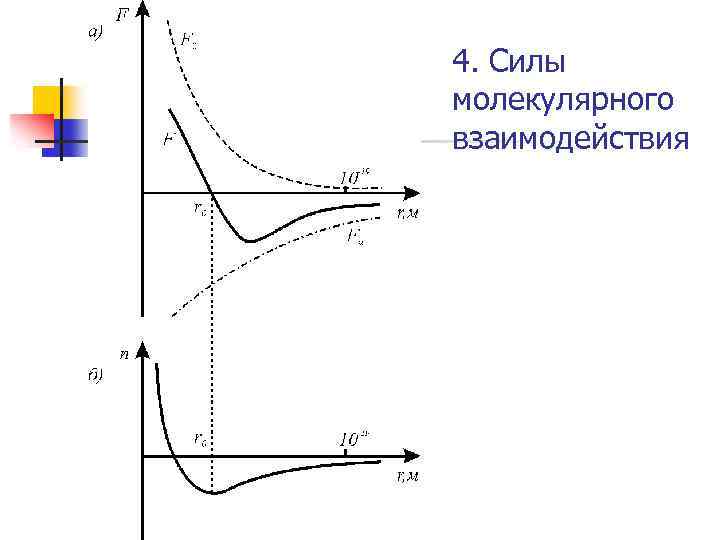 4. Силы молекулярного взаимодействия
4. Силы молекулярного взаимодействия
 5. Уравнение Ван-дер. Ваальса n n n С учётом собственного объёма молекул объём одного моля, в котором могут двигаться молекулы реального газа объём, занимаемый самими молекулам действие сил притяжения газа приводит к появлению внутреннего давления постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения молярный объём
5. Уравнение Ван-дер. Ваальса n n n С учётом собственного объёма молекул объём одного моля, в котором могут двигаться молекулы реального газа объём, занимаемый самими молекулам действие сил притяжения газа приводит к появлению внутреннего давления постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения молярный объём
 Уравнение Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса
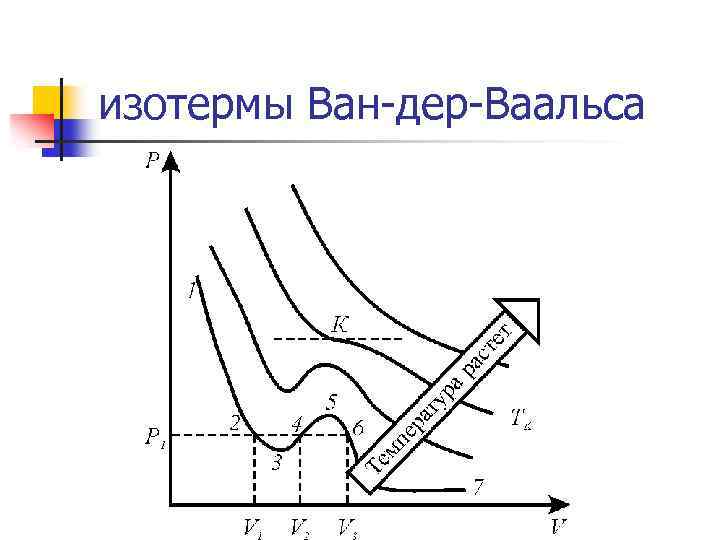 изотермы Ван-дер-Ваальса
изотермы Ван-дер-Ваальса
 n n При высоких температурах изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы, оставаясь монотонной спадающей кривой. При некоторой температуре на изотерме имеется лишь одна точка перегиба. Эта изотерма называется критической, соответствующая этой температуре точка К - критической точкой; в этой точке касательная к ней параллельна оси абсцисс. При низких температурах : Часть 6 -7 отвечает газообразному состоянию, часть 2 -1 – жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 -2, наблюдается равновесие жидкой и газообразной фаз вещества. В газообразном состоянии при температуре ниже критической вещество называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Состояние с критическими параметрами называется критическим состоянием.
n n При высоких температурах изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы, оставаясь монотонной спадающей кривой. При некоторой температуре на изотерме имеется лишь одна точка перегиба. Эта изотерма называется критической, соответствующая этой температуре точка К - критической точкой; в этой точке касательная к ней параллельна оси абсцисс. При низких температурах : Часть 6 -7 отвечает газообразному состоянию, часть 2 -1 – жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 -2, наблюдается равновесие жидкой и газообразной фаз вещества. В газообразном состоянии при температуре ниже критической вещество называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Состояние с критическими параметрами называется критическим состоянием.
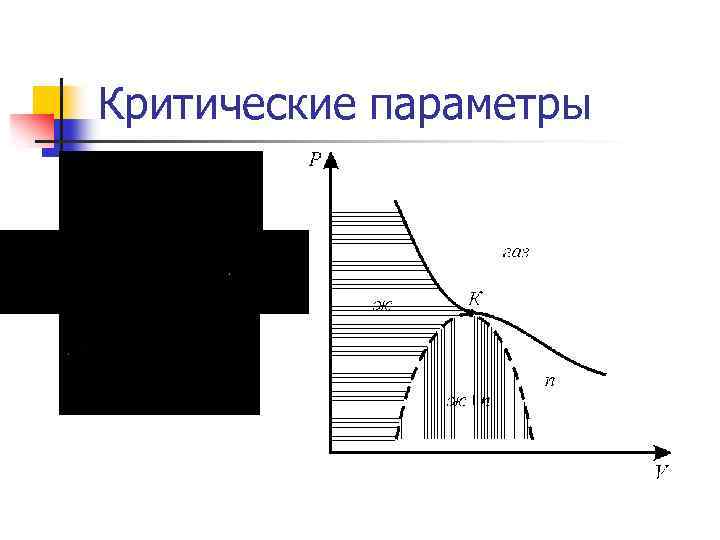 Критические параметры
Критические параметры
 Адиабатический процесс. Уравнение Пуассона n n Адиабатическим называется процесс, при котором отсутствует теплообмен вещества с окружающей средой, например распространение звука в среде Из I начала термодинамики для адиабатического процесса внешняя работа осуществляется за счёт изменения внутренней энергии молярная теплоёмкость газа при постоянном объёме
Адиабатический процесс. Уравнение Пуассона n n Адиабатическим называется процесс, при котором отсутствует теплообмен вещества с окружающей средой, например распространение звука в среде Из I начала термодинамики для адиабатического процесса внешняя работа осуществляется за счёт изменения внутренней энергии молярная теплоёмкость газа при постоянном объёме
 Уравнение Пуассона
Уравнение Пуассона
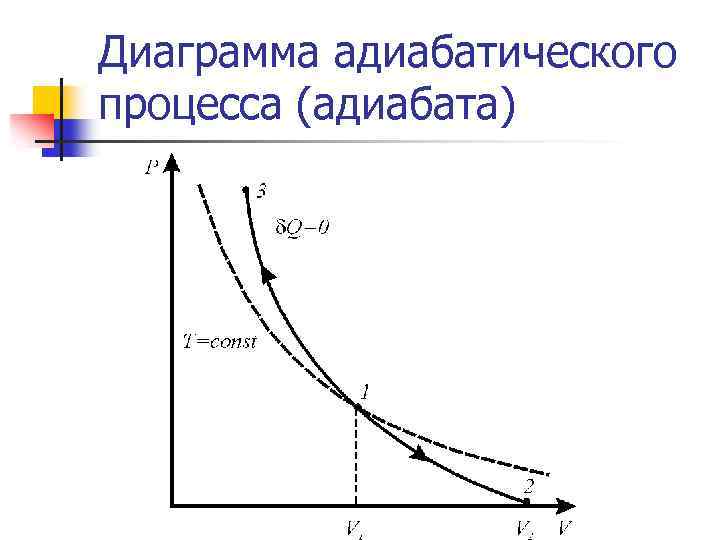 Диаграмма адиабатического процесса (адиабата)
Диаграмма адиабатического процесса (адиабата)


