Галогенопроизводные.Спирты.Тиоаналоги.pptx
- Количество слайдов: 97

Лекция № 8: Реакционная способность галогенопроизводных. 1. Классификация. Номенклатура. Особенности строения. Реакционные центры. 2. Реакции нуклеофильного замещения (SN) и реакции отщепления (E). 3. Реакции восстановления, электрофильного замещения, электрофильного присоединения, полимеризации. 4. Способы получения (с. 300 -301). 5. Отдельные представители. (с. 334 -336). Лектор: Атавина Ольга Васильевна кандидат биологических наук доцент кафедры общей и биоорганической химии

Классификация. Номенклатура. Особенности строения. Реакционные центры. Галогенопроизводными называют производные углеводородов, в которых один или несколько атомов водорода замещены на атомы галогена. Классификация. Номенклатура. I. В зависимости от строения радикала, связанного с галогеном различают предельные, непредельные, циклические, ароматические галогенопроизводные: CH 3 I – иодометан (метилиодид) CH 2=CHCl – хлороэтен (винилхлорид) бромоциклогексан (циклогексилбромид) 2 -хлоротиофен хлоробензол (фенилхлорид)

Классификация. Номенклатура. Особенности строения. Реакционные центры. II. В зависимости от типа галогена различают хлоро-, бромо-, фторо-, иодопроизводные. III. В зависимости от количества галогенов различают моно-, ди-, три-, …, полигалогенопроизводные. IV. В зависимости от характера углеродного звена различают первичные, вторичные, третичные галогенопроизводные. CH 3 -CH 2 -Br бромопропан 2 -бромо-2 -метилпропан

Классификация. Номенклатура. Особенности строения. Реакционные центры. Наличие в молекулах галогенопроизводных электроотрицательного атома галогена приводит к перераспределению электронной плотности, в результате чего возникает два реакционных центра: • электрофильный центр — атом углерода, связанный с галогеном; • СН-кислотный центр — полярная связь С—Н у атома углерода в β-положении к галогену.

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Реакции нуклеофильного замещения и реакции отщепления. Электрофильный центр может подвергаться атаке нуклеофилом. В результате чего могут осуществляться реакции нуклеофильного замещения (SN), т. е. замещение галогена на нуклеофил. За счет подвижного протона CH-кислотного центра параллельно с реакциями SN могут протекать реакции отщепления галогеноводорода (βэлиминирование (Е)). Субстрат реагент нуклеофил (основание)

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Например: Этанол Хлороэтан Этен Реакции SN и Е конкурируют друг с другом и в определенных условиях может преобладать одна из них.

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Реакции нуклеофильного замещения (SN) Реакции SN в галогеноалканах протекают только в растворах. Чем больше полярность связи C-X, тем больше реакционная способность в реакциях SN, поэтому реакционная способность уменьшается в ряду: R-I > R-Br > R-Cl Соединения со связью C-F чрезвычайно устойчивы и практически не вступают в реакции SN.

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Первичные алкилгалогениды и вторичные с небольшими по объему заместителями реагируют преимущественно по SN 2 механизму (бимолекулярное, второго порядка), третичные по SN 1 (мономолекуляное, первого порядка). В реакциях SN 2 скорость реакции пропорциональна концентрации обоих реагирующих веществ (и субстрата и нуклеофила): V = k [Nu-] [RX] В реакциях SN 1 скорость определяется самой медленной стадией, в которой участвует только одно соединение – субстрат: V = k [RX]
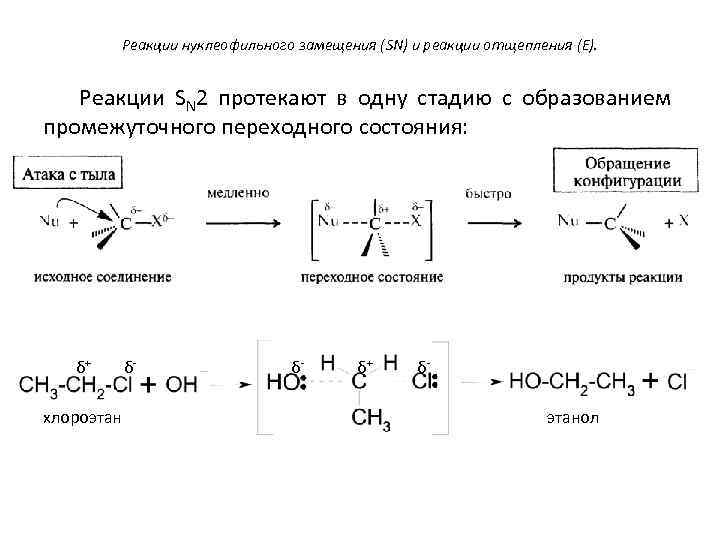
Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Реакции SN 2 протекают в одну стадию с образованием промежуточного переходного состояния: δ+ хлороэтан δ- δ- δ+ δэтанол
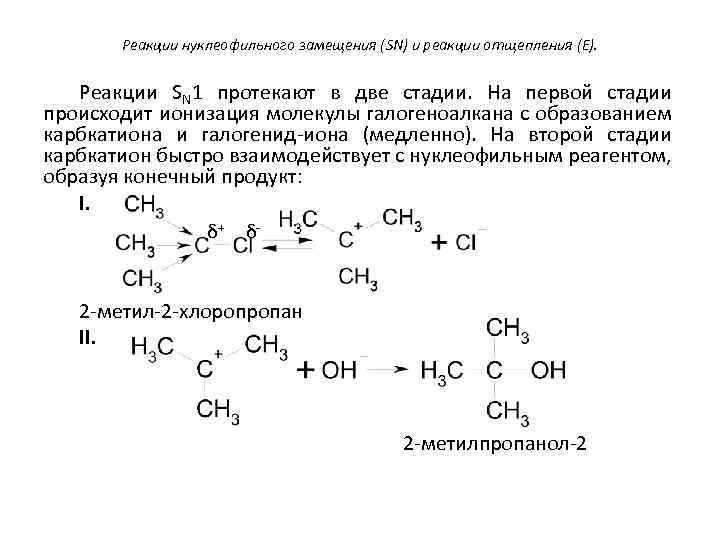
Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Реакции SN 1 протекают в две стадии. На первой стадии происходит ионизация молекулы галогеноалкана с образованием карбкатиона и галогенид-иона (медленно). На второй стадии карбкатион быстро взаимодействует с нуклеофильным реагентом, образуя конечный продукт: I. δ+ δ- 2 -метил-2 -хлоропропан II. 2 -метилпропанол-2

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Оптически активные третичные галогениды в которых галоген связан с ассиметрическим атомом углерода в реакциях SN 1 образуют рацематы: 3 -бромогексан D-3 -метилгексанол-3 L-3 -метилгексанол-3 рацемическая смесь

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Примеры реакций SN для галогеноалканов: 1. Гидролиз. При этом образуются спирты: CH 3 CH 2 Br + HOH CH 3 CH 2 OH + HBr Реакция обратима, поэтому гидролиз проводят в присутствии водного раствора щелочей при нагревании: CH 3 CH 2 Br + Na. OH(водн) CH 3 CH 2 OH + Na. Br 2. Взаимодействие с алкоголятами и фенолятами (р-я Вильямсона). Используют для получения простых эфиров: CH 3 CH 2 Br + C 2 H 5 ONa H 5 C 2 -O-C 2 H 5 + Na. Br CH 3 CH 2 Br + C 6 H 5 ONa H 5 C 2 -O-C 6 H 5 + Na. Br

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). 3. С солями карбоновых кислот, при этом образуются сложные эфиры: CH 3 CH 2 Br + CH 3 СOONa H 3 C-COO-C 2 H 5 + Na. Br 4. С аммиаком образуются амины: CH 3 CH 2 Br + 2 NH 3 H 3 C-CH 2 -NH 2 + NH 4 Br С избытком NH 3 образуется смесь первичных, вторичных, третичных аминов. 5. С солями циановодородной кислоты образуются нитрилы CH 3 CH 2 Br + KCN H 3 C-CH 2 -C N + KBr 6. С солями азотистой кислоты образуется нитросоединения CH 3 CH 2 Br + Na. NO 2 H 3 C-CH 2 -NO 2 + Na. Br

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). 7. С гидросульфидамии и сульфидами щелочных металлов образуются тиолы и диалкилсульфиды: CH 3 CH 2 Br + Na. SH H 3 C-CH 2 -SH + Na. Br 2 CH 3 CH 2 Br + Na 2 S H 3 C-CH 2 -S-CH 2 -CH 3 + 2 Na. Br 8. С солями галогеноводородных кислот (р-я Финкельштейна): ацетон CH 3 CH 2 Br + Na. I H 3 C-CH 2 -I + Na. Br Реакция имеет практическое значение для получения первичных фторо- и иодоалканов из более доступных хлорои бромопроизводных.
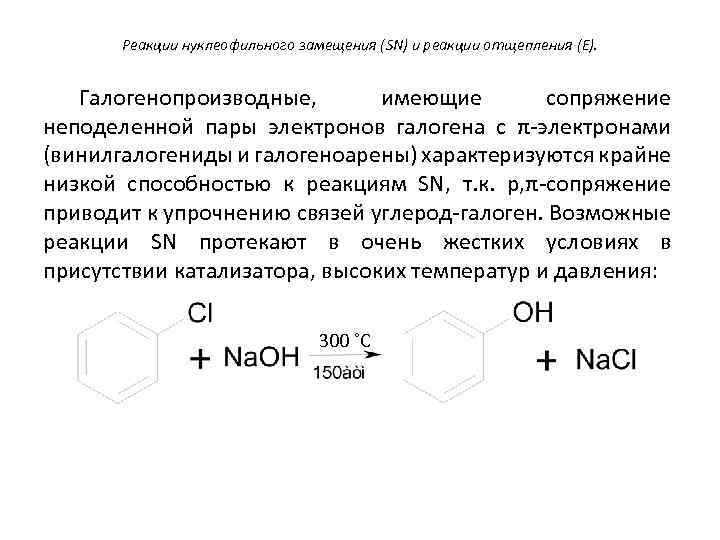
Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Галогенопроизводные, имеющие сопряжение неподеленной пары электронов галогена с π-электронами (винилгалогениды и галогеноарены) характеризуются крайне низкой способностью к реакциям SN, т. к. p, π-сопряжение приводит к упрочнению связей углерод-галоген. Возможные реакции SN протекают в очень жестких условиях в присутствии катализатора, высоких температур и давления: 300 ˚С
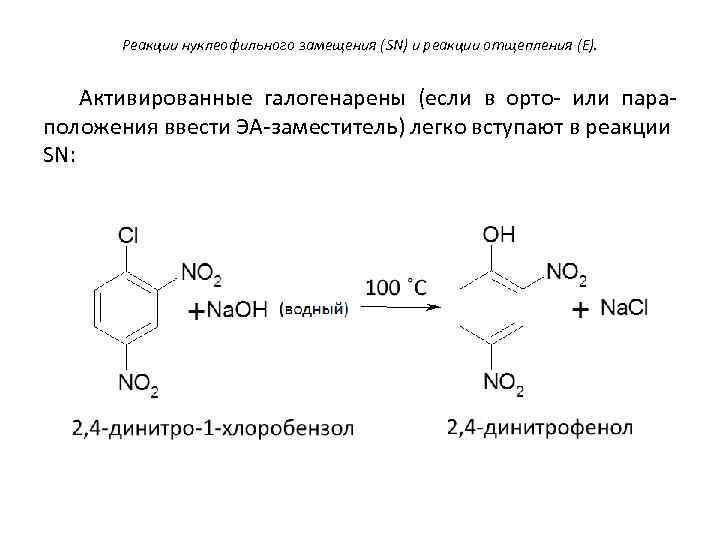
Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Активированные галогенарены (если в орто- или параположения ввести ЭА-заместитель) легко вступают в реакции SN:

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Реакции отщепления. Правило Зайцева. Процесс отщепления (элиминирования) становится доминирующим в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов. Элиминированию способствуют также повышение температуры реакционной смеси и концентрации реагентов. По склонности к реакциям элиминирования галогеналканы располагают в ряд: R-I > R-Br > R-Cl > R-F Благоприятное влияние также оказывает увеличение количества заместителей у электрофильного атома углерода, поэтому наиболее легко протекает элиминирование у третичных галогеналканов.

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Правило Зайцева гласит: Если в молекуле галогеноалкана имеется несколько возможных путей отщепления галогеноводорода, то преимущественно реализуется тот, по которому двойная связь образуется у наиболее замещенного атома углерода; то есть, вместе с галогеном уходит водород от соседнего наименее гидрогенизованного атома углерода. Например: CH 3 CH(Cl)CH 2 CH 3 + Na. OH (спирт) CH 3 -CH=CH-CH 3 Аналогично нуклеофильному замещению реакции отщепления у галогеноалканов могут протекать по бимолекулярному E 2 и мономолекулярному E 1 механизмам. Наиболее легко элиминирование по Е 2 протекает у первичных галогеналканов, по Е 1 – у третичных.

Реакции нуклеофильного замещения (SN) и реакции отщепления (E). Механизмы Е 2 и Е 1 имеют большое сходство с SN 2 и SN 1. Например, различия между SN 2 и Е 2 состоит в том, что частица с неподеленной электронной парой или несущая отрицательный заряд атакует электрофильный атом углерода по механизму SN 2 как нуклеофил, а по механизму Е 2 как основание. Механизм Е 2:

Реакции восстановления, электрофильного замещения, электрофильного присоединения, полимеризации. 1. При взаимодействии галогеналканов и галогенаренов с магнием в среде безводного диэтилового эфира образуются магнийорганические соединения (реактивы Гриньяра): C 2 H 5 Cl + Mg C 2 H 5 -Mg. Cl этилмагнийхлорид Реактивы Гриньяра являются очень реакционными соединениями, сильными нуклеофильными реагентами и сильными основаниями.

Реакции восстановления, электрофильного замещения, электрофильного присоединения, полимеризации. 2. В реакции с металлическим натрием металлорганические соединения образуются в качестве промежуточных продуктов в реакциях Вюрца и Вюрца-Фиттига, например: 2 C 6 H 5 -Br + 2 Na C 6 H 5 -C 6 H 5 + 2 Na. Br бифенил I. C 6 H 5 -Br + 2 Na C 6 H 5 Na + Na. Br фенилнатрий II. C 6 H 5 Na + C 6 H 5 -Br C 6 H 5 -C 6 H 5 + Na. Br 3. Галогеноалканы восстанавливаются водородом (в присутствии катализатора) или HI с образованием алканов: C 2 H 5 Cl C 2 H 6
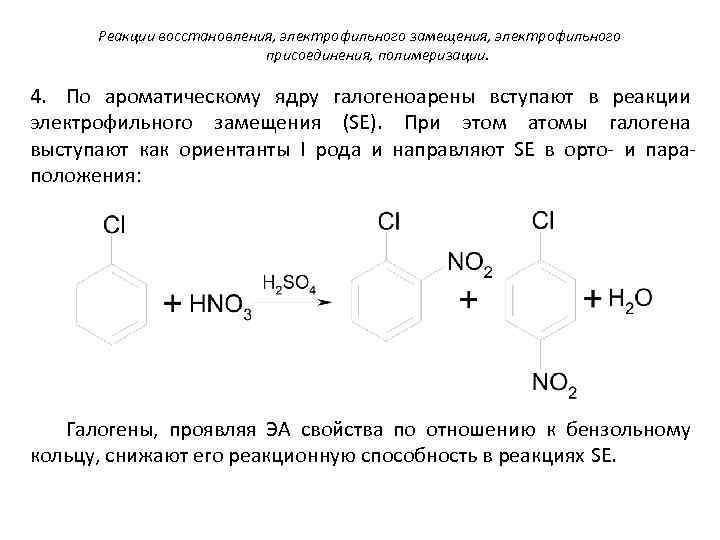
Реакции восстановления, электрофильного замещения, электрофильного присоединения, полимеризации. 4. По ароматическому ядру галогеноарены вступают в реакции электрофильного замещения (SE). При этом атомы галогена выступают как ориентанты I рода и направляют SE в орто- и параположения: Галогены, проявляя ЭА свойства по отношению к бензольному кольцу, снижают его реакционную способность в реакциях SE.

Реакции восстановления, электрофильного замещения, электрофильного присоединения, полимеризации. 5. Р-и электрофильного присоединения (AE) непредельных галогенопроизводных протекает по правилу Марковникова: CH 2=CH-Cl + HCl винилхлорид 1, 1 -дихлороэтан За счет отрицательного индуктивного эффекта галогена непредельные галогенопроизводные труднее вступают в реакцию AE, чем соответствующие им алкены. 6. В присутствии катализатора винилгалогениды легко вступают в реакции полимеризации, которые в промышленности используют для получения полимеров: поливинилхлорид
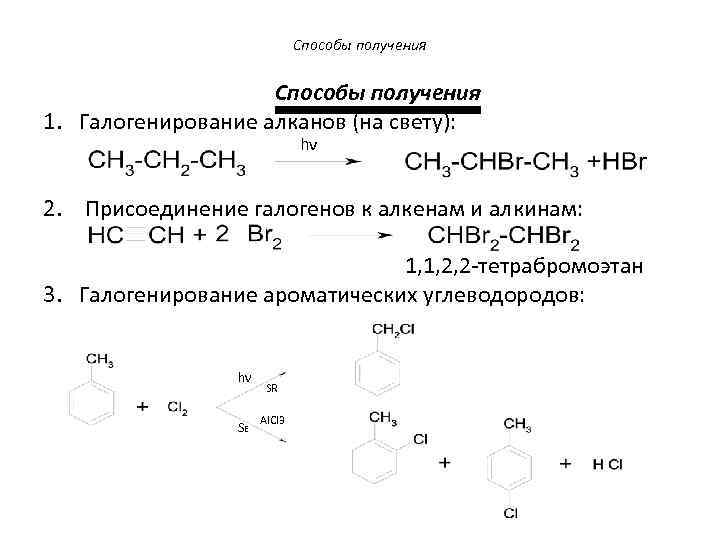
Способы получения 1. Галогенирование алканов (на свету): hν 2. Присоединение галогенов к алкенам и алкинам: 1, 1, 2, 2 -тетрабромоэтан 3. Галогенирование ароматических углеводородов: hν SE SR Al. Cl 3

Способы получения 4. Из спиртов: 5. Из карбонильных соединений (альдегидов и кетонов)

ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ ОРГАНИЧЕСКАЯ ХИМИЯ Лекция 9 Реакционная способность спиртов и их тиоаналогов. 1. 2. 3. 4. 5. 6. Классификация. Номенклатура. Особенности строения. Кислотные и основные свойства. Нуклеофильные свойства. Реакции с участием электрофильного центра (реакции нуклеофильного замещения). Реакции с участием С-Н-кислотного центра (реакции элиминирования). Реакции окисления. Лектор: кандидат биологических наук, доцент Атавина Ольга Васильевна
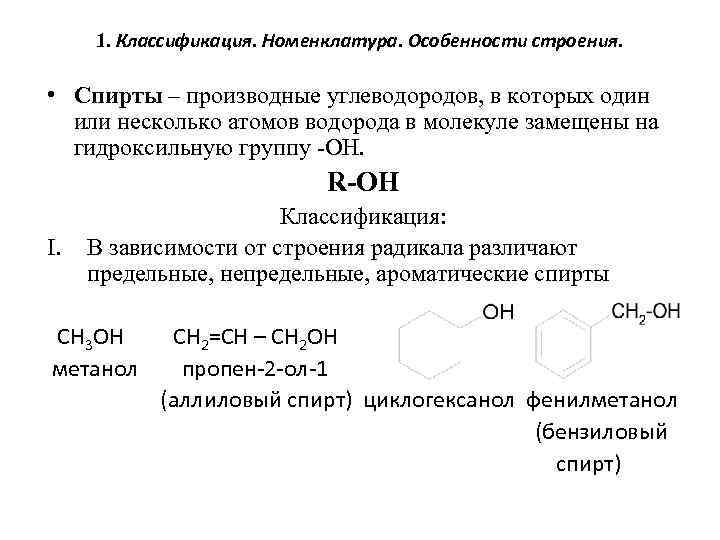
1. Классификация. Номенклатура. Особенности строения. • Спирты – производные углеводородов, в которых один или несколько атомов водорода в молекуле замещены на гидроксильную группу -ОН. R-OH I. Классификация: В зависимости от строения радикала различают предельные, непредельные, ароматические спирты CH 3 OH метанол CH 2=CH – CH 2 OH пропен-2 -ол-1 (аллиловый спирт) циклогексанол фенилметанол (бензиловый спирт)
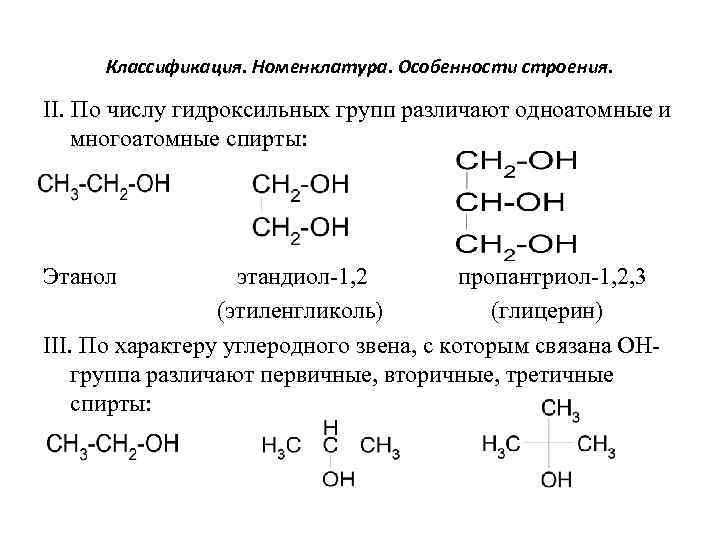
Классификация. Номенклатура. Особенности строения. II. По числу гидроксильных групп различают одноатомные и многоатомные спирты: Этанол этандиол-1, 2 пропантриол-1, 2, 3 (этиленгликоль) (глицерин) III. По характеру углеродного звена, с которым связана ОНгруппа различают первичные, вторичные, третичные спирты:

Классификация. Номенклатура. Особенности строения.

Классификация. Номенклатура. Особенности строения.

Классификация. Номенклатура. Особенности строения. • Тиоаналогами спиртов являются тиолы. R-SH • Тиолы – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены меркаптогруппой –SH. • Тиолы, в которых меркаптогруппа связана с алифатическим радикалом, называют тиоспиртами; с ароматическим радикалом – тиофенолами. метантиол этандитиол-1, 2 меркаптобензол (тиофенол)

2. Кислотные и основные свойства. • Спирты проявляют слабые кислотные и слабые основные свойства, то есть являются амфотерными веществами. • Кислотные свойства спиртов обусловлены подвижностью атомов водорода гидроксигруппы. • Спирты как кислоты реагируют со щелочными металлами, образуя алкоголяты, которые в растворах гидролизуются: 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 CH 2 ONa + H 2 O → CH 3 CH 2 OH + Na. OH Тиолы проявляют более выраженные кислотные свойства, чем спирты вследствие более высокой поляризуемости атома серы. При действии щелочей образуются соли – тиоляты, которые в растворах также в значительной степени гидролизованы. CH 3 CH 2 SH + Na. OH → CH 3 CH 2 ONa + H 2 O

Кислотные и основные свойства. • Особый интерес представляют реакции многоатомных спиртов с гидроксидом меди (II) с образованием хелатного комплекса синего цвета (качественная реакция на виц-диольный фрагмент): глицерин анионный хелатный комплекс глицерат меди (II)

Кислотные и основные свойства. • Основные свойства спиртов обусловлены наличием на атоме кислорода гидроксильной группы неподеленной пары электронов, способных присоединять протон. Так, с сильными кислотами первичные спирты на холоде образуют неустойчивые соли алкилоксония: Этилоксония бромид При переходе от первичных к третичным спиртам основные свойства возрастают, что связано с увеличением числа ЭД алкильных радикалов, усиливающих электронную плотность на атоме кислорода. • Основные свойства у тиолов практически отсутствуют.

3. Нуклеофильные свойства. • Реакции протекают с участием нуклеофильного центра, при этом сам спирт (или тиол) выступает как нуклеофил. 1. Реакции алкилирования. При этом спирты образуют простые эфиры. Нуклеофильность спиртов значительно возрастает, если превратить их в алкоксиды щелочных металлов, например, синтез Вильямсона: В результате алкилирования тиолов образуются диалкилсульфиды по схеме: Тиолы обладают более высокой нуклеофильностью по сравнению со спиртами, так как они не образуют прочных водородных связей с протонными растворителями, поэтому их неподеленные пары электронов более доступны для взаимодействия.

Нуклеофильные свойства. 2. Реакции ацилирования. В результате спирты образуют сложные эфиры как с минеральными, так и с карбоновыми кислотами. Например: а) этанол этилгидросульфат При 140˚С с избытком спирта реакция идет необратимо до образования простого эфира: диэтиловый эфир Суммарно: Вторичные и третичные спирты в этих условиях не образуют простых эфиров, а превращаются в алкены (конкурирующая реакция Е)

Нуклеофильные свойства. б) С карбоновыми кислотами (или их ангидридами, галогеноангидридами): метиловый эфир уксусной кислоты Ацилирование тиолов приводит к образованию тиоэфиров: метиловый эфир тиоуксусной кислоты

4. Реакции с участием электрофильного центра (нуклеофильного замещения SN). B этом случае спирт за счет α-атома углерода является объектом атаки другими нуклеофилами, например, возможно замещение ОН-группы на галоген. Общая схема реакции: Например: а) трет-бутиловый спирт трет-бутилхлорид б) бутанол-1 1 -хлоробутан При взаимодействии спиртов с реактивом Лукаса (смесь конц. HCl и Zn. Cl 2) соответствующие галогеноалканы образуются с различными скоростями, что свидетельствует о различии их реакционной способности. Первичные спирты реагируют с галогеноводородными кислотами по механизму SN 2, третичные (а также аллильного и бензильного типа) по SN 1, вторичные – по смешанному механизму.
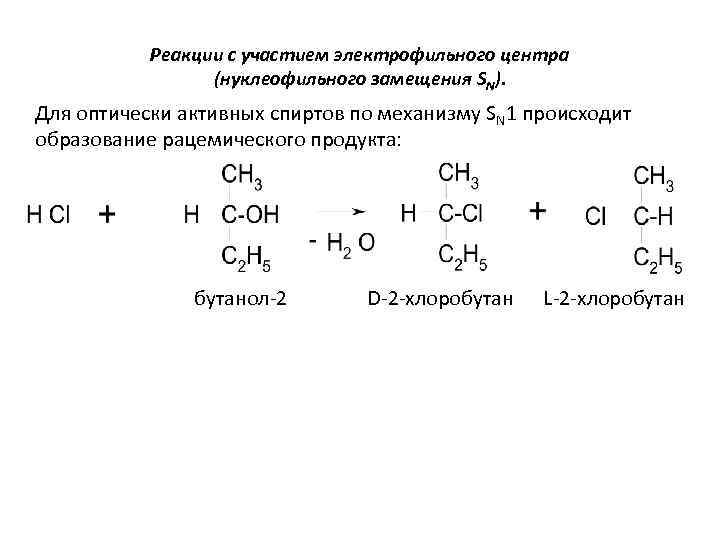
Реакции с участием электрофильного центра (нуклеофильного замещения SN). Для оптически активных спиртов по механизму SN 1 происходит образование рацемического продукта: бутанол-2 D-2 -хлоробутан L-2 -хлоробутан

Реакции с участием электрофильного центра (нуклеофильного замещения SN). В сильно разветвленных спиртах (особенно с третичными атомами углерода) реакция замещения OH-группы на галоген портекает с перегруппировкой углеродной цепи, например: 2, 2 -диметилпропанол-1 2 -бромо-2 -метилбутан

Реакции с участием электрофильного центра (нуклеофильного замещения SN). Более удобным для синтеза галогенопоизводных из спиртов является использование вместо галогеноводородных кислот галогенидов фосфора (PI 3, PBr 3, PCI 5) или тионилхлорида SOCl 2 (лабораторный способ), например:

Реакции с участием электрофильного центра (нуклеофильного замещения SN). В многоатомных спиртах при замещении OH-группы на галоген легко протекает замещение только одной OH-группы: Для дальнейшего замещения требуются более жесткие условия

5. Реакции с участием С-Н-кислотного центра (элиминирования). К реакциям β-элиминирования относят например реакции внутримолекулярной дегидратации спиртов с образованием алкенов. Реакция протекает в присутствии концентрированной серной кислоты: a) Реакция элиминирования первичных спиртов протекает при температуре больше 140˚С b) Наиболее легко в реакцию вступают третичные спирты, при этом отщепление воды происходит по правилу Зайцева:
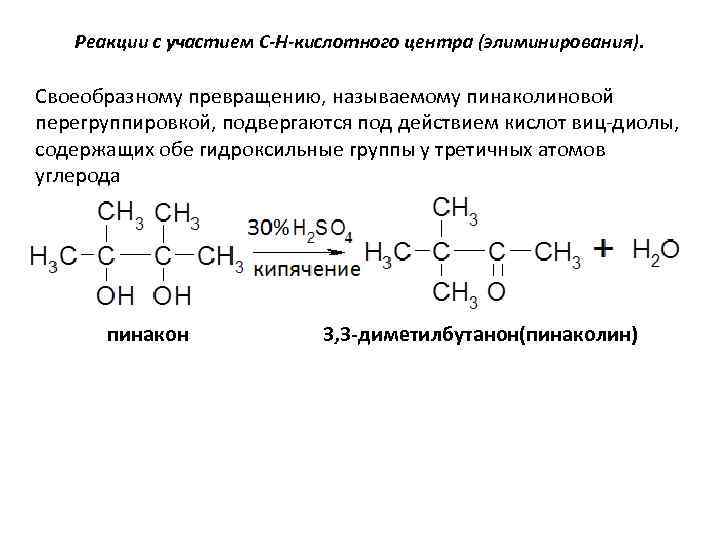
Реакции с участием С-Н-кислотного центра (элиминирования). Своеобразному превращению, называемому пинаколиновой перегруппировкой, подвергаются под действием кислот виц-диолы, содержащих обе гидроксильные группы у третичных атомов углерода пинакон 3, 3 -диметилбутанон(пинаколин)

6. Реакции окисления. • Первичные спирты при окислении первоначально образуют альдегиды, которые могут далее окисляться до карбоновых кислот по схеме: • Наиболее часто в качестве окислителей используют соединения хрома (Na 2 Cr 2 O 7, H+) и марганца (KMn. O 4, OH-). • Вторичные спирты при окислении образуют кетоны: • Третичные спирты устойчивы к окислению, поэтому их можно отличить от первичных и вторичных (например, по реакции с раствором KMn. O 4)

Реакции окисления. В жестких условиях третичные спирты окисляются с разрывом углеродного скелета молекулы и образуют смеси кетонов и карбоновых кислот, например: Окисление полиолов является многофакторным процессом. Например этиленгликоль под действием азотной кислоты или триоксида хрома через промежуточные альдегидные и карбоксильные соединения превращается в щавелевую кислоту:

Реакции окисления. В отличие от спиртов тиолы окисляются не по атому углерода, а по атому серы. При окислении в мягких условиях (например под действием H 2 O 2) образуются диалкилдисульфиды: При окислении сильными окислителями (KMn. O 4, HNO 3) образуются сульфокислоты:

Лекция № 10: Реакционная способность фенолов 1. 2. 3. 4. 5. Строение. Классификация. Реакционные центры. Кислотные и основные свойства. Реакции с участием нуклеофильного центра. Реакции с участием электрофильного центра. Реакции электрофильного замещения в ароматическом ядре. 6. Реакции восстановления и окисления. 7. Качественные реакции на фенолы Лектор: Атавина Ольга Васильевна кандидат биологических наук доцент кафедры общей и биоорганической химии

Строение. Классификация. Реакционные центры. 1. Строение. Классификация. Реакционные центры. Фенолы – производные ароматических углеводородов, в которых один или несколько атомов водорода в бензольном кольце замещены на гидроксильную группу -OH. По числу OH-групп различают одно-, двух-, трехатомные фенолы: К одноатомным фенолам относятся: a) Фенол (C 6 H 5 OH) (5% водный раствор – карболовая кислота) Обладает антисептическими свойствами, широко используется в производстве красителей, пластмасс, лекарственных веществ.

Строение. Классификация. Реакционные центры. b) Крезолы (п-, о-, м- метилфенолы) п-крезол, п-метилфенол, 4 -метилфенол Смесь изомерных крезолов со щелочами используют как дезинфицирующее средство в ветеринарной практике. c) Нафтолы Применяются в производстве нафтосульфокислот, галогено, нитро-нафтолов Например: β-нафтол широко известен как реагент в фармацевтическом анализе
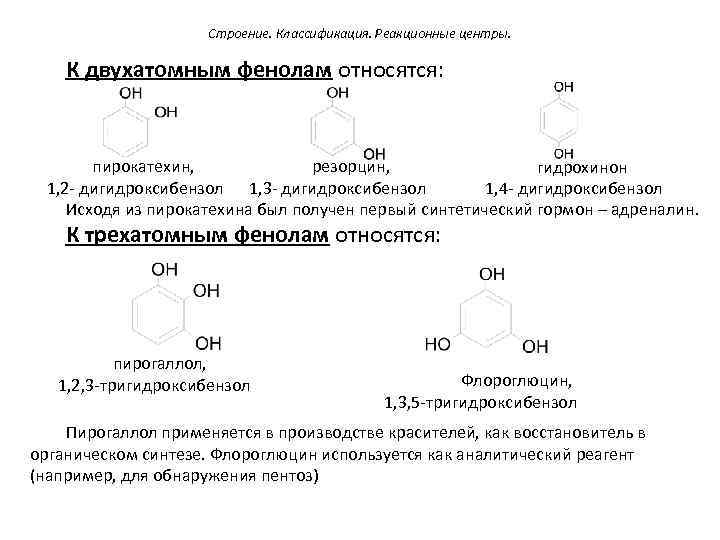
Строение. Классификация. Реакционные центры. К двухатомным фенолам относятся: пирокатехин, резорцин, гидрохинон 1, 2 - дигидроксибензол 1, 3 - дигидроксибензол 1, 4 - дигидроксибензол Исходя из пирокатехина был получен первый синтетический гормон – адреналин. К трехатомным фенолам относятся: пирогаллол, 1, 2, 3 -тригидроксибензол Флороглюцин, 1, 3, 5 -тригидроксибензол Пирогаллол применяется в производстве красителей, как восстановитель в органическом синтезе. Флороглюцин используется как аналитический реагент (например, для обнаружения пентоз)

Строение. Классификация. Реакционные центры в молекуле фенола Фенол представляет собой p, π-сопряженную систему. Реакционными центрами молекулы фенолов являются фенольная гидрокси-группа и ароматическое кольцо, которые взаимно влияют друг на друга. В молекуле фенола выделяют: • OH-кислотный центр • нуклеофильный и n-основный центр (атом кислорода с неподеленной электронной парой). • Электрофильный центр (α-атом углерода). • Реакционные центры бензольного кольца (2, 4, 6 положения)

Кислотные и основные свойства. 2. Кислотные и основные свойства. 1) Кислотные свойства. Фенолы более сильные OH-кислоты, чем спирты, что связано с повышенной стабильностью феноксид-аниона вследствие сопряжения. Поэтому фенолы взаимодействуют со щелочными металлами и щелочами с образованием солей – фенолятов, более устойчивых к гидролизу, чем алкоголяты: Как кислота фенол слабее угольной кислоты, поэтому угольная кислота вытесняет фенол из фенолятов:

Кислотные и основные свойства. Введение в орто- или пара-положение бензольного кольца электроноакцепторных заместителей (-NO 2, атомов галогенов и др. ) приводит к увеличению кислотности свойств фенола. Введение в пара-положение электронодонорных заместителей (-NH 2, OCH 3 и др. ) приводит к понижению кислотности. Для двухатомных фенолов можно было бы ожидать уменьшения кислотности, так как вторая гидрокси-группа будучи электронодонором должна понижать стабильность соответствующего аниона. На самом деле кислотность двухатомных фенолов несколько выше, чем у фенола, что объясняется вкладом сольватационного эффекта в стабилизацию аниона многоатомных фенолов как более полярных соединений, чем сам фенол.
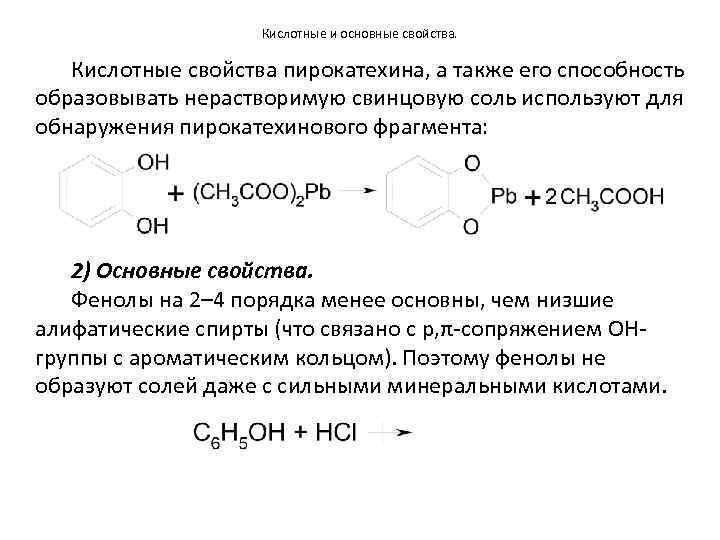
Кислотные и основные свойства. Кислотные свойства пирокатехина, а также его способность образовывать нерастворимую свинцовую соль используют для обнаружения пирокатехинового фрагмента: 2) Основные свойства. Фенолы на 2– 4 порядка менее основны, чем низшие алифатические спирты (что связано с p, π-сопряжением OHгруппы с ароматическим кольцом). Поэтому фенолы не образуют солей даже с сильными минеральными кислотами.
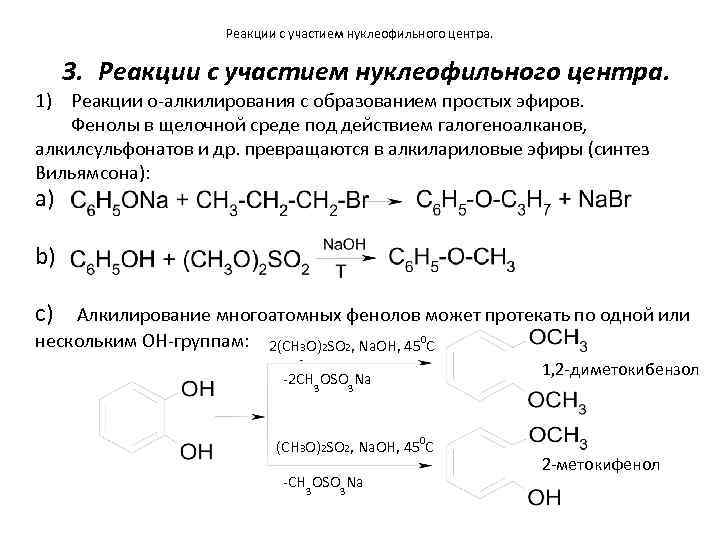
Реакции с участием нуклеофильного центра. 3. Реакции с участием нуклеофильного центра. 1) Реакции о-алкилирования с образованием простых эфиров. Фенолы в щелочной среде под действием галогеноалканов, алкилсульфонатов и др. превращаются в алкилариловые эфиры (синтез Вильямсона): a) b) c) Алкилирование многоатомных фенолов может протекать по одной или нескольким OH-группам: 2(СН 3 О)2 SO 2, Na. OH, 450 C -2 СН ОSO Na 3 3 (СН 3 О)2 SO 2, Na. OH, 450 C -СН ОSO Na 3 1, 2 -диметокибензол 3 2 -метокифенол

Реакции с участием нуклеофильного центра. 2) При взаимодействии фенолов и фенолятов с ангидридами или галогеноангидридами кислот получаются сложные эфиры фенолов: a) b) В отличие от спиртов, с самой уксусной кислотой реакция не пойдет, так как из-за уменьшения электронной плотности на атоме кислорода фенолы обладают более низкой нуклеофильностью, чем спирты.

Реакции с участием электрофильного центра. 4. Реакции с участием электрофильного центра. Повышенная прочность связи Cаром. – О в фенолах обуславливает трудности реакций нуклеофильного замещения (SN) фенольного гидроксила на другой нуклеофил: 1) Замещение на галоген. В отличие от спиртов, группа ОН-фенолов не замещается на атом галогена при взаимодействии галогеноводородов (или тионилхлорида). Только под действием пентахлорида фосфора PCl 5 или трихлорида фосфора PCl 3 происходит в малой степени замещение ОН-группы на атом хлора, а основным продуктом является эфир фосфорной или фосфористой кислоты. Например:
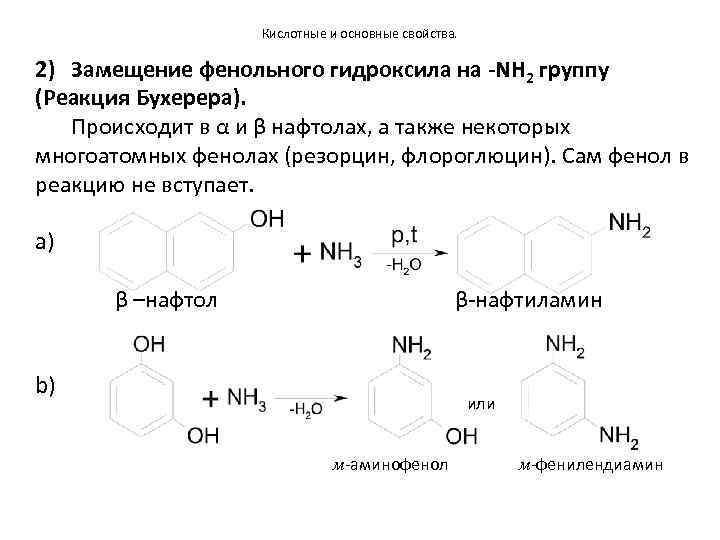
Кислотные и основные свойства. 2) Замещение фенольного гидроксила на -NH 2 группу (Реакция Бухерера). Происходит в α и β нафтолах, а также некоторых многоатомных фенолах (резорцин, флороглюцин). Сам фенол в реакцию не вступает. a) β –нафтол β-нафтиламин b) или м-аминофенол м-фенилендиамин

Реакции электрофильного замещения в ароматическом ядре. 5. Реакции электрофильного замещения в ароматическом ядре. Фенольная ОН-группа является электронодонором и одним из сильнейших ориентантов I рода. Поэтому реакции SE по сравнению с бензолом протекают очень активно. Столь же активны в подобных реакциях и многоатомные фенолы, особенно резорцин и флороглюцин, у которых наблюдается согласованная ориентация гидроксильных групп. 1) Галогенирование (Реакция идет легко без катализатора) Эта реакция используется для качественного и количественного определения фенола

Реакции электрофильного замещения в ароматическом ядре. Для того, чтобы ввести один или два атома галогена в бензольное кольцо фенола требуются специальные условия. При бромировании в малополярном растворителе (CCl 4 или CHCl 3) образуются орто- и пара-монобромофенолы с преобладающим количеством пара-изомера. При хлорировании в этих условиях образуется преимущественно орто-изомер. Иод непосредственно не иодирует фенол.
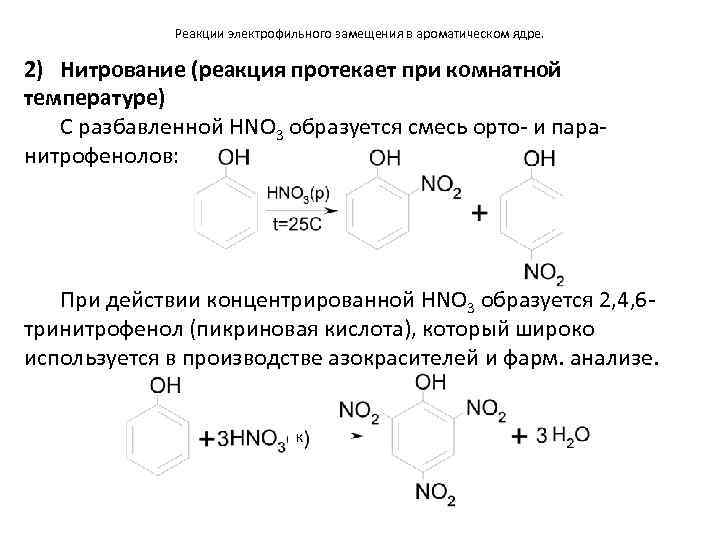
Реакции электрофильного замещения в ароматическом ядре. 2) Нитрование (реакция протекает при комнатной температуре) С разбавленной HNO 3 образуется смесь орто- и паранитрофенолов: При действии концентрированной HNO 3 образуется 2, 4, 6 тринитрофенол (пикриновая кислота), который широко используется в производстве азокрасителей и фарм. анализе. к

Реакции электрофильного замещения в ароматическом ядре. 3) Сульфирование Протекает легко. В зависимости от температуры получаются орто- или пара-изомеры.

Реакции электрофильного замещения в ароматическом ядре. 4) Гидроксиметилирование С формальдегидом в кислой или щелочной среде фенол образует орто- и пара-гидроксибензиловые спирты: Эти соединения далее могут вступать в реакции поликонденсации с образованием фенол-формальдегидных смол, являющихся дешевыми полимерами, нашедшими применение в различных областях техники
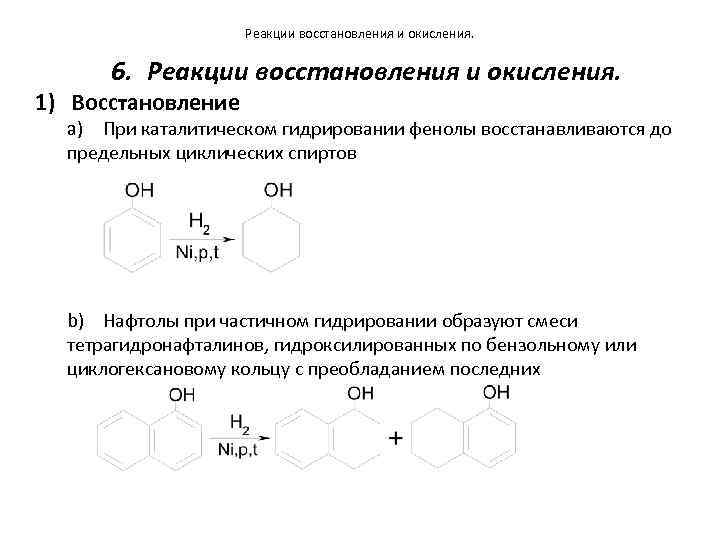
Реакции восстановления и окисления. 6. Реакции восстановления и окисления. 1) Восстановление a) При каталитическом гидрировании фенолы восстанавливаются до предельных циклических спиртов b) Нафтолы при частичном гидрировании образуют смеси тетрагидронафталинов, гидроксилированных по бензольному или циклогексановому кольцу с преобладанием последних
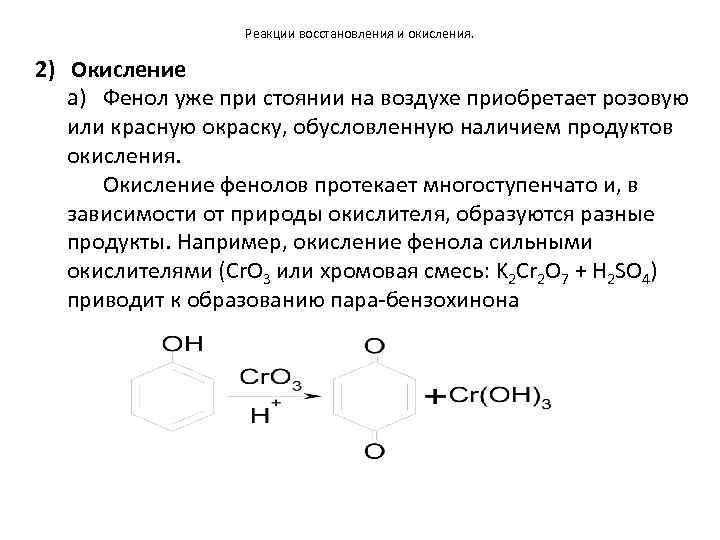
Реакции восстановления и окисления. 2) Окисление a) Фенол уже при стоянии на воздухе приобретает розовую или красную окраску, обусловленную наличием продуктов окисления. Окисление фенолов протекает многоступенчато и, в зависимости от природы окислителя, образуются разные продукты. Например, окисление фенола сильными окислителями (Cr. O 3 или хромовая смесь: K 2 Cr 2 O 7 + H 2 SO 4) приводит к образованию пара-бензохинона
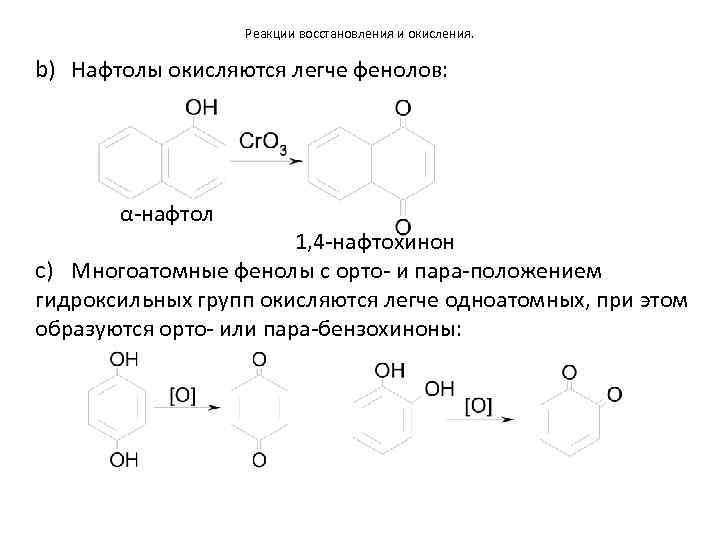
Реакции восстановления и окисления. b) Нафтолы окисляются легче фенолов: α-нафтол 1, 4 -нафтохинон c) Многоатомные фенолы с орто- и пара-положением гидроксильных групп окисляются легче одноатомных, при этом образуются орто- или пара-бензохиноны:

Качественные реакции на фенолы. 7. Качественные реакции на фенолы 1) Для большинства фенолов характерна цветная реакция с хлоридом железе (III). В результате образуются комплексные соединения, имеющие интенсивную окраску: Название Цвет продукта с Fe. Cl 3 Фенол Фиолетовый Крезолы Голубой Пирокатехин Зеленый Резорцин Синий Гидрохинон Желтый Пирогаллол Красный Флороглюцин Фиолетовый

Качественные реакции на фенолы. 2) Фенолы со свободными орто- и пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок (2, 4, 6 трибромофенол – белый осадок). 3) Реакция азосочетания с солями диазония. Обычно с этой целью применяется диазотированная сульфаниловая кислота. В процессе взаимодействия с фенолами образуются окрашенные продукты – азокрасители.

ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ ОРГАНИЧЕСКАЯ ХИМИЯ 1. 2. 3. 4. 5. 6. 7. Лекция № 11 -12: Карбонильные соединения (Альдегиды и кетоны) Классификация. Номенклатура. Реакционные центры. Реакции нуклеофильного присоединения (AN). Реакции присоединения-отщепления (AN-E). Альдольная и кротоновая конденсация. Реакции замещения. Реакции полимеризации и поликонденсации. Реакции восстановления и реакции окисления. Лектор: кандидат биологических наук, доцент Атавина Ольга Васильевна

Классификация. Номенклатура. Реакционные центры 1. Классификация. Номенклатура. Реакционные центры. Альдегиды и кетоны – соединения, содержащие карбонильную группу. Общая формула альдегидов: – альдегидная группа. Общая формула кетонов: Альдегиды в зависимости от радикалов, связанных с альдегидной группой, делятся на: а) предельные: – уксусный альдегид (ацетальдегид, этаналь) б) непредельные: – акриловый альдегид (акролеин, пропен-2 -аль)
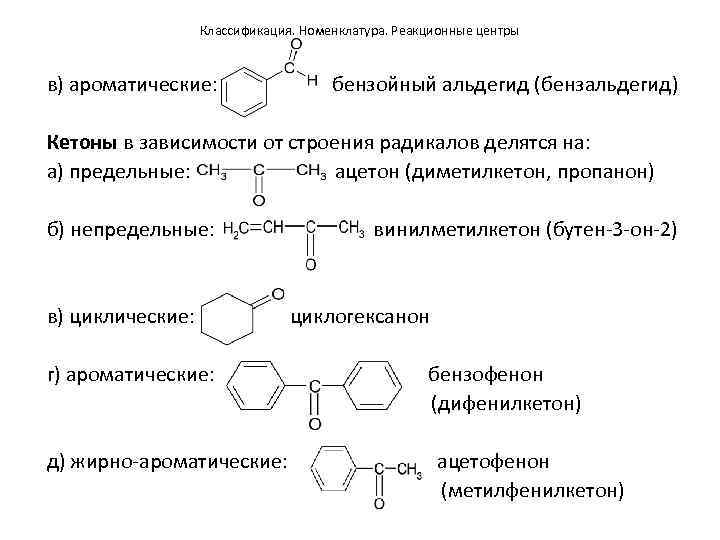
Классификация. Номенклатура. Реакционные центры в) ароматические: бензойный альдегид (бензальдегид) Кетоны в зависимости от строения радикалов делятся на: а) предельные: ацетон (диметилкетон, пропанон) б) непредельные: в) циклические: г) ароматические: д) жирно-ароматические: винилметилкетон (бутен-3 -он-2) циклогексанон бензофенон (дифенилкетон) ацетофенон (метилфенилкетон)
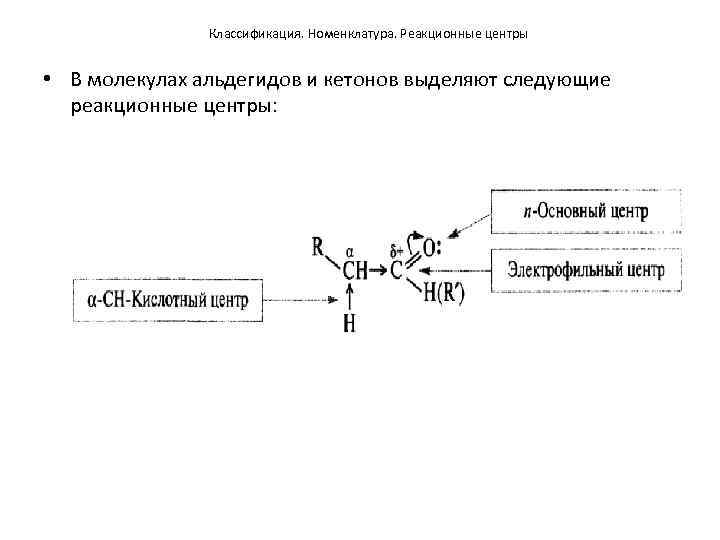
Классификация. Номенклатура. Реакционные центры • В молекулах альдегидов и кетонов выделяют следующие реакционные центры:
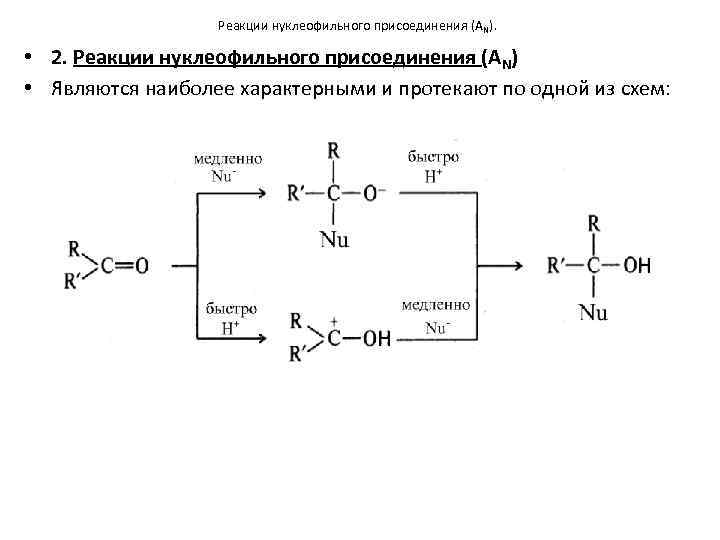
Реакции нуклеофильного присоединения (AN). • 2. Реакции нуклеофильного присоединения (AN) • Являются наиболее характерными и протекают по одной из схем: Н Н

Реакции нуклеофильного присоединения (AN) • Чем больше δ+ на карбонильном атоме углерода, тем легче он атакуется нуклеофильной частицей, поэтому ЭА – заместители повышают реакционную способность альдегидов и кетонов, а ЭД – снижают. • Альдегиды более реакционноспособны, чем кетоны, так как два радикала в кетонах за счет +I – эффекта уменьшают δ+ на карбонильном атоме углерода, а также за счет стерического фактора затрудняют доступ реагента к плоской карбонильной группе. • Ароматические альдегиды и кетоны менее реакционноспособны, чем алифатические.
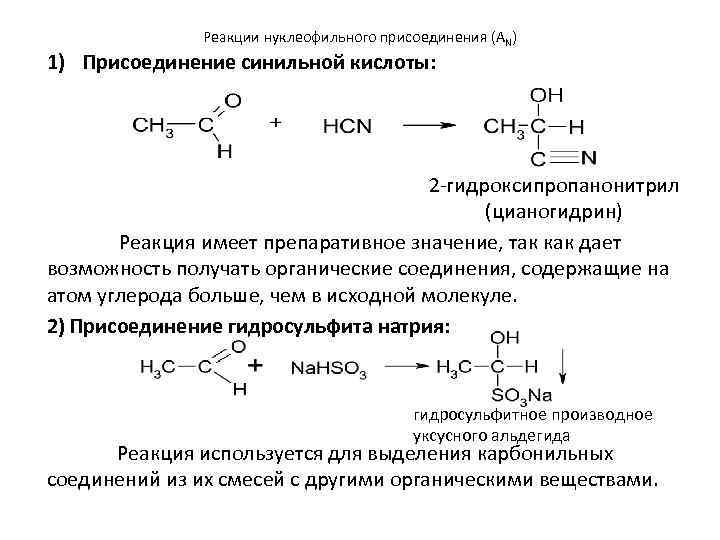
Реакции нуклеофильного присоединения (AN) 1) Присоединение синильной кислоты: 2 -гидроксипропанонитрил (цианогидрин) Реакция имеет препаративное значение, так как дает возможность получать органические соединения, содержащие на атом углерода больше, чем в исходной молекуле. 2) Присоединение гидросульфита натрия: гидросульфитное производное уксусного альдегида Реакция используется для выделения карбонильных соединений из их смесей с другими органическими веществами.

Реакции нуклеофильного присоединения (AN) 3)Присоединение воды. Общая схема реакции: Формальдегид присоединяет воду при комнатной температуре в отсутствие катализатора, и образует гидрат, устойчивый только в растворе: формальдегид Положение равновесия между карбонильным соединением и гем-диолом определяется электронными и стерическими (пространственными) факторами заместителей, связанных с атомом углерода карбонильной группы.

Реакции нуклеофильного присоединения (AN) Устойчивыми являются гидраты альдегидов, которые содержат в молекуле у α-углеродного атома сильные электроноакцепторные группы, например, хлоральгидрат. Хлораль, в котором трихлорметильная группа повышает частичный положительный заряд на атоме углерода карбонильной группы, образует устойчивый гемдиол, который может быть выделен из раствора в свободном состоянии. Хлоральгидрат применяется в медицине. Он обладает снотворным, противосудорожным и анестезирующим действием, входит в состав зубных капель «Дента» .

Реакции нуклеофильного присоединения (AN) 4) Присоединение магний-органических соединений (реактивов Гриньяра R-Mg. Hal): Реакция используется для получения спиртов. 5) Присоединение спиртов (реакция ацетализации). При этом образуются полуацетали и ацетали:

Реакции нуклеофильного присоединения (AN) В избытке спирта полуацетали превращаются в ацетали: 1, 1 -диметоксиэтан Ацетали – устойчивые вещества, могут быть выделены в чистом виде. Ацетали устойчивы к действию щелочей, но в присутствии кислот гидролизуются, что отличает ацетали от простых эфиров, которые в аналогичных условиях гидролизу не подвергаются. Реакцию ацетализации используют в фармхимии для «защиты» альдегидной группы, если не нужно чтобы она вступала в реакцию.

Реакции нуклеофильного присоединения (AN) Механизм реакции ацетализации:
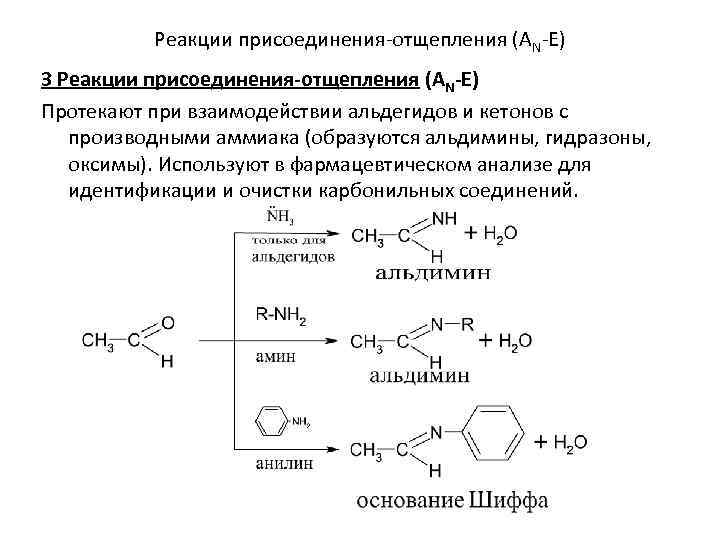
Реакции присоединения-отщепления (AN-E) 3 Реакции присоединения-отщепления (AN-E) Протекают при взаимодействии альдегидов и кетонов с производными аммиака (образуются альдимины, гидразоны, оксимы). Используют в фармацевтическом анализе для идентификации и очистки карбонильных соединений.
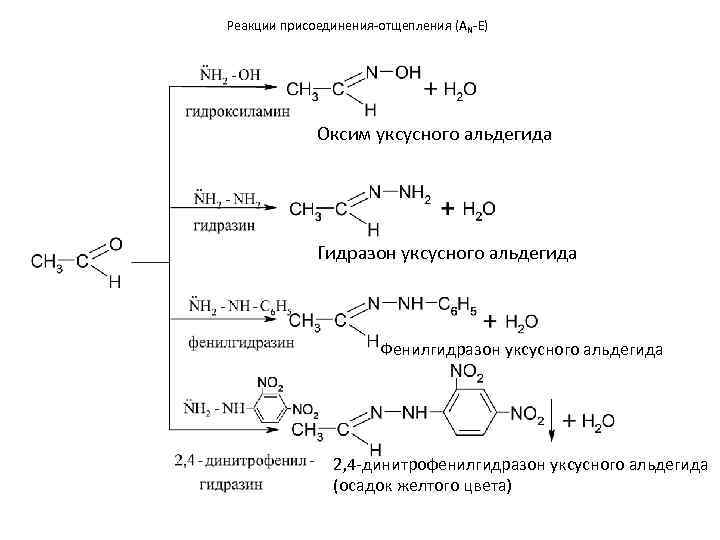
Реакции присоединения-отщепления (AN-E) Оксим уксусного альдегида Гидразон уксусного альдегида Фенилгидразон уксусного альдегида 2, 4 -динитрофенилгидразон уксусного альдегида (осадок желтого цвета)

Реакции присоединения-отщепления (AN-E)
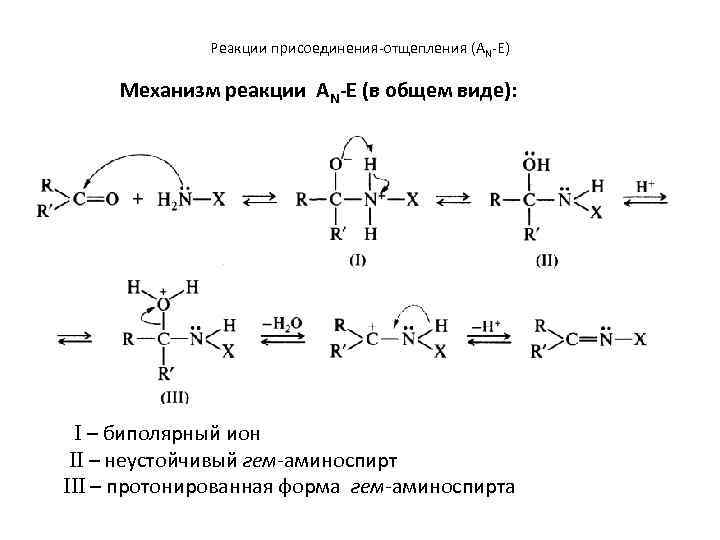
Реакции присоединения-отщепления (AN-E) Механизм реакции АN-E (в общем виде): I – биполярный ион II – неустойчивый гем-аминоспирт III – протонированная форма гем-аминоспирта

Альдольная и кротоновая конденсация. 4. Альдольная и кротоновая конденсация Под влиянием основных катализаторов альдегиды реагируют с образованием продуктов, имеющих удвоенную молекулярную массу по сравнению с исходной молекулой. Некоторые кетоны тоже способны к этой реакции, только в более жестких условиях. Альдольная конденсация протекает по механизму AN. Общая схема альдольной конденсации:
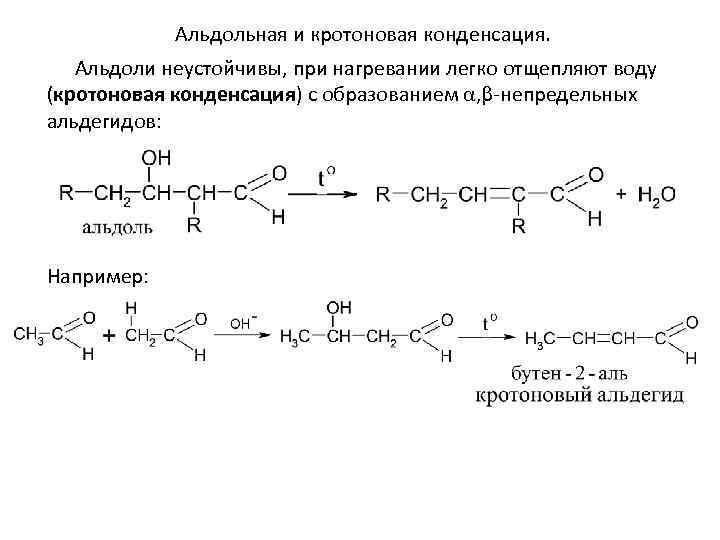
Альдольная и кротоновая конденсация. Альдоли неустойчивы, при нагревании легко отщепляют воду (кротоновая конденсация) с образованием α, β-непредельных альдегидов: Например:

Альдольная и кротоновая конденсация.
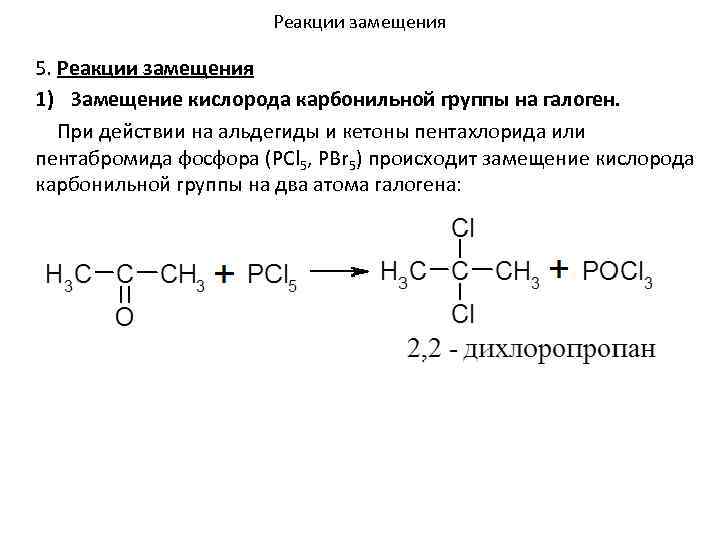
Реакции замещения 5. Реакции замещения 1) Замещение кислорода карбонильной группы на галоген. При действии на альдегиды и кетоны пентахлорида или пентабромида фосфора (PCl 5, PBr 5) происходит замещение кислорода карбонильной группы на два атома галогена:

Реакции замещения 2) Реакции галогенирования. При этом на галоген замещаются атомы водорода у α-углеродного атома. а) Если реакцию проводить в присутствии кислоты, пойдет моногалогенирование:

Реакции замещения б) Метилкетоны, а также ацетальдегид при взаимодействии с хлором, бромом или иодом в щелочной среде галогенируется по метильной группе, превращаясь в тригалогенопроизводные. Получившийся тригалогенокетон или тригалогеноацетальдегид в щелочной среде расщепляется на карбоновую кислоту (в виде соли) и галоформ (хлороформ, бромоформ, иодоформ). Иодоформная реакция широко используется для обнаружения ацетальдегида и метилкетонов.
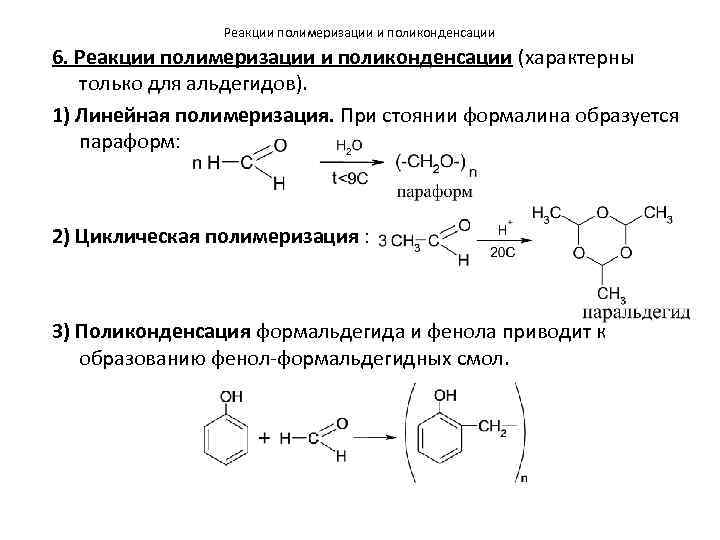
Реакции полимеризации и поликонденсации 6. Реакции полимеризации и поликонденсации (характерны только для альдегидов). 1) Линейная полимеризация. При стоянии формалина образуется параформ: 2) Циклическая полимеризация : 3) Поликонденсация формальдегида и фенола приводит к образованию фенол-формальдегидных смол.
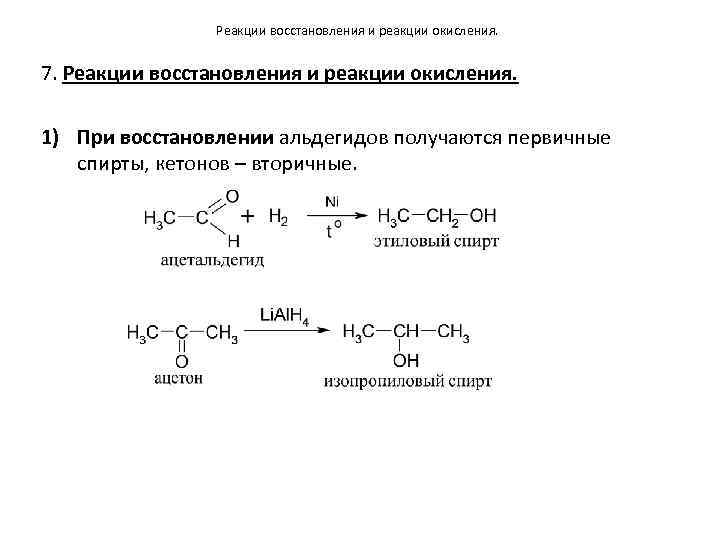
Реакции восстановления и реакции окисления. 7. Реакции восстановления и реакции окисления. 1) При восстановлении альдегидов получаются первичные спирты, кетонов – вторичные.

Реакции восстановления и реакции окисления. 2) Альдегиды легко окисляются, превращаясь в карбоновые кислоты с тем же числом атомов углерода в цепи. Это позволило разработать качественные реакции на альдегиды: а) При нагревании с аммиачным раствором оксида серебра [Ag(NH 3)2]OH (реактив Толленса) альдегид окисляется в кислоту, а серебро восстанавливается до металлического и осаждается на стенках реакционного сосуда в виде характерного темного слоя с зеркальным блеском – реакция серебряного зеркала:

Реакции восстановления и реакции окисления б) При действии на альдегид реактива Фелинга, имеющего синюю окраску (водный раствор Cu. SO 4, щелочи и солей винной кислоты), медь из двухвалентной восстанавливается до одновалентной, при этом выпадает красно-бурый осадок оксида меди (I) Cu 2 O: Оба реагента не затрагивают двойные связи. Обе реакции применяют для обнаружения альдегидов, причем реактив Фелинга не взаимодействует с ароматическими альдегидами.
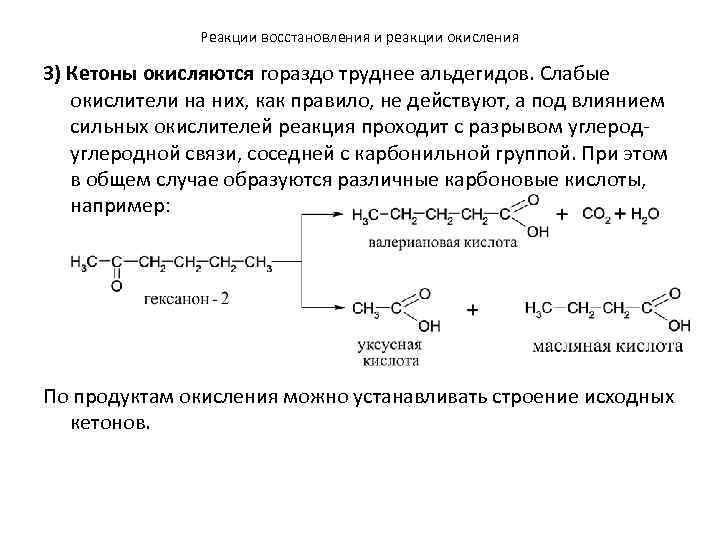
Реакции восстановления и реакции окисления 3) Кетоны окисляются гораздо труднее альдегидов. Слабые окислители на них, как правило, не действуют, а под влиянием сильных окислителей реакция проходит с разрывом углеродной связи, соседней с карбонильной группой. При этом в общем случае образуются различные карбоновые кислоты, например: По продуктам окисления можно устанавливать строение исходных кетонов.
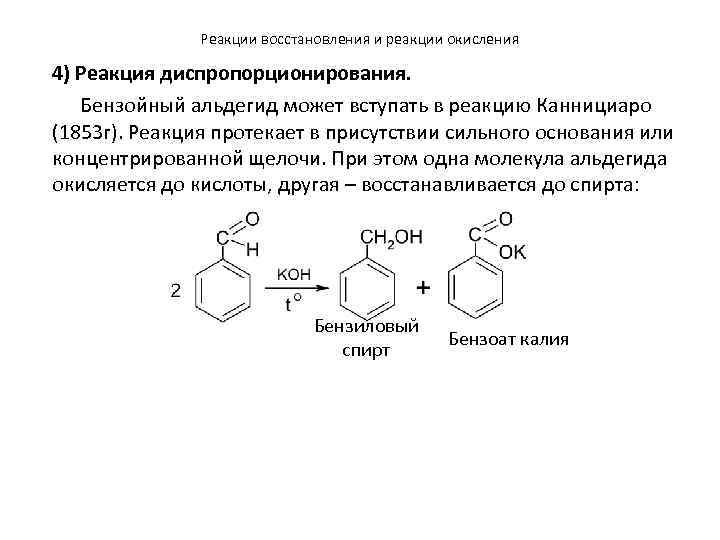
Реакции восстановления и реакции окисления 4) Реакция диспропорционирования. Бензойный альдегид может вступать в реакцию Каннициаро (1853 г). Реакция протекает в присутствии сильного основания или концентрированной щелочи. При этом одна молекула альдегида окисляется до кислоты, другая – восстанавливается до спирта: Бензиловый спирт Бензоат калия
Галогенопроизводные.Спирты.Тиоаналоги.pptx