Лекц 8 Наследственные болезни человека.ppt
- Количество слайдов: 100

Лекция № 8 Наследственные заболевания человека Профессор Смирнов Сергей Николаевич 1

План. 1. Понятие о наследственных болезнях. Классификация наследственных болезней человека. 2. Хромосмные болезни. 3. Генные болезни. 4. Заболевания человека с наследственной предрасположенностью. 5. Медико-генетические аспекты семьи. Профилактика наследственных и врожденных заболеваний. Медико-генетическое консультирование. Пренатальная диагностика наследственных заболеваний. 6. Генная инженерия. Биотехнология. Понятие о генной терапии. 2

1. Понятие о наследственных болезнях. Классификация наследственных болезней человека. Наследственные болезни - это болезни, вызванные изменениями в наследственном материале (мутациями). Около пяти процентов детей рождаются с наследственными аномалиями. В большинстве случаев это легкие аномалии, не приносящие значительного ущерба здоровью. Однако в 1% встречаются тяжелые формы заболеваний. Значимость изучения наследственных заболеваний определяется не только тяжестью их течения, но и значительными трудностями лечения и тяжестью прогноза. 3

Классификация наследственных болезней. 1. Хромосомные болезни. а) связанные с изменениями числа и формы аутосом. б) связанные с изменениями числа половых хромосом. 2. Генные болезни. а) множественные врожденные пороки развития. б) болезни обмена (ферментопатии). 3. Заболевания с наследственной предрасположенностью. 4

2. Хромосомные болезни. В основе патогенеза хромосомных болезней лежат хромосомные (изменение формы хромосом) и геномные (изменения числа хромосом) мутации. Эти мутации возникают вследствие нарушения процессов мейоза и митоза. 5

Клинически близкие проявления, трактуемые как одно заболевание, могут быть проявлением разных вариантов мутаций. Встречаются полные, мозаичные и транслокационные варианты заболеваний, связанных с изменением числа хромосом. Полный вариант - наличие измененного числа хромосом во всех клетках организма человека. Мозаичный вариант – это явления, при котором часть клеток организма имеет измененный набор хромосом, а оставшиеся – нормальный. Транслокационные формы вызваны транслокациями. 6

Хромосомные болезни, связанные с изменениями числа и формы аутосом. Синдром получил название в честь английского врача Джона Дауна (John Down), впервые описавшего в 1866 году. Синдром Дауна (синдром трисомии 21) встречается примерно у 1 на 700 новорожденных. У мальчиков и у девочек аномалия встречается с одинаковой частотой. Слово «синдром» означает набор признаков или характерных черт. Джон Лэнгдон Даун. 7

Кариотипы. При синдроме Дауна наблюдается кариотип 47, 21+ (трисомия по 21 хромосоме), или 47, 21+/46 (мозаичный вариант), или 46, Т 21/13; 46, Т 21/14; 46, Т 21/15 (транслокационный вариант). Во всех случаях у больного наблюдается появление лишней 21 хромосомы. Примерно в 91 % случаев возникает простая полная трисомия 21 хромосомы. Транслокация хромосомы 21 на другие хромосомы (чаще на 15, реже на 14, ещё реже на 21, 22 и Y-хромосому) встречается 4 % случаев возникновения синдрома, и мозаичный вариант синдрома – в 5 %. 8

Кариотипы человека с синдромом Дауна. Трисомия по 21 хромосоме. В 21 -й паре три хромосомы вместо двух. 9

Кариотип человека с синдромом Дауна. Транслокация 21 хромосомы на 14. Кариотип 46, Т 21/14. 10

Клинические проявления. Синдром проявляется отставанием в умственном развитии и множественными пороками развития, среди которых нарушения роста, низко посаженные уши, большой язык, монголоидный разрез глаз и многие другие. Наблюдается отставание в половом развитии и бесплодие. Продолжительность жизни 30 -40 лет. При наличии аномалий жизненно важных органов гибель может наступить значительно раньше. Диагноз синдрома Дауна ставится на основании результатов кариотипирования. 11

Основные клинические проявления синдрома Дауна. 12

Ребёнок с характерными чертами присущими синдрому Дауна (эпикантус, плоское лицо, открытый рот, увеличенный язык, маленький нос). 13

Синдром Эдвардса (синдром трисомии 18). Описан в 1960 году Джоном Эдвардсом (John H. Edwards). Частота примерно 1: 3000 - 1: 7000 новорожденных. Девочки с синдромом Эдвардса рождаются в три раза чаще мальчиков. Синдром Эдвардса развивается вследствие появления в кариотипе лишней хромосомы 18 пары. Кариотипы могут быть: 47, 18+ (трисомия 18 во всех клетках организма), 47, 18+/46 (мозаичная форма). Мозаицизм наблюдается в одном случае из десяти. Транслокационные формы встречаются реже. 14

Кариотипы человека с синдромом Эдвардса. Трисомия по 18 хромосоме. В 18 -й паре три хромосомы вместо двух. 15

Клинические проявления. Имеются аномалии мозгового и лицевого черепа. Нижняя челюсть и ротовое отверстие маленькие. Глазные щели узкие и короткие. Ушные раковины деформированы и низко расположены. Грудина короткая, наблюдается аномальное развитие стопы. Дефекты внутренних органов: пороки сердца и крупных сосудов, аномалии почек, изменения мозжечка, мозолистого тела, олив. Продолжительность жизни: 60 % детей умирают в возрасте до 3 месяцев. Основной причиной смерти служат остановка дыхания и нарушения работы сердца. Дети, доживающие до 2 -3 летнего возраста, имеют выраженную степень умственной отсталости. 16

Основные внешние проявления синдрома Эдвардса. 17

Ребенок с синдромом Эдвардса (трисомия 18). Короткая грудина, перекрещивающиеся пальцы, левосторонняя косолапость. 18

Стопа ребенка с синдромом Эдвардса (трисомия 18). Аномальное развитие стопы: пятка резко выступает, свод провисает (стопа-качалка), большой палец утолщен и укорочен. Кисть ребенка с синдромом Эдвардса (трисомия 18). Пальцы перекрещены, сжаты в кулак. Диагноз синдрома Эдвардса ставится на основании результатов кариотипирования. 19

Синдром Патау (трисомия 13). Впервые описан Эразмусом Бартолином в 1657. Хромосомную природу заболевания выявил доктор Клаус Патау в 1960. Синдром Патау встречается с частотой 1: 5000 -1: 14000. Соотношение полов близко к 1: 1. Кариотипы. 75 % случаев трисомии хромосомы 13 обусловлено появлением дополнительной хромосомы 13 (кариотип 47, 13+). 25 % случаев синдрома Патау – следствие транслокации с вовлечением хромосом 13 -й пары. Мозаицизм встречается крайне редко (кариотип 47, 13+/46). 20

Кариотип человека с синдромом Патау. Трисомия по 13 хромосоме. В 13 -й паре три хромосомы вместо двух. 21

Клинические проявления. При синдроме Патау наблюдаются врожденные пороки: микроцефалия, нарушение развития центральной нервной системы, низкий скошенный лоб, суженные глазные щели, микрофтальмия, помутнение роговицы, запавшая переносица, широкое основание носа, деформированные ушные раковины, расщелина верхней губы и нёба, полидактилия. 22

Часто встречаются пороки развития сердца: дефекты межжелудочковой и межпредсердной перегородок, транспозиции сосудов. Почки увеличены, выявляются пороки развития половых органов. В связи с тяжелыми врожденными пороками развития большинство детей с синдромом Патау умирают в первые недели или месяцы (95 % — до 1 года). Оставшиеся в живых страдают глубокой задержкой умственного развития. 23

Синдром Патау. Запавшая переносица, широкое основание носа. 24

Синдром Патау. Дисплазия кисти. Полидактилия. Синдром Патау. Дисплазия стоп. Полидактилия. Диагноз синдрома Патау ставится на основании результатов кариотипирования. 25

Синдром крика кошки. Классическим примером наследственного хромосомного заболевания, связанного с изменением формы аутосом является синдром крика кошки. Синдром кошачьего крика (Cri-Du-Chat Syndrome) (синонимы: болезнь кошачьего крика, синдром Лежена по имени описавшего в 1963 г. французского ученого). Частота возникновения синдрома примерно 1: 45000. Соотношение частоты возникновения у мальчиков и у девочек 1 : 1, 3. 26
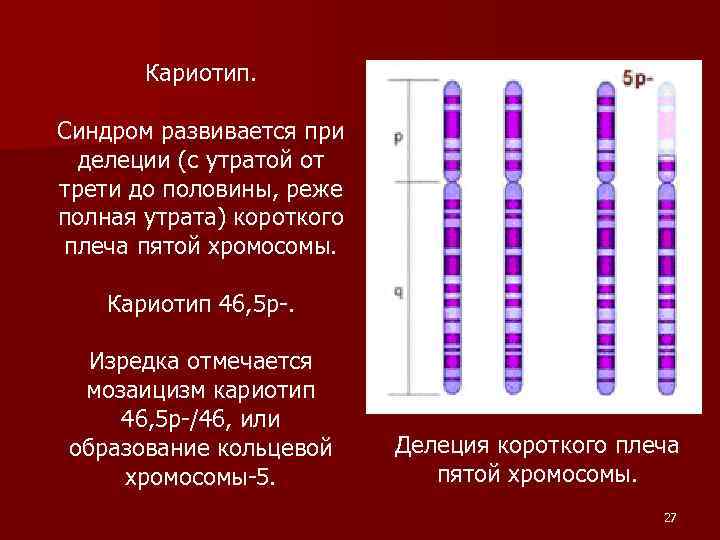
Кариотип. Синдром развивается при делеции (с утратой от трети до половины, реже полная утрата) короткого плеча пятой хромосомы. Кариотип 46, 5 р-. Изредка отмечается мозаицизм кариотип 46, 5 р-/46, или образование кольцевой хромосомы-5. Делеция короткого плеча пятой хромосомы. 27

Клинические проявления. Наблюдается общее отставание в развитии, лунообразное лицо с широко расставленными глазами. Наблюдается характерный плач ребёнка, напоминающий кошачье мяуканье, причиной которого является изменение гортани. Признак исчезает к концу первого года жизни. Кроме того, встречаются врожденные пороки сердца, костно-мышечной системы и внутренних органов, микроцефалия, птоз, низкое расположение и деформация ушных раковин, кожные складки впереди уха, гипертелоризм (увеличенное расстояние между какими-либо парными органами или анатомическим образованиями), эпикантус (поперечная кожная складка около внутреннего угла глаза), антимонголоидный 28 разрез глаз.

Синдром крика кошки. Деформация ушных раковин, глазной гипертелоризм. Диагноз синдрома крика кошки ставится на основании результатов кариотипирования. 29

Хромосомные болезни, связанные с изменениями числа половых хромосом. Синдром Шеришевского-Тернера - единственный совместимый с жизнью синдром моносомии. Впервые эта болезнь как наследственная была описана в 1925 г. Н. А. Шерешевским. В 1938 г. Тернер выделил характерную для этого симптомокомплекса триаду симптомов: половой инфантилизм, кожные крыловидные складки на боковых поверхностях шеи и деформацию локтевых суставов. Популяционная частота синдрома 1 на 1500 -5000 новорождённых девочек. 30

Кариотип. Наряду с истинной моносомией во всех клетках (кариотип 45, Х 0 или 45, X) встречаются делеции короткого или длинного плеча Х-хромосомы (кариотип 46, Х, Хр-; 46, X, Xq-), изохромосомы (кариотип 46, X, i(Xq); 46, X, i(Xp)), кольцевые хромосомы (кариотип 46, X, R(X)), а также различные варианты мозаицизма (кариотип 45, Х 0/46). Только 50% пациенток с синдромом Шерешевского-Тёрнера имеют простую полную моносомию (45, X). Остальные случаи - 3040% разнообразный мозаицизм (кариотип 45, Х 0/46) и более редкие варианты делеций, нзохромосом, кольцевых хромосом. 31

Кариотип человека с синдромом Шеришевского-Тернера. Моносомия по Х хромосоме. Одна Х хромосома вместо двух. Кариотип 45, Х 0 или 45, X. 32

Клинические проявления. Наблюдается отставание в физическом развитии, избыток кожи на шее, пороки развития костносуставной и сердечно-сосудистой систем, «лицо сфинкса» , лимфостаз (застой лимфы, клинически проявляющийся крупными отеками). Рост больных не превышает 135 -145 см. Присутствует отставание формирования половых признаком. Больные бесплодны. Интеллект у большинства больных практически сохранен. Имеет место психический инфантилизм с эйфорией при хорошей практической приспособляемости и социальной адаптации. 33

Синдром Шерешевского-Тёрнера Крыловидные складки кожи на боковых поверхностях шеи. Диагноз синдрома Шеришевского-Тернера ставится на основании результатов кариотипирования. 34

Синдромы полисомии Х-хромосом у женщин обусловлены увеличением числа Х-хромосом. Заболевание (трисомия-Х) впервые описала Джекобс (P. Jacobs) в 1959 году. Среди этих форм патологии наиболее частым является синдром, при котором набор хромосом составляет 47, XXX (синдром трисомии-Х). Частота синдрома трисомии-Х составляет 1 на 1000 -2000 новорожденных девочек. Синдромы тетрасомии-Х, пентасомии-Х и так далее встречаются очень редко. 35

Кариотип при синдромах полисомии Х-хромосом может быть 47, XXX (трисомия-Х), 48, ХХХХ (тетрасомия-Х), 49, ХХХХХ (пентасомия-Х) и так далее. Реже встречаются мозаичные формы 47, XXX/46, ХХ; 48, ХХХХ/46, ХХ; 49, ХХХХХ/46, ХХ. Кариотип женщины с синдромом трисомии-Х. 36

Клинические проявления. Больные обычно низкорослы. Характерны множественные аномалии: аномалии ушей, прикуса, высокое «готическое» нёбо, короткие пальцы, короткий искривленный мизинец, широкое расстояние между I и II пальцами на стопах, неполная синдактилия. У некоторых больных могут быть пороки развития внутренних органов. У многих больных отмечается нормальное половое развитие. У некоторых больных обнаруживается недоразвитие вторичных половых признаков. Нарушение полового созревания особенно выражено при синдромах тетрасомии и пентасомии-Х. При синдроме трисомии-Х могут быть расстройства менструального цикла, однако большинство женщин способны к деторождению. 37 37

Среди женщин с трисомией-Х встречаются нарушения интеллекта (дебильность). С увеличением числа Ххромосом степень психического недоразвития нарастает. Характерны эмоциональные расстройства. Диагноз синдрома полисомии Х-хромосом ставится на основании результатов кариотипирования. 38

Синдром Клайнфельтера впервые описан в 1942 году в работе Фуллера Олбрайта и Гарри Клайнфельтера. Частота синдрома колеблется в пределах 1 на 500 -1000 новорожденных мальчиков. Кариотип. Генетической особенностью этого синдрома является разнообразие цитогенетических вариантов и их сочетаний (мозаицизм). Обнаружено несколько вариантов кариотипов у лиц мужского пола: 47, XXY; 48, XXXY; 49 XXXXY. Наиболее распространен синдром Клайнфельтера с кариотипом 47, XXY. 39

Кариотип мужчины с синдромом Клайнфельтера (47, XXY). 40

Клинические проявления. Для мужчин с синдромом Клайнфельтера характерны высокий рост, длинные конечности и относительно короткое туловище, евнухоидизм, бесплодие, гинекомастия, повышенное выделение женских половых гормонов, склонность к ожирению. Присутствуют различные нарушения психики. Больные внушаемы, вялы, апатичны, безынициативны, у них часто отмечается умственная отсталость (обычно дебильность). Клиническая картина начинает проявляться у мальчиков в период полового созревания. 41

Основные внешние признаки синдрома Клайнфельтера. 42

Мальчик 6 лет с синдромом Клайнфельтера. Гинекомастия при синдроме Клайнфельтера. Диагноз синдрома Клайнфельтера ставится на основании результатов кариотипирования. 43

Синдром полисомии по Y-хромосоме. Частота рождения больных в среднем 1: 1000 мальчиков. Синдром дисомии по Y-хромосоме. (47, XYY) описан в 1961 году. Кариотип. Синдром полисомии У характеризуется наличием кариотипа 47, ХУУ, 48, ХУУУ. 44

Кариотип мужчины с синдромом полисомии (дисомии) по Y-хромосоме (47, XYY). Две Y хромосомы вместо одной 45

Клинические проявления. Лица с кариотипом 47, XYY не имеют четких фенотипических особенностей. В большинстве случаев это мужчины высокого роста (выше 186 см) со значительно развитой нижней челюстью. Строение туловища евнухоидное, отмечается микроорхидизм или крипторхизм. Они эмоционально неустойчивы, агрессивны, дебильны. Имеют склонность к антисоциальному поведению. Такие мужчины часто имеют нормальную фертильность (способны иметь детей). 46

Еще одной формой полисомии по Y-хромосоме является кариотип 48, XYYY. Считается, что частота возникновения этой хромосомной аномалии не превышает 1: 50000 новорожденных мальчиков. Описано лишь несколько таких бальных, их фенотип был сходен с фенотипом мужчин с синдромом 47, XYY. Диагноз синдрома полисомии-Y ставится на основании результатов кариотипирования. 47

3. Генные (моногенные) болезни. Генные болезни – это большая группа заболеваний, возникающих в результате повреждения ДНК на уровне гена. Общая распространенность моногенных болезней составляет 10 на 1000 новорожденных. Генные (моногенные) болезни разделяют на две группы: множественные врожденные пороки развития и болезни обмена веществ. 48

Множественные врожденные пороки развития вызываются генными мутациями. В основе патогенеза лежит феномен первичной плейотропии. В настоящее время известно несколько тысяч таких синдромов. 49

Классическим примером может служить синдром Марфана (Болезнь Марфана, Marfan syndrome). Впервые признаки заболевания были описаны Вильямсом (1876), в последующие годы А. Марфаном (1896). Заболевание из группы наследственных коллагенопатий, заболеваний соединительной ткани человека. Помимо изменений в органах опорно-двигательного аппарата (удлинённые кости скелета, гиперподвижность суставов, арахнодактилия), наблюдается патология в органах зрения (подвывих хрусталика) и сердечнососудистой системы (дилатация и аневризма аорты). 50

51

Диагноз множественных врожденных пороков развития ставится на основании наличия ядра симптомов (комплекса характерных фенотипических признаков) и на основании некоторых дополнительных методов исследования. Гиперподвижность суставов при синдроме Марфана. 52

Болезни обмена веществ возникают из-за мутаций генов, кодирующих ферменты, транспортные или структурные белки. В основе патогенеза лежит феномен вторичной плейотропии. Первичные эффекты мутантных генов могут проявляться в 4 вариантах: 1) отсутствие синтеза полипептида, 2) синтез аномального полипептида, 3) количественно недостаточный синтез полипептида, 4) количественно избыточный синтез полипептида. 53

В основе патогенеза ферментопатий лежит снижение активности течения или блок биохимической реакции, катализируемой определенным дефектным ферментом. Если при этом накапливаются начальные вещества реакции возникают болезни накопления. Классификация болезней обмена. 1. Нарушение обмена белков 2. Нарушение обмена аминокислот 3. Нарушение обмена липидов 4. Нарушение обмена углеводов 5. Нарушение обмена минеральных веществ. 54

Примером нарушения обмена белков служат талассемия, серповидно-клеточная анемия, сопровождающиеся избыточным разрушением эритроцитов. В этих случаях страдает синтез нормального гемоглобина. Эритроциты человека, страдающего талассемией. Серповидные эритроциты человека, страдающего серповидно-клеточной анемией. 55

Серповидноклеточная анемия - это наследственная гемоглобинопатия, вызванныя мутацией гена, приводящей к нарушению строения белка гемоглобина (первичный эффект), при котором он приобретает особое кристаллическое строение - так называемый гемоглобин S. Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислородтранспортирующей способностью (вторичный эффект), поэтому у больных с серповидноклеточной анемией ускорено разрушение эритроцитов в селезенке, укорочен срок их жизни, усилен гемолиз (третичный эффект) и часто имеются признаки хронической гипоксии (кислородной недостаточности). 56

Примеры нарушения обмена аминокислот фенилкетонурия и альбинизм. При альбинизме вследствие генной мутации страдает фермент тирозиназа. Поэтому нарушается течение реакции превращения тирозина в меланин. Количество последнего уменьшается. Меланин пигмент, от которого зависит окраска тканей. Поэтому у больных светлая кожа. 57

Ребенок с альбинизмом. 58

Фенилкетонурия служит примером болезни накопления. После мутации гена страдает фермент галактоза-1 фосфатуридилтрансфераза (первичный эффект). Нарушается превращение фенилаланина в тирозин (вторичный эффект). Фенилаланин накапливается, его метаболизм идет по обходному пути с образованием фенилпировиноградной кислоты (третичный эффект), которая оказывает токсическое воздействие в основном на нервную систему. 59

Пример нарушения обмена липидов болезнь Тея-Сакса или ранняя детская идиотия амавротическая. Вызывается мутацией гена, ответственного за синтез фермента гексозоаминидазы A фермента, принимающего участие в метаболизме ганглиозидов. В результате, ганглиозиды накапливаются в нервных клетках, нарушая их работу. Болезнь проявляется в нарушении моторных актов, восприятия и интеллектуальной деятельности. Для неё характерно наличие темно-красного пятна на сетчатке. Заканчивается летальным исходом в возрасте 5 - 6 лет. 60

Примеры нарушения обмена углеводов - галактоземия, фруктозурия. При этих заболеваниях нарушается метаболизм галактозы и фруктозы. К генным болезням, связанным с нарушением углеводного обмена следует отнести моногенные формы сахарного диабета, когда вследствие дефекта гормона инсулина или его рецепторов нарушается обмен глюкозы. 61

Галактоземия - наследственное заболевание, в основе которого лежит нарушение обмена веществ на пути преобразования галактозы в глюкозу (мутация структурного гена, ответственного за синтез фермента галактозо-1 -фосфатуридилтрансферазы). Заболевание проявляется в первые дни и недели жизни выраженной желтухой, увеличением печени, неврологической симптоматикой (судороги, нистагм (непроизвольное движение глазных яблок), гипотония мышц), рвотой; в дальнейшем обнаруживается отставание в физическом и нервно-психическом развитии, возникает катаракта. При лабораторном исследовании в крови определяется галактоза, специальными методами (хроматография) удается обнаружить галактозу в моче. 62

Фруктозурия вызывается мутациями геном, несущих информацию о фементах фруктокиназа, фруктозо-1 фосфатальдолаза и фруктозо-1, 6 -дифосфатальдолаза. Отмечается повышение уровня фруктозы в крови и появление фруктозы в моче. 63

Пример нарушения минерального обмена - болезнь Коновалова-Вильсона. Болезнь Вильсона-Коновалова или гепатоцеребральная дистрофия или гепатолентикулярная дегенерация или болезнь Вестфаля-Вильсона-Коновалова – наследственное заболевание, в основе патогенеза которого лежит мутация гена, отвечающего за синтез транспортного белка церуллоплазмина, связывающего медь. Медь откладывается во внутренних органах, особенно в печени и в головном мозге, функционирование которых нарушается. 64

Кольцо Кайзера-Флейшера (отложение меди) у пациента, страдающего болезнью Вильсона. Коновалова. Диагностика моногенных болезней обмена основана на применении биохимических исследования. веществ методов 65

4. Заболевания человека с наследственной предрасположенностью нельзя назвать наследственными в полном смысле этого термина. Здесь ведущая роль принадлежит не мутациям. Эти заболевания возникают при действии множества факторов, поэтому их называют полигенными или мультифакториальными. Такие заболевания характеризуются аддитивно-полигенным наследованием с пороговым эффектом. 66

Часть факторов развития полигенных болезней определяется генотипом. Указанные факторы представляют собой группу генов, каждый из которых скорее нормален, чем патологически изменен. Однако, эти гены могут определять предрасположенность к тому или иному заболеванию. Чем больше у человека таких генов, тем вероятнее возникновение у него заболевания. Другая часть факторов, вызывающих развитие болезни - факторы внешней среды. Чем больше таких факторов, тем вероятнее возникновение заболевания. Провоцирующими факторами для возникновения этих заболеваний являются стрессы, погрешности в диете, гиподинамия, вредные привычки, вредные факторы окружающей среды. 67

Эта группа болезней составляет 92% от общего числа наследственных патологий человека. С возрастом частота заболеваний возрастает. Распространение мультифакториальных болезней в разных популяциях человека может значительно варьировать, что связано с различием генетических и средовых факторов. Мультифакториальные заболевания составляют значительную часть нозологий, с которыми сталкивается врач общей практики. Этим определяется особая значимость знаний в данной области. Примерами мультифакториальных заболеваний служат рак, сахарный диабет, шизофрения, эпилепсия, ишемическая болезнь сердца, гипертензия и многие другие. 68

5. Медико-генетические аспекты семьи. Профилактика наследственных и врожденных заболеваний. Медико-генетическое консультирование. Пренатальная диагностика наследственных заболеваний. Основной медико-генетической проблемой семьи является профилактика рождения ребенка, больного наследственными заболеваниями. Эта профилактика реализуется путем информирования семьи о сути наследственной патологии и методах ее предотвращения, осуществлением дородовой (пренатальной) диагностики и медикогенетическим консультированием. 69

Медико-генетическое консультирование (МГК) - один из видов специализированной медицинской помощи, направленный на предотвращение рождения ребенка с наследственным заболеванием. Впервые медико-генетическая консультация была организована С. Н. Давиденковым в конце 20 -х годов прошлого века на базе Института нервно-психиатрической профилактики в Москве, а первый кабинет по медико-генетическому консультированию был открыт в 1941 году в Мичиганском университете в США. Принято считать, что термин «генетическая консультация» был предложен С. Ридом в 1947 году. 70

Суть медико-генетического консультирования состоит в определении прогноза рождения ребенка с наследственной патологией, объяснении вероятности этого события и помощи консультирующейся семье в принятии решения о деторождении. Задачи МГК: установление (уточнение) генетического диагноза заболевания, прогнозирование вероятности рождения детей с наследственным заболеванием, объяснение смысла медико-генетического заключения заинтересованным лицам, популяризация медикогенетических знаний. 71

Виды МГК: проспективное консультирование (консультирование, при котором в семье нет больных детей), ретроспективное консультирование (консультирование, при котором в семье уже есть больные дети). Этапы МГК: диагностика (установление генетического диагноза), прогнозирование, заключение. 72

Первый этап МГК. Уточнение генетического диагноза в медико-генетической консультации проводится с помощью генетического анализа. Применяется генеалогический метод, цитогенетическое исследование, биохимический и иммунологический методы. Генеалогический метод исследования применяется во всех случаях. Не менее чем в 10 % случаев применяется цитогенетическое исследование. Это необходимо для прогноза при установленном диагнозе хромосомной болезни и уточнении диагноза в неясных случаях при врожденных пороках развития. Биохимический и иммунологический методы не являются специфичными для генетической консультации, но широко применяются для уточнения диагноза болезней обмена веществ и заболеваний, связанных с нарушениями иммунной системы. Кроме того, в процессе генетического консультирования иногда возникает потребность дополнительного параклинического обследования. 73

На втором этапе определяют прогноз потомства. Генетический риск может быть определен путем теоретических расчетов с использованием методов генетического анализа и вариационной статистики, или с помощью эмпирических данных (на основе таблиц эмпирического риска). При моногенных, менделирующих болезнях прогноз основывается на расчете вероятности появления потомства в соответствии с генетическими закономерностями. Если у пробанда установлена вновь возникшая мутация, то риск рождения ребенка с такой же патологией незначителен. 74

При хромосомных болезнях определение риска повторного рождения потомства с хромосомными аномалиями зависит от того, каковы кариотипы родителей (мозаицизм, структурные аномалии хромосом). В случае отсутствия нарушений в кариотипе родителей вероятность повторного рождения ребенка с хромосомной аномалией оценивается по эмпирическим данным для каждого вида аномалии с учетом возраста родителей. 75

При мультифакториальных заболеваниях основой оценки риска являются эмпирические данные о популяционной и семейной частоте каждого из них. Специфический генетический риск до 5 % принято считать низким, до 10 % - повышенным в легкой степени, до 20 % - средним, выше 20 % - высоким. Генетический риск средней степени расценивают как противопоказание к зачатию или показание к прерыванию уже имеющейся беременности. 76

Третий этап МГК включает представление заключения и советы родителям. Заключительные этапы консультирования требуют самого пристального внимания. Нельзя получить правильный эффект консультирования, если пациенты неправильно поймут объяснения врача-генетика. Для достижения цели консультирования при беседе с пациентами следует учитывать уровень их образования, социальноэкономическое положение семьи, структуру личности и взаимоотношения в семье. Толкование риска должно быть приспособлено к каждому случаю индивидуально. Кроме того, роль врача не должна сводиться только к объяснению смысла риска, врач должен помочь в принятии решения. 77

Пренатальная диагностика наследственных заболеваний - медицинские мероприятия, с помощью которых можно установить наличие заболевания у еще не родившегося плода. Столь раннее установление диагноза неоценимо при наличии у плода тяжелых болезней, которые не поддаются лечению и поэтому приводят к инвалидности или смерти ребенка после рождения. Чаще всего пренатальная диагностика направлена на выявление у плода наследственных заболеваний и пороков развития. 78

Существуют различные виды пренатальной диагностики. Инвазивные методы предполагают проникновение в полость матки. При этом забираются для исследований образцы околоплодных вод, хориона или плаценты, кровь из пуповины плода. К этим методам относятся биопсия хориона, амниоцентез, плацентоцентез и кордоцентез. Неинвазивные методы. При их проведении полость матки не затрагивается. Для исследования используют кровь беременной женщины (скрининг материнских сывороточных факторов), мазки из половых путей, а также проводят ультразвуковое сканирование плода, оболочек и плаценты. 79 79

Инвазивные методы. Биопсия хориона. Биопсию хориона проводят на сроках 10 - 11 недель беременности. Под контролем ультразвукового сканирования в канал шейки матки беременной женщины вводится катетер. После соприкосновения конца катетера с хорионом, в него с помощью шприца насасывается небольшое количество хориональной ткани. Эта ткань (а не ткань собственно зародыша) исследуется в лаборатории разными методами. Есть еще один способ забора хориона: при этом образец ткани засасывают в шприц через длинную иглу, введенную в полость матки через брюшную стенку под контролем ультразвукового аппарата. 80

Биопсия хориона. Схема проведения. Полученный материал исследуют цитогенетическими (для установления диагноза хромосомных болезней) и биохимическими (для установления диагноза болезней обмена веществ) методами. 81

Амниоцентез обычно проводят на 15 - 16 неделе беременности. Под контролем ультразвукового аппарата путем прокола брюшной стенки в полость матки вводится игла. Через иглу в шприц набирают околоплодную жидкость. В дальнейшем можно исследовать химический состав жидкости и клетки плода, которые в ней находятся. В околоплодных водах находятся слущенные клетки кожи плода, эпителиоциты из мочевыводящих путей плода. 82
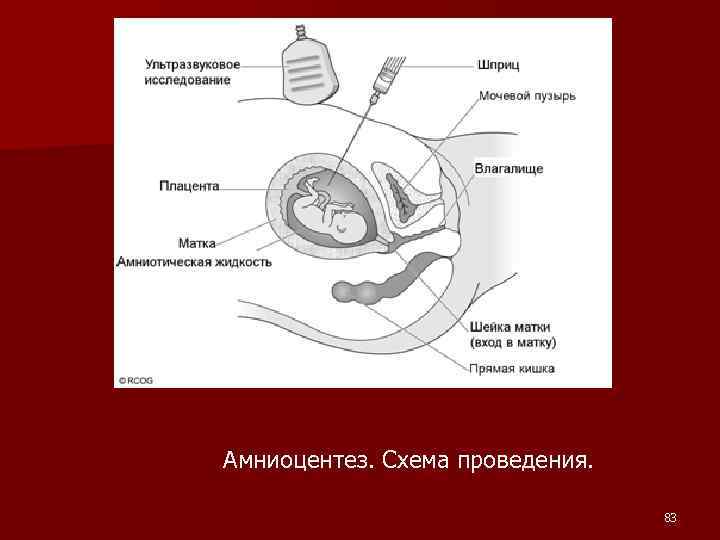
Амниоцентез. Схема проведения. 83

Плацентоцентез и кордоцентез. Производят прокол иглой передней брюшной стенки женщины и под контролем ультразвукового аппарата забирают фрагменты плаценты (при плацентоцентезе) или пуповинную кровь плода (при кордоцентезе). Полученный материал исследуют цитогенетическими (для установления диагноза хромосомных болезней) и биохимическими (для установления диагноза болезней обмена веществ) методами. 84

Неинвазивные методы. Скрининг материнских сывороточных факторов (СМСФ). Это неинвазивный метод дородовой диагностики некоторых тяжелых заболеваний у плода. Его часто называют "тройным" тестом, поскольку при его проведении исследуется содержание в крови беременной женщины трех веществ: альфафетопротеина (АФП), хорионического гонадотропина (ХГ) и неконъюгированного эстриола (НЭ). 85

В случаях, когда у плода имеются некоторые тяжелые пороки развития, анализ показывает значительное повышение уровня АФП в крови матери. При синдроме Дауна у плода, уровень АФП в крови матери сильно снижается. В случае болезни плода (например, синдрома Дауна) ХГ и НЭ также отклоняются от нормальных значений. При использовании этого метода устанавливается предварительный дмагноз. Для дальнейшего уточнения диагноза назначается дополнительное обследование - ультразвуковое сканирование, амниоцентез, плацентоцентез или кордоцентез. 86

Ультразвуковое исследование (сканирование) - это способ оценки состояние плода без вторжения в полость матки. При проведении этого исследования на поверхность живота беременной женщины устанавливается специальный датчик, который испускает звуковые волны высокой частоты. По достижении тканей плода эти волны отражаются и улавливаются датчиком снова. Компьютерная обработка этих волн и формирует изображение на экране монитора. Изображение называется сонограммой. Иногда используют датчик, который вводится во влагалище женщины. 87

При помощи УЗИ можно определить: УЗИ позволяет определить: пороки развития плода, пол ребенка и срок беременности; предлежание плода и плаценты; количество околоплодных вод; наличие и качество сердцебиения плода. Стандартные ультразвуковые исследования проводят в разные сроки беременности. Обязательное ультразвуковое исследование плода должна пройти каждая беременная женщина на сроке 15 - 18 недель. Если возникает подозрение на какой-либо дефект развития у плода, делается повторное УЗИ на сроках 22 -23 недели. 88

Ультрасонограмма (УЗИ) плода. 89

6. Генная инженерия. Биотехнология. Понятие о генной терапии. Генная инженерия - совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма (клеток), осуществления манипуляций с генами и введения их в другие организмы. Генная инженерия служит для получения желаемых качеств организма. Генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования. 90

Примерами применения генной инженерии являются получение новых генетически модифицированных сортов зерновых культур, производство человеческого инсулина путём использования генномодифицированных бактерий, производство эритропоэтина в культуре клеток или новых пород экспериментальных мышей для научных исследований. Трансгенные организмы - это те организмы, которым введены гены других организмов. 91

Основные этапы решения генноинженерной задачи следующие: 1. Получение изолированного гена. 2. Введение гена в вектор для переноса в организм. 3. Перенос вектора с геном в модифицируемый организм. 4. Преобразование клеток организма. 5. Отбор генетически модифицированных организмов (ГМО) и устранение тех, которые не были успешно модифицированы. Вектор – молекула нуклеиновой кислоты, чаще всего ДНК, используемая в генетической инженерии для передачи генетического материала другой клетке. Существуют векторы: плазмиды, фагмиды, векторы на основе вирусов. 92

Общий принцип генной инженерии на примере плазмиды из E. Cоli p. BR 322. В заранее выделенную ДНК хозяина вводят in vitro нужный ген из другого источника. Полученную таким образом рекомбинантную молекулу, снова внедряют в клеткухозяина, в которой она будет реплицироваться и стабильно передаваться клеткам-потомкам при последующем клеточном делении. 93

Биотехнология - производственное использование биологических агентов (микроорганизмы, растительные клетки, животные клетки, части клеток: клеточные мембраны, рибосомы, митохондрии, хлоропласты) для получения ценных продуктов и осуществления целевых превращений. В биотехнологических процессах также используются такие биологические макромолекулы как рибонуклеиновые кислоты (ДНК, РНК), белки - чаще всего ферменты. 94

Например, гормон роста секретируется передней долей гипофиза. При недостатке гормона возникает карликовость. Раньше этот гормон получали из гипофиза трупов. Сейчас его получают из генетически модифицированной кишечной палочки. Из несовершенных грибов получен препарат циклоспорин, который используется при трансплантации органов для подавления иммунных реакций, приводящих к отторжению тканей. 95

Генная терапия – совокупность генноинженерных, биотехнологических и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. Это новая область, ориентированная на исправление дефектов, вызванных мутациями, или придания клеткам новых функций. Используется прием введения новой генетической информации в клетки млекопитающих. Это позволяет разрабатывать прямые методы лечения наследственных болезней – методы генной терапии. 96

Существует несколько способов генной терапии. Фетальная генная терапия. ДНК вводят в зиготу или эмбрион на ранней стадии развития. Введенный материал попадет во все клетки реципиента, в том числе и в половые клетки. Соматическая генная терапия. Генетический материал вводят только в соматические клетки. Кроме того используется активация собственных генов организма с целью полного или частичного преодоления действия мутантного гена. 97

Существует два способа введения генетической информации в организм. При ex vivo генной терапии клетки берут из организма, вводят в них требуемую генетическую информацию и возвращают в тот же организм. При in vivo генной терапии доставка генов осуществляется непосредственно в организм. 98

В 2010 году в мире около 400 проектов по генной терапии находятся на различных стадиях клинических испытаний. Пока генная терапия применяется в основном в онкологии (более 60% проектов). Примерно по 15% приходится на генную терапию инфекционных (СПИД, гепатит В, туберкулез) и моногенных заболеваний (муковисцидоз, семейная гиперхолестеринемия, мукополисахаридозы, гемофилия А и некоторые другие болезни). Генная терапия успешно применяется для лечения не только наследственных, но и значительно более распространенных мультифакториальных болезней (диабет, остеопороз, ревматоидный артрит, различные опухоли). 99

Благодарю за внимание! 100
Лекц 8 Наследственные болезни человека.ppt