OM_TM_Lc_08.pptx
- Количество слайдов: 13
 Лекция 8 Кристаллизации металлов 1. Энергетические условия процесса кристаллизации 2. Механизм процесса кристаллизации 3. Реальная форма кристаллических образований Lk 8_OM i TM 1
Лекция 8 Кристаллизации металлов 1. Энергетические условия процесса кристаллизации 2. Механизм процесса кристаллизации 3. Реальная форма кристаллических образований Lk 8_OM i TM 1
 1. Энергетические условия процесса кристаллизации Система - совокупность индивидуальных веществ, между которыми или частями которых обеспечена возможность обмена энергией, а также процессов диффузии (лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму). Компоненты систему. системы - вещества, которые образуют Фаза - однородная часть системы, ограниченная от других частей системы поверхностью раздела, при переходе через которую свойства изменяются скачком. Lk 8_OM i TM 2
1. Энергетические условия процесса кристаллизации Система - совокупность индивидуальных веществ, между которыми или частями которых обеспечена возможность обмена энергией, а также процессов диффузии (лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму). Компоненты систему. системы - вещества, которые образуют Фаза - однородная часть системы, ограниченная от других частей системы поверхностью раздела, при переходе через которую свойства изменяются скачком. Lk 8_OM i TM 2
 условия – температура и давление температура При Тпл - подвижность атомов в узлах решетки, и при Т=Тпл вырываются из узлов, решетка разрушается с образованием ж. фазы. Тпл : ртуть -38, 9 °С; олово - 232 °С; цинк - 419 °С; алюминий - 660 °С; медь - 1083 °С; железо - 1536 °С … вольфрам - 3410 °С. При Тпл - подвижность атомов, вблизи Тпл образуются группировки атомов, в которых атомы упакованы как в кристаллах - центры кристаллизации (зародыши). При Т=Тпл образуется кр. решетка, и металл переходит в тв. состояние. Lk 8_OM i TM 3
условия – температура и давление температура При Тпл - подвижность атомов в узлах решетки, и при Т=Тпл вырываются из узлов, решетка разрушается с образованием ж. фазы. Тпл : ртуть -38, 9 °С; олово - 232 °С; цинк - 419 °С; алюминий - 660 °С; медь - 1083 °С; железо - 1536 °С … вольфрам - 3410 °С. При Тпл - подвижность атомов, вблизи Тпл образуются группировки атомов, в которых атомы упакованы как в кристаллах - центры кристаллизации (зародыши). При Т=Тпл образуется кр. решетка, и металл переходит в тв. состояние. Lk 8_OM i TM 3
 Кристаллизация - процесс перехода из Ж или Г-состояния в Тв. при определенной температуре, образуется кр. решетка и возникают кристаллы. II закон термодинамики: Любой самопроизвольно текущий процесс идет в случае, если новое состояние более устойчиво, т. е. обладает меньшим запасом свободной энергии. Свободная энергия - такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Lk 8_OM i TM 4
Кристаллизация - процесс перехода из Ж или Г-состояния в Тв. при определенной температуре, образуется кр. решетка и возникают кристаллы. II закон термодинамики: Любой самопроизвольно текущий процесс идет в случае, если новое состояние более устойчиво, т. е. обладает меньшим запасом свободной энергии. Свободная энергия - такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Lk 8_OM i TM 4
 F = U - TS где F -свободная энергия; U - полная внутренняя энергия системы; Т -температура; S – энтропия Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается (второй закон термодинамики). Рис. 2. Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры Любая термодинамическая система стремится к min свободной энергии Lk 8_OM i TM 5
F = U - TS где F -свободная энергия; U - полная внутренняя энергия системы; Т -температура; S – энтропия Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается (второй закон термодинамики). Рис. 2. Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры Любая термодинамическая система стремится к min свободной энергии Lk 8_OM i TM 5
 Ts (Fж = Fкр) – равновесная или теоретическая температура кристаллизации. Фактическая температура кристаллизации Тn (Tф) температура, при которой практически начинается кристаллизация. Переохлаждение - охлаждение жидкости ниже температуры кристаллизации. Перенагревание - превращение из кр. состояния в жидкое может произойти только выше температуры Ts Степень переохлаждения - ∆T = Ts - Tф. зависит от: • природы металла, • степени его загрязненности, • скорости охлаждения. Lk 8_OM i TM 6
Ts (Fж = Fкр) – равновесная или теоретическая температура кристаллизации. Фактическая температура кристаллизации Тn (Tф) температура, при которой практически начинается кристаллизация. Переохлаждение - охлаждение жидкости ниже температуры кристаллизации. Перенагревание - превращение из кр. состояния в жидкое может произойти только выше температуры Ts Степень переохлаждения - ∆T = Ts - Tф. зависит от: • природы металла, • степени его загрязненности, • скорости охлаждения. Lk 8_OM i TM 6
 Рис. 3 – Температурные кривые кристаллизации с разными скоростями охлаждения. Lk 8_OM i TM 7
Рис. 3 – Температурные кривые кристаллизации с разными скоростями охлаждения. Lk 8_OM i TM 7
 2. Механизм процесса кристаллизации два элементарных процессов при понижении температуры в жидком металле образуются кристаллики – центры кристаллизации (зародыши ) рост кристаллов из этих центров Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Лекция 5 8
2. Механизм процесса кристаллизации два элементарных процессов при понижении температуры в жидком металле образуются кристаллики – центры кристаллизации (зародыши ) рост кристаллов из этих центров Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Лекция 5 8
 Рис. 4. Схема процесса кристаллизации Lk 8_OM i TM 9
Рис. 4. Схема процесса кристаллизации Lk 8_OM i TM 9
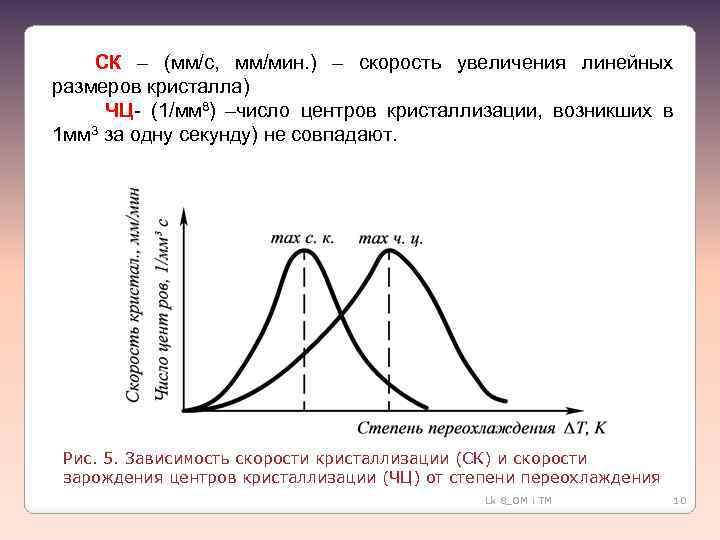 СК – (мм/с, мм/мин. ) – скорость увеличения линейных размеров кристалла) ЧЦ- (1/мм 8) –число центров кристаллизации, возникших в 1 мм 3 за одну секунду) не совпадают. Рис. 5. Зависимость скорости кристаллизации (СК) и скорости зарождения центров кристаллизации (ЧЦ) от степени переохлаждения Lk 8_OM i TM 10
СК – (мм/с, мм/мин. ) – скорость увеличения линейных размеров кристалла) ЧЦ- (1/мм 8) –число центров кристаллизации, возникших в 1 мм 3 за одну секунду) не совпадают. Рис. 5. Зависимость скорости кристаллизации (СК) и скорости зарождения центров кристаллизации (ЧЦ) от степени переохлаждения Lk 8_OM i TM 10
 3. Реальная форма кристаллических образований Факторы, влияющие на скорость кристаллизации: • • • скорости и направления отвода тепла; наличия нерастворившихся частиц (центров кристаллизации); конвекционных токов жидкости. Дендрит - древовидный кристалл Рис. 6. Схема строения дендрита: 1, 2 и 3 – оси соответственно первого, второго и третьего порядков Lk 8_OM i TM 11
3. Реальная форма кристаллических образований Факторы, влияющие на скорость кристаллизации: • • • скорости и направления отвода тепла; наличия нерастворившихся частиц (центров кристаллизации); конвекционных токов жидкости. Дендрит - древовидный кристалл Рис. 6. Схема строения дендрита: 1, 2 и 3 – оси соответственно первого, второго и третьего порядков Lk 8_OM i TM 11
 Снежинка - дендрит льда Дендрит окисла железа Дендрит окисла марганца в кварце Lk 8_OM i TM 12
Снежинка - дендрит льда Дендрит окисла железа Дендрит окисла марганца в кварце Lk 8_OM i TM 12
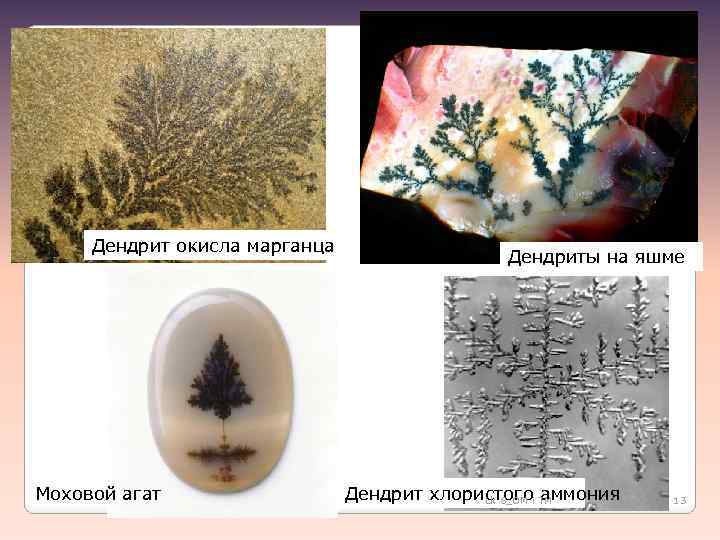 Дендрит окисла марганца Моховой агат Дендриты на яшме Дендрит хлористого аммония Lk 8_OM i TM 13
Дендрит окисла марганца Моховой агат Дендриты на яшме Дендрит хлористого аммония Lk 8_OM i TM 13


