ХАООС Лекция 8.ppt
- Количество слайдов: 24
 Лекция № 8 АНАЛИЗ КОМПОНЕНТОВ АТМОСФЕРЫ План: 1. Кислотные газы 2. Парниковые газы 3. Хлор органические соединения 4. Аммиак 5. Пары ртути
Лекция № 8 АНАЛИЗ КОМПОНЕНТОВ АТМОСФЕРЫ План: 1. Кислотные газы 2. Парниковые газы 3. Хлор органические соединения 4. Аммиак 5. Пары ртути
 Основным условием существования жизни на Земле является чистый воздух атмосферы, необходимый для дыхания живых организмов. Человек в течение суток потребляет примерно 15 кг воздуха, 1, 5 кг пищи, 2, 5 л воды. Если без воды и пищи можно прожить дни и даже недели, то без воздуха - считанные минуты. Загрязнение воздуха наносит серьезный ущерб здоровью человека, природе, промышленности, сельскому и коммунальному хозяйству. В составе атмосферного воздуха 78 % азота, 21 % кислорода, 0, 03 % диоксида углерода, присутствуют озон, метан, аргон, неон, гелий. Из всех газов наибольшая роль принадлежит кислороду, являющемуся обязательным элементом круговорота веществ в биосфере. Кислород, являющийся продуктом фотосинтеза зеленых растений, за 2, 5 млрд лет накопился в атмосфере в количестве 1, 5 • 1015 т. Одно дерево производит за сутки 180 л кислорода. Человек потребляет в покое 360 л кислорода, при физической нагрузке 700 - 900 л в сутки.
Основным условием существования жизни на Земле является чистый воздух атмосферы, необходимый для дыхания живых организмов. Человек в течение суток потребляет примерно 15 кг воздуха, 1, 5 кг пищи, 2, 5 л воды. Если без воды и пищи можно прожить дни и даже недели, то без воздуха - считанные минуты. Загрязнение воздуха наносит серьезный ущерб здоровью человека, природе, промышленности, сельскому и коммунальному хозяйству. В составе атмосферного воздуха 78 % азота, 21 % кислорода, 0, 03 % диоксида углерода, присутствуют озон, метан, аргон, неон, гелий. Из всех газов наибольшая роль принадлежит кислороду, являющемуся обязательным элементом круговорота веществ в биосфере. Кислород, являющийся продуктом фотосинтеза зеленых растений, за 2, 5 млрд лет накопился в атмосфере в количестве 1, 5 • 1015 т. Одно дерево производит за сутки 180 л кислорода. Человек потребляет в покое 360 л кислорода, при физической нагрузке 700 - 900 л в сутки.
 Вопрос 1 Кислотные газы Одной из первостепенных экологических проблем является повышение кислотности окружающей среды - «кислотные дожди» ( «отрава с неба» ). Кислотный дождь – дождь (и снег) подкисленный (р. Н ниже 5, 6) из-за растворения в атмосферной влаге промышленных выбросов (SO 2, NOx, HCl и др. ) Термин «кислые дожди» был введен английским химиком А. Смитом в начале 70 -х годов XX века. Причина кислотных дождей. Атмосферными загрязнителями считают диоксид серы (SO 2) и диоксид азота (NO 2). Поступление в атмосферу больших количеств диоксида серы и окислов азота приводит к снижению р. Н - повышению концентрации ионов водорода - атмосферных осадков. Это происходит из-за вторичных реакций в атмосфере, приводящих к образованию сильных кислот – серной и азотной. Растворение кислот в атмосферной влаге приводит к выпадению кислотных дождей. Концентрация ионов водорода (р. Н) в дождевой воде в ряде случаев снижается на 2 -2, 5 единицы (сока лимона), т. е. вместо нормальных 5. 6 -5, 7.
Вопрос 1 Кислотные газы Одной из первостепенных экологических проблем является повышение кислотности окружающей среды - «кислотные дожди» ( «отрава с неба» ). Кислотный дождь – дождь (и снег) подкисленный (р. Н ниже 5, 6) из-за растворения в атмосферной влаге промышленных выбросов (SO 2, NOx, HCl и др. ) Термин «кислые дожди» был введен английским химиком А. Смитом в начале 70 -х годов XX века. Причина кислотных дождей. Атмосферными загрязнителями считают диоксид серы (SO 2) и диоксид азота (NO 2). Поступление в атмосферу больших количеств диоксида серы и окислов азота приводит к снижению р. Н - повышению концентрации ионов водорода - атмосферных осадков. Это происходит из-за вторичных реакций в атмосфере, приводящих к образованию сильных кислот – серной и азотной. Растворение кислот в атмосферной влаге приводит к выпадению кислотных дождей. Концентрация ионов водорода (р. Н) в дождевой воде в ряде случаев снижается на 2 -2, 5 единицы (сока лимона), т. е. вместо нормальных 5. 6 -5, 7.
 ПРИЧИНЫ ОБРАЗОВАНИЯ КИСЛОТНЫХ ДОЖДЕЙ § Искусственные источники § Естественные причины вулканы § гроза § минеральные удобрения § сжигание топлива § топливо самолетов § нефтепереработка § автотранспорт
ПРИЧИНЫ ОБРАЗОВАНИЯ КИСЛОТНЫХ ДОЖДЕЙ § Искусственные источники § Естественные причины вулканы § гроза § минеральные удобрения § сжигание топлива § топливо самолетов § нефтепереработка § автотранспорт
 ОБРАЗОВАНИЕ КИСЛОТНЫХ ДОЖДЕЙ Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот. Частично диоксид серы в результате фотохимического окисления превращается в оксид серы(VI) (серный ангидрид) SО 3: 2 SO 2 + O 2 ↔ 2 SО 3, который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты: SО 3 + H 2 O → H 2 SО 4 H 2 SО 4 ↔ H+ + HSО 4 Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SO 2 • n. H 2 O, который часто называют сернистой кислотой H 2 SО 3 : SO 2 + H 2 O → H 2 SО 3 H 2 SО 3 ↔ H+ + HSО 3 Сернистая кислота во влажном воздухе постепенно окисляется до серной: 2 H 2 SО 3 + O 2 → 2 H 2 SО 4 Аэрозоли серной и сернистой кислот конденсируются в водяном паре атмосферы и становятся причиной кислотных осадков. Они составляют около 2/3 кислотных осадков. Остальное приходится на долю аэрозолей азотной и азотистой кислот, образующихся при взаимодействии диоксида азота с водяным паром атмосферы: 2 NO 2 + H 2 O→ HNO 3 + HNO 2 HNO 3 ↔ H+ +NO 3 HNO 2 ↔ H+ +NO 2 -
ОБРАЗОВАНИЕ КИСЛОТНЫХ ДОЖДЕЙ Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот. Частично диоксид серы в результате фотохимического окисления превращается в оксид серы(VI) (серный ангидрид) SО 3: 2 SO 2 + O 2 ↔ 2 SО 3, который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты: SО 3 + H 2 O → H 2 SО 4 H 2 SО 4 ↔ H+ + HSО 4 Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SO 2 • n. H 2 O, который часто называют сернистой кислотой H 2 SО 3 : SO 2 + H 2 O → H 2 SО 3 H 2 SО 3 ↔ H+ + HSО 3 Сернистая кислота во влажном воздухе постепенно окисляется до серной: 2 H 2 SО 3 + O 2 → 2 H 2 SО 4 Аэрозоли серной и сернистой кислот конденсируются в водяном паре атмосферы и становятся причиной кислотных осадков. Они составляют около 2/3 кислотных осадков. Остальное приходится на долю аэрозолей азотной и азотистой кислот, образующихся при взаимодействии диоксида азота с водяным паром атмосферы: 2 NO 2 + H 2 O→ HNO 3 + HNO 2 HNO 3 ↔ H+ +NO 3 HNO 2 ↔ H+ +NO 2 -
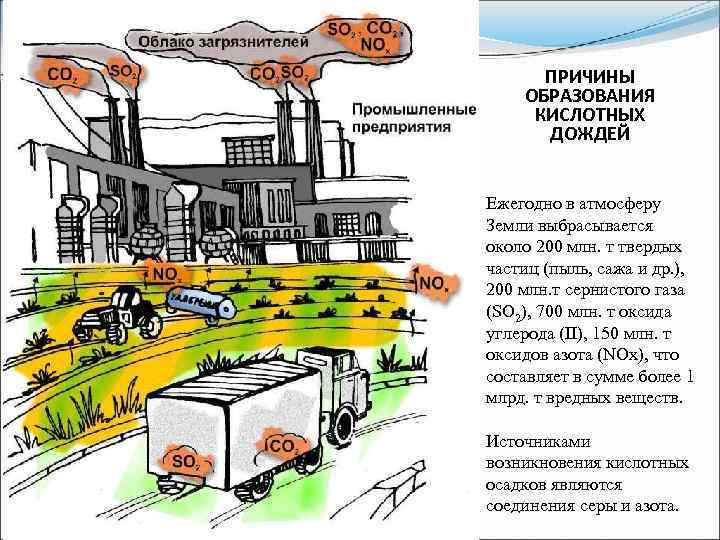 ПРИЧИНЫ ОБРАЗОВАНИЯ КИСЛОТНЫХ ДОЖДЕЙ Ежегодно в атмосферу Земли выбрасывается около 200 млн. т твердых частиц (пыль, сажа и др. ), 200 млн. т сернистого газа (SO 2), 700 млн. т оксида углерода (II), 150 млн. т оксидов азота (NOx), что составляет в сумме более 1 млрд. т вредных веществ. Источниками возникновения кислотных осадков являются соединения серы и азота.
ПРИЧИНЫ ОБРАЗОВАНИЯ КИСЛОТНЫХ ДОЖДЕЙ Ежегодно в атмосферу Земли выбрасывается около 200 млн. т твердых частиц (пыль, сажа и др. ), 200 млн. т сернистого газа (SO 2), 700 млн. т оксида углерода (II), 150 млн. т оксидов азота (NOx), что составляет в сумме более 1 млрд. т вредных веществ. Источниками возникновения кислотных осадков являются соединения серы и азота.
 Чем опасны кислотные осадки? Они наносят значительный экологический, экономический и эстетический ущерб. С экологической точки зрения немаловажное значение имеет р. Н атмосферных осадков. От его значения зависит жизнедеятельность всех организмов, особенно в водной среде. В пресноводных бассейнах (озерах, ручьях) р. Н воды равно 6– 7. Все «нормальные» формы жизни прекращаются при р. Н в воде меньше 5. Кроме того, многие пищевые цепи, охватывающие диких животных, начинаются в водоемах. Далее сокращаются популяции птиц, т. к. личинки для их питания погибают в кислой воде. В воде озер вымирают микроорганизмы, развиваются анаэробные (бескислородные) процессы с выделением метана и сероводорода. На больших пространствах наблюдается деградация хвойных лесов. Опадает хвоя, загнивает древесина. Попадая на листья и хвою деревьев, кислоты нарушают защитный восковой покров, делая деревья уязвимыми для насекомых - вредителей и болезней. Кислотные осадки, просачиваясь через почву, способны выщелачивать алюминий и тяжелые металлы. Соединения алюминия являются токсичными соединениями, которые разрушают корневую систему растений и резко снижают деятельность редуцентов. Экономический и эстетический ущерб от кислотных дождей проявляется в следующем: кислотные осадки медленно, но верно растворяют сооружения из мрамора и известняка.
Чем опасны кислотные осадки? Они наносят значительный экологический, экономический и эстетический ущерб. С экологической точки зрения немаловажное значение имеет р. Н атмосферных осадков. От его значения зависит жизнедеятельность всех организмов, особенно в водной среде. В пресноводных бассейнах (озерах, ручьях) р. Н воды равно 6– 7. Все «нормальные» формы жизни прекращаются при р. Н в воде меньше 5. Кроме того, многие пищевые цепи, охватывающие диких животных, начинаются в водоемах. Далее сокращаются популяции птиц, т. к. личинки для их питания погибают в кислой воде. В воде озер вымирают микроорганизмы, развиваются анаэробные (бескислородные) процессы с выделением метана и сероводорода. На больших пространствах наблюдается деградация хвойных лесов. Опадает хвоя, загнивает древесина. Попадая на листья и хвою деревьев, кислоты нарушают защитный восковой покров, делая деревья уязвимыми для насекомых - вредителей и болезней. Кислотные осадки, просачиваясь через почву, способны выщелачивать алюминий и тяжелые металлы. Соединения алюминия являются токсичными соединениями, которые разрушают корневую систему растений и резко снижают деятельность редуцентов. Экономический и эстетический ущерб от кислотных дождей проявляется в следующем: кислотные осадки медленно, но верно растворяют сооружения из мрамора и известняка.
 ПОСЛЕДСТВИЯ КИСЛОТНЫХ ДОЖДЕЙ: -в природе В результате выпадения кислотных осадков нарушается равновесие в экосистемах, ухудшается продуктивность сельскохозяйственных растений и питательные свойства почв. -в технике В результате коррозии разрушаются металлические конструкции. -в архитектуре Кислотные осадки разрушают сооружения из мрамора и известняка. Исторические памятники Греции и Рима, простояв тысячелетия, за последние годы разрушаются прямо на глазах. В Голландии статуи на соборе Св. Иоанна "тают, как леденцы". - нанесение вреда здоровью людей
ПОСЛЕДСТВИЯ КИСЛОТНЫХ ДОЖДЕЙ: -в природе В результате выпадения кислотных осадков нарушается равновесие в экосистемах, ухудшается продуктивность сельскохозяйственных растений и питательные свойства почв. -в технике В результате коррозии разрушаются металлические конструкции. -в архитектуре Кислотные осадки разрушают сооружения из мрамора и известняка. Исторические памятники Греции и Рима, простояв тысячелетия, за последние годы разрушаются прямо на глазах. В Голландии статуи на соборе Св. Иоанна "тают, как леденцы". - нанесение вреда здоровью людей
 Вопрос 2 Парниковые газы Парниковый эффект – эффект разогрева приземного слоя воздуха, вызванный тем, что атмосфера поглощает тепловое излучение земной поверхности, в которое превращается большая часть достигшей Земли световой энергии Солнца. В глобальном масштабе, содержащийся в воздухе углекислый газ играет ту же роль, что и стекло. Световая энергия проникает сквозь атмосферу, поглощается поверхностью Земли, преобразуется в тепловую энергию, и выделяется в виде инфракрасного излучения. Однако углекислый газ и некоторые другие газы, в отличие от других природных элементов атмосферы, его поглощают. При этом он нагревается и в свою очередь нагревает атмосферу в целом. Значит, чем больше в ней углекислого газа, тем больше инфракрасных лучей будет поглощено и тем теплее она станет. Климат, к которому мы привыкли, обеспечивается концентрацией углекислого газа в атмосфере на уровне 0, 03%. Если мы увеличиваем концентрацию углекислого газа, то происходит потепление климата.
Вопрос 2 Парниковые газы Парниковый эффект – эффект разогрева приземного слоя воздуха, вызванный тем, что атмосфера поглощает тепловое излучение земной поверхности, в которое превращается большая часть достигшей Земли световой энергии Солнца. В глобальном масштабе, содержащийся в воздухе углекислый газ играет ту же роль, что и стекло. Световая энергия проникает сквозь атмосферу, поглощается поверхностью Земли, преобразуется в тепловую энергию, и выделяется в виде инфракрасного излучения. Однако углекислый газ и некоторые другие газы, в отличие от других природных элементов атмосферы, его поглощают. При этом он нагревается и в свою очередь нагревает атмосферу в целом. Значит, чем больше в ней углекислого газа, тем больше инфракрасных лучей будет поглощено и тем теплее она станет. Климат, к которому мы привыкли, обеспечивается концентрацией углекислого газа в атмосфере на уровне 0, 03%. Если мы увеличиваем концентрацию углекислого газа, то происходит потепление климата.
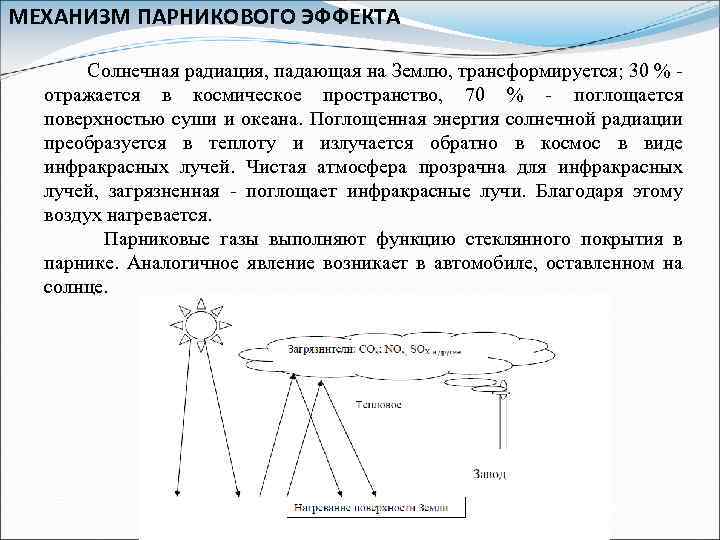 МЕХАНИЗМ ПАРНИКОВОГО ЭФФЕКТА Солнечная радиация, падающая на Землю, трансформируется; 30 % - отражается в космическое пространство, 70 % - поглощается поверхностью суши и океана. Поглощенная энергия солнечной радиации преобразуется в теплоту и излучается обратно в космос в виде инфракрасных лучей. Чистая атмосфера прозрачна для инфракрасных лучей, загрязненная - поглощает инфракрасные лучи. Благодаря этому воздух нагревается. Парниковые газы выполняют функцию стеклянного покрытия в парнике. Аналогичное явление возникает в автомобиле, оставленном на солнце.
МЕХАНИЗМ ПАРНИКОВОГО ЭФФЕКТА Солнечная радиация, падающая на Землю, трансформируется; 30 % - отражается в космическое пространство, 70 % - поглощается поверхностью суши и океана. Поглощенная энергия солнечной радиации преобразуется в теплоту и излучается обратно в космос в виде инфракрасных лучей. Чистая атмосфера прозрачна для инфракрасных лучей, загрязненная - поглощает инфракрасные лучи. Благодаря этому воздух нагревается. Парниковые газы выполняют функцию стеклянного покрытия в парнике. Аналогичное явление возникает в автомобиле, оставленном на солнце.
 Еще несколько лет назад учёные предупреждали человечество об усилении парникового эффекта и угрозе глобального потепления. В то время к их мнению не прислушались, но вскоре ситуация изменилась. Последствия глобального потепления климата становятся всё более заметными. Климат меняется на глазах. Невиданная жара в Европе и Северной Америке вызывает не только массовые инфаркты, но и катастрофические наводнения. Жестокие засухи, чудовищные цунами, ураганные ветры, невиданные доселе бури – теперь все мы стали невольными свидетелями этих явлений. Наводнения Засухи Ураганы Тайфуны
Еще несколько лет назад учёные предупреждали человечество об усилении парникового эффекта и угрозе глобального потепления. В то время к их мнению не прислушались, но вскоре ситуация изменилась. Последствия глобального потепления климата становятся всё более заметными. Климат меняется на глазах. Невиданная жара в Европе и Северной Америке вызывает не только массовые инфаркты, но и катастрофические наводнения. Жестокие засухи, чудовищные цунами, ураганные ветры, невиданные доселе бури – теперь все мы стали невольными свидетелями этих явлений. Наводнения Засухи Ураганы Тайфуны
 Очевидная причина возникновения парникового эффекта – использование традиционных энергоносителей в промышленности и автомобилистами. К менее очевидным причинам можно отнести вырубку лесов, переработку отходов, и добычу угля. Значительно способствуют увеличению парникового эффекта хлорфторуглеводороды, углекислый газ (СО 2), метан (СН 4) , оксиды серы и азота. Однако наибольшую роль в этом процессе играет всё же углекислый газ, поскольку у него относительно длинный жизненный цикл в атмосфере и во всех странах его объёмы непрестанно возрастают. Его антропогенными источниками могут быть: сжигание ископаемого топлива (каменного угля, нефти, природного газа), лесные пожары, инициированные человеком, а также изменение характера землепользования (например распашка целинных земель). Метан выделяется в процессе добычи, переработки и транспортировки нефти и природного газа, образуется при хранении и переработке мусора, горении органических веществ, при выращивании риса, в результате ферментации пищи в организмах жвачных животных и др. Антропогенными источниками закиси азота являются процесс денитрификации, происходящий на землях сельскохозяйственного пользования в результате внесения азотсодержащих удобрений; пастбищное скотоводство; промышленность; транспорт.
Очевидная причина возникновения парникового эффекта – использование традиционных энергоносителей в промышленности и автомобилистами. К менее очевидным причинам можно отнести вырубку лесов, переработку отходов, и добычу угля. Значительно способствуют увеличению парникового эффекта хлорфторуглеводороды, углекислый газ (СО 2), метан (СН 4) , оксиды серы и азота. Однако наибольшую роль в этом процессе играет всё же углекислый газ, поскольку у него относительно длинный жизненный цикл в атмосфере и во всех странах его объёмы непрестанно возрастают. Его антропогенными источниками могут быть: сжигание ископаемого топлива (каменного угля, нефти, природного газа), лесные пожары, инициированные человеком, а также изменение характера землепользования (например распашка целинных земель). Метан выделяется в процессе добычи, переработки и транспортировки нефти и природного газа, образуется при хранении и переработке мусора, горении органических веществ, при выращивании риса, в результате ферментации пищи в организмах жвачных животных и др. Антропогенными источниками закиси азота являются процесс денитрификации, происходящий на землях сельскохозяйственного пользования в результате внесения азотсодержащих удобрений; пастбищное скотоводство; промышленность; транспорт.
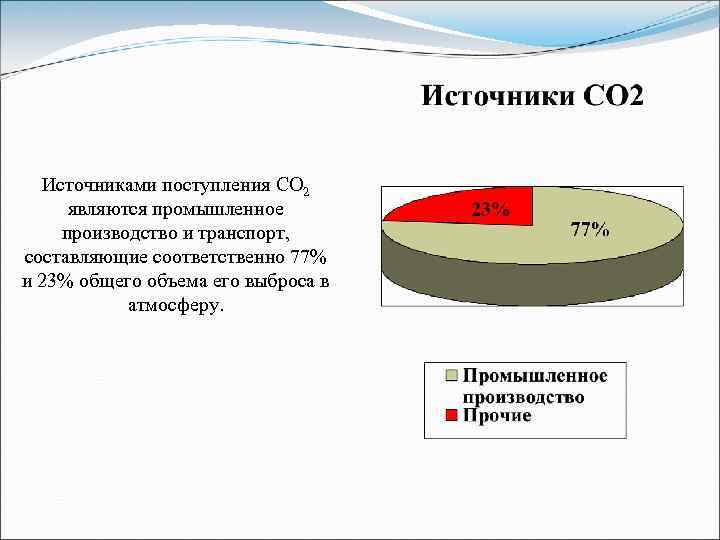 Источниками поступления СО 2 являются промышленное производство и транспорт, составляющие соответственно 77% и 23% общего объема его выброса в атмосферу.
Источниками поступления СО 2 являются промышленное производство и транспорт, составляющие соответственно 77% и 23% общего объема его выброса в атмосферу.
 Вопрос 3 Хлор органические соединения Хлорорганические соединения — продукты замещения в различных органических соединениях атомов водорода хлором. К хлорорганическим соединениям относят полихлорированные диоксины, дибензофураны, полихлорированные дифенилы, а также хлорорганические пестициды. Хлорорганические соединения плохо растворяются в воде, но обладают повышенной биологической активностью и оказывают негативное воздействие на живые организмы даже на уровне микропримесей. В водоемах они поглощаются частицами органических веществ и накапливаются в осадках. При хлорировании воды загрязненной органическими веществами происходит образование хлорорганических соединений, являющимися канцерогенами. Токсичность хлора определяется видом соединений и их концентрацией. ПДК хлора в атмосферном воздухе составляет 0, 03 мг/м 3.
Вопрос 3 Хлор органические соединения Хлорорганические соединения — продукты замещения в различных органических соединениях атомов водорода хлором. К хлорорганическим соединениям относят полихлорированные диоксины, дибензофураны, полихлорированные дифенилы, а также хлорорганические пестициды. Хлорорганические соединения плохо растворяются в воде, но обладают повышенной биологической активностью и оказывают негативное воздействие на живые организмы даже на уровне микропримесей. В водоемах они поглощаются частицами органических веществ и накапливаются в осадках. При хлорировании воды загрязненной органическими веществами происходит образование хлорорганических соединений, являющимися канцерогенами. Токсичность хлора определяется видом соединений и их концентрацией. ПДК хлора в атмосферном воздухе составляет 0, 03 мг/м 3.
 Диоксины Эти вещества обычно поступают в атмосферу: — при производстве органических веществ на основе ароматических соединений и хлора; — в составе выбросов предприятий целлюлозно-бумажной промышленности, предприятий металлургической промышленности и дымовых газов мусоросжигательных заводов. В России был утвержден норматив содержания диоксинов в атмосферном воздухе, равный 0, 5 пг/м 3 (1 г содержит 1012 пг). Такое низкое значение ПДК обусловлено тем, что диоксины характеризуются чрезвычайно высокой токсичностью. Высокая опасность диоксинов заключается в том, что даже ничтожные концентрации этих веществ вызывают подавление иммунной системы у человека и ослабляют способность организма адаптироваться к условиям окружающей природной среды. Кроме того, диоксины поражают печень и пищевой тракт человеческого организма.
Диоксины Эти вещества обычно поступают в атмосферу: — при производстве органических веществ на основе ароматических соединений и хлора; — в составе выбросов предприятий целлюлозно-бумажной промышленности, предприятий металлургической промышленности и дымовых газов мусоросжигательных заводов. В России был утвержден норматив содержания диоксинов в атмосферном воздухе, равный 0, 5 пг/м 3 (1 г содержит 1012 пг). Такое низкое значение ПДК обусловлено тем, что диоксины характеризуются чрезвычайно высокой токсичностью. Высокая опасность диоксинов заключается в том, что даже ничтожные концентрации этих веществ вызывают подавление иммунной системы у человека и ослабляют способность организма адаптироваться к условиям окружающей природной среды. Кроме того, диоксины поражают печень и пищевой тракт человеческого организма.
 Хлорорганические пестициды (ХОП) Применение в сельском хозяйстве, хранение. Особенно большие количества ХОП поступают в атмосферу при использовании сельскохозяйственной авиации. Атмосфера. ХОП переносятся с воздухом на большие расстояния. Фоновые концентрации гексахлорана и ПДК в воздухе над океаном - соответственно 0, 4 -0, 6 и 0, 03 -1, 0 нг/м 3. Максимальные концентрации ХОП отмечаются в атмосфере в теплый период с пиковыми значениями весной и осенью. В отличие от концентраций диоксинов, наблюдаемые в поверхностных водах концентрации ХОП сохраняются в среднем на уровне 1 -50 нг/см 3, что связано с их более высокой растворимостью в воде. ХОП хорошо адсорбируются органическим веществом почвы или донным илом и за счет этого способны перемещаться с поверхностными водами. Загрязнение водных объектов ХОП обусловлено главным образом поверхностным стоком с загрязненных полей, а также осаждением из атмосферы. Попадая в водоемы, ХОП сравнительно быстро перераспределяются между водой и донными отложениями. Помимо общей токсичности, повышают риск развития рака. Некоторые ХОП способны нарушать структуру генетического аппарата. Повреждают репродуктивную функцию.
Хлорорганические пестициды (ХОП) Применение в сельском хозяйстве, хранение. Особенно большие количества ХОП поступают в атмосферу при использовании сельскохозяйственной авиации. Атмосфера. ХОП переносятся с воздухом на большие расстояния. Фоновые концентрации гексахлорана и ПДК в воздухе над океаном - соответственно 0, 4 -0, 6 и 0, 03 -1, 0 нг/м 3. Максимальные концентрации ХОП отмечаются в атмосфере в теплый период с пиковыми значениями весной и осенью. В отличие от концентраций диоксинов, наблюдаемые в поверхностных водах концентрации ХОП сохраняются в среднем на уровне 1 -50 нг/см 3, что связано с их более высокой растворимостью в воде. ХОП хорошо адсорбируются органическим веществом почвы или донным илом и за счет этого способны перемещаться с поверхностными водами. Загрязнение водных объектов ХОП обусловлено главным образом поверхностным стоком с загрязненных полей, а также осаждением из атмосферы. Попадая в водоемы, ХОП сравнительно быстро перераспределяются между водой и донными отложениями. Помимо общей токсичности, повышают риск развития рака. Некоторые ХОП способны нарушать структуру генетического аппарата. Повреждают репродуктивную функцию.
 Вопрос 4 Аммиак По объему выбросов аммиак занимает первое место среди специфических загрязнителей атмосферного воздуха. Он попадает в воздух в составе выбросов производства аммиака, азотной кислоты, азотных удобрений, металлургических предприятий, различных химических Выброс аммиака в атмосферу производств. Аммиак – это бесцветный газ с очень резким запахом. Длительное вдыхание аммиака может вызвать смерть. Термин «аммиак» берет свое начало от соединения под названием «хлорид аммония» , открытого около храма Юпитера Аммона в Египте. Первым, кто получил чистый аммиак, был английский химик Джозеф Пристли. Это произошло в 1774 году, тогда его назвали «щелочным газом» . Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Незначительные количества аммиака присутствуют в воздухе при разложении животных и растительности. В незначительных количествах он может входить в состав дождевой воды. Но для промышленного использования аммиак получают искусственным путем. В состав аммиака входят азот и водород. При их соединении получается аммиак. Азот получают из воздуха, водород – из воды. Оба компонента высушивают, нагревают, сжимают, при температуре 530° С смесь пропускают через соединение различных солей, в результате получается аммиак.
Вопрос 4 Аммиак По объему выбросов аммиак занимает первое место среди специфических загрязнителей атмосферного воздуха. Он попадает в воздух в составе выбросов производства аммиака, азотной кислоты, азотных удобрений, металлургических предприятий, различных химических Выброс аммиака в атмосферу производств. Аммиак – это бесцветный газ с очень резким запахом. Длительное вдыхание аммиака может вызвать смерть. Термин «аммиак» берет свое начало от соединения под названием «хлорид аммония» , открытого около храма Юпитера Аммона в Египте. Первым, кто получил чистый аммиак, был английский химик Джозеф Пристли. Это произошло в 1774 году, тогда его назвали «щелочным газом» . Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Незначительные количества аммиака присутствуют в воздухе при разложении животных и растительности. В незначительных количествах он может входить в состав дождевой воды. Но для промышленного использования аммиак получают искусственным путем. В состав аммиака входят азот и водород. При их соединении получается аммиак. Азот получают из воздуха, водород – из воды. Оба компонента высушивают, нагревают, сжимают, при температуре 530° С смесь пропускают через соединение различных солей, в результате получается аммиак.
 Аммиак почти наполовину легче воздуха. После сжатия и охлаждения он превращается в жидкость, напоминающую воду, но кипящую при температуре минус 34° С. По окончании сжатия аммиак испаряется. При этом он поглощает много тепла. Вот почему его используют в холодильниках. Поступивший в атмосферу аммиак образует ион аммония, который в свою очередь взаимодействует с кислотами и способствует уменьшению кислотности дождевых капель. Реакции аммиака в атмосфере представлены ниже: NH 3 + H 2 S 04 = NH 4 HSO 4 (аммиак + серная кислота = гидросульфат аммония); NH 3 + NH 4 HS 04 = (NH 4)2 S 04 (аммиак + гидросульфат аммония = сульфат аммония); NH 3 + HN 03 = NH 4 N 03 (аммиак + азотная кислота = нитрат аммония)
Аммиак почти наполовину легче воздуха. После сжатия и охлаждения он превращается в жидкость, напоминающую воду, но кипящую при температуре минус 34° С. По окончании сжатия аммиак испаряется. При этом он поглощает много тепла. Вот почему его используют в холодильниках. Поступивший в атмосферу аммиак образует ион аммония, который в свою очередь взаимодействует с кислотами и способствует уменьшению кислотности дождевых капель. Реакции аммиака в атмосфере представлены ниже: NH 3 + H 2 S 04 = NH 4 HSO 4 (аммиак + серная кислота = гидросульфат аммония); NH 3 + NH 4 HS 04 = (NH 4)2 S 04 (аммиак + гидросульфат аммония = сульфат аммония); NH 3 + HN 03 = NH 4 N 03 (аммиак + азотная кислота = нитрат аммония)
 Аммиак применяется в химической промышленности, где он выступает в качестве реагента в органическом и неорганическом синтезе. В окружающую среду аммиак попасть может в результате недостаточной очистки сточных вод и отходящих газов химических производств. В природе аммиак образуется при разложении азотсодержащих органических соединений. Антропогенные источники поступления в окружающую среду. Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы. В районах техногенного загрязнения концентрации аммиака достигают величин 0, 015 -0, 057 мг/м 3, в контрольных районах – 0, 003 -0, 005 мг/м 3. Предельно допустимой концентрацией NH 3 в воздухе производственных помещений считается 0, 02 мг/л. Смеси аммиака с воздухом, содержащие от 16 до 28 объёмн. % аммиака взрывоопасны. При высоких концентрациях в воздухе аммиак раздражает слизистые оболочки. Острое отравление аммиаком вызывает поражение глаз, дыхательных путей, одышку и воспаление легких.
Аммиак применяется в химической промышленности, где он выступает в качестве реагента в органическом и неорганическом синтезе. В окружающую среду аммиак попасть может в результате недостаточной очистки сточных вод и отходящих газов химических производств. В природе аммиак образуется при разложении азотсодержащих органических соединений. Антропогенные источники поступления в окружающую среду. Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы. В районах техногенного загрязнения концентрации аммиака достигают величин 0, 015 -0, 057 мг/м 3, в контрольных районах – 0, 003 -0, 005 мг/м 3. Предельно допустимой концентрацией NH 3 в воздухе производственных помещений считается 0, 02 мг/л. Смеси аммиака с воздухом, содержащие от 16 до 28 объёмн. % аммиака взрывоопасны. При высоких концентрациях в воздухе аммиак раздражает слизистые оболочки. Острое отравление аммиаком вызывает поражение глаз, дыхательных путей, одышку и воспаление легких.
 Вопрос 5 Пары ртути Ртуть благодаря своим удивительным свойствам, занимает особое место среди других металлов и широко используется в науке и технике. Ртуть остаётся в жидком состоянии в интервале температур от 357, 25 до -38. 87 и легко испаряется при комнатной температуре.
Вопрос 5 Пары ртути Ртуть благодаря своим удивительным свойствам, занимает особое место среди других металлов и широко используется в науке и технике. Ртуть остаётся в жидком состоянии в интервале температур от 357, 25 до -38. 87 и легко испаряется при комнатной температуре.
 В атмосферу Земли непрерывно поступают пары ртути из литосферы и частично из гидросферы. Источниками поступления паров ртути в атмосферу являются многие производства, перерабатывающие ртутное сырьё, а также изготовляющие ртутные приборы и препараты. Небольшие количества ртути, содержащиеся в каменном угле, нефти и газе, попадают в атмосферу при сгорании этих продуктов. В результате в 1 м 3 воздуха постоянно находится 2*108 г паров ртути. Эти сравнительно небольшие количества ртути далеки от насыщения ими воздуха. Однако в результате испарения ртути в течение миллиардов лет, атмосфера Земли должна была бы содержать такие количества ртути, которые сделали бы невозможным существование жизни на Земле в ее современных формах. Это не происходит потому, что наряду с испарением ртути в атмосферу она постоянно удаляется из нее. Действительно, растворяясь в дождевой воде и адсорбируясь снегом, ртуть вместе с атмосферными осадками возвращается на Землю. Как показывают наблюдения, в течение года на Землю выпадает в среднем около 500000 км 3 атмосферных осадков вместе с которыми переносится на сушу и в гидросферу около 100000 т ртути, что примерно в 20 раз превышает мировую добычу ртути в течение года.
В атмосферу Земли непрерывно поступают пары ртути из литосферы и частично из гидросферы. Источниками поступления паров ртути в атмосферу являются многие производства, перерабатывающие ртутное сырьё, а также изготовляющие ртутные приборы и препараты. Небольшие количества ртути, содержащиеся в каменном угле, нефти и газе, попадают в атмосферу при сгорании этих продуктов. В результате в 1 м 3 воздуха постоянно находится 2*108 г паров ртути. Эти сравнительно небольшие количества ртути далеки от насыщения ими воздуха. Однако в результате испарения ртути в течение миллиардов лет, атмосфера Земли должна была бы содержать такие количества ртути, которые сделали бы невозможным существование жизни на Земле в ее современных формах. Это не происходит потому, что наряду с испарением ртути в атмосферу она постоянно удаляется из нее. Действительно, растворяясь в дождевой воде и адсорбируясь снегом, ртуть вместе с атмосферными осадками возвращается на Землю. Как показывают наблюдения, в течение года на Землю выпадает в среднем около 500000 км 3 атмосферных осадков вместе с которыми переносится на сушу и в гидросферу около 100000 т ртути, что примерно в 20 раз превышает мировую добычу ртути в течение года.
 Удаление ртути из атмосферы происходит также в результате абсорбции ее водами гидросферы, а также в результате образования в атмосфере хлоридов и сульфидов ртути, адсорбции паров ртути почвами, гидратами окислов железа, марганца, алюминия и пр. Таким образом, происходит круговорот ртути в природе. В атмосфере постоянно содержится от 200 до 250 т ртути. Среднее содержание ртути в атмосфере 0, 5 — 2, 0 нг/м 3 (ПДК = 0, 0003 мг/м 3). Соотношение вкладов природных и антропогенных источников в суммарное загрязнение атмосферного воздуха зависит от конкретного региона. Основными антропогенными источниками ртути, загрязняющими атмосферу, почву и водные экосистемы, являются: собственно производство ртути, черная и цветная металлургия, целлюлозно-бумажная промышленность, сжигание угля, коксохимическое производство, сжигание отходов, химикотехнологические процессы, в которых ртуть и ее соединения используются в качестве реагентов, катализаторов и электродов для получения широко применяемых в народном хозяйстве продуктов и добычи драгоценных металлов, а также различные ртутьсодержащие приборы (вакуумметры, барометры, термометры и т. п. ) и изделия электроники и электротехники (ртутные батареи и микробатарейки, люминесцентные лампы и др. ). Одни только люминесцентные лампы, используемые на территории России, содержат -500 т металлической ртути. Токсическое действие металлической ртути отличается от действия ртутных паров, являющихся основным источником ртутных отравлений, и от влияния на организм ртутных соединений.
Удаление ртути из атмосферы происходит также в результате абсорбции ее водами гидросферы, а также в результате образования в атмосфере хлоридов и сульфидов ртути, адсорбции паров ртути почвами, гидратами окислов железа, марганца, алюминия и пр. Таким образом, происходит круговорот ртути в природе. В атмосфере постоянно содержится от 200 до 250 т ртути. Среднее содержание ртути в атмосфере 0, 5 — 2, 0 нг/м 3 (ПДК = 0, 0003 мг/м 3). Соотношение вкладов природных и антропогенных источников в суммарное загрязнение атмосферного воздуха зависит от конкретного региона. Основными антропогенными источниками ртути, загрязняющими атмосферу, почву и водные экосистемы, являются: собственно производство ртути, черная и цветная металлургия, целлюлозно-бумажная промышленность, сжигание угля, коксохимическое производство, сжигание отходов, химикотехнологические процессы, в которых ртуть и ее соединения используются в качестве реагентов, катализаторов и электродов для получения широко применяемых в народном хозяйстве продуктов и добычи драгоценных металлов, а также различные ртутьсодержащие приборы (вакуумметры, барометры, термометры и т. п. ) и изделия электроники и электротехники (ртутные батареи и микробатарейки, люминесцентные лампы и др. ). Одни только люминесцентные лампы, используемые на территории России, содержат -500 т металлической ртути. Токсическое действие металлической ртути отличается от действия ртутных паров, являющихся основным источником ртутных отравлений, и от влияния на организм ртутных соединений.
 Критерием оценки влияния выбросов предприятий на окружающую среду является сравнение практических концентраций примесей в атмосфере с предельно допустимыми (ПДК). Фактическая концентрация вредных веществ в воздухе не должна превышать ПДК. Для предотвращения загрязнения атмосферы введены нормативы на выбросы вредных веществ непосредственно из каждого источника (труба, шахта и т. д. ). Стандартом установлены величины предельно допустимых выбросов (ПДВ) вредных веществ в атмосферу. ПДВ - количество вредных веществ, выбрасываемых в единицу времени (г/с), которое в сумме с выбросами из других источников загрязнения не создает приземной концентрации примеси, превышающей значение ПДК. ПДВ - это научно-технический норматив для конкретного источника загрязнения. Если в воздухе населенных мест концентрация вредных веществ меньше либо равна ПДК, а величина ПДВ по объективным причинам не может быть достигнута, то в этом случае фактический выброс, превышающий ПДВ, называется временно согласованным выбросом (ВСВ).
Критерием оценки влияния выбросов предприятий на окружающую среду является сравнение практических концентраций примесей в атмосфере с предельно допустимыми (ПДК). Фактическая концентрация вредных веществ в воздухе не должна превышать ПДК. Для предотвращения загрязнения атмосферы введены нормативы на выбросы вредных веществ непосредственно из каждого источника (труба, шахта и т. д. ). Стандартом установлены величины предельно допустимых выбросов (ПДВ) вредных веществ в атмосферу. ПДВ - количество вредных веществ, выбрасываемых в единицу времени (г/с), которое в сумме с выбросами из других источников загрязнения не создает приземной концентрации примеси, превышающей значение ПДК. ПДВ - это научно-технический норматив для конкретного источника загрязнения. Если в воздухе населенных мест концентрация вредных веществ меньше либо равна ПДК, а величина ПДВ по объективным причинам не может быть достигнута, то в этом случае фактический выброс, превышающий ПДВ, называется временно согласованным выбросом (ВСВ).
 При осуществлении контроля за состоянием воздуха как территории населенных пунктов, так и в рабочей зоне производственных помещений используют качественный и количественный анализы газовых смесей. С помощью качественного анализа определяют присутствие в воздухе или газовых потоках отдельных компонентов, не устанавливая их содержания. При количественном анализе определяют состав газовой смеси (в процентах) или содержание в ней определенного компонента (компонентов). На практике обычно не требуется полного анализа газовой смеси, и определяются лишь некоторые, наиболее важные ее составляющие. Качественный анализ газовых смесей производится с помощью органолептического и индикационного методов, а также с использованием жидких и пористых поглотителей. Для анализа газов используют широкий ассортимент растворов, называемых газоанализаторами. Выбор метода газового анализа и соответственно газоанализатора определенного типа диктуется особенностями анализируемого компонента, которые отличают его от других компонентов смеси. В практике заводских лабораторий и научно -исследовательских организаций используют газоанализаторы -механические, -тепловые, - магнитные, -оптические, -хроматографические и некоторые другие.
При осуществлении контроля за состоянием воздуха как территории населенных пунктов, так и в рабочей зоне производственных помещений используют качественный и количественный анализы газовых смесей. С помощью качественного анализа определяют присутствие в воздухе или газовых потоках отдельных компонентов, не устанавливая их содержания. При количественном анализе определяют состав газовой смеси (в процентах) или содержание в ней определенного компонента (компонентов). На практике обычно не требуется полного анализа газовой смеси, и определяются лишь некоторые, наиболее важные ее составляющие. Качественный анализ газовых смесей производится с помощью органолептического и индикационного методов, а также с использованием жидких и пористых поглотителей. Для анализа газов используют широкий ассортимент растворов, называемых газоанализаторами. Выбор метода газового анализа и соответственно газоанализатора определенного типа диктуется особенностями анализируемого компонента, которые отличают его от других компонентов смеси. В практике заводских лабораторий и научно -исследовательских организаций используют газоанализаторы -механические, -тепловые, - магнитные, -оптические, -хроматографические и некоторые другие.


