Lektsia_8_2.pptx
- Количество слайдов: 51
 Лекция 8. 2
Лекция 8. 2
 Химические методы получения наноматериалов
Химические методы получения наноматериалов
 Методы восстановления: получение наноматериала, чаще всего металла, путем восстановления его из исходных кислородсодержащих соеди нений. Процесс восстановления может быть также конечным этапом получения нанопорошков металлов другим методом.
Методы восстановления: получение наноматериала, чаще всего металла, путем восстановления его из исходных кислородсодержащих соеди нений. Процесс восстановления может быть также конечным этапом получения нанопорошков металлов другим методом.
 Восстановле ниеоксидов и других твердых соединений металлов Один из наиболее распространенных и экономичных способов получения наноматериалов Восстановители: • газы — водород, моно оксид углерода, конвертированный природный газ; • твердые восстановители — углерод (кокс, сажа), металлы (натрий, калий), гидриды металлов. Исходное сырье: оксиды, гидроксиды, другие химические соединения металлов, руды и концентраты после соответствующей подготовки (обогащение, удаление примесей и т. п. ), отходы и побочные продукты металлургического производства. Размер и форма синтезируемого порошка зависят от состава и свойств как ис ходного материала, так и восстановителя, а также темпера туры и времени восстановления.
Восстановле ниеоксидов и других твердых соединений металлов Один из наиболее распространенных и экономичных способов получения наноматериалов Восстановители: • газы — водород, моно оксид углерода, конвертированный природный газ; • твердые восстановители — углерод (кокс, сажа), металлы (натрий, калий), гидриды металлов. Исходное сырье: оксиды, гидроксиды, другие химические соединения металлов, руды и концентраты после соответствующей подготовки (обогащение, удаление примесей и т. п. ), отходы и побочные продукты металлургического производства. Размер и форма синтезируемого порошка зависят от состава и свойств как ис ходного материала, так и восстановителя, а также темпера туры и времени восстановления.
 Взаимодействие с газами (Н 2, СО) и углеродом Получают металлы: Fe, W, Ni, Re, Mo, Си, Со. Данным процессам восстановления соответствуют реакции: • Ме. О + Н 2 —> Me + Н 20, • Ме. О + СО —> Me + С 02, • Ме. О + С —> Me + СО
Взаимодействие с газами (Н 2, СО) и углеродом Получают металлы: Fe, W, Ni, Re, Mo, Си, Со. Данным процессам восстановления соответствуют реакции: • Ме. О + Н 2 —> Me + Н 20, • Ме. О + СО —> Me + С 02, • Ме. О + С —> Me + СО
 Взаимодействие с гидридами Используется для получения нанопорошков Zr, Та, Hf, Cr, Nb. Химическая реакция: Ме. О + Са. Н 2 = Me + Са. О + Н 2, где Ме. О — оксид металла Для получения наноматериала высокой чистоты необхо димо применение реагентов, содержащих мало примесей, по скольку чистота конечного продукта в значительной степени зависит от чистоты исходного сырья и восстановителя
Взаимодействие с гидридами Используется для получения нанопорошков Zr, Та, Hf, Cr, Nb. Химическая реакция: Ме. О + Са. Н 2 = Me + Са. О + Н 2, где Ме. О — оксид металла Для получения наноматериала высокой чистоты необхо димо применение реагентов, содержащих мало примесей, по скольку чистота конечного продукта в значительной степени зависит от чистоты исходного сырья и восстановителя
 Способ металлотермии Получают Pt, Ag, Си, Zn, Со, Ni, Fe, Mo, Cr. Процесс восстановления проводится в прису тствии нафталина в безводных средах : Ме'а (A)b + Me" = Me'c'(A)d + Me' Средний диаметр частиц, получаемых данным способом: • Au, Ag, Pt 10 нм, • другие металлы — около 30 нм. • Распределение частиц по размерам узкое. Получае мые порошки пирофорны, поэтому для их защиты необходи мо предпринимать специальные меры.
Способ металлотермии Получают Pt, Ag, Си, Zn, Со, Ni, Fe, Mo, Cr. Процесс восстановления проводится в прису тствии нафталина в безводных средах : Ме'а (A)b + Me" = Me'c'(A)d + Me' Средний диаметр частиц, получаемых данным способом: • Au, Ag, Pt 10 нм, • другие металлы — около 30 нм. • Распределение частиц по размерам узкое. Получае мые порошки пирофорны, поэтому для их защиты необходи мо предпринимать специальные меры.
 Химическое восстановление металлов из растворов Восстановление ионов металла из водных растворов их солей: восстановители Н 2, СО, гидразин, гипофосфит, формальдегид и др. Н 2 , СО процесс проводится при повышенных температурах (около 200 °С) и высоких давлениях (более 5 МПа) в автоклавах. Исходным сырьем в этом случае являются растворы сернокислых или аммиач ных солей соответствующих металлов. Данным способом по лучены порошки Си, i, Со, Ag и композиции N на их основе.
Химическое восстановление металлов из растворов Восстановление ионов металла из водных растворов их солей: восстановители Н 2, СО, гидразин, гипофосфит, формальдегид и др. Н 2 , СО процесс проводится при повышенных температурах (около 200 °С) и высоких давлениях (более 5 МПа) в автоклавах. Исходным сырьем в этом случае являются растворы сернокислых или аммиач ных солей соответствующих металлов. Данным способом по лучены порошки Си, i, Со, Ag и композиции N на их основе.
 Сильные восстано вители: гидразин, гипофосфит, формальдегид и др. Таким способом произведены нанопорошки Fe, Ni, Со, Си и компо зиции на их основе с частицами сферической формы разме ром менее 5 нм. Сложности при получении нанопорошков метал лов и плавов: с • высокая реакционная способность, • в неко торых лучаях пирофорность. с
Сильные восстано вители: гидразин, гипофосфит, формальдегид и др. Таким способом произведены нанопорошки Fe, Ni, Со, Си и компо зиции на их основе с частицами сферической формы разме ром менее 5 нм. Сложности при получении нанопорошков метал лов и плавов: с • высокая реакционная способность, • в неко торых лучаях пирофорность. с
 Получение наночастиц на носителях Один из возможных способов снизить реакционную способность Носители: активированные угли, ко торые пропитывают растворами солей металлов. В случае получения двухкомпонентной системы нанесение исходных ве ществ возможно двумя методами: • пропитка смесью раство ров • последовательная пропитка растворами разных солей. Этим методом после проведения восстановительного отжига при температуре около 1073 К получены сплавы Fe Ni и Fe Co. Если температуры восстановления более низкие, про исходит образование фаз чистых металлов. Размер частиц получаемых порошков составляет от 10 до 300 нм.
Получение наночастиц на носителях Один из возможных способов снизить реакционную способность Носители: активированные угли, ко торые пропитывают растворами солей металлов. В случае получения двухкомпонентной системы нанесение исходных ве ществ возможно двумя методами: • пропитка смесью раство ров • последовательная пропитка растворами разных солей. Этим методом после проведения восстановительного отжига при температуре около 1073 К получены сплавы Fe Ni и Fe Co. Если температуры восстановления более низкие, про исходит образование фаз чистых металлов. Размер частиц получаемых порошков составляет от 10 до 300 нм.
 Достоинства методов восстановления определяются возможностью: • получения порошков сплавов с содержанием компонен тов от 0 до 100% ; • получения как гомогенного продукта (твердый раствор и химическое соединение), так и гетерогенной системы; • использования дешевого сырья, экономичностью. Недостатки методов восстановления: • ограничение по активности металлов к разным восста новителям; • загрязнение наноматериалов восстановителем.
Достоинства методов восстановления определяются возможностью: • получения порошков сплавов с содержанием компонен тов от 0 до 100% ; • получения как гомогенного продукта (твердый раствор и химическое соединение), так и гетерогенной системы; • использования дешевого сырья, экономичностью. Недостатки методов восстановления: • ограничение по активности металлов к разным восста новителям; • загрязнение наноматериалов восстановителем.
 Метод газофазных химических реакций Основан на синте зе наноматериалов в ходе химического взаимодействия, про текающего в атмосфере паров легколетучих соединений. Все многообразие газофазных химических реакций можно, при менительно к получению наноматериалов, азделить на: р • ре акцииразложения, протекающие с участием одного исход ного химического соединения: А = В + С, • реакции между двумя и более химическими соединениями: А + В = С + D
Метод газофазных химических реакций Основан на синте зе наноматериалов в ходе химического взаимодействия, про текающего в атмосфере паров легколетучих соединений. Все многообразие газофазных химических реакций можно, при менительно к получению наноматериалов, азделить на: р • ре акцииразложения, протекающие с участием одного исход ного химического соединения: А = В + С, • реакции между двумя и более химическими соединениями: А + В = С + D
 Обязательным условием использования первого типа хи мических реакций является существование подходящего хи мического соединения, содержащего все элементы конечного продукта, что встречается нечасто, поэтому второй тип газо фазных реакций является более распространенным. Для проведения газофазной химической реакции исход ные вещества должны быть легколетучими. В качестве ис ходных соединенийиспользуются: • галогениды, особенно хло риды, металлов; • оксихлориды металлов МОn. С 1 m, • алкоокси ды (OR)n, M • алкильные соединения M(R)n, • пары металлов • и т. д.
Обязательным условием использования первого типа хи мических реакций является существование подходящего хи мического соединения, содержащего все элементы конечного продукта, что встречается нечасто, поэтому второй тип газо фазных реакций является более распространенным. Для проведения газофазной химической реакции исход ные вещества должны быть легколетучими. В качестве ис ходных соединенийиспользуются: • галогениды, особенно хло риды, металлов; • оксихлориды металлов МОn. С 1 m, • алкоокси ды (OR)n, M • алкильные соединения M(R)n, • пары металлов • и т. д.
 Свойства наноматериалов в зна чительной степени зависят от конструкционных особеннос тей установки: • типа реакционного сосуда, • метода нагрева, • температурного градиента в системе, • температуры реакцион ной газовой смеси, • метода ее введения в реакционный сосуд и т. д.
Свойства наноматериалов в зна чительной степени зависят от конструкционных особеннос тей установки: • типа реакционного сосуда, • метода нагрева, • температурного градиента в системе, • температуры реакцион ной газовой смеси, • метода ее введения в реакционный сосуд и т. д.
 С помощью метода газофазных реакций получен ряд ве ществ , непосредственный синтез которых другими методами связан со значительными трудностями, а именно: • бор, газовая сажа, • металлы, сплавы, • нитриды, карбиды, • силициды, суль фиды. Конечный продукт, в зависимости от условий реакции (температуры, скорости подачи реагентов, условий конденса ции), может иметь вид: • пленки, мелких пластинок, • нитевид ных ристаллов, аморфного осадка к • или нанопорошков.
С помощью метода газофазных реакций получен ряд ве ществ , непосредственный синтез которых другими методами связан со значительными трудностями, а именно: • бор, газовая сажа, • металлы, сплавы, • нитриды, карбиды, • силициды, суль фиды. Конечный продукт, в зависимости от условий реакции (температуры, скорости подачи реагентов, условий конденса ции), может иметь вид: • пленки, мелких пластинок, • нитевид ных ристаллов, аморфного осадка к • или нанопорошков.
 Примеры • Для синтеза Ti. B 2 используется взаимодействие в газовой фазе паров Na в среде аргона с газовой смесью дос таточно летучих хлоридов Ti и В. Натрий связывает анионы хлора, а бор взаимодействует с Ti с образованием порошков диборида титана. • При взаимодействии Si. Cl 4 и Si. H 4 с углеродсодержащим газом образуется Si. C, а азотосодержащим — Si 3 N 4.
Примеры • Для синтеза Ti. B 2 используется взаимодействие в газовой фазе паров Na в среде аргона с газовой смесью дос таточно летучих хлоридов Ti и В. Натрий связывает анионы хлора, а бор взаимодействует с Ti с образованием порошков диборида титана. • При взаимодействии Si. Cl 4 и Si. H 4 с углеродсодержащим газом образуется Si. C, а азотосодержащим — Si 3 N 4.
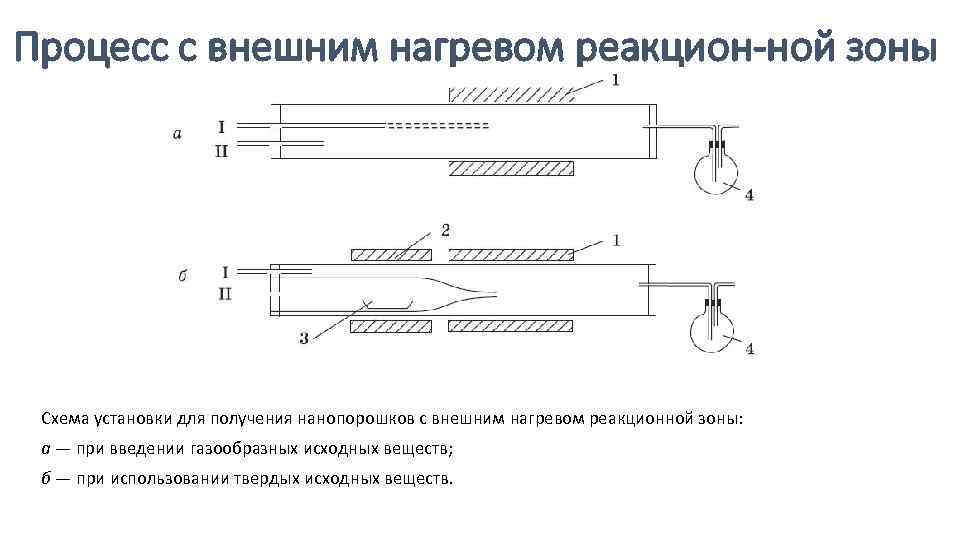 Процесс с внешним нагревом реакцион ной зоны Схема установки для получения нанопорошков с внешним нагревом реакционной зоны: а — при введении газообразных исходных веществ; б — при использовании твердых исходных веществ.
Процесс с внешним нагревом реакцион ной зоны Схема установки для получения нанопорошков с внешним нагревом реакционной зоны: а — при введении газообразных исходных веществ; б — при использовании твердых исходных веществ.
 Для введения реакционного газа служат трубки I и II. Печь 1 осуществляет нагрев реакционной зоны. Дополни тельная печь 2 служит для подогрева исходного вещества 3 в случае необходимости его испарения непосредственно в реак ционном сосуде (б). Газообразные продукты реак ции попадают в емкости 4, где происходит их охлаждение и конденсация. Реакционную трубку, как правило, изготавли вают из кварца, керамического материала или глинозема.
Для введения реакционного газа служат трубки I и II. Печь 1 осуществляет нагрев реакционной зоны. Дополни тельная печь 2 служит для подогрева исходного вещества 3 в случае необходимости его испарения непосредственно в реак ционном сосуде (б). Газообразные продукты реак ции попадают в емкости 4, где происходит их охлаждение и конденсация. Реакционную трубку, как правило, изготавли вают из кварца, керамического материала или глинозема.
 В газовой фазе можно по лучать нанодисперсный i. N с размером T частиц около 10 нм. • Сначала при пропускании газа NH 4 Cl над порошком металла при 400 °С образуется гидрид титана: Ti —> Тi. H 1. 924 • При азотировании гидрида титана в газовой смеси NH 4 C 1 + NH 3 происходит синтез нитрида титана Тi. H 1. 924 —> Ti. N NH 4 Cl играет роль поставщика водорода при получении гидрида титана, а на стадии синтеза нитрида Ti он активизи рует процессы переноса через газовую фазу и препятствует росту частиц.
В газовой фазе можно по лучать нанодисперсный i. N с размером T частиц около 10 нм. • Сначала при пропускании газа NH 4 Cl над порошком металла при 400 °С образуется гидрид титана: Ti —> Тi. H 1. 924 • При азотировании гидрида титана в газовой смеси NH 4 C 1 + NH 3 происходит синтез нитрида титана Тi. H 1. 924 —> Ti. N NH 4 Cl играет роль поставщика водорода при получении гидрида титана, а на стадии синтеза нитрида Ti он активизи рует процессы переноса через газовую фазу и препятствует росту частиц.
 В этом методе получения проблемой является отделение наночастиц от газовой фазы. Частицы имеют наноразмеры, их концентрация в газовом потоке мала, а температура газа достаточно высокая. Для улавливания наночастиц применя ются : • специальные фильтры, например: • керамические, • электрофильтры, • центробежное осаждение в агрега тах типа иклонов: ц циклоны с жидкой пленкой, специаль ные азовые центрифуги, г холодный вращающийся барабан
В этом методе получения проблемой является отделение наночастиц от газовой фазы. Частицы имеют наноразмеры, их концентрация в газовом потоке мала, а температура газа достаточно высокая. Для улавливания наночастиц применя ются : • специальные фильтры, например: • керамические, • электрофильтры, • центробежное осаждение в агрега тах типа иклонов: ц циклоны с жидкой пленкой, специаль ные азовые центрифуги, г холодный вращающийся барабан
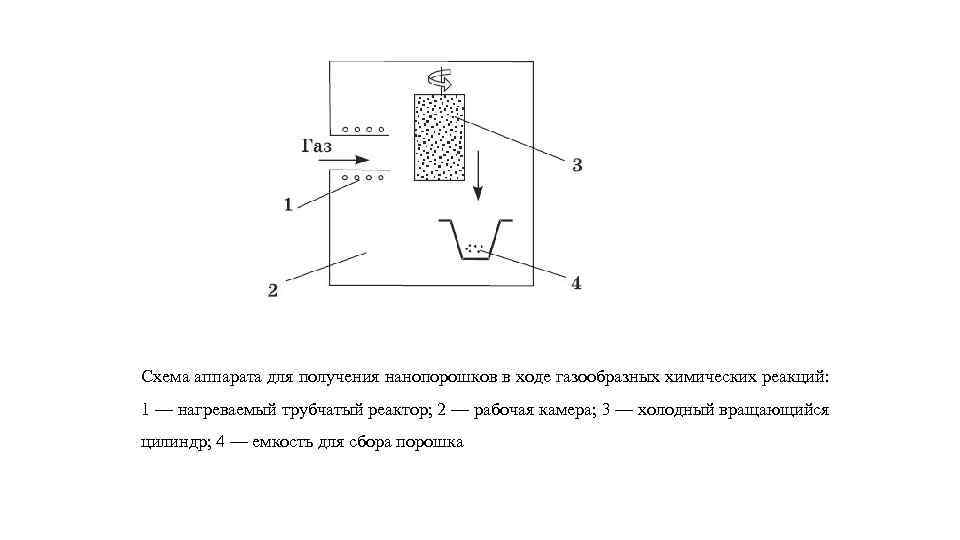 Схема аппарата для получения нанопорошков в ходе газообразных химических реакций: 1 — нагреваемый трубчатый реактор; 2 — рабочая камера; 3 — холодный вращающийся цилиндр; 4 — емкость для сбора порошка
Схема аппарата для получения нанопорошков в ходе газообразных химических реакций: 1 — нагреваемый трубчатый реактор; 2 — рабочая камера; 3 — холодный вращающийся цилиндр; 4 — емкость для сбора порошка
 Преимущества метода газофазных реакций являются: • возможность синтеза ряда уникальных соединений; • узкое распределение частиц по размерам; • высокая чистота продукта. Недостаток метода газофазных реакций можно отметить необходимость использования сложного специаль ного оборудования.
Преимущества метода газофазных реакций являются: • возможность синтеза ряда уникальных соединений; • узкое распределение частиц по размерам; • высокая чистота продукта. Недостаток метода газофазных реакций можно отметить необходимость использования сложного специаль ного оборудования.
 Процес сытермической диссоциации или пиролиза Ис ходные реагенты соли изкомолекулярных органических кислот: н формиаты, оксалаты, ацетаты метал лов, а также карбонаты и карбонилы металлов. Диссоциация проводится в температурном интервале 200 400 °С. Иници ировать азложение можно различными способами. Чаще всего р применяется тепловая энергия, но можно использовать и высокочастотное излучение, лазерное излучение, ионизи рующее излучение, поток плазмы, поток электронов, тепло, выделяющееся при трении, и др. Суммарную реакцию пиролиза формиатов можно предста вить в общем виде следующим образом: (НСОО)2 Ме > Ме. О + Н 2 + СО + С 02 + Н 20 + Me Реакция восстановления оксидов металлов газами СО и Н 2, выделяющимися при пиролизе, в этом случае рассматри вается как вторичная. Согласно данной схеме происходит разложение формиатов Си и Zn.
Процес сытермической диссоциации или пиролиза Ис ходные реагенты соли изкомолекулярных органических кислот: н формиаты, оксалаты, ацетаты метал лов, а также карбонаты и карбонилы металлов. Диссоциация проводится в температурном интервале 200 400 °С. Иници ировать азложение можно различными способами. Чаще всего р применяется тепловая энергия, но можно использовать и высокочастотное излучение, лазерное излучение, ионизи рующее излучение, поток плазмы, поток электронов, тепло, выделяющееся при трении, и др. Суммарную реакцию пиролиза формиатов можно предста вить в общем виде следующим образом: (НСОО)2 Ме > Ме. О + Н 2 + СО + С 02 + Н 20 + Me Реакция восстановления оксидов металлов газами СО и Н 2, выделяющимися при пиролизе, в этом случае рассматри вается как вторичная. Согласно данной схеме происходит разложение формиатов Си и Zn.
 В случае получения Mn, Fe, Со, Ni, Zn, Са на первом этапе происходит разложение формиата: (НСОО)2 Ме > Me + Н 2 + 2 С 02. Однако по мере накопления продуктов этой реакции мо гут развиваться вторичные процессы окисления: • при пиролизе формиатов Ni преобладает выход сво бодного металла, • при пиролизе формиатов Мп и Fe — оксидов металлов. Формиат кобальта занимает промежуточное положение: об разуется 50 60% Со. О и 40 50% Со.
В случае получения Mn, Fe, Со, Ni, Zn, Са на первом этапе происходит разложение формиата: (НСОО)2 Ме > Me + Н 2 + 2 С 02. Однако по мере накопления продуктов этой реакции мо гут развиваться вторичные процессы окисления: • при пиролизе формиатов Ni преобладает выход сво бодного металла, • при пиролизе формиатов Мп и Fe — оксидов металлов. Формиат кобальта занимает промежуточное положение: об разуется 50 60% Со. О и 40 50% Со.
 Температуры разложения свежеприготовленных формиатов повышаются в ряду Fe > Ni > Со > Сu. При этом скорости разложения меняются в обратном порядке. На свойства получаемого нанопорошка влияют: • время изотермической выдержки, • тол щина лоя формиата с • градиент температуры в реакционной зоне, • наличие защитной среды от окисления • и др.
Температуры разложения свежеприготовленных формиатов повышаются в ряду Fe > Ni > Со > Сu. При этом скорости разложения меняются в обратном порядке. На свойства получаемого нанопорошка влияют: • время изотермической выдержки, • тол щина лоя формиата с • градиент температуры в реакционной зоне, • наличие защитной среды от окисления • и др.
 При определенных температурных условиях термическо го распада формиатов возможно образование нанопорошка, каждая частица которого покрыта полимерной оболочкой. Например, при разложении двухводных формиатов железа и никеля образуются частицы, состоящие из Fe 304 и Ni. O с раз мерами 20 и 50 нм и полимерного покрытия толщиной 3 5 нм, соответственно.
При определенных температурных условиях термическо го распада формиатов возможно образование нанопорошка, каждая частица которого покрыта полимерной оболочкой. Например, при разложении двухводных формиатов железа и никеля образуются частицы, состоящие из Fe 304 и Ni. O с раз мерами 20 и 50 нм и полимерного покрытия толщиной 3 5 нм, соответственно.
 Схему разложения оксалатов Мп, Fe, Си можно предста вить в следующем виде: Ме. С 204 —> Ме. О + С 02, оксалаты Со, Ni, Си и Zn диссоциируют по уравнению: Ме. С 204 —> Ме. О + 2 С 02. Методом пиролиза оксалатов, формиатов и других солей получают порошки с размером частиц около 100 нм.
Схему разложения оксалатов Мп, Fe, Си можно предста вить в следующем виде: Ме. С 204 —> Ме. О + С 02, оксалаты Со, Ni, Си и Zn диссоциируют по уравнению: Ме. С 204 —> Ме. О + 2 С 02. Методом пиролиза оксалатов, формиатов и других солей получают порошки с размером частиц около 100 нм.
 Термической диссоциацией карбонилов, протекающей по реакции: • Мех(СО)у —> х Me + у СО при t возможно получение нанопорошков Ni, Mo, Fe, Cr, W. Так же арбонильным способом синтезируют полиметалличес кие к пленки с наноструктурой. Процесс заключается в терми ческой диссоциации смеси карбонилов металлов на нагретой подложке. Реакция проводится при температурах до 500 °С, размер кристаллитов в пленке порядка 20 нм.
Термической диссоциацией карбонилов, протекающей по реакции: • Мех(СО)у —> х Me + у СО при t возможно получение нанопорошков Ni, Mo, Fe, Cr, W. Так же арбонильным способом синтезируют полиметалличес кие к пленки с наноструктурой. Процесс заключается в терми ческой диссоциации смеси карбонилов металлов на нагретой подложке. Реакция проводится при температурах до 500 °С, размер кристаллитов в пленке порядка 20 нм.
 При получении порошков сложных соединений целесооб разно использовать в качестве исходных двойные соли, ком плексные соединения, органические вещества или твердые растворы, в которых соотношение компонентов наиболее близко к синтезируемому соединению. Примеры: Нанопорошки Al. N со средним размером 8 нм синтезировали путем разложения в аммиаке полиамида алюминия при 630 °С. Бориды переходных металлов получали разло жением боргидридов при 330 430 °С. Разложением полиме ров типа полиборазола и поливинилборазола получали ВС 4 и BN. Наноразмерные порошковые композиции WC Co изго тавливали разложением смеси вольфрамата триэтилендиаминкобальта и вольфрамовой кислоты или метавольфрамата аммония и хлористого кобальта. Порошки имели размер 20 40 нм.
При получении порошков сложных соединений целесооб разно использовать в качестве исходных двойные соли, ком плексные соединения, органические вещества или твердые растворы, в которых соотношение компонентов наиболее близко к синтезируемому соединению. Примеры: Нанопорошки Al. N со средним размером 8 нм синтезировали путем разложения в аммиаке полиамида алюминия при 630 °С. Бориды переходных металлов получали разло жением боргидридов при 330 430 °С. Разложением полиме ров типа полиборазола и поливинилборазола получали ВС 4 и BN. Наноразмерные порошковые композиции WC Co изго тавливали разложением смеси вольфрамата триэтилендиаминкобальта и вольфрамовой кислоты или метавольфрамата аммония и хлористого кобальта. Порошки имели размер 20 40 нм.
 Разложение соединений можно проводить в ударной тру бе. Закрытую с обеих сторон трубу перегораживают на нерав ные части тонкой диафрагмой, например, из алюминиевой фольги. Более длинную часть трубы заполняют под давлени ем 1000 2500 Па разлагаемым соединением. Другую часть трубы заполняют гелием или смесью гелия с азотом до тех пор, пока разделительная мембрана не прорвется. При раз рыве образуется ударная волна, во фронте которой темпера тура достигает 2000 К. Металлоорганические соединения разлагаются за несколько микросекунд (нанопорошки Pb, Fe)
Разложение соединений можно проводить в ударной тру бе. Закрытую с обеих сторон трубу перегораживают на нерав ные части тонкой диафрагмой, например, из алюминиевой фольги. Более длинную часть трубы заполняют под давлени ем 1000 2500 Па разлагаемым соединением. Другую часть трубы заполняют гелием или смесью гелия с азотом до тех пор, пока разделительная мембрана не прорвется. При раз рыве образуется ударная волна, во фронте которой темпера тура достигает 2000 К. Металлоорганические соединения разлагаются за несколько микросекунд (нанопорошки Pb, Fe)
 Преимущества: • высокая производительность; • экономичность. Недостатки: • содержание значительных количеств оксидов в метал лических порошках; • пирофорность получаемого продукта.
Преимущества: • высокая производительность; • экономичность. Недостатки: • содержание значительных количеств оксидов в метал лических порошках; • пирофорность получаемого продукта.
 Методы получения нанома териалов, основанные на окислении исходных веществ С целью получения нанодисперсной сажи — аморфного углерода — разработан метод низкотемпературного горения углеводородов. Процесс проводится в двухсекционном реак торе. В первой секции, температура которой 423 773 К, про исходит предварительный нагрев. Во второй секции при температурах 1073 1173 К осуществляется воспламенение и контролируемое горение, в результате которого образуется сажа, размер частиц которой порядка 100 нм.
Методы получения нанома териалов, основанные на окислении исходных веществ С целью получения нанодисперсной сажи — аморфного углерода — разработан метод низкотемпературного горения углеводородов. Процесс проводится в двухсекционном реак торе. В первой секции, температура которой 423 773 К, про исходит предварительный нагрев. Во второй секции при температурах 1073 1173 К осуществляется воспламенение и контролируемое горение, в результате которого образуется сажа, размер частиц которой порядка 100 нм.
 Осаждение из расплава металла Заключается в окислении металла или сплавов газами. Например, при пропускании воздуха после окончания процесса получают материал с час тицами оксидов и остатками металла. Метод позволяет полу чать композиционный материал, но аналогичным способом можно синтезировать и керамические материалы.
Осаждение из расплава металла Заключается в окислении металла или сплавов газами. Например, при пропускании воздуха после окончания процесса получают материал с час тицами оксидов и остатками металла. Метод позволяет полу чать композиционный материал, но аналогичным способом можно синтезировать и керамические материалы.
 Метод гидролиза солей металлов Для получения коллоидных частиц оксидов. Нанооксиды Ti, Zr, Al, Ir получены гидролизом соответствующих хлоридов, гипохлоридов, сульфатов. Во избежание коагуля ции наночастиц для стабилизации коллоидных растворов используются полифосфаты, амины, гидроксильные ионы. Весьма удобно применение гидролиза алкоксидов метал лов. Например, гидролиз алкоксида Si дает возможность по лучать оксид кремния, у которого мало растворимых солей, не содержащих катионов щелочных металлов. При этом алкоксиды хорошо растворимы в спиртах, их достаточно про сто получить при взаимодействии спиртов и металлов.
Метод гидролиза солей металлов Для получения коллоидных частиц оксидов. Нанооксиды Ti, Zr, Al, Ir получены гидролизом соответствующих хлоридов, гипохлоридов, сульфатов. Во избежание коагуля ции наночастиц для стабилизации коллоидных растворов используются полифосфаты, амины, гидроксильные ионы. Весьма удобно применение гидролиза алкоксидов метал лов. Например, гидролиз алкоксида Si дает возможность по лучать оксид кремния, у которого мало растворимых солей, не содержащих катионов щелочных металлов. При этом алкоксиды хорошо растворимы в спиртах, их достаточно про сто получить при взаимодействии спиртов и металлов.
 Получение наноматериалов электрохимическими методами Использование электрического тока позволяет осущест вить процессы, которые в обычных условиях не происходят или идут очень медленно. Принцип метода электроосаждения заключается в про пускании постоянного тока через водные растворы солей в процессе осаждения из них металлического порошка.
Получение наноматериалов электрохимическими методами Использование электрического тока позволяет осущест вить процессы, которые в обычных условиях не происходят или идут очень медленно. Принцип метода электроосаждения заключается в про пускании постоянного тока через водные растворы солей в процессе осаждения из них металлического порошка.
 • Катод и анод, имеющие форму плас тины, погружают в специально подобранный электролит. Для обеспечения чистоты конечного продукта в качестве анода лучше использовать тот же металл, что и осаждаемый. Однако по технологическим причинам это не всегда возмож но. • По этой причине, при производстве медного порошка применяют анод из алюминия, а при получении железного порошка — из молибдена или хромоникелевого сплава. Кро ме того, к материалу анода предъявляются требования по высокой кислотостойкости и небольшому сопротивлению. В свою очередь, дисперсность получаемого порошка зависит от качества и шероховатости катода. • В ходе процесса электролиза около анода и катода проте кает электролитическая реакция, и на катоде выделяется по рошок. Осадок с катода периодически удаляется, что необхо димо для получения порошка требуемой зернистости и рав номерного состава. • Т. к. состав электролита около электродов непрерывно меняется, в ходе процесса осуще ствляют принудительную циркуляцию электролита в ванне. • После отделения от катода порошок промывают, что осу ществляется или в устройстве типа мешалки, или методом центробежного удаления воды. Сушка после промывки для предотвращения окисления, как правило, проводится под вакуумом.
• Катод и анод, имеющие форму плас тины, погружают в специально подобранный электролит. Для обеспечения чистоты конечного продукта в качестве анода лучше использовать тот же металл, что и осаждаемый. Однако по технологическим причинам это не всегда возмож но. • По этой причине, при производстве медного порошка применяют анод из алюминия, а при получении железного порошка — из молибдена или хромоникелевого сплава. Кро ме того, к материалу анода предъявляются требования по высокой кислотостойкости и небольшому сопротивлению. В свою очередь, дисперсность получаемого порошка зависит от качества и шероховатости катода. • В ходе процесса электролиза около анода и катода проте кает электролитическая реакция, и на катоде выделяется по рошок. Осадок с катода периодически удаляется, что необхо димо для получения порошка требуемой зернистости и рав номерного состава. • Т. к. состав электролита около электродов непрерывно меняется, в ходе процесса осуще ствляют принудительную циркуляцию электролита в ванне. • После отделения от катода порошок промывают, что осу ществляется или в устройстве типа мешалки, или методом центробежного удаления воды. Сушка после промывки для предотвращения окисления, как правило, проводится под вакуумом.
 Данным методом можно получить около 30 металлов. Продукты этого метода имеют высокую чистоту. Металлы, осаждающиеся на катоде, в зависимости от условий про цесса могут получаться в виде порошка, губки или дендритов, которые легко измельчить небольшим механическим воздействием. Электролизные порошки хорошо прессуются, что важно при производстве изделий.
Данным методом можно получить около 30 металлов. Продукты этого метода имеют высокую чистоту. Металлы, осаждающиеся на катоде, в зависимости от условий про цесса могут получаться в виде порошка, губки или дендритов, которые легко измельчить небольшим механическим воздействием. Электролизные порошки хорошо прессуются, что важно при производстве изделий.
 Разновиднос тиметода электролитического осаждения Электрофлотационный способ получения дисперсных по рошков заключается в кристаллизации металлов в двухслой ной ванне при обязательном присутствии в органическом слое поверхностно активных веществ. Получаемые дисперсные по рошки имеют иглообразную или палочкообразную форму (Fe, Со) и используются при производстве постоянных магнитов и магнитных лаков.
Разновиднос тиметода электролитического осаждения Электрофлотационный способ получения дисперсных по рошков заключается в кристаллизации металлов в двухслой ной ванне при обязательном присутствии в органическом слое поверхностно активных веществ. Получаемые дисперсные по рошки имеют иглообразную или палочкообразную форму (Fe, Со) и используются при производстве постоянных магнитов и магнитных лаков.
 В способе электролиза расплава солей процесс ведется при сравнительно высоких температурах. В качестве электроли та используются соли металлов. Этим методом можно полу чить нанопорошки e, Ni, Cr, Ag, Th, Nb, F Ti, Zr, Be.
В способе электролиза расплава солей процесс ведется при сравнительно высоких температурах. В качестве электроли та используются соли металлов. Этим методом можно полу чить нанопорошки e, Ni, Cr, Ag, Th, Nb, F Ti, Zr, Be.
 Получение нанопорошков возможно также способом жидкометаллического катода. В этом случае в качестве ка тода используется жидкий металл, в котором осаждается металлический порошок. Как правило, для катода исполь зуется ртуть. Процесс проводится в растворе какой либо не органической кислоты. Этим методом можно получать по рошки e, Со, Zr или сплавов, F например Fe Co. Форма час тиц преимущественно дендритная (10 20 нм). Данные порошки используются главным образом для магнитов.
Получение нанопорошков возможно также способом жидкометаллического катода. В этом случае в качестве ка тода используется жидкий металл, в котором осаждается металлический порошок. Как правило, для катода исполь зуется ртуть. Процесс проводится в растворе какой либо не органической кислоты. Этим методом можно получать по рошки e, Со, Zr или сплавов, F например Fe Co. Форма час тиц преимущественно дендритная (10 20 нм). Данные порошки используются главным образом для магнитов.
 Способ электрохимического синтеза из расплава заклю чается в получении химических соединений в жидкой ван не при пропускании электрического тока. Реакции проис ходят при высоких температурах, что обеспечивает синтез высокотемпературных модификаций соединений. Основной проблемой при осаждении из расплава является исключе ние захвата синтезируемым порошком компонентов раство рителя и побочных соединений. Поэтому для оптимизации кристаллизации процесс проводят при относительно низкой степени неравновесности. Меняя электрические параметры процесса, можно также влиять на размеры получаемых час тиц.
Способ электрохимического синтеза из расплава заклю чается в получении химических соединений в жидкой ван не при пропускании электрического тока. Реакции проис ходят при высоких температурах, что обеспечивает синтез высокотемпературных модификаций соединений. Основной проблемой при осаждении из расплава является исключе ние захвата синтезируемым порошком компонентов раство рителя и побочных соединений. Поэтому для оптимизации кристаллизации процесс проводят при относительно низкой степени неравновесности. Меняя электрические параметры процесса, можно также влиять на размеры получаемых час тиц.
 Анодным растворением Аl в растворе NH 4 Br NH 3 при 70 °С и последующим прокаливанием при 110 °С в среде азо та был получен порошок Al. N с размером частиц 25 нм. Этим методом синтезировали также прекурсор [Al(NH 2)3 NH]n, термическое разложение которого позволило получить Al. N с размером частиц 8 нм.
Анодным растворением Аl в растворе NH 4 Br NH 3 при 70 °С и последующим прокаливанием при 110 °С в среде азо та был получен порошок Al. N с размером частиц 25 нм. Этим методом синтезировали также прекурсор [Al(NH 2)3 NH]n, термическое разложение которого позволило получить Al. N с размером частиц 8 нм.
 Преимущества: • возможность эффективного воздействия на свойства по рошка посредством изменения параметров электролиза; • рафинирование материала в процессе его получения; • высокая производительность. Недостатки: • сравнительно дорог из за необходимости специального оборудования; • характеризуется высокой энергоемкостью; • требует подбора реагентов, диссоциирующих в раство рителе.
Преимущества: • возможность эффективного воздействия на свойства по рошка посредством изменения параметров электролиза; • рафинирование материала в процессе его получения; • высокая производительность. Недостатки: • сравнительно дорог из за необходимости специального оборудования; • характеризуется высокой энергоемкостью; • требует подбора реагентов, диссоциирующих в раство рителе.
 Получение наноматериалов путем сочетания химических и физических превращений В данной группе методов диспергирование непосредствен но связано как с физическим воздействием, так и с химичес кой реакцией. В частности, в процессах разложения паров соединений металлов с помощью различных излучений хи мическая реакция происходит в результате физического воз действия.
Получение наноматериалов путем сочетания химических и физических превращений В данной группе методов диспергирование непосредствен но связано как с физическим воздействием, так и с химичес кой реакцией. В частности, в процессах разложения паров соединений металлов с помощью различных излучений хи мическая реакция происходит в результате физического воз действия.
 Лазер При использовании лазера реактор имеет прозрачные для этих лучей окна. В простейшем случае через два окна прохо дит луч одного или двух лазеров, направленных навстречу. Поток реакционной смеси пересекает лазерные лучи перпен дикулярно. Размер частиц зависит от давления в реакцион ной камере и интенсивности излучения лазера. Считается, что параметрами лазерного луча управлять легче, чем высо кочастотной или дуговой плазмой. Это, в свою очередь, по зволяет получать нанопорошки с более узким распределе нием частиц по размерам.
Лазер При использовании лазера реактор имеет прозрачные для этих лучей окна. В простейшем случае через два окна прохо дит луч одного или двух лазеров, направленных навстречу. Поток реакционной смеси пересекает лазерные лучи перпен дикулярно. Размер частиц зависит от давления в реакцион ной камере и интенсивности излучения лазера. Считается, что параметрами лазерного луча управлять легче, чем высо кочастотной или дуговой плазмой. Это, в свою очередь, по зволяет получать нанопорошки с более узким распределе нием частиц по размерам.
 Данным способом получен нитрид кремния с размером час тиц 10 20 нм из смеси Si. H 4 и NH 3. С использованием лазера также синтезированы наночастицы Mem. C„ (Me Ti, Zr, Hf, V) с соотношением Н: С примерно 1, 5 г 2, 0. Для получения нанопорошока y Fe применяют С 02 лазер. Исходной является смесь газов Fe(CO)5 и SF 6, процесс прохо дит при комнатной температуре. Синтезированные частицы имеют сферическую форму, размер 6 8 нм
Данным способом получен нитрид кремния с размером час тиц 10 20 нм из смеси Si. H 4 и NH 3. С использованием лазера также синтезированы наночастицы Mem. C„ (Me Ti, Zr, Hf, V) с соотношением Н: С примерно 1, 5 г 2, 0. Для получения нанопорошока y Fe применяют С 02 лазер. Исходной является смесь газов Fe(CO)5 и SF 6, процесс прохо дит при комнатной температуре. Синтезированные частицы имеют сферическую форму, размер 6 8 нм
 Синтез нанопорошков карбидов, оксидов и нитридов воз можен с помощью импульсного лазерного нагрева металлов • в разреженной атмосфере метана (в случае карбидов), • кислоро да в случае оксидов), ( • азота и аммиака (в случае нитридов). Испарение нескольких металлов в газовую фазу позволяет получить смеси нанопорошков оксидов различных металлов, оксидно нитридные или карбидо нитридные смеси.
Синтез нанопорошков карбидов, оксидов и нитридов воз можен с помощью импульсного лазерного нагрева металлов • в разреженной атмосфере метана (в случае карбидов), • кислоро да в случае оксидов), ( • азота и аммиака (в случае нитридов). Испарение нескольких металлов в газовую фазу позволяет получить смеси нанопорошков оксидов различных металлов, оксидно нитридные или карбидо нитридные смеси.
 Рентгеновское и γ излучение Путем разложения азидов тяжелых металлов (Me. Nn) получают порошки меди и се ребра в наносостоянии. Главным достоинством способа явля ется получение бездефектных частиц металлов.
Рентгеновское и γ излучение Путем разложения азидов тяжелых металлов (Me. Nn) получают порошки меди и се ребра в наносостоянии. Главным достоинством способа явля ется получение бездефектных частиц металлов.
 Метод электродугового разряда • Анод изготавливается из участвующего в реакции вещества: металла, например Ni, Fe, W, или соединения металлов. Дуговой разряд создается в атмосфере реакционного газа. Пример: изготовление высокоплотных маг нитных записывающих носителей на основе магнитных ме таллов, которое осуществляется при взаимодействии паров галогенидов магнитных металлов с водородом при давлении 50 600 мм рт. ст. Размер частиц, получаемых этим методом, составляет 17 39 нм. • При разложении летучих гидридов в высокочастотном (41 МГц) электрическом разряде при давлении в реакторе до 50 мм рт. ст. получены нанопорошки германия и кремния. В данном процессе частицы кремния имеют размер 10 100 нм, германия 100 500 нм.
Метод электродугового разряда • Анод изготавливается из участвующего в реакции вещества: металла, например Ni, Fe, W, или соединения металлов. Дуговой разряд создается в атмосфере реакционного газа. Пример: изготовление высокоплотных маг нитных записывающих носителей на основе магнитных ме таллов, которое осуществляется при взаимодействии паров галогенидов магнитных металлов с водородом при давлении 50 600 мм рт. ст. Размер частиц, получаемых этим методом, составляет 17 39 нм. • При разложении летучих гидридов в высокочастотном (41 МГц) электрическом разряде при давлении в реакторе до 50 мм рт. ст. получены нанопорошки германия и кремния. В данном процессе частицы кремния имеют размер 10 100 нм, германия 100 500 нм.
 Способ синтеза наноматериалов в химическом пламени смеси газов В качестве исходных реагентов используются фториды, хлориды и оксиды металлов Химическое пламя создают газовые смеси водорода и фтора, углеводоро дов и кислорода. Данным способом получены металлы Мо, Ni, Сu, сплавы, оксиды. Размер нанопорошка менее 100 нм, форма частиц обычно сферическая.
Способ синтеза наноматериалов в химическом пламени смеси газов В качестве исходных реагентов используются фториды, хлориды и оксиды металлов Химическое пламя создают газовые смеси водорода и фтора, углеводоро дов и кислорода. Данным способом получены металлы Мо, Ni, Сu, сплавы, оксиды. Размер нанопорошка менее 100 нм, форма частиц обычно сферическая.
 Плазменный способ Используется низкотемпературная (4000 8000 К) азотная, аммиачная, углеводородная, аргоновая плазма дугового, тлеющего, высоко или сверхвысокочастот ного разрядов. Это один из самых распространенных спосо бов получения нанопорошков нитридов, боридов, карбидов и оксидов.
Плазменный способ Используется низкотемпературная (4000 8000 К) азотная, аммиачная, углеводородная, аргоновая плазма дугового, тлеющего, высоко или сверхвысокочастот ного разрядов. Это один из самых распространенных спосо бов получения нанопорошков нитридов, боридов, карбидов и оксидов.


