7.Спектроскопия УФ и ВС.ppt
- Количество слайдов: 63
 Лекция № 7 Спектроскопия в ультрафиолетовой и видимой области 1
Лекция № 7 Спектроскопия в ультрафиолетовой и видимой области 1
 Спектроскопия УФ- и видимого диапазона Литература • Д. В. Козлов, Г. А. Костин, А. П. Чупахин «Основные принципы спектроскопии и ее применение в химии» • А. Б. Никольский «Физические методы исследования неорганических веществ» • Ю. А. Пентин, Г. М. Курамшина «Основы молекулярной спектроскопии» • Браун Д. , Флойд А. , Сейнзбери М. «Спектроскопия органических веществ» • Сильверстейн Р, Басслер Г. Моррил Т. «Спектрометрическая идентификация органических соединений» • Булатов М. И. , Калинкин И. П. «Практическое руководство по фотометрическим методам анализа» 2
Спектроскопия УФ- и видимого диапазона Литература • Д. В. Козлов, Г. А. Костин, А. П. Чупахин «Основные принципы спектроскопии и ее применение в химии» • А. Б. Никольский «Физические методы исследования неорганических веществ» • Ю. А. Пентин, Г. М. Курамшина «Основы молекулярной спектроскопии» • Браун Д. , Флойд А. , Сейнзбери М. «Спектроскопия органических веществ» • Сильверстейн Р, Басслер Г. Моррил Т. «Спектрометрическая идентификация органических соединений» • Булатов М. И. , Калинкин И. П. «Практическое руководство по фотометрическим методам анализа» 2
 3
3
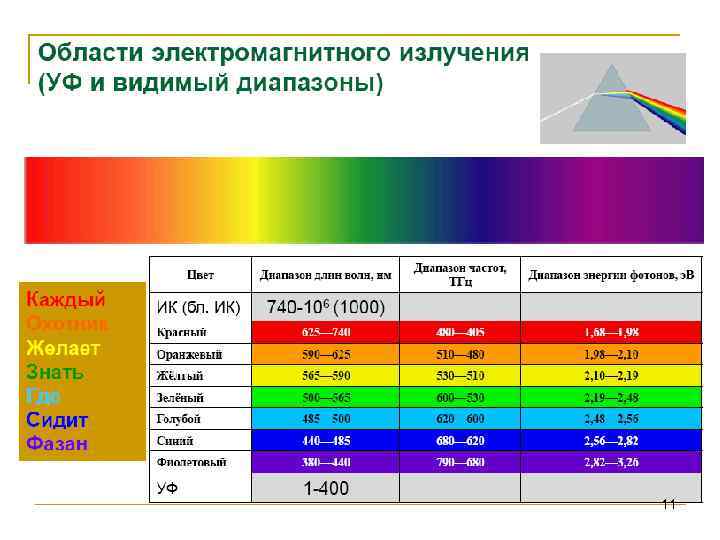
 УФ-видимая спектроскопия • • Электронные спектры молекул Для возбуждения валентных электронов молекул необходимо излучение, лежащее в УФ-видимой области. Энергии такого излучения достаточно для того, чтобы одновременно возбудить колебательные и вращательные состояния молекул. Разделение УФ-видимой области спектра показано на рис. 4. 1. 1. При длинах волн ниже 190 нм начинает интенсивно поглощать кислород воздуха; работа в этом диапазоне возможна лишь в вакууме. Поэтому диапазон 100 -200 нм называют вакуумной УФобластью. Человеческий глаз восприимчив лишь к излучению видимого диапазона. Окраска различных предметов обусловлена тем, что они поглощают видимое излучение некоторых длин волн и отражают (или пропускают, если речь идет о прозрачных телах) излучение при всех остальных длинах волн. 4
УФ-видимая спектроскопия • • Электронные спектры молекул Для возбуждения валентных электронов молекул необходимо излучение, лежащее в УФ-видимой области. Энергии такого излучения достаточно для того, чтобы одновременно возбудить колебательные и вращательные состояния молекул. Разделение УФ-видимой области спектра показано на рис. 4. 1. 1. При длинах волн ниже 190 нм начинает интенсивно поглощать кислород воздуха; работа в этом диапазоне возможна лишь в вакууме. Поэтому диапазон 100 -200 нм называют вакуумной УФобластью. Человеческий глаз восприимчив лишь к излучению видимого диапазона. Окраска различных предметов обусловлена тем, что они поглощают видимое излучение некоторых длин волн и отражают (или пропускают, если речь идет о прозрачных телах) излучение при всех остальных длинах волн. 4
 5
5
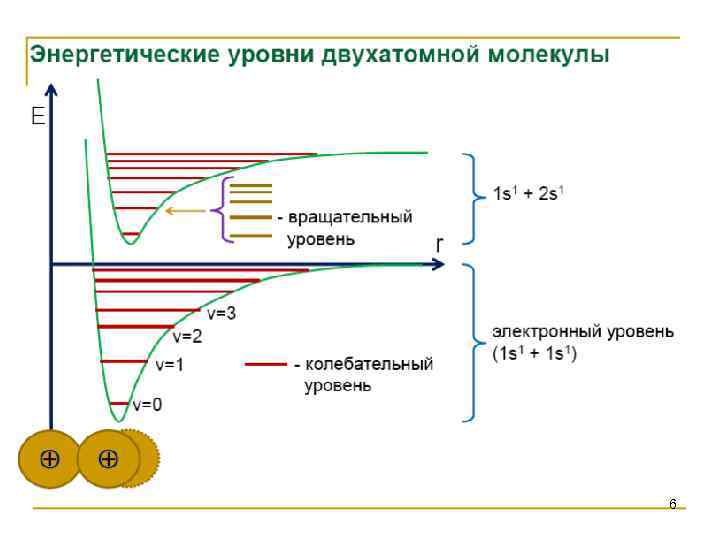 6
6
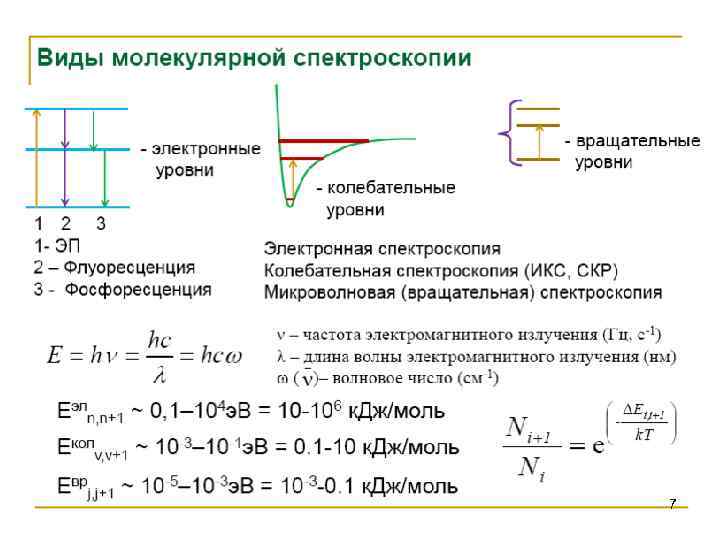 7
7
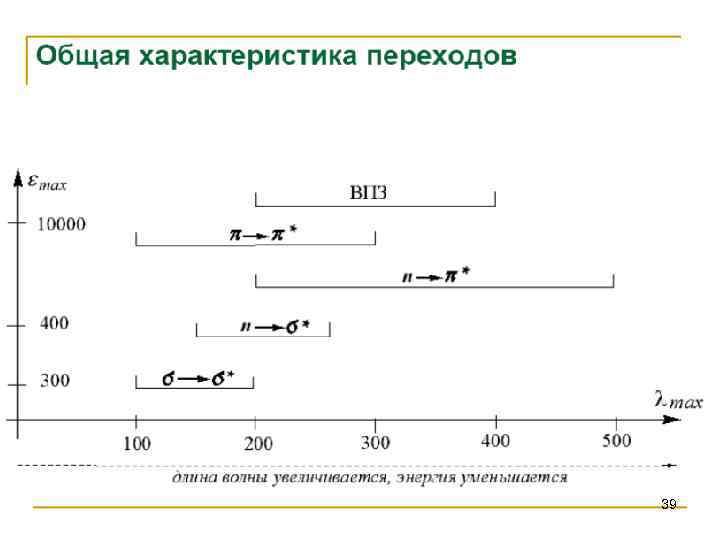
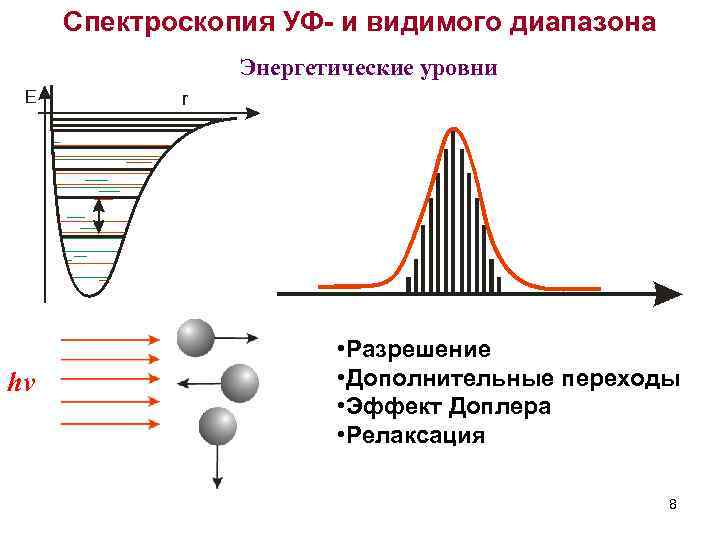 Спектроскопия УФ- и видимого диапазона Энергетические уровни hν • Разрешение • Дополнительные переходы • Эффект Доплера • Релаксация 8
Спектроскопия УФ- и видимого диапазона Энергетические уровни hν • Разрешение • Дополнительные переходы • Эффект Доплера • Релаксация 8
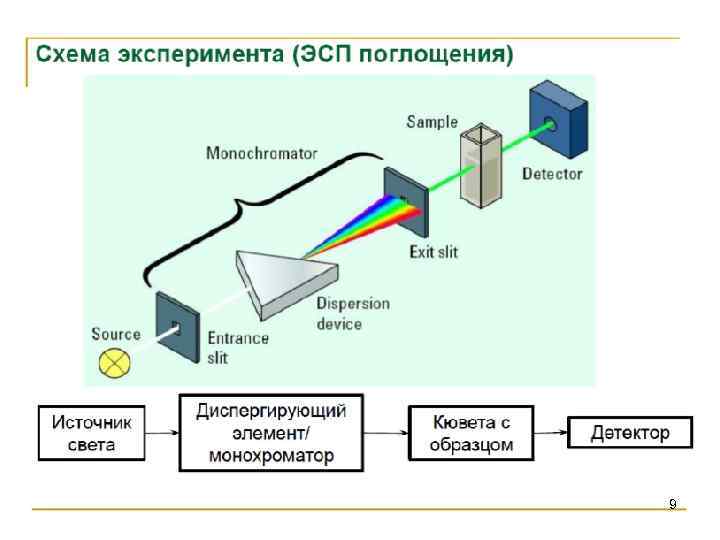 9
9
 10
10
 11
11
 12
12
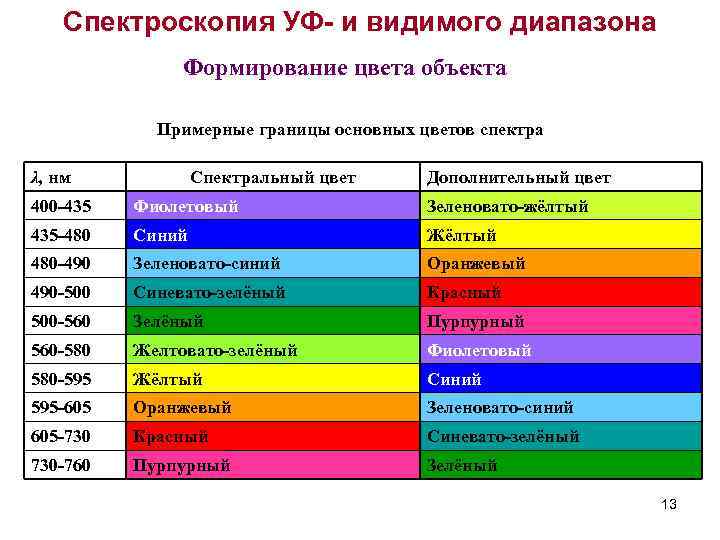 Спектроскопия УФ- и видимого диапазона Формирование цвета объекта Примерные границы основных цветов спектра λ, нм Спектральный цвет Дополнительный цвет 400 -435 Фиолетовый Зеленовато-жёлтый 435 -480 Синий Жёлтый 480 -490 Зеленовато-синий Оранжевый 490 -500 Синевато-зелёный Красный 500 -560 Зелёный Пурпурный 560 -580 Желтовато-зелёный Фиолетовый 580 -595 Жёлтый Синий 595 -605 Оранжевый Зеленовато-синий 605 -730 Красный Синевато-зелёный 730 -760 Пурпурный Зелёный 13
Спектроскопия УФ- и видимого диапазона Формирование цвета объекта Примерные границы основных цветов спектра λ, нм Спектральный цвет Дополнительный цвет 400 -435 Фиолетовый Зеленовато-жёлтый 435 -480 Синий Жёлтый 480 -490 Зеленовато-синий Оранжевый 490 -500 Синевато-зелёный Красный 500 -560 Зелёный Пурпурный 560 -580 Желтовато-зелёный Фиолетовый 580 -595 Жёлтый Синий 595 -605 Оранжевый Зеленовато-синий 605 -730 Красный Синевато-зелёный 730 -760 Пурпурный Зелёный 13
 Электронные переходы • Светопоглощение молекул в УФ-видимой области связано с возбуждением валентных электронов, находящихся в различных состояниях n-, σ-, π -электронов (обычно в органических соединениях), d-, f-электронов (в ионах металлов), а также с электронными переходами с переносом заряда (в комплексных соединениях). • Разделение молекулярных орбиталей на n-, σ-, π- орбитали связано с различным характером распределения электронной плотности. • Для σ-орбиталей электронная плотность распределена симметрично относительно оси, связывающей ядра атомов. • π-орбитали характеризуются симметрией относительно плоскости, проходящей через два или более ядер. σ-, πорбитали могут быть связывающими или разрыхляющими. • n-орбитали локализованы на гетероатоме, они является несвязывающими. В отличие от σ-, π -орбиталей, для них не существует парной разрыхляющей орбитали. • В качестве примера на рис. 4. 1. 2. приведено распределение электронной плотности для некоторых орбиталей двухатомной молекулы. 14
Электронные переходы • Светопоглощение молекул в УФ-видимой области связано с возбуждением валентных электронов, находящихся в различных состояниях n-, σ-, π -электронов (обычно в органических соединениях), d-, f-электронов (в ионах металлов), а также с электронными переходами с переносом заряда (в комплексных соединениях). • Разделение молекулярных орбиталей на n-, σ-, π- орбитали связано с различным характером распределения электронной плотности. • Для σ-орбиталей электронная плотность распределена симметрично относительно оси, связывающей ядра атомов. • π-орбитали характеризуются симметрией относительно плоскости, проходящей через два или более ядер. σ-, πорбитали могут быть связывающими или разрыхляющими. • n-орбитали локализованы на гетероатоме, они является несвязывающими. В отличие от σ-, π -орбиталей, для них не существует парной разрыхляющей орбитали. • В качестве примера на рис. 4. 1. 2. приведено распределение электронной плотности для некоторых орбиталей двухатомной молекулы. 14
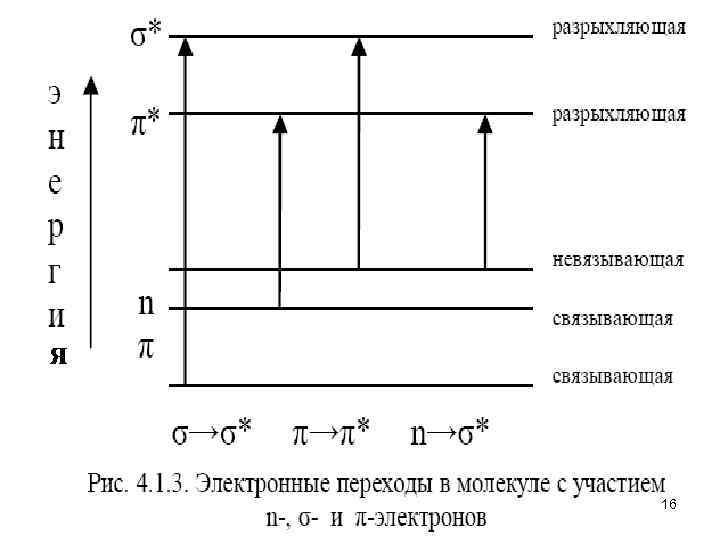
 • Для молекулярных электронных переходов также справедливы определенные правила отбора. Они связаны с изменением спинового состояния, симметрии молекулярных орбиталей, колебательных квантовых чисел (принцип Франка-Кондона) и другими факторами. На рис. 4. 1. 3 изображены возможные переходы n-, σ-, π-электронов. • σ→σ* – переходы связаны с самыми большими изменениями энергии. Они наблюдаются главным образом в вакуумной УФобласти (например, для насыщенных углеводородов). Коротковолновая полоса поглощения молекулы СН 4 лежит при 125 нм. • Гомологи метана поглощают в более длинноволновой области, поскольку для возбуждения электронов связи Для связи С–С требуется меньше энергии, чем для связи С–Н. Поскольку измерения при длинах волн меньше 190 нм возможны только с применением специальных вакуумных спектрометров, для аналитической практики σ→σ* – переходы представляют незначительный интерес. • n →σ* – переходы наблюдаются в более длинноволновой области спектра по сравнению с σ→σ* – переходами. Значение длины волны в максимуме поглощения зависит от характера связи гетероатома и его электроотрицательности. • n →π* и π→π* – переходы имеют для аналитической химии наибольшее значение. Они находятся в наиболее длинноволновой области и имеют наибольшую интенсивность по сравнению с 15 другими переходами всех других типов.
• Для молекулярных электронных переходов также справедливы определенные правила отбора. Они связаны с изменением спинового состояния, симметрии молекулярных орбиталей, колебательных квантовых чисел (принцип Франка-Кондона) и другими факторами. На рис. 4. 1. 3 изображены возможные переходы n-, σ-, π-электронов. • σ→σ* – переходы связаны с самыми большими изменениями энергии. Они наблюдаются главным образом в вакуумной УФобласти (например, для насыщенных углеводородов). Коротковолновая полоса поглощения молекулы СН 4 лежит при 125 нм. • Гомологи метана поглощают в более длинноволновой области, поскольку для возбуждения электронов связи Для связи С–С требуется меньше энергии, чем для связи С–Н. Поскольку измерения при длинах волн меньше 190 нм возможны только с применением специальных вакуумных спектрометров, для аналитической практики σ→σ* – переходы представляют незначительный интерес. • n →σ* – переходы наблюдаются в более длинноволновой области спектра по сравнению с σ→σ* – переходами. Значение длины волны в максимуме поглощения зависит от характера связи гетероатома и его электроотрицательности. • n →π* и π→π* – переходы имеют для аналитической химии наибольшее значение. Они находятся в наиболее длинноволновой области и имеют наибольшую интенсивность по сравнению с 15 другими переходами всех других типов.
 я 16
я 16
 • Рассмотрим сначала молекулу с изолированной πсвязью. Электроны π-связей более легко возбудимы, чем электроны σ-связей. • В УФ-видимой области можно наблюдать и полосы, обусловленные переходами d- и f- электронов. • Для аналитической химии особенно важны соединения, имеющие в своем спектре полосы переноса заряда. Они возникают при взаимодействии атомов-донора и акцептора электронов. • Типичными примерами могут служить многие комплексы ионов металлов с органическими реагентами, например, иона Fe 2+ (акцептор электронов) с 1, 10 -фенантролином (донор электронов). • Для таких полос молярный коэффициент поглощения достигает значений 1000 и выше. • Поэтому комплексы с переносом заряда очень целесообразно использовать для фотометрического определения металлов. 17
• Рассмотрим сначала молекулу с изолированной πсвязью. Электроны π-связей более легко возбудимы, чем электроны σ-связей. • В УФ-видимой области можно наблюдать и полосы, обусловленные переходами d- и f- электронов. • Для аналитической химии особенно важны соединения, имеющие в своем спектре полосы переноса заряда. Они возникают при взаимодействии атомов-донора и акцептора электронов. • Типичными примерами могут служить многие комплексы ионов металлов с органическими реагентами, например, иона Fe 2+ (акцептор электронов) с 1, 10 -фенантролином (донор электронов). • Для таких полос молярный коэффициент поглощения достигает значений 1000 и выше. • Поэтому комплексы с переносом заряда очень целесообразно использовать для фотометрического определения металлов. 17
 18
18
 Спектроскопия УФ- и видимого диапазона Закон Бугера-Ламберта-Бера D – оптическая плотность I, I 0 – интенсивность излучения ε – коэффициент экстинкции С – концентрация l - длина кюветы Правило аддитивности ТОЛЬКО ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ!!! 19
Спектроскопия УФ- и видимого диапазона Закон Бугера-Ламберта-Бера D – оптическая плотность I, I 0 – интенсивность излучения ε – коэффициент экстинкции С – концентрация l - длина кюветы Правило аддитивности ТОЛЬКО ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ!!! 19
 20
20
 21
21
 22
22
 23
23
 24
24
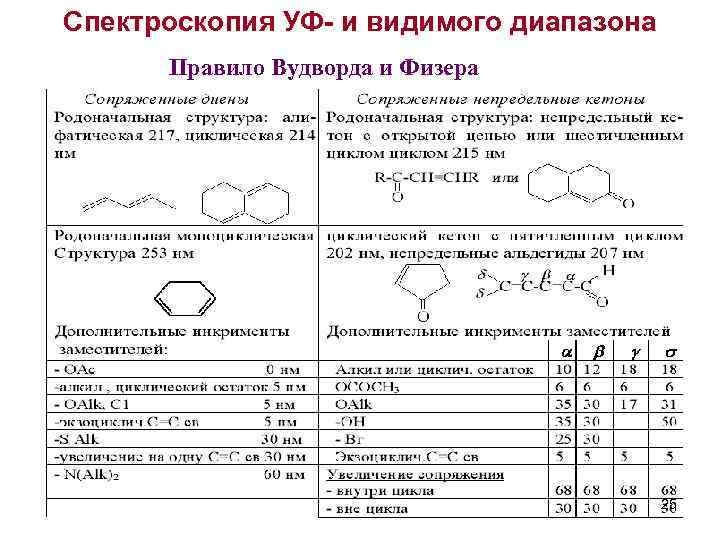 Спектроскопия УФ- и видимого диапазона Правило Вудворда и Физера 25
Спектроскопия УФ- и видимого диапазона Правило Вудворда и Физера 25
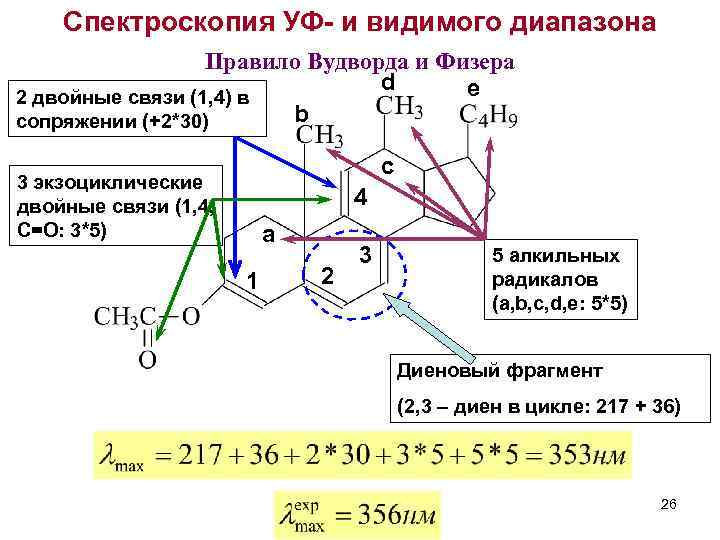 Спектроскопия УФ- и видимого диапазона Правило Вудворда и Физера d e 2 двойные связи (1, 4) в b сопряжении (+2*30) c 3 экзоциклические двойные связи (1, 4, С=О: 3*5) 4 a 1 2 3 5 алкильных радикалов (a, b, c, d, e: 5*5) Диеновый фрагмент (2, 3 – диен в цикле: 217 + 36) 26
Спектроскопия УФ- и видимого диапазона Правило Вудворда и Физера d e 2 двойные связи (1, 4) в b сопряжении (+2*30) c 3 экзоциклические двойные связи (1, 4, С=О: 3*5) 4 a 1 2 3 5 алкильных радикалов (a, b, c, d, e: 5*5) Диеновый фрагмент (2, 3 – диен в цикле: 217 + 36) 26
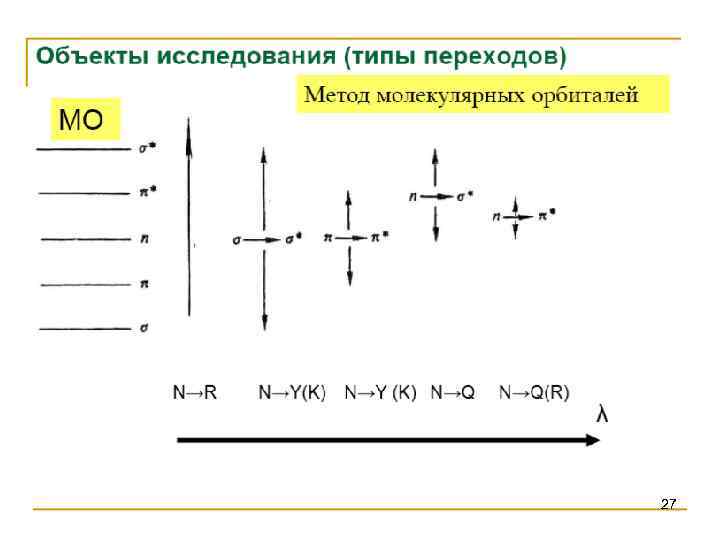 27
27
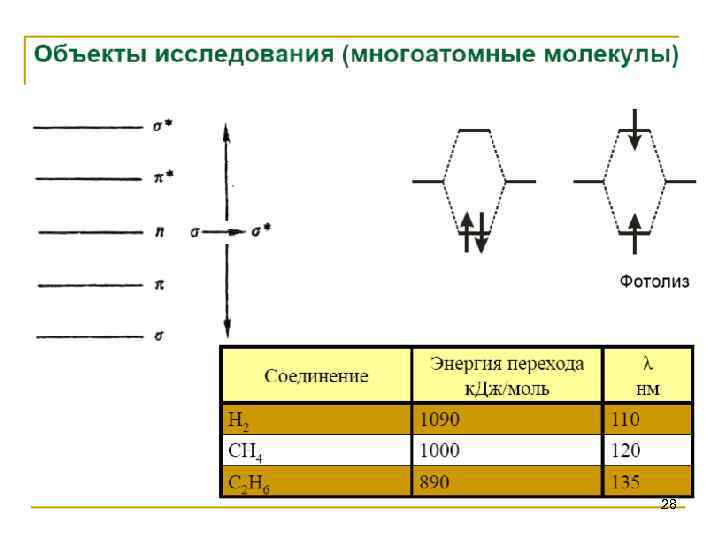 28
28
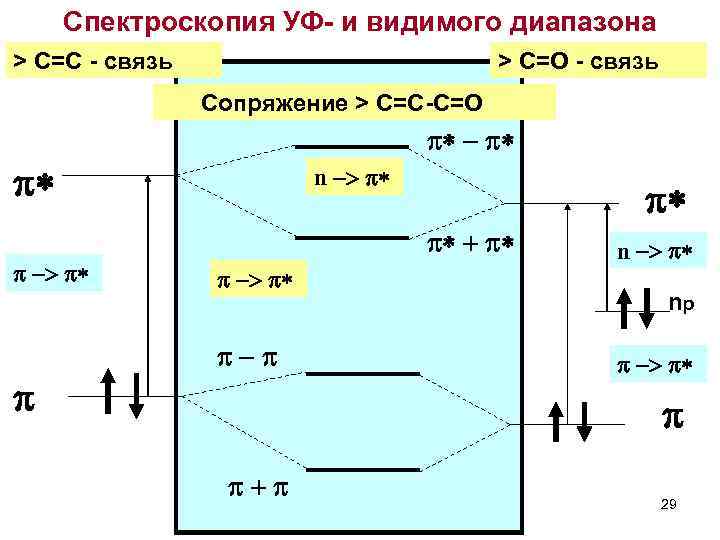 Спектроскопия УФ- и видимого диапазона > C=C - связь > C=O - связь Сопряжение > C=C-C=O p* - p* p* p -> p* p n -> p* p* p* + p* p -> p* p-p n -> p* np p -> p* p p+p 29
Спектроскопия УФ- и видимого диапазона > C=C - связь > C=O - связь Сопряжение > C=C-C=O p* - p* p* p -> p* p n -> p* p* p* + p* p -> p* p-p n -> p* np p -> p* p p+p 29
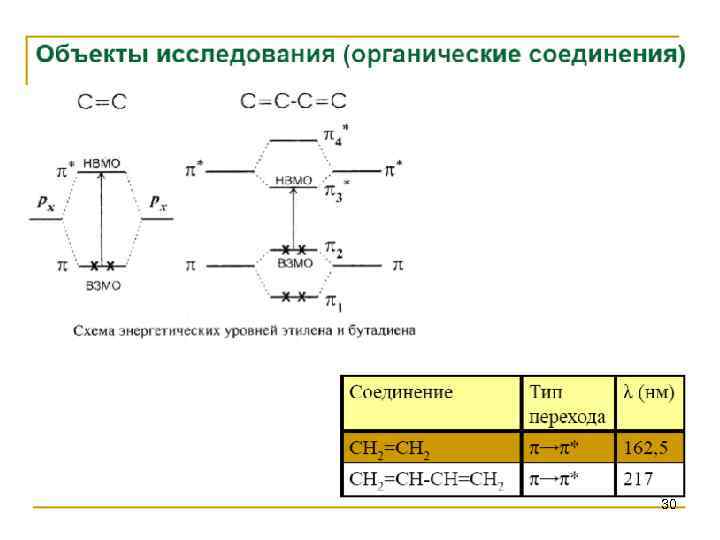 30
30
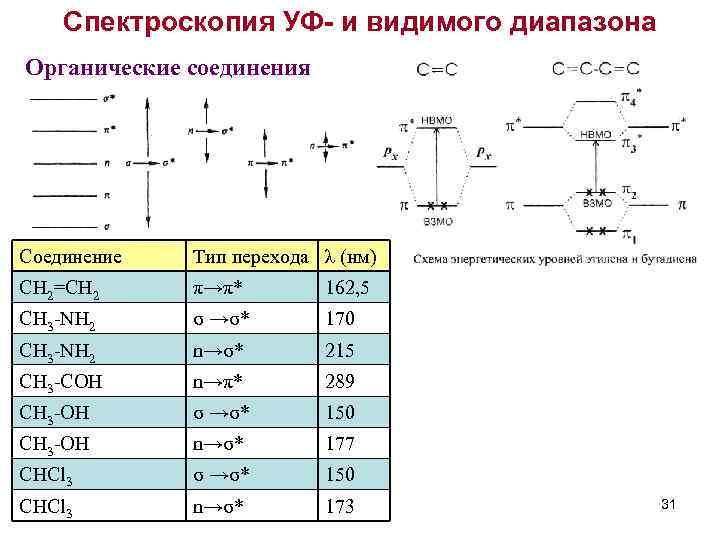 Спектроскопия УФ- и видимого диапазона Органические соединения Соединение Тип перехода λ (нм) CH 2=CH 2 π→π* 162, 5 CH 3 -NH 2 σ →σ* 170 CH 3 -NH 2 n→σ* 215 CH 3 -COH n→π* 289 CH 3 -OH σ →σ* 150 CH 3 -OH n→σ* 177 CHCl 3 σ →σ* 150 CHCl 3 n→σ* 173 31
Спектроскопия УФ- и видимого диапазона Органические соединения Соединение Тип перехода λ (нм) CH 2=CH 2 π→π* 162, 5 CH 3 -NH 2 σ →σ* 170 CH 3 -NH 2 n→σ* 215 CH 3 -COH n→π* 289 CH 3 -OH σ →σ* 150 CH 3 -OH n→σ* 177 CHCl 3 σ →σ* 150 CHCl 3 n→σ* 173 31
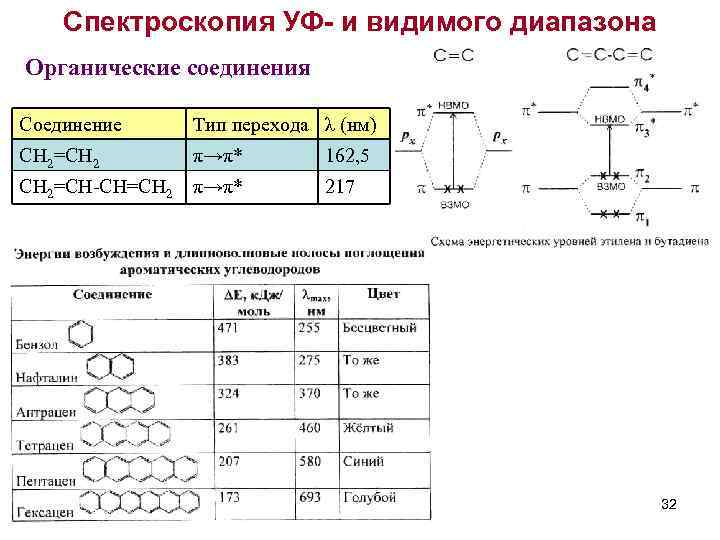 Спектроскопия УФ- и видимого диапазона Органические соединения Соединение Тип перехода λ (нм) CH 2=CH 2 π→π* 162, 5 CH 2=CH-CH=CH 2 π→π* 217 32
Спектроскопия УФ- и видимого диапазона Органические соединения Соединение Тип перехода λ (нм) CH 2=CH 2 π→π* 162, 5 CH 2=CH-CH=CH 2 π→π* 217 32
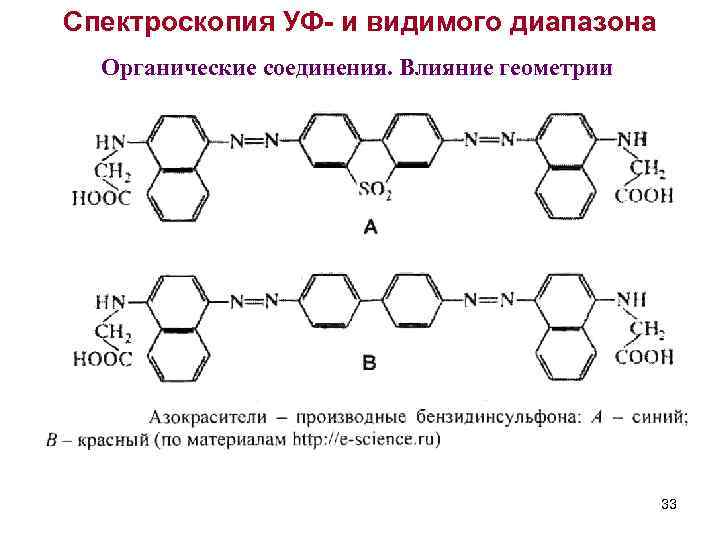 Спектроскопия УФ- и видимого диапазона Органические соединения. Влияние геометрии 33
Спектроскопия УФ- и видимого диапазона Органические соединения. Влияние геометрии 33
 34
34
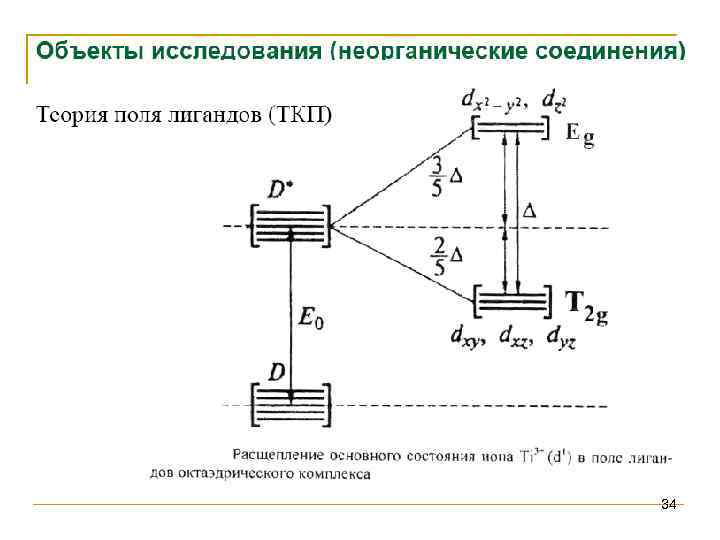
 Спектроскопия УФ- и видимого диапазона Неорганические соединения Зависимость Δ: Заряд ядра Степень окисления Δ Спектрохимический ряд лигандов: I- < Br- < SCN- ≈ Cl- < NO 3 - < F-
Спектроскопия УФ- и видимого диапазона Неорганические соединения Зависимость Δ: Заряд ядра Степень окисления Δ Спектрохимический ряд лигандов: I- < Br- < SCN- ≈ Cl- < NO 3 - < F-
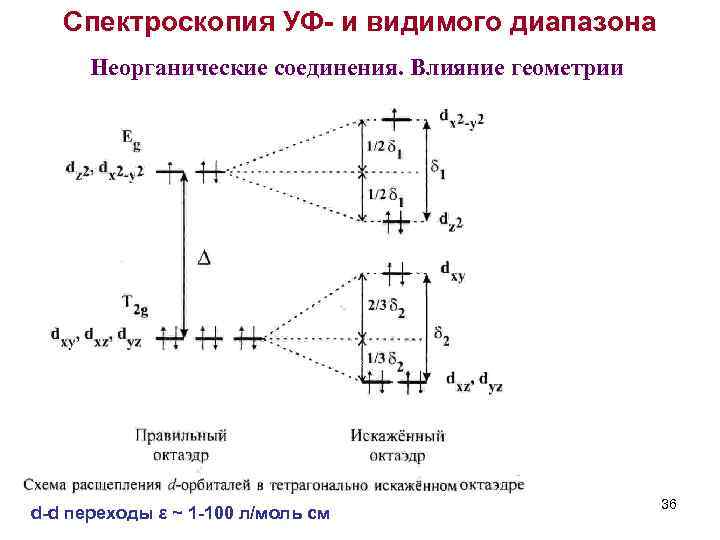 Спектроскопия УФ- и видимого диапазона Неорганические соединения. Влияние геометрии d-d переходы ε ~ 1 -100 л/моль см 36
Спектроскопия УФ- и видимого диапазона Неорганические соединения. Влияние геометрии d-d переходы ε ~ 1 -100 л/моль см 36
 37
37
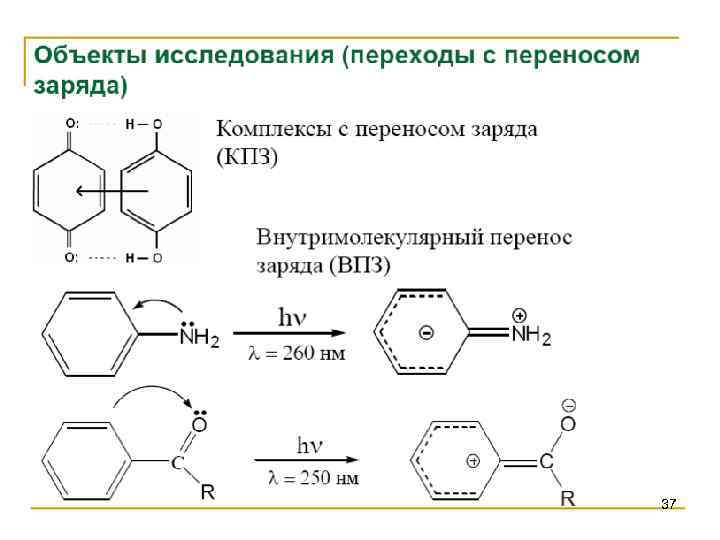
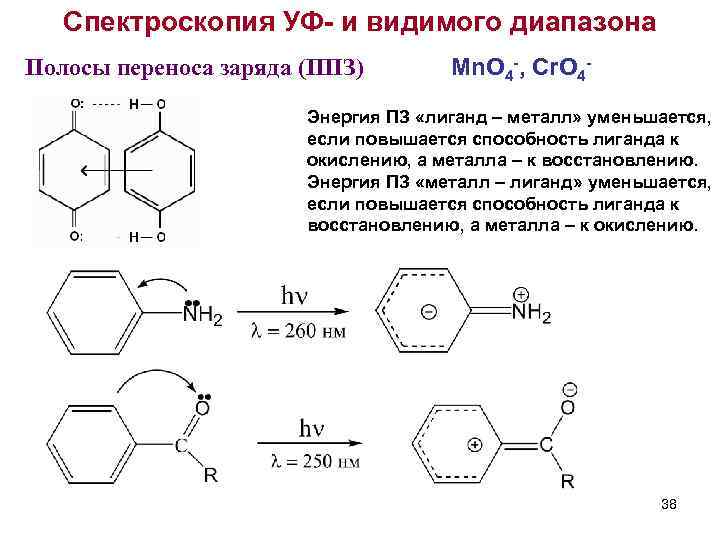 Спектроскопия УФ- и видимого диапазона Полосы переноса заряда (ППЗ) Mn. O 4 -, Cr. O 4 - Энергия ПЗ «лиганд – металл» уменьшается, если повышается способность лиганда к окислению, а металла – к восстановлению. Энергия ПЗ «металл – лиганд» уменьшается, если повышается способность лиганда к восстановлению, а металла – к окислению. 38
Спектроскопия УФ- и видимого диапазона Полосы переноса заряда (ППЗ) Mn. O 4 -, Cr. O 4 - Энергия ПЗ «лиганд – металл» уменьшается, если повышается способность лиганда к окислению, а металла – к восстановлению. Энергия ПЗ «металл – лиганд» уменьшается, если повышается способность лиганда к восстановлению, а металла – к окислению. 38
 39
39
 40
40
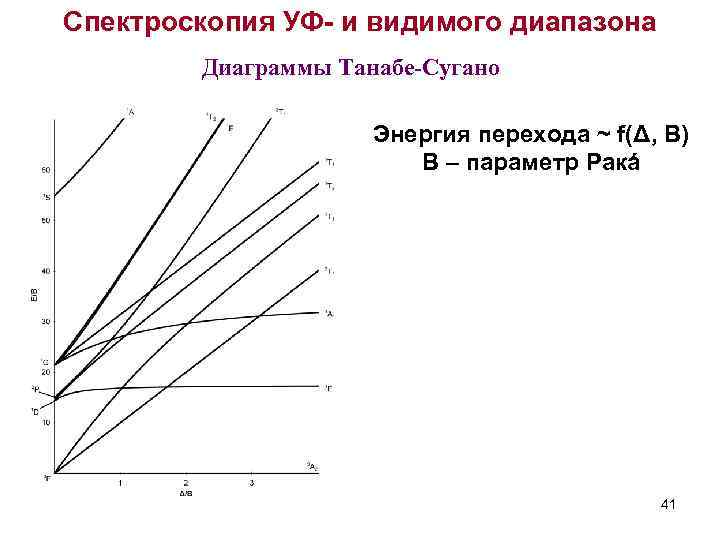 Спектроскопия УФ- и видимого диапазона Диаграммы Танабе-Сугано Энергия перехода ~ f(Δ, B) B – параметр Ракá 41
Спектроскопия УФ- и видимого диапазона Диаграммы Танабе-Сугано Энергия перехода ~ f(Δ, B) B – параметр Ракá 41
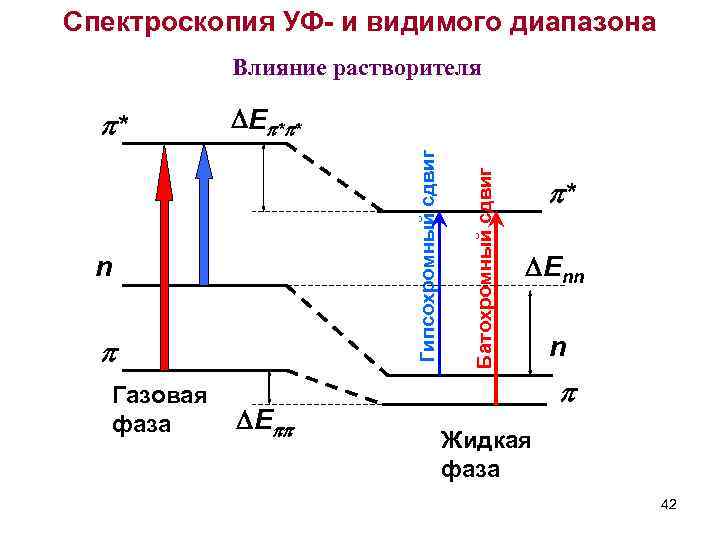 Спектроскопия УФ- и видимого диапазона Влияние растворителя n Газовая фаза E Батохромный сдвиг E * * Гипсохромный сдвиг * * Enn n Жидкая фаза 42
Спектроскопия УФ- и видимого диапазона Влияние растворителя n Газовая фаза E Батохромный сдвиг E * * Гипсохромный сдвиг * * Enn n Жидкая фаза 42
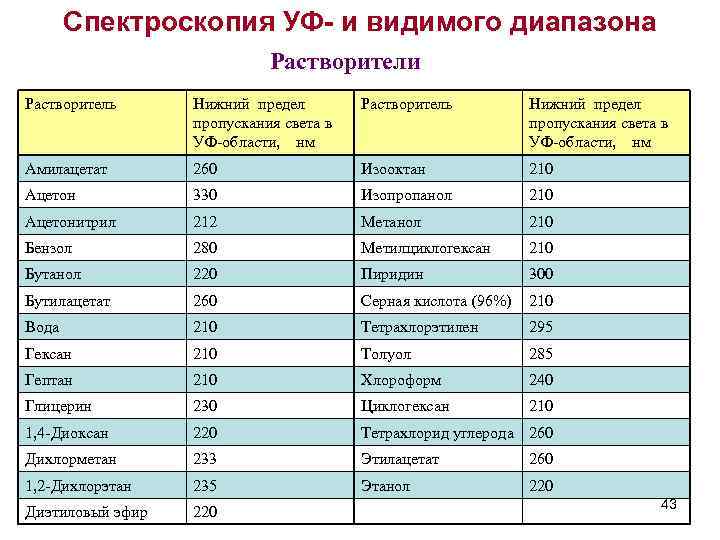 Спектроскопия УФ- и видимого диапазона Растворители Растворитель Нижний предел пропускания света в УФ-области, нм Амилацетат 260 Изооктан 210 Ацетон 330 Изопропанол 210 Aцетонитрил 212 Метанол 210 Бензол 280 Метилциклогексан 210 Бутанол 220 Пиридин 300 Бутилацетат 260 Серная кислота (96%) 210 Вода 210 Тетрахлорэтилен 295 Гексан 210 Толуол 285 Гептан 210 Хлороформ 240 Глицерин 230 Циклогексан 210 1, 4 -Диоксан 220 Тетрахлорид углерода 260 Дихлорметан 233 Этилацетат 260 1, 2 -Дихлорэтан 235 Этанол 220 Диэтиловый эфир 220 43
Спектроскопия УФ- и видимого диапазона Растворители Растворитель Нижний предел пропускания света в УФ-области, нм Амилацетат 260 Изооктан 210 Ацетон 330 Изопропанол 210 Aцетонитрил 212 Метанол 210 Бензол 280 Метилциклогексан 210 Бутанол 220 Пиридин 300 Бутилацетат 260 Серная кислота (96%) 210 Вода 210 Тетрахлорэтилен 295 Гексан 210 Толуол 285 Гептан 210 Хлороформ 240 Глицерин 230 Циклогексан 210 1, 4 -Диоксан 220 Тетрахлорид углерода 260 Дихлорметан 233 Этилацетат 260 1, 2 -Дихлорэтан 235 Этанол 220 Диэтиловый эфир 220 43
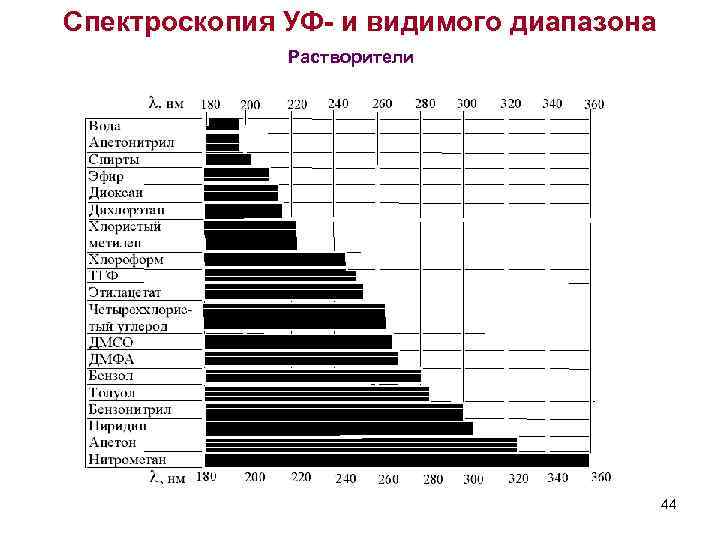 Спектроскопия УФ- и видимого диапазона Растворители 44
Спектроскопия УФ- и видимого диапазона Растворители 44
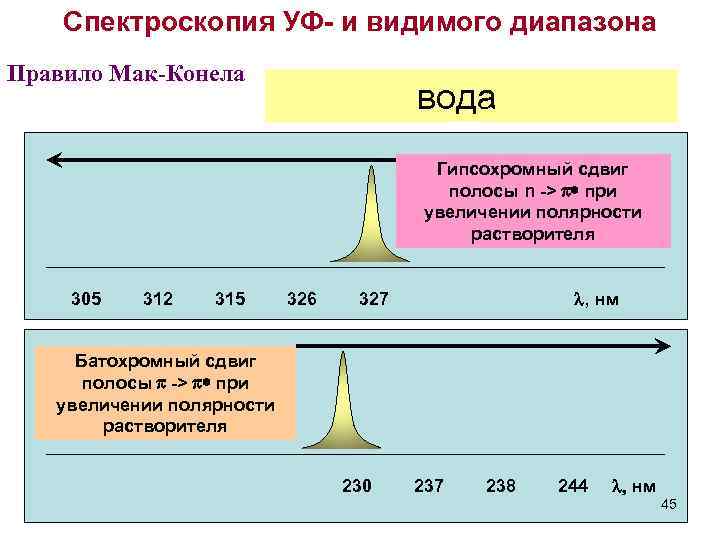 Спектроскопия УФ- и видимого диапазона Правило Мак-Конела диэтиловый эфир вода метанол этанол гексан Гипсохромный сдвиг полосы n -> p* при увеличении полярности растворителя 305 312 315 326 l, нм 327 Батохромный сдвиг полосы p -> p* при увеличении полярности растворителя 230 237 238 244 l, нм 45
Спектроскопия УФ- и видимого диапазона Правило Мак-Конела диэтиловый эфир вода метанол этанол гексан Гипсохромный сдвиг полосы n -> p* при увеличении полярности растворителя 305 312 315 326 l, нм 327 Батохромный сдвиг полосы p -> p* при увеличении полярности растворителя 230 237 238 244 l, нм 45
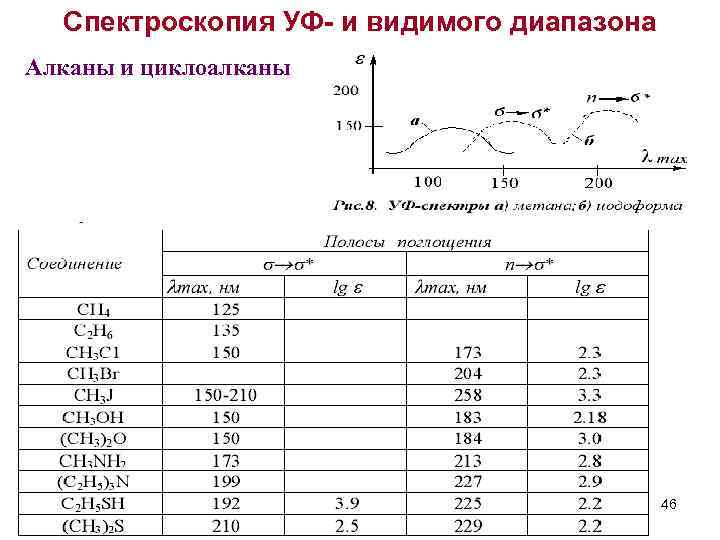 Спектроскопия УФ- и видимого диапазона Алканы и циклоалканы 46
Спектроскопия УФ- и видимого диапазона Алканы и циклоалканы 46
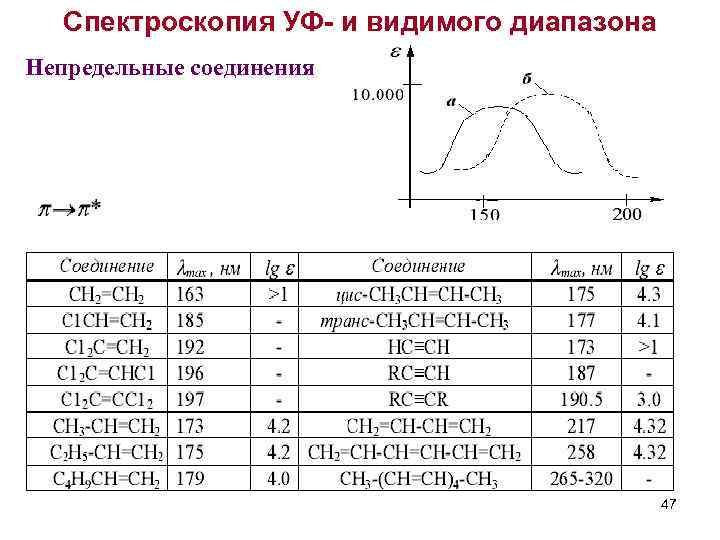 Спектроскопия УФ- и видимого диапазона Непредельные соединения 47
Спектроскопия УФ- и видимого диапазона Непредельные соединения 47
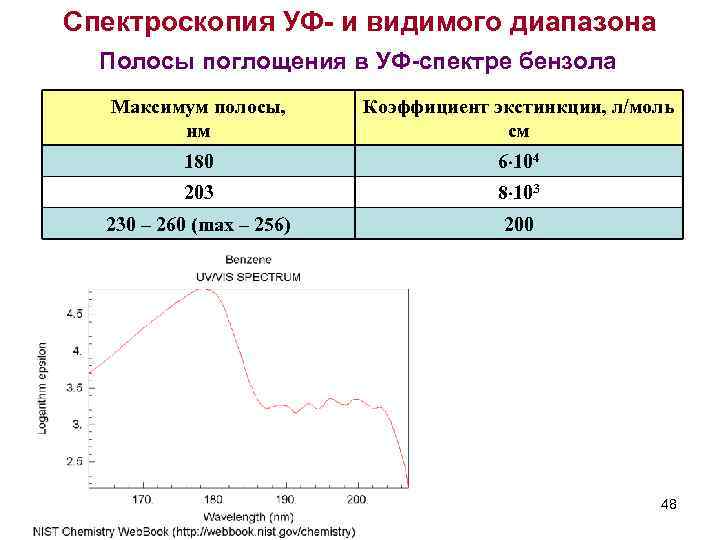 Спектроскопия УФ- и видимого диапазона Полосы поглощения в УФ-спектре бензола Максимум полосы, нм Коэффициент экстинкции, л/моль см 180 6 104 203 8 103 230 – 260 (max – 256) 200 48
Спектроскопия УФ- и видимого диапазона Полосы поглощения в УФ-спектре бензола Максимум полосы, нм Коэффициент экстинкции, л/моль см 180 6 104 203 8 103 230 – 260 (max – 256) 200 48
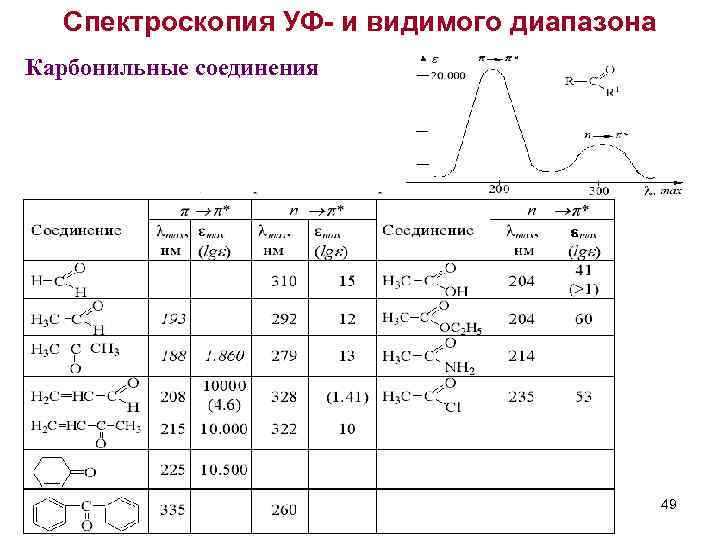 Спектроскопия УФ- и видимого диапазона Карбонильные соединения 49
Спектроскопия УФ- и видимого диапазона Карбонильные соединения 49
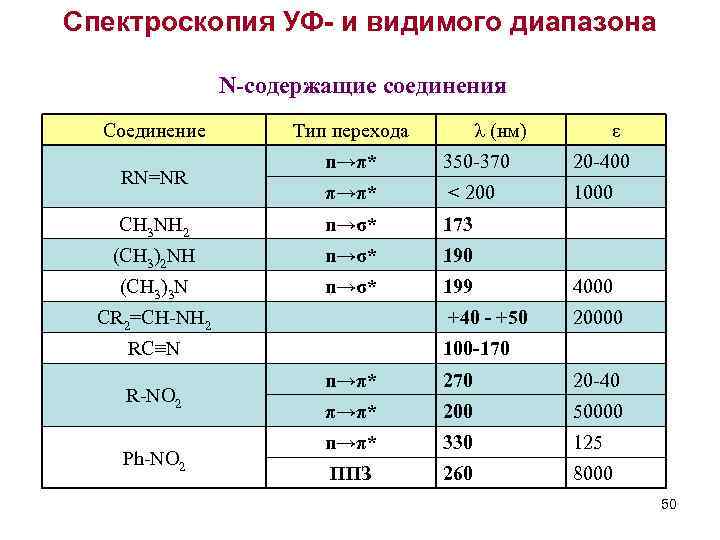 Спектроскопия УФ- и видимого диапазона N-содержащие соединения Соединение Тип перехода λ (нм) ε n→π* 350 -370 20 -400 π→π* < 200 1000 CH 3 NH 2 n→σ* 173 (CH 3)2 NH n→σ* 190 (CH 3)3 N n→σ* 199 4000 +40 - +50 20000 RN=NR CR 2=CH-NH 2 RC≡N R-NO 2 Ph-NO 2 100 -170 n→π* 270 20 -40 π→π* 200 50000 n→π* 330 125 ППЗ 260 8000 50
Спектроскопия УФ- и видимого диапазона N-содержащие соединения Соединение Тип перехода λ (нм) ε n→π* 350 -370 20 -400 π→π* < 200 1000 CH 3 NH 2 n→σ* 173 (CH 3)2 NH n→σ* 190 (CH 3)3 N n→σ* 199 4000 +40 - +50 20000 RN=NR CR 2=CH-NH 2 RC≡N R-NO 2 Ph-NO 2 100 -170 n→π* 270 20 -40 π→π* 200 50000 n→π* 330 125 ППЗ 260 8000 50
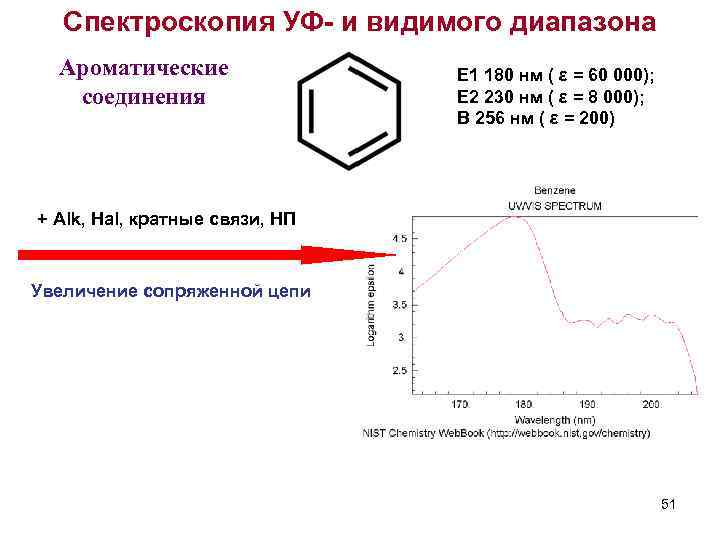 Спектроскопия УФ- и видимого диапазона Ароматические соединения E 1 180 нм ( ε = 60 000); E 2 230 нм ( ε = 8 000); B 256 нм ( ε = 200) + Alk, Hal, кратные связи, НП Увеличение сопряженной цепи 51
Спектроскопия УФ- и видимого диапазона Ароматические соединения E 1 180 нм ( ε = 60 000); E 2 230 нм ( ε = 8 000); B 256 нм ( ε = 200) + Alk, Hal, кратные связи, НП Увеличение сопряженной цепи 51
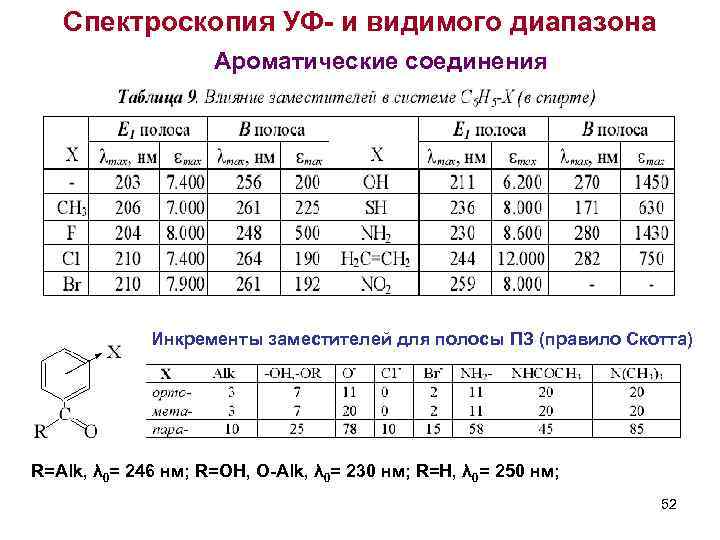 Спектроскопия УФ- и видимого диапазона Ароматические соединения Инкременты заместителей для полосы ПЗ (правило Скотта) R=Alk, λ 0= 246 нм; R=OH, O-Alk, λ 0= 230 нм; R=H, λ 0= 250 нм; 52
Спектроскопия УФ- и видимого диапазона Ароматические соединения Инкременты заместителей для полосы ПЗ (правило Скотта) R=Alk, λ 0= 246 нм; R=OH, O-Alk, λ 0= 230 нм; R=H, λ 0= 250 нм; 52
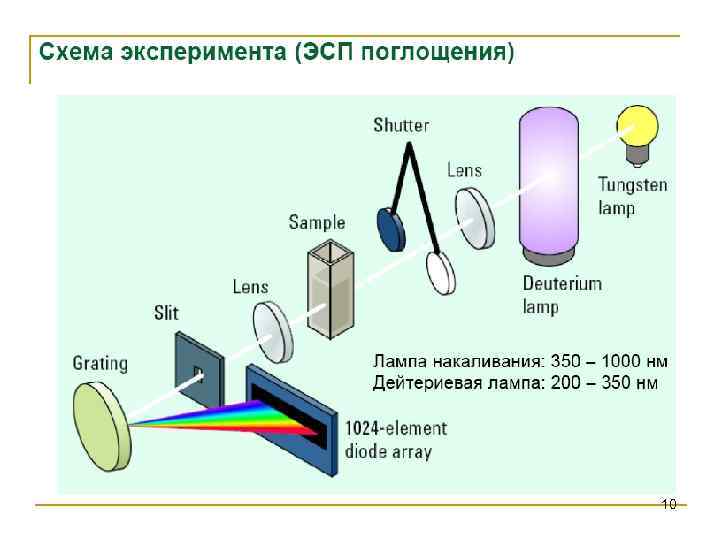
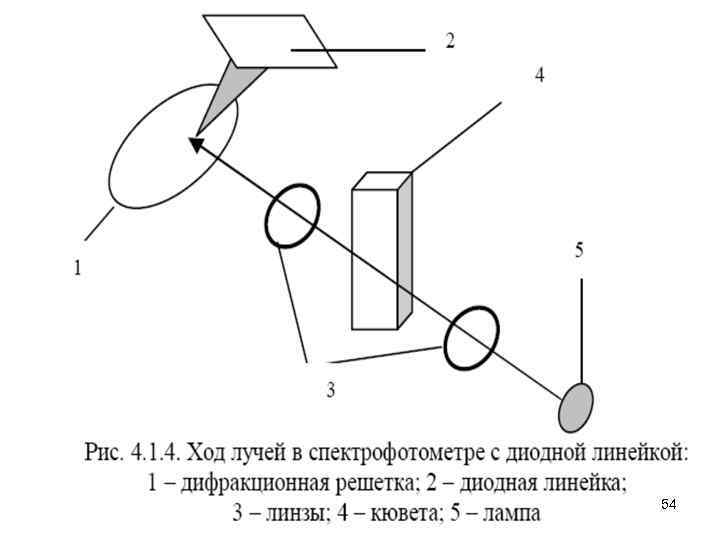
 Аппаратура • Аппаратура в спектроскопии УФ-видимой области вполне соответствует общей блок-схеме. В качестве источников излучения в УФ-области используют дейтериевые, вольфрамовые и галогеновые лампы. Для монохроматизации света можно использовать самое простое устройство − светофильтр. В высококачественных спектрофотометрах преобладают дифракционные решетки. Измерение светопоглощения • Методом спектроскопии в УФ-видимой области изучают, главным образом, жидкие среды. При измерениях в видимой области образцы можно помещать в стеклянные кюветы. В УФ-области стекло обладает собственным поглощением, поэтому там необходимо использовать кюветы из кварца. • В качестве детектора используют ФЭУ, а в некоторых случаях − фотоэлементы. В фотометрах с быстрой регистрацией применяют массивы фотоэлементов или фотодиодов (диодные линейки). Отличие таких приборов от обычных состоит в способе облучения образца и детектора 53 (рис. 4. 1. 4).
Аппаратура • Аппаратура в спектроскопии УФ-видимой области вполне соответствует общей блок-схеме. В качестве источников излучения в УФ-области используют дейтериевые, вольфрамовые и галогеновые лампы. Для монохроматизации света можно использовать самое простое устройство − светофильтр. В высококачественных спектрофотометрах преобладают дифракционные решетки. Измерение светопоглощения • Методом спектроскопии в УФ-видимой области изучают, главным образом, жидкие среды. При измерениях в видимой области образцы можно помещать в стеклянные кюветы. В УФ-области стекло обладает собственным поглощением, поэтому там необходимо использовать кюветы из кварца. • В качестве детектора используют ФЭУ, а в некоторых случаях − фотоэлементы. В фотометрах с быстрой регистрацией применяют массивы фотоэлементов или фотодиодов (диодные линейки). Отличие таких приборов от обычных состоит в способе облучения образца и детектора 53 (рис. 4. 1. 4).
 54
54
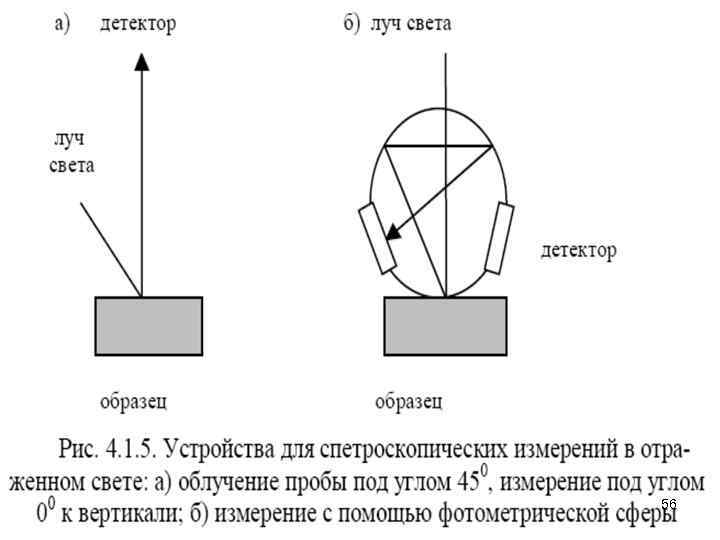
 • Раствор образца облучают полихроматическим светом и лишь затем разлагают его с помощью дифракционной решетки. Полученный световой пучок направляют на детектор − диодную линейку. • При использовании многоканальной регистрации время записи спектра лимитировано только скоростью считывания показаний диодов, а разрешение достигает от 1 до 5 нм. Весь спектр в области 200 -800 нм можно записать за 0, 1 с. Для улучшения отношения сигнал-шум спектр записывают несколько раз и усредняют результаты. Измерения в отраженном свете • При исследовании непрозрачных образцов вместо кюветы используют устройство для измерения отраженного света. На рис. 4. 1. 5 показаны два таких устройства. • В первом случае (а) образец облучают световым потоком под углом 450 к его поверхности, а отраженный свет измеряют в направлении, перпендикулярном поверхности образца. • Во втором случае (б) используют фотометрическую сферу. Здесь световой поток падает на образец перпендикулярно его поверхности, затем многократно отражается во всех направлениях и, наконец, попадает на детектор. • В качестве образца сравнения используют сильно рассеивающий непоглощающий материал, например, порошок 55 сульфата бария или оксида магния.
• Раствор образца облучают полихроматическим светом и лишь затем разлагают его с помощью дифракционной решетки. Полученный световой пучок направляют на детектор − диодную линейку. • При использовании многоканальной регистрации время записи спектра лимитировано только скоростью считывания показаний диодов, а разрешение достигает от 1 до 5 нм. Весь спектр в области 200 -800 нм можно записать за 0, 1 с. Для улучшения отношения сигнал-шум спектр записывают несколько раз и усредняют результаты. Измерения в отраженном свете • При исследовании непрозрачных образцов вместо кюветы используют устройство для измерения отраженного света. На рис. 4. 1. 5 показаны два таких устройства. • В первом случае (а) образец облучают световым потоком под углом 450 к его поверхности, а отраженный свет измеряют в направлении, перпендикулярном поверхности образца. • Во втором случае (б) используют фотометрическую сферу. Здесь световой поток падает на образец перпендикулярно его поверхности, затем многократно отражается во всех направлениях и, наконец, попадает на детектор. • В качестве образца сравнения используют сильно рассеивающий непоглощающий материал, например, порошок 55 сульфата бария или оксида магния.
 56
56
 Количественный анализ 57
Количественный анализ 57
 Спектрофотометрические определения 58
Спектрофотометрические определения 58
 59
59
 60
60
 61
61
 Чувствительность фотометрического анализа • Метод молекулярной абсорбционной спектроскопии применяется главным образом для определения средних и низких содержаний. • Пределы обнаружения зависят от значения молярного коэффициента поглощения фотометрируемого соединения, а также от величин фонового сигнала (сигнала контрольного опыта). Последняя, в свою очередь, определяется чистотой применяемых реагентов и наличием загрязнений, поступающих извне. • При молярном коэффициенте поглощения порядка 40000, величине оптической плотности 0, 010 толщине кюветы 1 см можно, в соответствии с законом Ламберта-Бера, определять концентрации порядка 2· 10 -7 М. Если принять молярную массу определяемого компонента равной 50, то это соответствует массовой концентрации 10 нг/мл. 62
Чувствительность фотометрического анализа • Метод молекулярной абсорбционной спектроскопии применяется главным образом для определения средних и низких содержаний. • Пределы обнаружения зависят от значения молярного коэффициента поглощения фотометрируемого соединения, а также от величин фонового сигнала (сигнала контрольного опыта). Последняя, в свою очередь, определяется чистотой применяемых реагентов и наличием загрязнений, поступающих извне. • При молярном коэффициенте поглощения порядка 40000, величине оптической плотности 0, 010 толщине кюветы 1 см можно, в соответствии с законом Ламберта-Бера, определять концентрации порядка 2· 10 -7 М. Если принять молярную массу определяемого компонента равной 50, то это соответствует массовой концентрации 10 нг/мл. 62
 Селективность фотометрического анализа • По сравнению с ААСА фотометрический метод менее селективен. Существует лишь очень небольшое число специально синтезированных реагентов, селективно взаимодействующих с одним определенным ионом металла. • В то же время есть много способов, позволяющих значительно улучшить селективность фотометрических определений. • Это достигается выбором необходимого значения р. Н, применением маскирующих реагентов, сочетанием фотометрического анализа с методами разделения, например, экстракцией. либо применением специальных математических методов анализа многокомпонентных систем. 63
Селективность фотометрического анализа • По сравнению с ААСА фотометрический метод менее селективен. Существует лишь очень небольшое число специально синтезированных реагентов, селективно взаимодействующих с одним определенным ионом металла. • В то же время есть много способов, позволяющих значительно улучшить селективность фотометрических определений. • Это достигается выбором необходимого значения р. Н, применением маскирующих реагентов, сочетанием фотометрического анализа с методами разделения, например, экстракцией. либо применением специальных математических методов анализа многокомпонентных систем. 63


