оптика-07.ppt
- Количество слайдов: 21
 Лекция 7 Расчет констант равновесий по спектрофотометрическим данным
Лекция 7 Расчет констант равновесий по спектрофотометрическим данным

 Метод основан на изучении зависимости поглощения при постоянной концентрации металла в зависимости от концентрации лиганда. l-s S + [L] = const [M] = const Строится зависимость оптической плотности от концентрации лиганда С(L).
Метод основан на изучении зависимости поглощения при постоянной концентрации металла в зависимости от концентрации лиганда. l-s S + [L] = const [M] = const Строится зависимость оптической плотности от концентрации лиганда С(L).
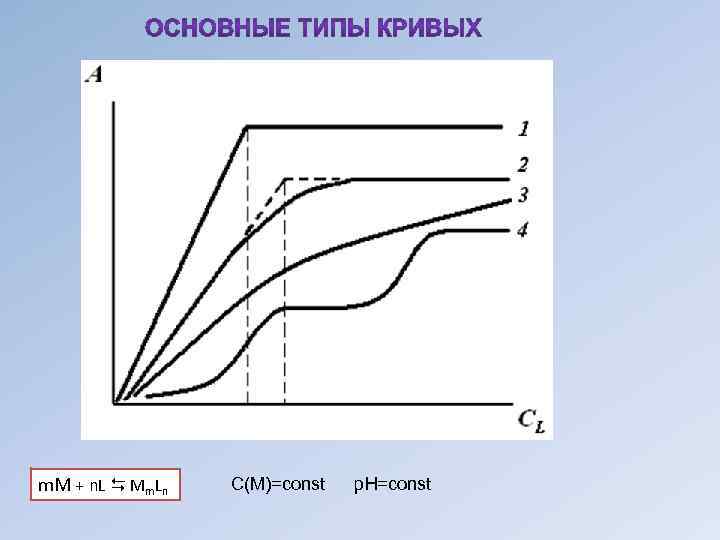 m. M + n. L Mm. Ln С(М)=const р. Н=const
m. M + n. L Mm. Ln С(М)=const р. Н=const
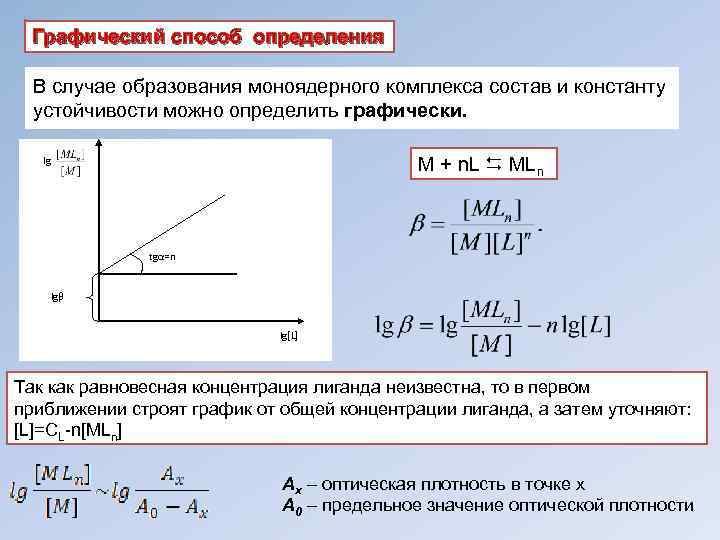 Графический способ определения В случае образования моноядерного комплекса состав и константу устойчивости можно определить графически. M + n. L MLn lg tgα=n lgβ lg[L] Так как равновесная концентрация лиганда неизвестна, то в первом приближении строят график от общей концентрации лиганда, а затем уточняют: [L]=CL-n[MLn] Ах – оптическая плотность в точке х А 0 – предельное значение оптической плотности
Графический способ определения В случае образования моноядерного комплекса состав и константу устойчивости можно определить графически. M + n. L MLn lg tgα=n lgβ lg[L] Так как равновесная концентрация лиганда неизвестна, то в первом приближении строят график от общей концентрации лиганда, а затем уточняют: [L]=CL-n[MLn] Ах – оптическая плотность в точке х А 0 – предельное значение оптической плотности
![M + n. L MLn Как найти равновесные концентрации [ML], [M] и [L]? M + n. L MLn Как найти равновесные концентрации [ML], [M] и [L]?](https://present5.com/presentation/42427608_292635972/image-6.jpg) M + n. L MLn Как найти равновесные концентрации [ML], [M] и [L]? а) горизонтальный участок: [ML]=[M]T Предельное значение А 0 при избытке лиганда отвечает 100% накоплению металлокомплекса, для которого можно найти ɛ: [ ]T – (total) общая или суммарная концентрация в условиях равновесия
M + n. L MLn Как найти равновесные концентрации [ML], [M] и [L]? а) горизонтальный участок: [ML]=[M]T Предельное значение А 0 при избытке лиганда отвечает 100% накоплению металлокомплекса, для которого можно найти ɛ: [ ]T – (total) общая или суммарная концентрация в условиях равновесия
![1. L – анион сильной кислоты [L]≠f(p. H) б) участок роста А: Находим для 1. L – анион сильной кислоты [L]≠f(p. H) б) участок роста А: Находим для](https://present5.com/presentation/42427608_292635972/image-7.jpg) 1. L – анион сильной кислоты [L]≠f(p. H) б) участок роста А: Находим для каждой точки x на подъеме значения [ML]. Затем для каждой точки на подъеме находим [M] и [L]: Получаем набор констант для каждой точки х.
1. L – анион сильной кислоты [L]≠f(p. H) б) участок роста А: Находим для каждой точки x на подъеме значения [ML]. Затем для каждой точки на подъеме находим [M] и [L]: Получаем набор констант для каждой точки х.
![2. L – анион слабой одноосновной кислоты [L]=f(p. H) HL H+ + L=> [HL]x=[HL]T 2. L – анион слабой одноосновной кислоты [L]=f(p. H) HL H+ + L=> [HL]x=[HL]T](https://present5.com/presentation/42427608_292635972/image-8.jpg) 2. L – анион слабой одноосновной кислоты [L]=f(p. H) HL H+ + L=> [HL]x=[HL]T –n[MLn] x [H+]=10 -p. H
2. L – анион слабой одноосновной кислоты [L]=f(p. H) HL H+ + L=> [HL]x=[HL]T –n[MLn] x [H+]=10 -p. H
![3. L – анион слабой двухосновной кислоты [L]=f(p. H) H 2 L H+ + 3. L – анион слабой двухосновной кислоты [L]=f(p. H) H 2 L H+ +](https://present5.com/presentation/42427608_292635972/image-9.jpg) 3. L – анион слабой двухосновной кислоты [L]=f(p. H) H 2 L H+ + HL- => HL- H+ + L 2 - => [H+]=10 -p. H
3. L – анион слабой двухосновной кислоты [L]=f(p. H) H 2 L H+ + HL- => HL- H+ + L 2 - => [H+]=10 -p. H
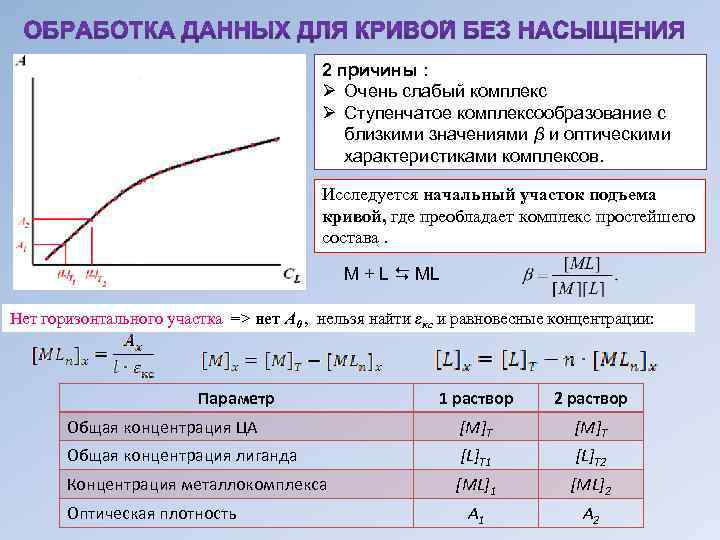 2 причины : Ø Очень слабый комплекс Ø Ступенчатое комплексообразование с близкими значениями β и оптическими характеристиками комплексов. Исследуется начальный участок подъема кривой, где преобладает комплекс простейшего состава. M + L ML Нет горизонтального участка => нет А 0 , нельзя найти εкс и равновесные концентрации: Параметр 1 раствор 2 раствор Общая концентрация ЦА [M]T Общая концентрация лиганда [L]T 1 [L]T 2 Концентрация металлокомплекса [ML]1 [ML]2 А 1 А 2 Оптическая плотность
2 причины : Ø Очень слабый комплекс Ø Ступенчатое комплексообразование с близкими значениями β и оптическими характеристиками комплексов. Исследуется начальный участок подъема кривой, где преобладает комплекс простейшего состава. M + L ML Нет горизонтального участка => нет А 0 , нельзя найти εкс и равновесные концентрации: Параметр 1 раствор 2 раствор Общая концентрация ЦА [M]T Общая концентрация лиганда [L]T 1 [L]T 2 Концентрация металлокомплекса [ML]1 [ML]2 А 1 А 2 Оптическая плотность
 Для двух растворов запишем выражения для константы устойчивости: M + L ML 1 раствор: [M]1=[M]T - [ML]1 [L]1=[L]T 1 - [ML]1 2 раствор: [M]2=[M]T - [ML]2 [L]2=[L]T 2 - [ML]2 β 1=β 2=βx
Для двух растворов запишем выражения для константы устойчивости: M + L ML 1 раствор: [M]1=[M]T - [ML]1 [L]1=[L]T 1 - [ML]1 2 раствор: [M]2=[M]T - [ML]2 [L]2=[L]T 2 - [ML]2 β 1=β 2=βx
![Выразим [ML]1, считая для упрощения расчетов [L]≈ [L]T, то есть [L]1=[L]T 1 - [ML]1≈ Выразим [ML]1, считая для упрощения расчетов [L]≈ [L]T, то есть [L]1=[L]T 1 - [ML]1≈](https://present5.com/presentation/42427608_292635972/image-12.jpg) Выразим [ML]1, считая для упрощения расчетов [L]≈ [L]T, то есть [L]1=[L]T 1 - [ML]1≈ [L]T 1 и [L]2=[L]T 2 - [ML]2≈ [L]T 2 Умножим числитель и знаменатель на р.
Выразим [ML]1, считая для упрощения расчетов [L]≈ [L]T, то есть [L]1=[L]T 1 - [ML]1≈ [L]T 1 и [L]2=[L]T 2 - [ML]2≈ [L]T 2 Умножим числитель и знаменатель на р.
![1. Зная [ML], можно найти εКС: 2. Зная [ML]1, находим [ML]2=p • [ML]1 1. Зная [ML], можно найти εКС: 2. Зная [ML]1, находим [ML]2=p • [ML]1](https://present5.com/presentation/42427608_292635972/image-13.jpg) 1. Зная [ML], можно найти εКС: 2. Зная [ML]1, находим [ML]2=p • [ML]1 и вычисляем εКС: 3. Аналогичным способом вычисляем для других точек [ML]x и сравниваем найденные εКС – совпадение εКС в разных точках свидетельствует о верности выбранной модели комплексообразования : M + L ML.
1. Зная [ML], можно найти εКС: 2. Зная [ML]1, находим [ML]2=p • [ML]1 и вычисляем εКС: 3. Аналогичным способом вычисляем для других точек [ML]x и сравниваем найденные εКС – совпадение εКС в разных точках свидетельствует о верности выбранной модели комплексообразования : M + L ML.
![4. Зная для каждой точки х равновесную концентрацию комплекса [ML]x , находим равновесные концентрации 4. Зная для каждой точки х равновесную концентрацию комплекса [ML]x , находим равновесные концентрации](https://present5.com/presentation/42427608_292635972/image-14.jpg) 4. Зная для каждой точки х равновесную концентрацию комплекса [ML]x , находим равновесные концентрации металла и лиганда : n=1 5. Вычисляем константу устойчивости для каждой точки x :
4. Зная для каждой точки х равновесную концентрацию комплекса [ML]x , находим равновесные концентрации металла и лиганда : n=1 5. Вычисляем константу устойчивости для каждой точки x :
 Метод сдвига равновесий можно использовать для определения: ü Состава металлокомплексов ü Устойчивости металлокомплексов Метод сдвига равновесий нельзя использовать для определения констант устойчивости : Ø Очень прочных комплексов (lgβ>10) Ø При ступенчатом комплексообразовании с близкими β (нужно учесть промежуточное КЧ N, n>N>1) - используют математическую обработку по программе CPESSP.
Метод сдвига равновесий можно использовать для определения: ü Состава металлокомплексов ü Устойчивости металлокомплексов Метод сдвига равновесий нельзя использовать для определения констант устойчивости : Ø Очень прочных комплексов (lgβ>10) Ø При ступенчатом комплексообразовании с близкими β (нужно учесть промежуточное КЧ N, n>N>1) - используют математическую обработку по программе CPESSP.
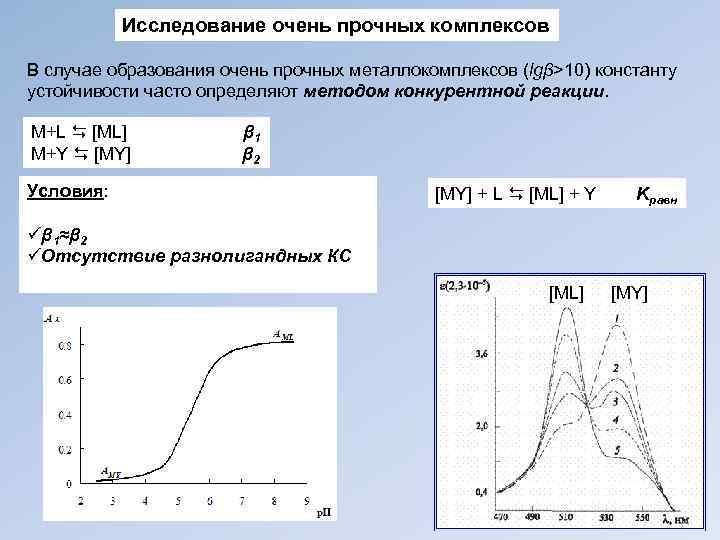 Исследование очень прочных комплексов В случае образования очень прочных металлокомплексов (lgβ>10) константу устойчивости часто определяют методом конкурентной реакции. М+L [ML] β 1 М+Y [MY] β 2 Условия: [MY] + L [ML] + Y Kравн üβ 1≈β 2 üОтсутствие разнолигандных КС [ML] [MY]
Исследование очень прочных комплексов В случае образования очень прочных металлокомплексов (lgβ>10) константу устойчивости часто определяют методом конкурентной реакции. М+L [ML] β 1 М+Y [MY] β 2 Условия: [MY] + L [ML] + Y Kравн üβ 1≈β 2 üОтсутствие разнолигандных КС [ML] [MY]
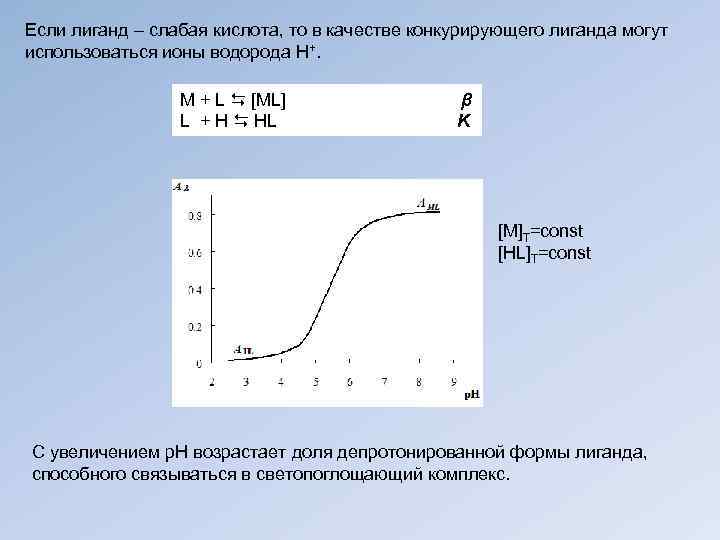 Если лиганд – слабая кислота, то в качестве конкурирующего лиганда могут использоваться ионы водорода Н+. М + L [ML] β L + H HL K [M]T=const [HL]T=const С увеличением р. Н возрастает доля депротонированной формы лиганда, способного связываться в светопоглощающий комплекс.
Если лиганд – слабая кислота, то в качестве конкурирующего лиганда могут использоваться ионы водорода Н+. М + L [ML] β L + H HL K [M]T=const [HL]T=const С увеличением р. Н возрастает доля депротонированной формы лиганда, способного связываться в светопоглощающий комплекс.

 Вторичные концентрационные переменные Для определения константы устойчивости при последовательном образовании моноядерных комплексов из двух частиц (металл и лиганд) разработан ряд алгебраических приемов. Они основаны на применении так называемых вторичных концентрационных переменных и разработаны первоначально для ускорения обработки данных вручную. Но эти приемы значительно оптимизируют и машинные расчеты. Вторичные концентрационные переменные связаны с равновесными концентрациями [M] и [L] и, следовательно, с величинами констант устойчивости β.
Вторичные концентрационные переменные Для определения константы устойчивости при последовательном образовании моноядерных комплексов из двух частиц (металл и лиганд) разработан ряд алгебраических приемов. Они основаны на применении так называемых вторичных концентрационных переменных и разработаны первоначально для ускорения обработки данных вручную. Но эти приемы значительно оптимизируют и машинные расчеты. Вторичные концентрационные переменные связаны с равновесными концентрациями [M] и [L] и, следовательно, с величинами констант устойчивости β.
 M T – общая концентрация металла 1. Функция Ледена F 2. Степень образования С С = MLC / M T С представляет собой мольную долю компонента [MLC]. Если c=0, то нет комплексообразования (α 0=1). 3. Функция Фронеуса, закомплексованность, функция закомплексованности Ф Ф- отношение общей концентрации металла к равновесной
M T – общая концентрация металла 1. Функция Ледена F 2. Степень образования С С = MLC / M T С представляет собой мольную долю компонента [MLC]. Если c=0, то нет комплексообразования (α 0=1). 3. Функция Фронеуса, закомплексованность, функция закомплексованности Ф Ф- отношение общей концентрации металла к равновесной
 4. Функция образования, функция Бьеррума - среднее число лигандов, приходящееся на 1 ион металла (в отличие от n, может быть дробным).
4. Функция образования, функция Бьеррума - среднее число лигандов, приходящееся на 1 ион металла (в отличие от n, может быть дробным).


