2010 Лекция 7 ОВР.ppt
- Количество слайдов: 31
 ЛЕКЦИЯ 7. ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ И ЭЛЕКТРОХИМИЯ
ЛЕКЦИЯ 7. ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ И ЭЛЕКТРОХИМИЯ
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Степень окисления атома любого элемента в свободном состоянии равна нулю (Н 2, О 2, Fe, Na). • Степень окисления любого простого одноатомного иона равна его заряду: Na+ = +1, Ca 2+ = +2, Cl- = -1, H+ = +1. • H 2 O, NH 3, CH 4, H+ = +1; Na. H, H- = -1. • H 2 O, H 2 SO 4, NO, CO 2, CН 3 COOH, O-2 = -2; • H 2 O 2, O 1 - = -1; OF 2, O+2 = +2. •
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Степень окисления атома любого элемента в свободном состоянии равна нулю (Н 2, О 2, Fe, Na). • Степень окисления любого простого одноатомного иона равна его заряду: Na+ = +1, Ca 2+ = +2, Cl- = -1, H+ = +1. • H 2 O, NH 3, CH 4, H+ = +1; Na. H, H- = -1. • H 2 O, H 2 SO 4, NO, CO 2, CН 3 COOH, O-2 = -2; • H 2 O 2, O 1 - = -1; OF 2, O+2 = +2. •
 ОКИСЛЕНИЕМ называется процесс повышения валентности (степени окисления) одного или более из элементов, входящих в молекулу или ион, а ВОССТАНОВЛЕНИЕМ - ее понижение. Вещества или ионы, вызывающие окисление другого участника реакции, т. е. отнимающие его электроны, называются окислителями, а вызывающие восстановление партнера восстановителями.
ОКИСЛЕНИЕМ называется процесс повышения валентности (степени окисления) одного или более из элементов, входящих в молекулу или ион, а ВОССТАНОВЛЕНИЕМ - ее понижение. Вещества или ионы, вызывающие окисление другого участника реакции, т. е. отнимающие его электроны, называются окислителями, а вызывающие восстановление партнера восстановителями.
 Важнейшие окислители – галогены, КMn. O 4, К 2 Mn. O 4, K 2 Cr 2 O 7, O 2, O 3, H 2 O 2, (NH 4)2 S 2 O 8, ионы Au 3+, Ag+, гипохлориты, хлораты, и др. Важнейшие восстановители – металлы, водород, уголь, СО, H 2 S, SO 2, HI, HBr, HCl, Sn. Cl 2, Fe. SO 4, Mn. SO 4, Cr. Cl 3, KNO 2, NH 3, гидразин N 2 H 4, NO, H 3 PO 4, альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза, и др.
Важнейшие окислители – галогены, КMn. O 4, К 2 Mn. O 4, K 2 Cr 2 O 7, O 2, O 3, H 2 O 2, (NH 4)2 S 2 O 8, ионы Au 3+, Ag+, гипохлориты, хлораты, и др. Важнейшие восстановители – металлы, водород, уголь, СО, H 2 S, SO 2, HI, HBr, HCl, Sn. Cl 2, Fe. SO 4, Mn. SO 4, Cr. Cl 3, KNO 2, NH 3, гидразин N 2 H 4, NO, H 3 PO 4, альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза, и др.
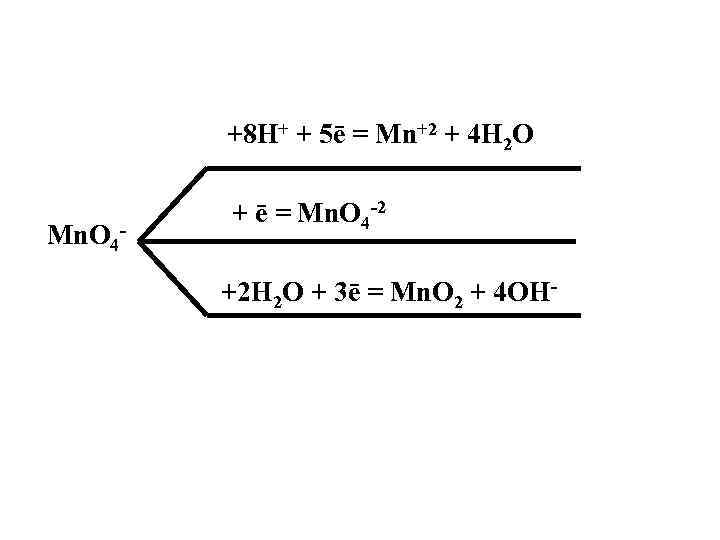 +8 H+ + 5ē = Mn+2 + 4 H 2 O Mn. O 4 - + ē = Mn. O 4 -2 +2 H 2 O + 3ē = Mn. O 2 + 4 OH-
+8 H+ + 5ē = Mn+2 + 4 H 2 O Mn. O 4 - + ē = Mn. O 4 -2 +2 H 2 O + 3ē = Mn. O 2 + 4 OH-
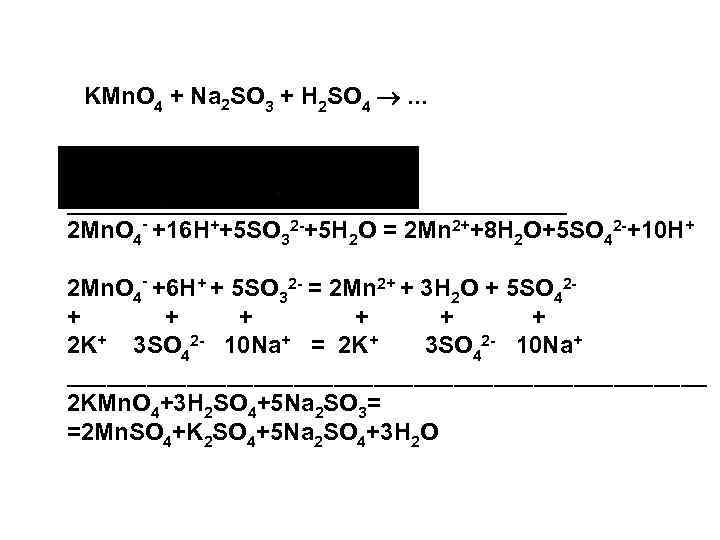 KMn. O 4 + Na 2 SO 3 + H 2 SO 4 . . . _________________________ 2 Mn. O 4 - +16 H++5 SO 32 -+5 H 2 O = 2 Mn 2++8 H 2 O+5 SO 42 -+10 H+ 2 Mn. O 4 - +6 H+ + 5 SO 32 - = 2 Mn 2+ + 3 H 2 O + 5 SO 42+ + + 2 K+ 3 SO 42 - 10 Na+ = 2 K+ 3 SO 42 - 10 Na+ ________________________ 2 KMn. O 4+3 H 2 SO 4+5 Na 2 SO 3= =2 Mn. SO 4+K 2 SO 4+5 Na 2 SO 4+3 H 2 O
KMn. O 4 + Na 2 SO 3 + H 2 SO 4 . . . _________________________ 2 Mn. O 4 - +16 H++5 SO 32 -+5 H 2 O = 2 Mn 2++8 H 2 O+5 SO 42 -+10 H+ 2 Mn. O 4 - +6 H+ + 5 SO 32 - = 2 Mn 2+ + 3 H 2 O + 5 SO 42+ + + 2 K+ 3 SO 42 - 10 Na+ = 2 K+ 3 SO 42 - 10 Na+ ________________________ 2 KMn. O 4+3 H 2 SO 4+5 Na 2 SO 3= =2 Mn. SO 4+K 2 SO 4+5 Na 2 SO 4+3 H 2 O
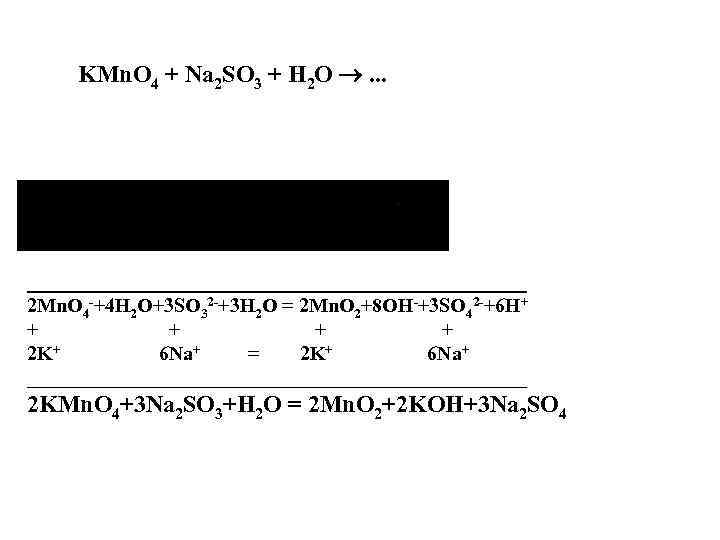 KMn. O 4 + Na 2 SO 3 + H 2 O . . . _________________________ 2 Mn. O 4 -+4 H 2 O+3 SO 32 -+3 H 2 O = 2 Mn. O 2+8 OH-+3 SO 42 -+6 H+ + + 2 K+ 6 Na+ = 2 K+ 6 Na+ _________________________ 2 KMn. O 4+3 Na 2 SO 3+H 2 O = 2 Mn. O 2+2 KOH+3 Na 2 SO 4
KMn. O 4 + Na 2 SO 3 + H 2 O . . . _________________________ 2 Mn. O 4 -+4 H 2 O+3 SO 32 -+3 H 2 O = 2 Mn. O 2+8 OH-+3 SO 42 -+6 H+ + + 2 K+ 6 Na+ = 2 K+ 6 Na+ _________________________ 2 KMn. O 4+3 Na 2 SO 3+H 2 O = 2 Mn. O 2+2 KOH+3 Na 2 SO 4
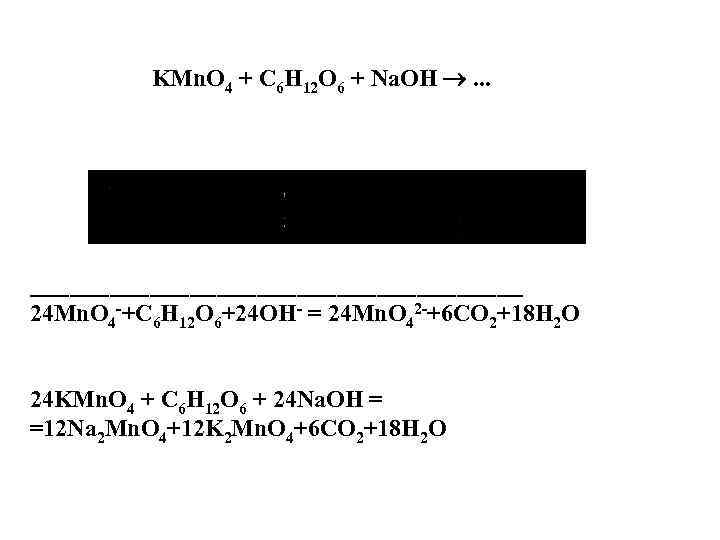 KMn. O 4 + C 6 H 12 O 6 + Na. OH . . . ___________________ 24 Mn. O 4 -+C 6 H 12 O 6+24 OH- = 24 Mn. O 42 -+6 CO 2+18 H 2 O 24 KMn. O 4 + C 6 H 12 O 6 + 24 Na. OH = =12 Na 2 Mn. O 4+12 K 2 Mn. O 4+6 CO 2+18 H 2 O
KMn. O 4 + C 6 H 12 O 6 + Na. OH . . . ___________________ 24 Mn. O 4 -+C 6 H 12 O 6+24 OH- = 24 Mn. O 42 -+6 CO 2+18 H 2 O 24 KMn. O 4 + C 6 H 12 O 6 + 24 Na. OH = =12 Na 2 Mn. O 4+12 K 2 Mn. O 4+6 CO 2+18 H 2 O
![+14 H++6ē=2 Cr 3++7 H 2 O; [Cr(H 2 O)6]3+ Cr 2 O 72 +14 H++6ē=2 Cr 3++7 H 2 O; [Cr(H 2 O)6]3+ Cr 2 O 72](https://present5.com/presentation/14143876_40805767/image-9.jpg) +14 H++6ē=2 Cr 3++7 H 2 O; [Cr(H 2 O)6]3+ Cr 2 O 72 - +2 OH-=2 Cr. O 42 -+H 2 O; Cr. O 42 -+4 H 2 O+3ē=[Cr(OH)4]-+4 OH- +7 H 2 O+6ē=2 Cr(OH)3+8 OH-
+14 H++6ē=2 Cr 3++7 H 2 O; [Cr(H 2 O)6]3+ Cr 2 O 72 - +2 OH-=2 Cr. O 42 -+H 2 O; Cr. O 42 -+4 H 2 O+3ē=[Cr(OH)4]-+4 OH- +7 H 2 O+6ē=2 Cr(OH)3+8 OH-
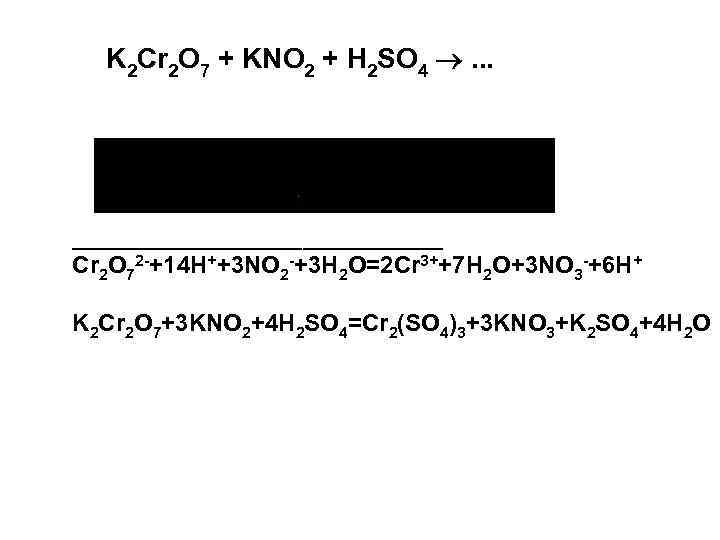 K 2 Cr 2 O 7 + KNO 2 + H 2 SO 4 . . . ___________________ Cr 2 O 72 -+14 H++3 NO 2 -+3 H 2 O=2 Cr 3++7 H 2 O+3 NO 3 -+6 H+ K 2 Cr 2 O 7+3 KNO 2+4 H 2 SO 4=Cr 2(SO 4)3+3 KNO 3+K 2 SO 4+4 H 2 O
K 2 Cr 2 O 7 + KNO 2 + H 2 SO 4 . . . ___________________ Cr 2 O 72 -+14 H++3 NO 2 -+3 H 2 O=2 Cr 3++7 H 2 O+3 NO 3 -+6 H+ K 2 Cr 2 O 7+3 KNO 2+4 H 2 SO 4=Cr 2(SO 4)3+3 KNO 3+K 2 SO 4+4 H 2 O
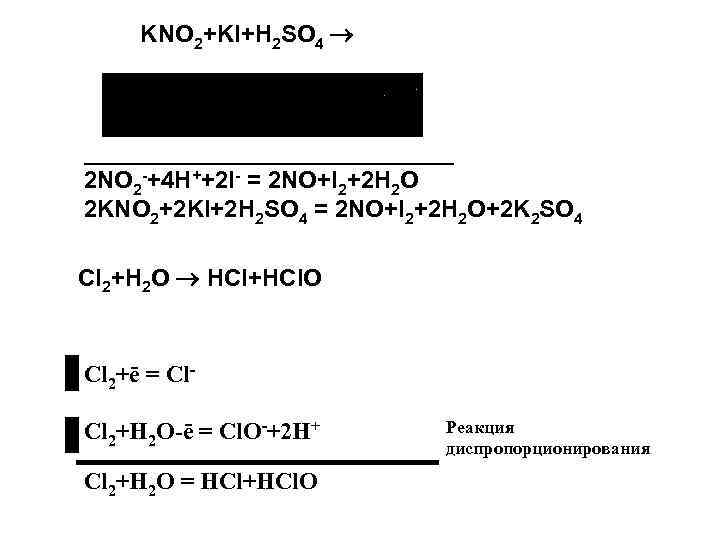 KNO 2+KI+H 2 SO 4 ___________________ 2 NO 2 -+4 H++2 I- = 2 NO+I 2+2 H 2 O 2 KNO 2+2 KI+2 H 2 SO 4 = 2 NO+I 2+2 H 2 O+2 K 2 SO 4 Cl 2+H 2 O HCl+HCl. O Cl 2+ē = Cl. Cl 2+H 2 O-ē = Cl. O-+2 H+ Cl 2+H 2 O = HCl+HCl. O Реакция диспропорционирования
KNO 2+KI+H 2 SO 4 ___________________ 2 NO 2 -+4 H++2 I- = 2 NO+I 2+2 H 2 O 2 KNO 2+2 KI+2 H 2 SO 4 = 2 NO+I 2+2 H 2 O+2 K 2 SO 4 Cl 2+H 2 O HCl+HCl. O Cl 2+ē = Cl. Cl 2+H 2 O-ē = Cl. O-+2 H+ Cl 2+H 2 O = HCl+HCl. O Реакция диспропорционирования
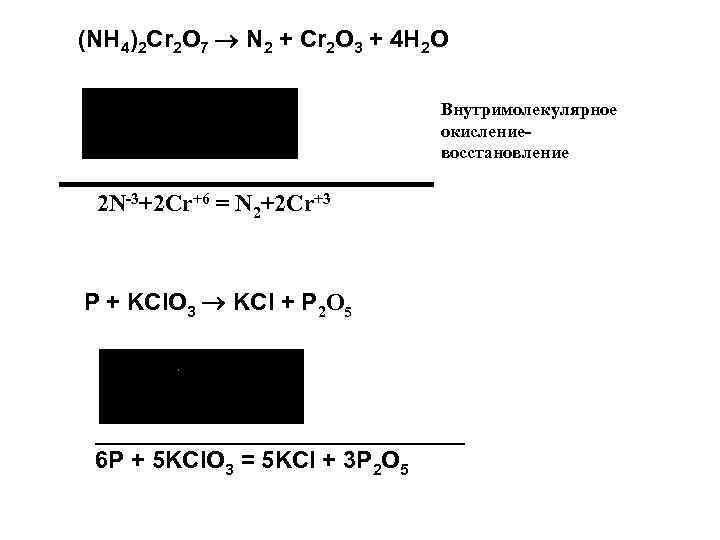 (NH 4)2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O Внутримолекулярное окислениевосстановление 2 N-3+2 Cr+6 = N 2+2 Cr+3 P + KCl. O 3 KCl + P 2 O 5 ___________________ 6 P + 5 KCl. O 3 = 5 KCl + 3 P 2 O 5
(NH 4)2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O Внутримолекулярное окислениевосстановление 2 N-3+2 Cr+6 = N 2+2 Cr+3 P + KCl. O 3 KCl + P 2 O 5 ___________________ 6 P + 5 KCl. O 3 = 5 KCl + 3 P 2 O 5
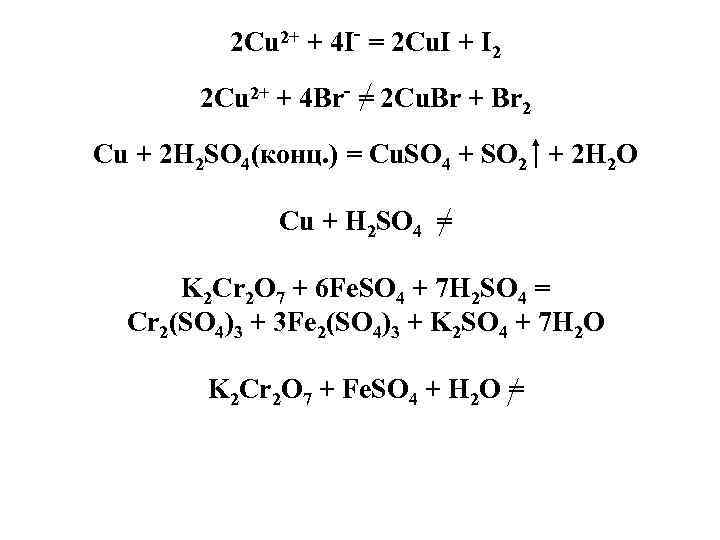 2 Cu 2+ + 4 I- = 2 Cu. I + I 2 2 Cu 2+ + 4 Br- = 2 Cu. Br + Br 2 Cu + 2 H 2 SO 4(конц. ) = Cu. SO 4 + SO 2 + 2 H 2 O Cu + H 2 SO 4 = K 2 Cr 2 O 7 + 6 Fe. SO 4 + 7 H 2 SO 4 = Cr 2(SO 4)3 + 3 Fe 2(SO 4)3 + K 2 SO 4 + 7 H 2 O K 2 Cr 2 O 7 + Fe. SO 4 + H 2 O =
2 Cu 2+ + 4 I- = 2 Cu. I + I 2 2 Cu 2+ + 4 Br- = 2 Cu. Br + Br 2 Cu + 2 H 2 SO 4(конц. ) = Cu. SO 4 + SO 2 + 2 H 2 O Cu + H 2 SO 4 = K 2 Cr 2 O 7 + 6 Fe. SO 4 + 7 H 2 SO 4 = Cr 2(SO 4)3 + 3 Fe 2(SO 4)3 + K 2 SO 4 + 7 H 2 O K 2 Cr 2 O 7 + Fe. SO 4 + H 2 O =
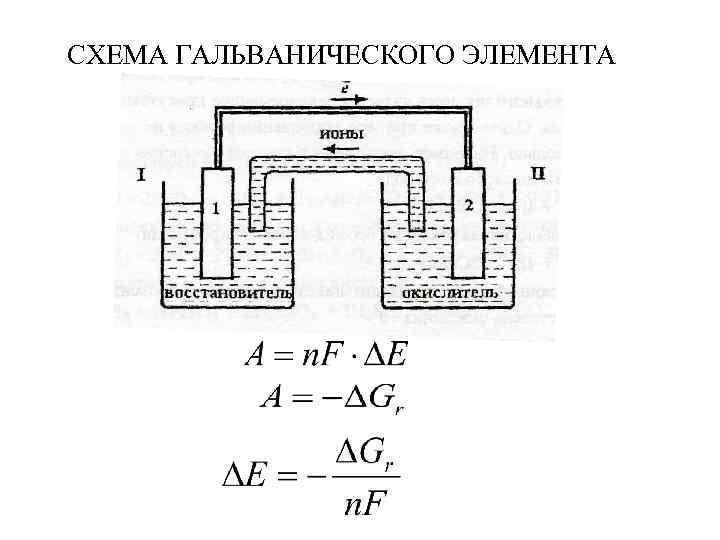 СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
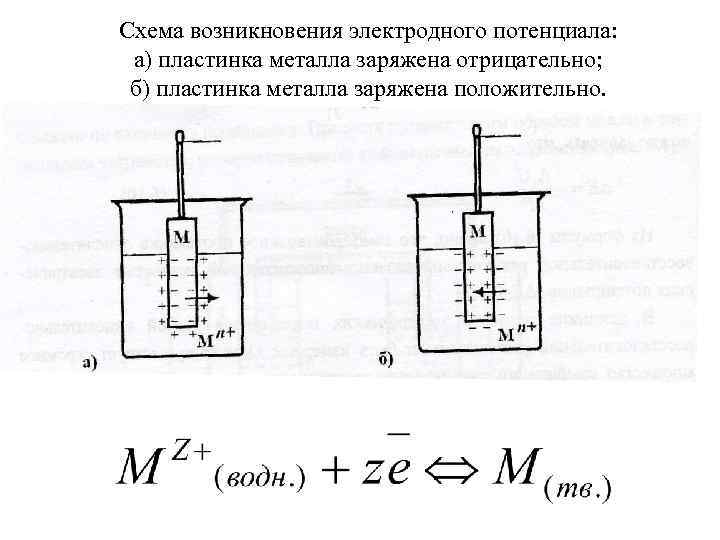 Схема возникновения электродного потенциала: а) пластинка металла заряжена отрицательно; б) пластинка металла заряжена положительно.
Схема возникновения электродного потенциала: а) пластинка металла заряжена отрицательно; б) пластинка металла заряжена положительно.
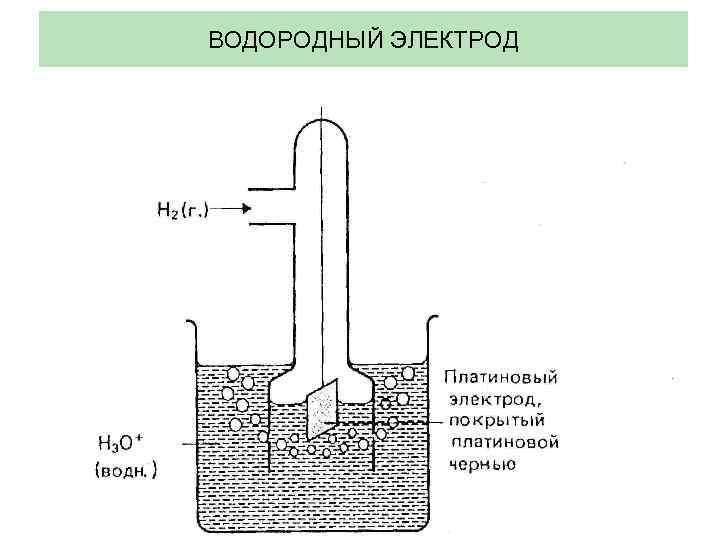 ВОДОРОДНЫЙ ЭЛЕКТРОД
ВОДОРОДНЫЙ ЭЛЕКТРОД
 Если в системе Мz+ aq. / M(тв. ) активность ионов Мz+ равна единице и измерения проводятся при 250 С, полученная величина ЭП будет представлять собой важную электрохимическую константу – стандартный электродный потенциал Е 0. Pt|H 2(г. ), 1 атм. H 3 O+(вод. ), 1 моль/дм 3||Мz+(вод. )|1 моль/дм 3|| М(тв. )
Если в системе Мz+ aq. / M(тв. ) активность ионов Мz+ равна единице и измерения проводятся при 250 С, полученная величина ЭП будет представлять собой важную электрохимическую константу – стандартный электродный потенциал Е 0. Pt|H 2(г. ), 1 атм. H 3 O+(вод. ), 1 моль/дм 3||Мz+(вод. )|1 моль/дм 3|| М(тв. )
 Полуэлемент с более положительным электродным потенциалом всегда помещается в правой части схематической записи гальванического элемента. Э. Д. С. химического источника тока определяется выражением: Еист. = Епр. - Ел. Zn(тв. )|Zn(водн. )2+||Ni(водн. )2+|Ni(тв. ); Zn(тв. )+Ni(водн. )2+ Zn(водн. )2++Ni(тв. )
Полуэлемент с более положительным электродным потенциалом всегда помещается в правой части схематической записи гальванического элемента. Э. Д. С. химического источника тока определяется выражением: Еист. = Епр. - Ел. Zn(тв. )|Zn(водн. )2+||Ni(водн. )2+|Ni(тв. ); Zn(тв. )+Ni(водн. )2+ Zn(водн. )2++Ni(тв. )
 Стандартные окислительновосстановительные потенциалы. Li+(водн. )+ē Li(тв. ) К+(водн. )+ē K(тв. ) Ca 2+(водн. )+2ē Ca(тв. ) Na+(водн. )+ē Na(тв. ) Mg 2+(водн. )+2ē Mg(тв. ) Al 3+(водн. )+3ē Al(тв. ) Zn 2+(водн. )+2ē Zn(тв. ) Sn 2+(водн. )+2ē Sn(тв. ) Pb 2+(водн. )+2ē Pb(тв. ) 2 H+(водн. )+2ē H 2(г. ) Cu 2+(водн. )+2ē Cu(тв. ) I 2(к. )+2ē 2 I-(вод. ) Fe 2+(водн. )+2ē Fe(тв. ) Ag+(водн. )+ē Ag(тв. ) Br 2(ж. )+2ē 2 Br-(водн. ) Сl 2(г. )+2ē 2 Сl-(водн. ) F 2(г. )+2ē 2 F-(водн. ) -3, 04 -2, 92 -2, 87 -2, 71 -2, 38 -1, 66 -0, 76 -0, 14 -0, 13 0 +0, 34 +0, 54 +0, 77 +0, 80 +1, 07 +1, 36 +2, 87
Стандартные окислительновосстановительные потенциалы. Li+(водн. )+ē Li(тв. ) К+(водн. )+ē K(тв. ) Ca 2+(водн. )+2ē Ca(тв. ) Na+(водн. )+ē Na(тв. ) Mg 2+(водн. )+2ē Mg(тв. ) Al 3+(водн. )+3ē Al(тв. ) Zn 2+(водн. )+2ē Zn(тв. ) Sn 2+(водн. )+2ē Sn(тв. ) Pb 2+(водн. )+2ē Pb(тв. ) 2 H+(водн. )+2ē H 2(г. ) Cu 2+(водн. )+2ē Cu(тв. ) I 2(к. )+2ē 2 I-(вод. ) Fe 2+(водн. )+2ē Fe(тв. ) Ag+(водн. )+ē Ag(тв. ) Br 2(ж. )+2ē 2 Br-(водн. ) Сl 2(г. )+2ē 2 Сl-(водн. ) F 2(г. )+2ē 2 F-(водн. ) -3, 04 -2, 92 -2, 87 -2, 71 -2, 38 -1, 66 -0, 76 -0, 14 -0, 13 0 +0, 34 +0, 54 +0, 77 +0, 80 +1, 07 +1, 36 +2, 87
 Величины стандартных электродных потенциалов служат обоснованием ряда напряжений металлов, который имеет вид: K, Na, Ba, Ca, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, |H|, Cu, Sb, Bi, Hg, Ag, Pt.
Величины стандартных электродных потенциалов служат обоснованием ряда напряжений металлов, который имеет вид: K, Na, Ba, Ca, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, |H|, Cu, Sb, Bi, Hg, Ag, Pt.
 ПРАВИЛА БЕКЕТОВА 1. Чем левее в ряду напряжений находится металл, тем большей восстановительной способностью он обладает. 2. Каждый металл ряда, не разлагающий воду, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. Pb(CH 3 COO)2+Zn Zn(CH 3 COO)2+Pb 3. Все металлы, стоящие левее водорода, вытесняют (восстанавливают) его из разбавленных кислот, а стоящие правее - не вытесняют водород.
ПРАВИЛА БЕКЕТОВА 1. Чем левее в ряду напряжений находится металл, тем большей восстановительной способностью он обладает. 2. Каждый металл ряда, не разлагающий воду, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. Pb(CH 3 COO)2+Zn Zn(CH 3 COO)2+Pb 3. Все металлы, стоящие левее водорода, вытесняют (восстанавливают) его из разбавленных кислот, а стоящие правее - не вытесняют водород.
 Уравнение Нернста Где Еm – электродный потенциал металла; а– активность ионов; E 0 m- стандартный электродный потенциал; R- универсальная газовая постоянная, равная 8, 31 Дж/град. *моль; Т – температура, К; n – валентность; F – константа Фарадея, равная 96494 Кл.
Уравнение Нернста Где Еm – электродный потенциал металла; а– активность ионов; E 0 m- стандартный электродный потенциал; R- универсальная газовая постоянная, равная 8, 31 Дж/град. *моль; Т – температура, К; n – валентность; F – константа Фарадея, равная 96494 Кл.
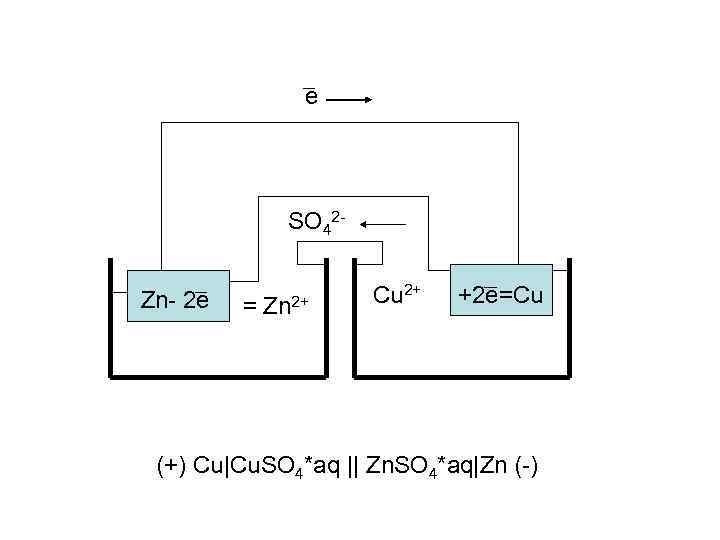 e SO 42 Zn- 2 e = Zn 2+ Cu 2+ +2 e=Cu (+) Cu|Cu. SO 4*aq || Zn. SO 4*aq|Zn (-)
e SO 42 Zn- 2 e = Zn 2+ Cu 2+ +2 e=Cu (+) Cu|Cu. SO 4*aq || Zn. SO 4*aq|Zn (-)
 Zn – 2 e = Zn 2+ Cu 2+ + 2 e = Cu _________ Zn + Cu 2+ = Zn 2+ + Cu DE = 0, 34 – (-0, 76) = +1, 1 B В момент равновесия:
Zn – 2 e = Zn 2+ Cu 2+ + 2 e = Cu _________ Zn + Cu 2+ = Zn 2+ + Cu DE = 0, 34 – (-0, 76) = +1, 1 B В момент равновесия:
 2 KMn. O 4 + 5 KNO 2 + 3 H 2 SO 4 = 5 KNO 3 + 2 KMn. O 4 + K 2 SO 4 + 3 H 2 O NO 3 - + 2 H+ + 2 e = NO 2 - + H 2 O E 0 = +0, 94 B 5 Mn. O 4 - + 8 H+ + 5 e = Mn 2+ + 4 H 2 O 2 NO 2 - + H 2 O – 2 e = NO 3 - + 2 H+ E 0 = 1, 51 B E 0 = -0, 94 B E 0 = 1, 51 В E 0 = - 0, 94 B 5 NO 2 - + 2 Mn. O 4 -+6 H+ = 5 NO 3 -+2 Mn 2++3 H 2 O E 0 = 0, 57 B
2 KMn. O 4 + 5 KNO 2 + 3 H 2 SO 4 = 5 KNO 3 + 2 KMn. O 4 + K 2 SO 4 + 3 H 2 O NO 3 - + 2 H+ + 2 e = NO 2 - + H 2 O E 0 = +0, 94 B 5 Mn. O 4 - + 8 H+ + 5 e = Mn 2+ + 4 H 2 O 2 NO 2 - + H 2 O – 2 e = NO 3 - + 2 H+ E 0 = 1, 51 B E 0 = -0, 94 B E 0 = 1, 51 В E 0 = - 0, 94 B 5 NO 2 - + 2 Mn. O 4 -+6 H+ = 5 NO 3 -+2 Mn 2++3 H 2 O E 0 = 0, 57 B
 Na. Cl + I 2 = ? I 2 + 2ē = 2 I- E 0 = 0, 54 B Cl 2 + 2ē = 2 Cl- E 0 = 1, 36 B 2 Cl- - 2ē = Cl 2 I 2 + 2ē = 2 I 2 Cl- + I 2 = Cl 2 + 2 IПроцесс не идет E 0 = -1, 36 B E 0 = 0, 54 B DE 0 = -0, 82 B DE 0 < 0
Na. Cl + I 2 = ? I 2 + 2ē = 2 I- E 0 = 0, 54 B Cl 2 + 2ē = 2 Cl- E 0 = 1, 36 B 2 Cl- - 2ē = Cl 2 I 2 + 2ē = 2 I 2 Cl- + I 2 = Cl 2 + 2 IПроцесс не идет E 0 = -1, 36 B E 0 = 0, 54 B DE 0 = -0, 82 B DE 0 < 0
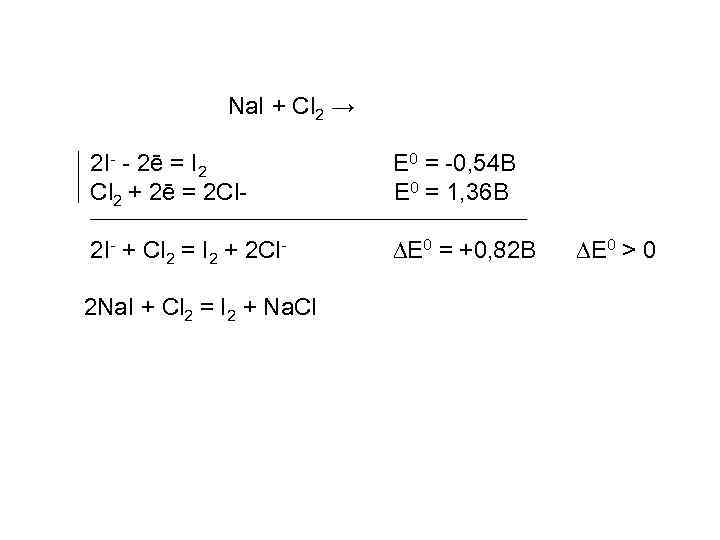 Na. I + Cl 2 → 2 I- - 2ē = I 2 Cl 2 + 2ē = 2 Cl- E 0 = -0, 54 B E 0 = 1, 36 B 2 I- + Cl 2 = I 2 + 2 Cl- DE 0 = +0, 82 B 2 Na. I + Cl 2 = I 2 + Na. Cl DE 0 > 0
Na. I + Cl 2 → 2 I- - 2ē = I 2 Cl 2 + 2ē = 2 Cl- E 0 = -0, 54 B E 0 = 1, 36 B 2 I- + Cl 2 = I 2 + 2 Cl- DE 0 = +0, 82 B 2 Na. I + Cl 2 = I 2 + Na. Cl DE 0 > 0
 ЭЛЕКТРОЛИЗ • Это разложение веществ с помощью электричества. • На аноде (+) всегда осуществляется окислительная полуреакция – анионы или молекулы воды теряют электроны и разряжаются. • На катоде (-) всегда осуществляется восстановительная полуреакция – катионы или молекулы воды приобретают электроны и разряжаются.
ЭЛЕКТРОЛИЗ • Это разложение веществ с помощью электричества. • На аноде (+) всегда осуществляется окислительная полуреакция – анионы или молекулы воды теряют электроны и разряжаются. • На катоде (-) всегда осуществляется восстановительная полуреакция – катионы или молекулы воды приобретают электроны и разряжаются.
 1. Электролиз расплава солей Na. Cl→Na+ + Cl(-)K. Na+ + ē → Na (+)A. Cl- - ē → 1/2 Cl 2 Na. OH → Na+ + OH(-)K. Na+ + ē → Na (+)A. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2 Na 2 SO 4 → 2 Na+ +SO 42(-)K. Na+ + ē → Na (+)A. SO 42 - - 2ē → SO 3 + ½ O 2
1. Электролиз расплава солей Na. Cl→Na+ + Cl(-)K. Na+ + ē → Na (+)A. Cl- - ē → 1/2 Cl 2 Na. OH → Na+ + OH(-)K. Na+ + ē → Na (+)A. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2 Na 2 SO 4 → 2 Na+ +SO 42(-)K. Na+ + ē → Na (+)A. SO 42 - - 2ē → SO 3 + ½ O 2
 2. Электролиз водных растворов. При электролизе растворов солей активных щелочных и щелочноземельных металлов на катоде выделяется водород, а в прикатодном пространстве образуется гидроксид металла. Если в растворе катионы Mg 2+ или металлов, стоящих правее Mg, то происходит выделение металла. Ионы Cl-, Br-, I-, S 2 - окисляются легче до свободных веществ, чем ионы ОН-. Однако при наличии кислородсодержащих анионов SO 42 -, SO 32 -, NO 3 -, на аноде происходит окисление ионов ОН-. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2
2. Электролиз водных растворов. При электролизе растворов солей активных щелочных и щелочноземельных металлов на катоде выделяется водород, а в прикатодном пространстве образуется гидроксид металла. Если в растворе катионы Mg 2+ или металлов, стоящих правее Mg, то происходит выделение металла. Ионы Cl-, Br-, I-, S 2 - окисляются легче до свободных веществ, чем ионы ОН-. Однако при наличии кислородсодержащих анионов SO 42 -, SO 32 -, NO 3 -, на аноде происходит окисление ионов ОН-. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2
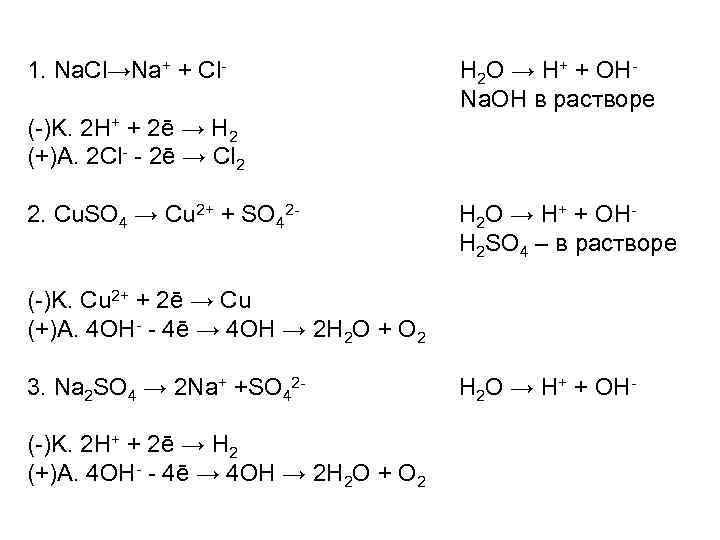 1. Na. Cl→Na+ + Cl- H 2 O → H+ + OHNa. OH в растворе (-)K. 2 H+ + 2ē → H 2 (+)A. 2 Cl- - 2ē → Cl 2 2. Cu. SO 4 → Cu 2+ + SO 42 - H 2 O → H+ + OHH 2 SO 4 – в растворе (-)K. Cu 2+ + 2ē → Cu (+)A. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2 3. Na 2 SO 4 → 2 Na+ +SO 42(-)K. 2 H+ + 2ē → H 2 (+)A. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2 H 2 O → H+ + OH-
1. Na. Cl→Na+ + Cl- H 2 O → H+ + OHNa. OH в растворе (-)K. 2 H+ + 2ē → H 2 (+)A. 2 Cl- - 2ē → Cl 2 2. Cu. SO 4 → Cu 2+ + SO 42 - H 2 O → H+ + OHH 2 SO 4 – в растворе (-)K. Cu 2+ + 2ē → Cu (+)A. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2 3. Na 2 SO 4 → 2 Na+ +SO 42(-)K. 2 H+ + 2ē → H 2 (+)A. 4 OH- - 4ē → 4 OH → 2 H 2 O + O 2 H 2 O → H+ + OH-


