Lecture_07_2017.ppt
- Количество слайдов: 42
 ЛЕКЦИЯ № 7 НАРУШЕНИЯ КИСЛОТНОЩЕЛОЧНОГО РАВНОВЕСИЯ АЦИДОЗЫ, АЛКАЛОЗЫ МЕХАНИЗМЫ КОМПЕНСАЦИИ И КОРРЕКЦИ Зав. кафедрой – проф. Вастьянов Р. С. http: //facebook. com/groups/1931771850426027/ vastyanov@odmu. edu
ЛЕКЦИЯ № 7 НАРУШЕНИЯ КИСЛОТНОЩЕЛОЧНОГО РАВНОВЕСИЯ АЦИДОЗЫ, АЛКАЛОЗЫ МЕХАНИЗМЫ КОМПЕНСАЦИИ И КОРРЕКЦИ Зав. кафедрой – проф. Вастьянов Р. С. http: //facebook. com/groups/1931771850426027/ vastyanov@odmu. edu
 УБЕДИТЕЛЬНАЯ ПРОСЬБА!
УБЕДИТЕЛЬНАЯ ПРОСЬБА!
 КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ #1 1. Метаболическая активность организма зависит от регуляции кислотнощелочного равновесия, что соответствует величине p. H Вне. Кл. Жидк 2. Возбудимость клеток, активность ферментов, протекание биохимических реакций зависят от величины p. H. Диапазон p. H - ничтожен 3. Величина p. H меняется при многих патологических состояниях 4. Стабильность p. H крови поддерживается активностью буферных систем крови, лёгких и почек 5. Регуляция количества кислот и оснований в организме обеспечивает слабо щелочную (7. 35 -7. 45) величину p. H Вне. Кл. Жидк, что соответствует примерному содержанию H+ в 40 нмоль/л 6. Регуляция КЩР обеспечивается точными механизмами синтеза, поддержания активности и распада кислот и оснований 7. Существенные отклонения от нормальных величин p. H нарушают метаболизм, функции клеточных мембран, концентрации ионов 8. Поддержание КЩР жизненно важно для человека. Величина p. H крови ниже 7. 0 и выше 7. 8 несовместима с жизнью!
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ #1 1. Метаболическая активность организма зависит от регуляции кислотнощелочного равновесия, что соответствует величине p. H Вне. Кл. Жидк 2. Возбудимость клеток, активность ферментов, протекание биохимических реакций зависят от величины p. H. Диапазон p. H - ничтожен 3. Величина p. H меняется при многих патологических состояниях 4. Стабильность p. H крови поддерживается активностью буферных систем крови, лёгких и почек 5. Регуляция количества кислот и оснований в организме обеспечивает слабо щелочную (7. 35 -7. 45) величину p. H Вне. Кл. Жидк, что соответствует примерному содержанию H+ в 40 нмоль/л 6. Регуляция КЩР обеспечивается точными механизмами синтеза, поддержания активности и распада кислот и оснований 7. Существенные отклонения от нормальных величин p. H нарушают метаболизм, функции клеточных мембран, концентрации ионов 8. Поддержание КЩР жизненно важно для человека. Величина p. H крови ниже 7. 0 и выше 7. 8 несовместима с жизнью!
 КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ #2 1. Концентрация водородных ионов – это число полярных группировок в макромолекулах, прежде всего белковых, а значит: • Активность всех ферментов • Емкость транспортных белков, в т. ч. Hb • Работа трансмембранных насосов • Функция ионных и других каналов 2. H+ и ОН- влияют на обмен других ионов: • Обмен протонов на К+ • Иммобилизация Са 2+ избытком ОН-
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ #2 1. Концентрация водородных ионов – это число полярных группировок в макромолекулах, прежде всего белковых, а значит: • Активность всех ферментов • Емкость транспортных белков, в т. ч. Hb • Работа трансмембранных насосов • Функция ионных и других каналов 2. H+ и ОН- влияют на обмен других ионов: • Обмен протонов на К+ • Иммобилизация Са 2+ избытком ОН-
 ХИМИЯ кислот и оснований #1 1. Кислота – молекула, которая может высвобождать свободные ионы H+, основание – молекула, которая в состоянии присоединить или обменять H+ 2. Большинство кислот и оснований в организме– химически слабые; угольная к-та (H 2 CO 3) – слабая к-та, образованная из CO 2 и бикарбонат иона (HCO 3−), который является слабым основанием 3. Концентрация H+ в жидкостных средах организма низкая относительно других ионов. Концентрация ионов Na+ в 1 миллион раз превышает таковую концентрацию ионов H+ 4. По причине малой концентрации в жидкостях организма величину p. H рассчитывают с учетом концентрации H+ ионов 5. Величина p. H – это отрицательный логарифм концентрации ионов H+, выраженная в м. Экв/л. 6. Величина p. H=7. 0 означает концентрацию H+ в 10− 7 степени (0. 0000001 м. Экв/л) 7. Вследствие обратной зависимости низкая величина p. H означает высокий уровень H+, а высокая величина p. H – незначительную концентрацию H+
ХИМИЯ кислот и оснований #1 1. Кислота – молекула, которая может высвобождать свободные ионы H+, основание – молекула, которая в состоянии присоединить или обменять H+ 2. Большинство кислот и оснований в организме– химически слабые; угольная к-та (H 2 CO 3) – слабая к-та, образованная из CO 2 и бикарбонат иона (HCO 3−), который является слабым основанием 3. Концентрация H+ в жидкостных средах организма низкая относительно других ионов. Концентрация ионов Na+ в 1 миллион раз превышает таковую концентрацию ионов H+ 4. По причине малой концентрации в жидкостях организма величину p. H рассчитывают с учетом концентрации H+ ионов 5. Величина p. H – это отрицательный логарифм концентрации ионов H+, выраженная в м. Экв/л. 6. Величина p. H=7. 0 означает концентрацию H+ в 10− 7 степени (0. 0000001 м. Экв/л) 7. Вследствие обратной зависимости низкая величина p. H означает высокий уровень H+, а высокая величина p. H – незначительную концентрацию H+
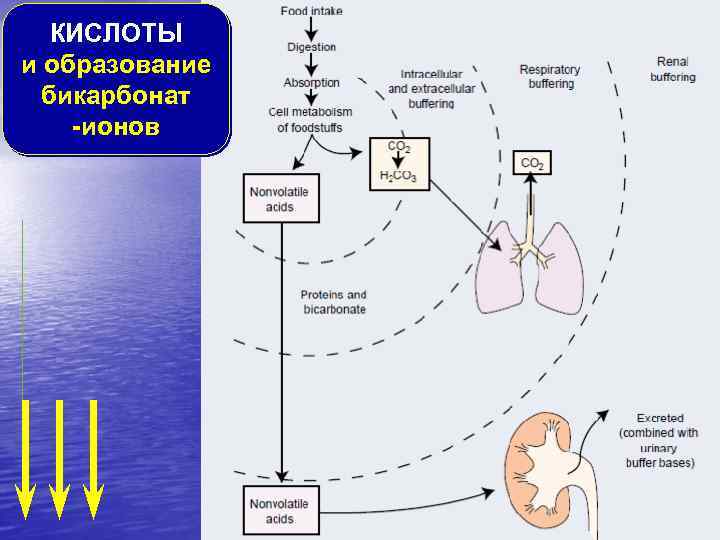 КИСЛОТЫ и образование бикарбонат -ионов
КИСЛОТЫ и образование бикарбонат -ионов
 Образование (биосинтез) кислот 1. В процессе окисления серо-содержащих аминокислот (метионина, цистеина, цистина) синтезируется серная кислота 2. Лактат образуется при анаэробном окислении глюкозы (гликогена) 3. Фосфорная кислота, синтезирующаяся при метаболизме фосфолипидов, является основным источником H+ 4. Мочевая кислота синтезируется при метаболизме нуклеопротеинов 5. Aцетоуксусная и β-гидроксимасляная кислоты синтезируются в результате метаболизма триглицеридов 6. Уксусная кислота существует краткосрочно, поскольку в организме быстро распадается с образованием CO 2 и H 2 O Основные источники оснований – процессы метаболизма аминокислот (аспартат и глутамат) и некоторых органических анионов (цитрат, лактат, ацетат)
Образование (биосинтез) кислот 1. В процессе окисления серо-содержащих аминокислот (метионина, цистеина, цистина) синтезируется серная кислота 2. Лактат образуется при анаэробном окислении глюкозы (гликогена) 3. Фосфорная кислота, синтезирующаяся при метаболизме фосфолипидов, является основным источником H+ 4. Мочевая кислота синтезируется при метаболизме нуклеопротеинов 5. Aцетоуксусная и β-гидроксимасляная кислоты синтезируются в результате метаболизма триглицеридов 6. Уксусная кислота существует краткосрочно, поскольку в организме быстро распадается с образованием CO 2 и H 2 O Основные источники оснований – процессы метаболизма аминокислот (аспартат и глутамат) и некоторых органических анионов (цитрат, лактат, ацетат)
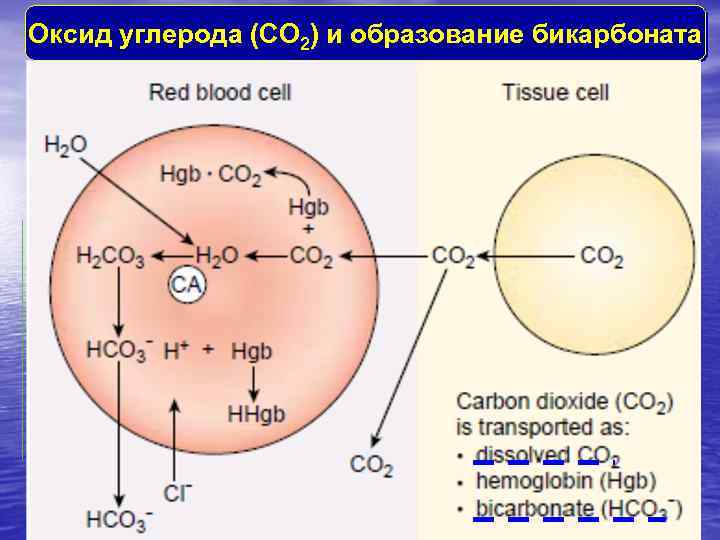 Оксид углерода (CО 2) и образование бикарбоната
Оксид углерода (CО 2) и образование бикарбоната
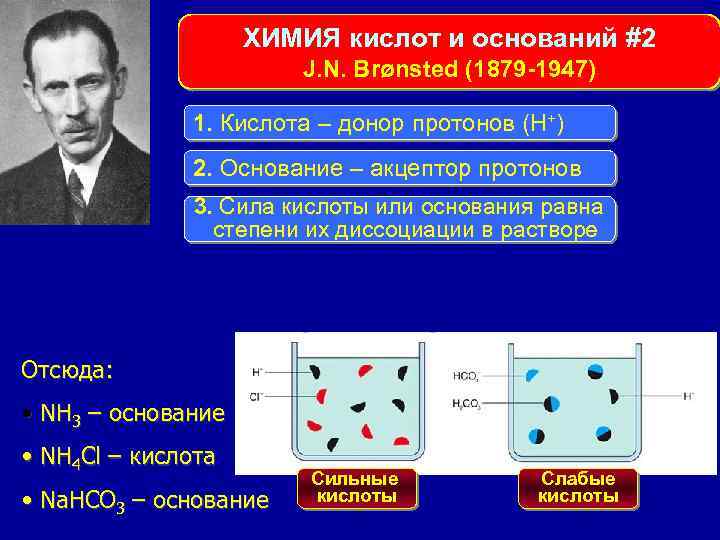 ХИМИЯ кислот и оснований #2 J. N. Brønsted (1879 -1947) 1. Кислота – донор протонов (Н+) 2. Основание – акцептор протонов 3. Сила кислоты или основания равна степени их диссоциации в растворе Отсюда: • NH 3 – основание • NH 4 Cl – кислота • Na. HCO 3 – основание Сильные кислоты Слабые кислоты
ХИМИЯ кислот и оснований #2 J. N. Brønsted (1879 -1947) 1. Кислота – донор протонов (Н+) 2. Основание – акцептор протонов 3. Сила кислоты или основания равна степени их диссоциации в растворе Отсюда: • NH 3 – основание • NH 4 Cl – кислота • Na. HCO 3 – основание Сильные кислоты Слабые кислоты
 Расчет величины p. H 1. H+ ионы. Поступление с пищей (уксус) либо в результате метаболизма, элиминация – при помощи почек 2. OH– ионы. Поступление с пищей (солевые или слабокислые растворы). В особенности – при вегетарианской диете 3. CO 2. Концентрация может изменяться вследствие нарушений метаболизма CO 2 или выделения лёгкими CO 2 4. HCO 3 - ионы. Элиминируются из организма кровью при помощи почек или ЖКТ (диарея) Величина p. H рассчитывается при помощи уравнения Хендерсона-Хассельбаха (Henderson-Hasselbalch equation)
Расчет величины p. H 1. H+ ионы. Поступление с пищей (уксус) либо в результате метаболизма, элиминация – при помощи почек 2. OH– ионы. Поступление с пищей (солевые или слабокислые растворы). В особенности – при вегетарианской диете 3. CO 2. Концентрация может изменяться вследствие нарушений метаболизма CO 2 или выделения лёгкими CO 2 4. HCO 3 - ионы. Элиминируются из организма кровью при помощи почек или ЖКТ (диарея) Величина p. H рассчитывается при помощи уравнения Хендерсона-Хассельбаха (Henderson-Hasselbalch equation)
 Уравнение Хендерсона-Хассельбаха Henderson-Hasselbalch equation p. H=7. 4
Уравнение Хендерсона-Хассельбаха Henderson-Hasselbalch equation p. H=7. 4
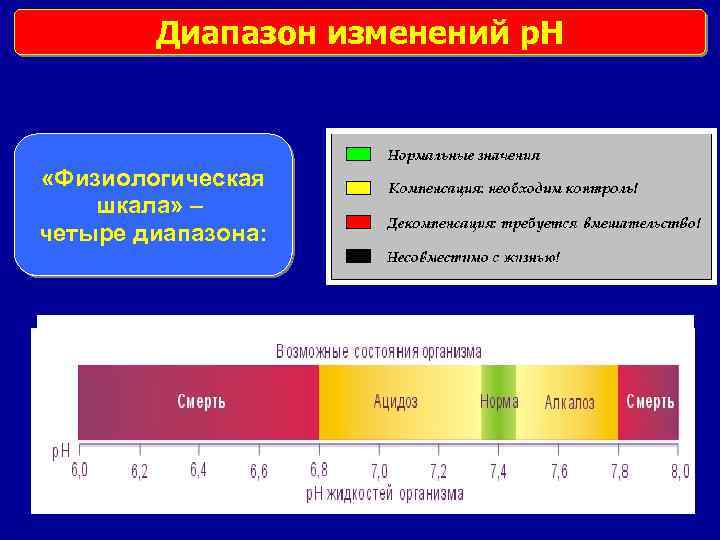 Диапазон изменений p. H «Физиологическая шкала» – четыре диапазона:
Диапазон изменений p. H «Физиологическая шкала» – четыре диапазона:
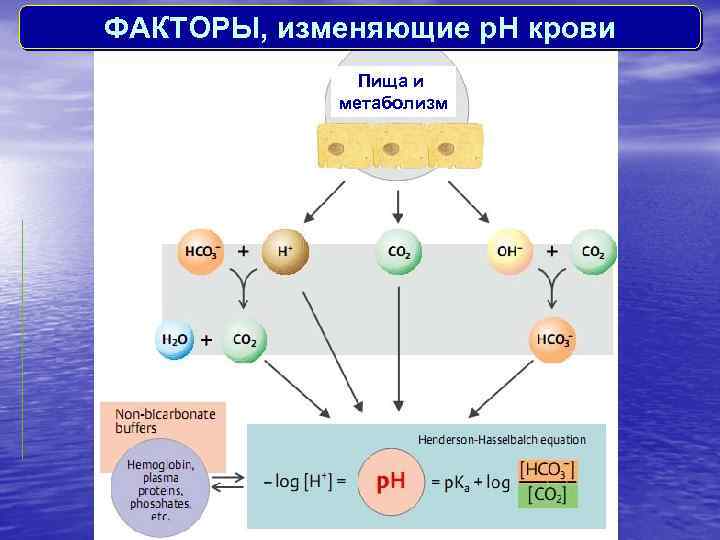 ФАКТОРЫ, изменяющие p. H крови Пища и метаболизм
ФАКТОРЫ, изменяющие p. H крови Пища и метаболизм
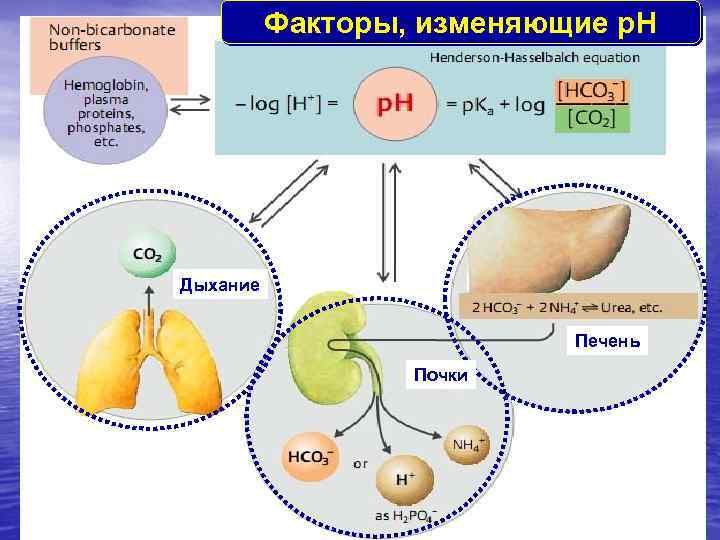 Факторы, изменяющие p. H Дыхание Печень Почки
Факторы, изменяющие p. H Дыхание Печень Почки
 Буферные системы организма 1. Стабильность (поддержание) p. H преимущественно обеспечивается активностью буферных систем 2. Буферная система – химически активная единица, которая минимализует сдвиг p. H при добавлении кислоты или основания 3. Оперативная регуляция p. H зависит от работы буферных систем во вне- и внутриклеточной средах организма 4. Важно: буферные системы не предотвращают изменения p. H Величина p. H жидкостных сред организма регулируется 3 механизмами 1 -я линия регуляции p. H – вне- и внутрикл. буферные системы 2 -я линия регуляции p. H – лёгкие (контроль выделения CO 2) 3 -я линия регуляции p. H – почки (контроль выделения H+ и регуляция выделения HCO 3−
Буферные системы организма 1. Стабильность (поддержание) p. H преимущественно обеспечивается активностью буферных систем 2. Буферная система – химически активная единица, которая минимализует сдвиг p. H при добавлении кислоты или основания 3. Оперативная регуляция p. H зависит от работы буферных систем во вне- и внутриклеточной средах организма 4. Важно: буферные системы не предотвращают изменения p. H Величина p. H жидкостных сред организма регулируется 3 механизмами 1 -я линия регуляции p. H – вне- и внутрикл. буферные системы 2 -я линия регуляции p. H – лёгкие (контроль выделения CO 2) 3 -я линия регуляции p. H – почки (контроль выделения H+ и регуляция выделения HCO 3−
 Как работает буфер? 1. Смесь слабой кислоты и ее соли с сильным основанием или слабого основания и его соли с сильной кислотой 2. Цель – связать поступающие извне Н+ и ОН-
Как работает буфер? 1. Смесь слабой кислоты и ее соли с сильным основанием или слабого основания и его соли с сильной кислотой 2. Цель – связать поступающие извне Н+ и ОН-
 Буферные системы организма БФ в крови Tканевые БС HCO 3 - белковая Mышцы гемоглобин фосфатная Кости
Буферные системы организма БФ в крови Tканевые БС HCO 3 - белковая Mышцы гемоглобин фосфатная Кости
 МЕД, 2004 ОТНОСИТЕЛЬНАЯ ЁМКОСТЬ БУФЕРОВ КРОВИ ПЛАЗМА ЭРИТРОЦИТЫ 35% гидрокарбонатный 7% белковый 1% фосфатный 35% гемоглобиновый 18% гидрокарбонатный 4% фосфатный
МЕД, 2004 ОТНОСИТЕЛЬНАЯ ЁМКОСТЬ БУФЕРОВ КРОВИ ПЛАЗМА ЭРИТРОЦИТЫ 35% гидрокарбонатный 7% белковый 1% фосфатный 35% гемоглобиновый 18% гидрокарбонатный 4% фосфатный
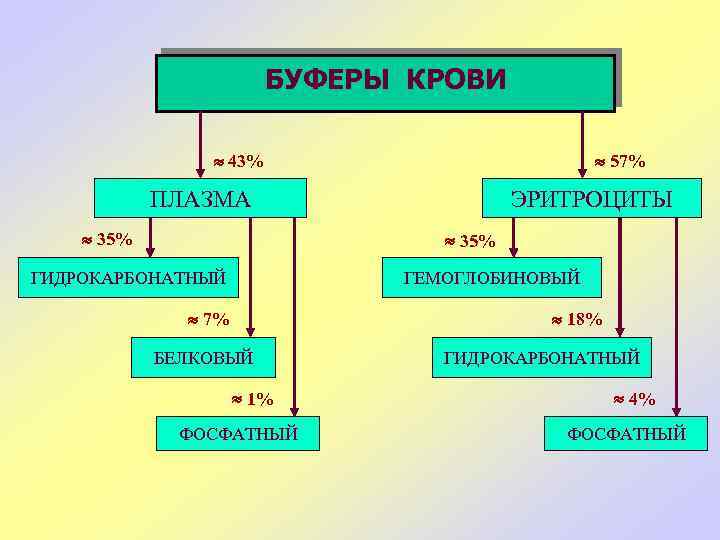 БУФЕРЫ КРОВИ 43% 57% ПЛАЗМА 35% ЭРИТРОЦИТЫ 35% ГИДРОКАРБОНАТНЫЙ ГЕМОГЛОБИНОВЫЙ 7% 18% БЕЛКОВЫЙ 1% ФОСФАТНЫЙ ГИДРОКАРБОНАТНЫЙ 4% ФОСФАТНЫЙ
БУФЕРЫ КРОВИ 43% 57% ПЛАЗМА 35% ЭРИТРОЦИТЫ 35% ГИДРОКАРБОНАТНЫЙ ГЕМОГЛОБИНОВЫЙ 7% 18% БЕЛКОВЫЙ 1% ФОСФАТНЫЙ ГИДРОКАРБОНАТНЫЙ 4% ФОСФАТНЫЙ
 Респираторные механизмы поддержания p. H Респираторный механизм регулирует колебания CO 2 1. Пр каждом выдохе организм выделяет CO 2 и H 2 O 2. Гиповентиляция вызывает дыхательный ацидоз, при гипервентиляции развивается дыхательный алкалоз. Респираторные нейроны при этом регулируют частоту и глубину дыхания (дыхательный объём) 3. Изменения параметров частоты и глубины дыхания могут частично скорректировать метаболические нарушения 4. Повышенный уровень напряжения CO 2 в крови – мощный стимул для гипервентиляции; при этом в большей степени активируются центральные, в меньшей – периферические хеморецепторы
Респираторные механизмы поддержания p. H Респираторный механизм регулирует колебания CO 2 1. Пр каждом выдохе организм выделяет CO 2 и H 2 O 2. Гиповентиляция вызывает дыхательный ацидоз, при гипервентиляции развивается дыхательный алкалоз. Респираторные нейроны при этом регулируют частоту и глубину дыхания (дыхательный объём) 3. Изменения параметров частоты и глубины дыхания могут частично скорректировать метаболические нарушения 4. Повышенный уровень напряжения CO 2 в крови – мощный стимул для гипервентиляции; при этом в большей степени активируются центральные, в меньшей – периферические хеморецепторы
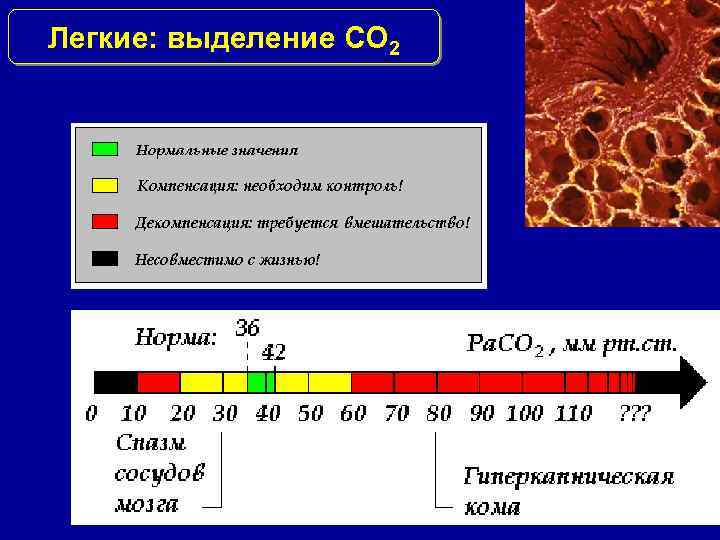 Легкие: выделение СО 2
Легкие: выделение СО 2
 Почечные механизмы поддержания p. H Почечные механизмы – мощнейший источник компенсации изменений p. H. Медленно активирующийся, но длительно действующий 1. Почки – наиболее эффективный регулятор p. H крови 2. Почки экскретируют большее кол-во кислот , чем лёгкие. При необходимости могут экскретировать основания, что лёгкие делать вообще не могут Почки фильтруют HCO 32 мощнейшие внутриканальцевые БС Уровень K+ в плазме детерминирует выделение почками H+ Фосфатная буферная с-ма Аммиачная буферная с-ма Альдостерон! Консервация или элиминация HCO 3− ионов Выделение мочевой к-ты
Почечные механизмы поддержания p. H Почечные механизмы – мощнейший источник компенсации изменений p. H. Медленно активирующийся, но длительно действующий 1. Почки – наиболее эффективный регулятор p. H крови 2. Почки экскретируют большее кол-во кислот , чем лёгкие. При необходимости могут экскретировать основания, что лёгкие делать вообще не могут Почки фильтруют HCO 32 мощнейшие внутриканальцевые БС Уровень K+ в плазме детерминирует выделение почками H+ Фосфатная буферная с-ма Аммиачная буферная с-ма Альдостерон! Консервация или элиминация HCO 3− ионов Выделение мочевой к-ты
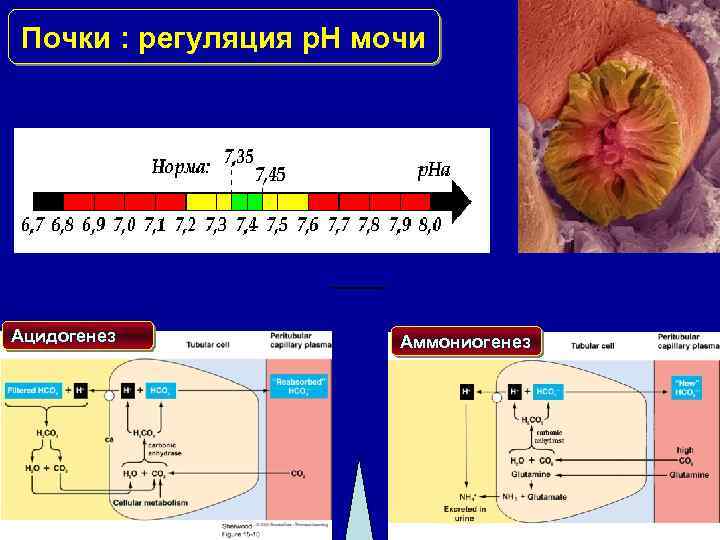 Почки : регуляция p. H мочи Ацидогенез Аммониогенез
Почки : регуляция p. H мочи Ацидогенез Аммониогенез
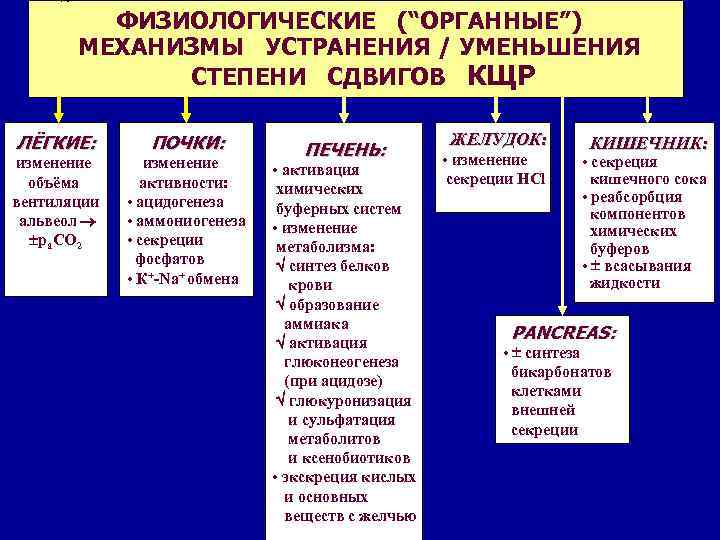 ГЭОТАР-МЕД, 2004 ФИЗИОЛОГИЧЕСКИЕ (“ОРГАННЫЕ”) МЕХАНИЗМЫ УСТРАНЕНИЯ / УМЕНЬШЕНИЯ СТЕПЕНИ СДВИГОВ КЩР ЛЁГКИЕ: ПОЧКИ: изменение объёма вентиляции альвеол ра. СО 2 изменение активности: • ацидогенеза • аммониогенеза • секреции фосфатов • К+-Na+ обмена ПЕЧЕНЬ: • активация химических буферных систем • изменение метаболизма: синтез белков крови образование аммиака активация глюконеогенеза (при ацидозе) глюкуронизация и сульфатация метаболитов и ксенобиотиков • экскреция кислых и основных веществ с желчью ЖЕЛУДОК: • изменение секреции HCl КИШЕЧНИК: • секреция кишечного сока • реабсорбция компонентов химических буферов • всасывания жидкости PANCREAS: • синтеза бикарбонатов клетками внешней секреции
ГЭОТАР-МЕД, 2004 ФИЗИОЛОГИЧЕСКИЕ (“ОРГАННЫЕ”) МЕХАНИЗМЫ УСТРАНЕНИЯ / УМЕНЬШЕНИЯ СТЕПЕНИ СДВИГОВ КЩР ЛЁГКИЕ: ПОЧКИ: изменение объёма вентиляции альвеол ра. СО 2 изменение активности: • ацидогенеза • аммониогенеза • секреции фосфатов • К+-Na+ обмена ПЕЧЕНЬ: • активация химических буферных систем • изменение метаболизма: синтез белков крови образование аммиака активация глюконеогенеза (при ацидозе) глюкуронизация и сульфатация метаболитов и ксенобиотиков • экскреция кислых и основных веществ с желчью ЖЕЛУДОК: • изменение секреции HCl КИШЕЧНИК: • секреция кишечного сока • реабсорбция компонентов химических буферов • всасывания жидкости PANCREAS: • синтеза бикарбонатов клетками внешней секреции
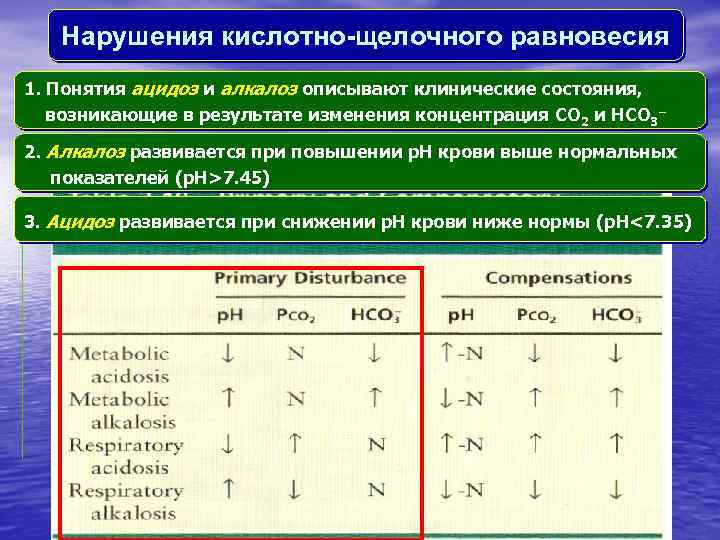 Нарушения кислотно-щелочного равновесия 1. Понятия aцидоз и aлкалоз описывают клинические состояния, возникающие в результате изменения концентрация CO 2 и HCO 3− 2. Aлкалоз развивается при повышении p. H крови выше нормальных показателей (p. H>7. 45) 3. Aцидоз развивается при снижении p. H крови ниже нормы (p. H<7. 35)
Нарушения кислотно-щелочного равновесия 1. Понятия aцидоз и aлкалоз описывают клинические состояния, возникающие в результате изменения концентрация CO 2 и HCO 3− 2. Aлкалоз развивается при повышении p. H крови выше нормальных показателей (p. H>7. 45) 3. Aцидоз развивается при снижении p. H крови ниже нормы (p. H<7. 35)
![МЕД, 2004 ВИДЫ НАРУШЕНИЙ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ КРИТЕРИИ ВИДЫ НАРУШЕНИЙ КЩР *Направленность изменений [Н+] и МЕД, 2004 ВИДЫ НАРУШЕНИЙ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ КРИТЕРИИ ВИДЫ НАРУШЕНИЙ КЩР *Направленность изменений [Н+] и](https://present5.com/presentation/-59738726_452893527/image-26.jpg) МЕД, 2004 ВИДЫ НАРУШЕНИЙ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ КРИТЕРИИ ВИДЫ НАРУШЕНИЙ КЩР *Направленность изменений [Н+] и р. Н ·ацидозы ·алкалозы *Степень компенсированности расстройств КЩР ·компенсированные (р. Н 7, 35 – 7, 45) ·некомпенсированные (р. Н 7, 34; 7, 46) *Происхождение причин нарушений КЩР ·экзогенные ·эндогенные *Причины и механизмы развития нарушений КЩР ·газовые (респираторные) ·негазовые: - метаболические, - выделительные: • почечные, • желудочные, • кишечные, • ”потовыделительные” (гипогидратационные) - экзогенные ·смешанные (комбинированные)
МЕД, 2004 ВИДЫ НАРУШЕНИЙ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ КРИТЕРИИ ВИДЫ НАРУШЕНИЙ КЩР *Направленность изменений [Н+] и р. Н ·ацидозы ·алкалозы *Степень компенсированности расстройств КЩР ·компенсированные (р. Н 7, 35 – 7, 45) ·некомпенсированные (р. Н 7, 34; 7, 46) *Происхождение причин нарушений КЩР ·экзогенные ·эндогенные *Причины и механизмы развития нарушений КЩР ·газовые (респираторные) ·негазовые: - метаболические, - выделительные: • почечные, • желудочные, • кишечные, • ”потовыделительные” (гипогидратационные) - экзогенные ·смешанные (комбинированные)
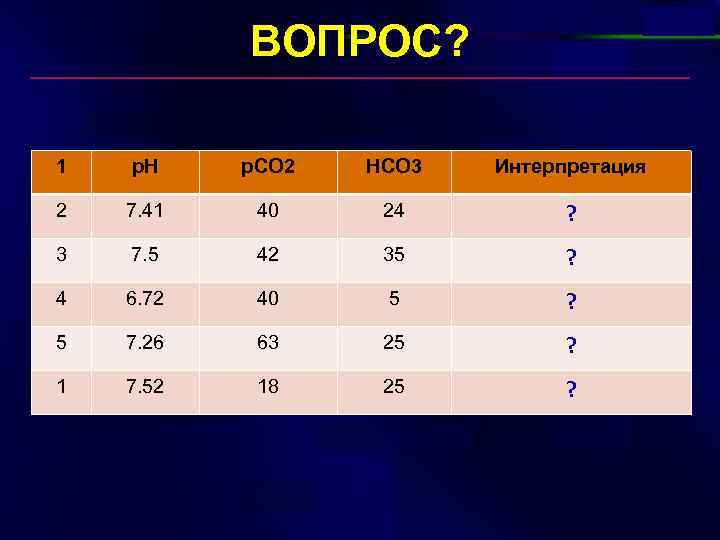 ВОПРОС? 1 p. H p. CO 2 HCO 3 Интерпретация 2 7. 41 40 24 ? 3 7. 5 42 35 ? 4 6. 72 40 5 ? 5 7. 26 63 25 ? 1 7. 52 18 25 ?
ВОПРОС? 1 p. H p. CO 2 HCO 3 Интерпретация 2 7. 41 40 24 ? 3 7. 5 42 35 ? 4 6. 72 40 5 ? 5 7. 26 63 25 ? 1 7. 52 18 25 ?
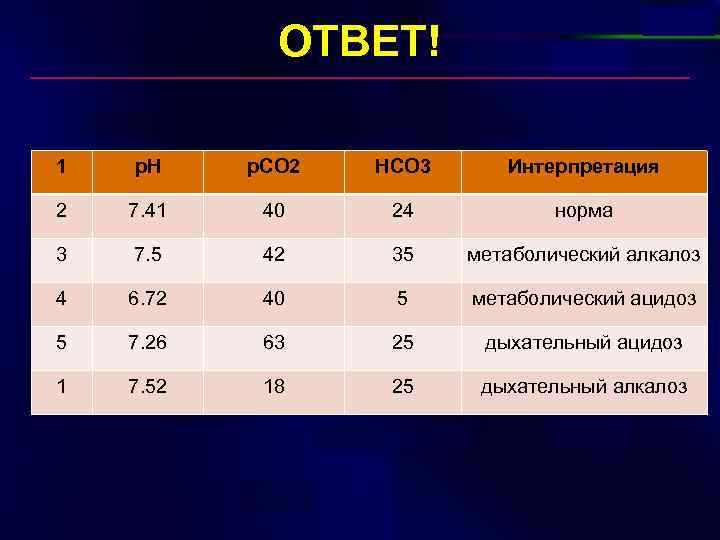 ОТВЕТ! 1 p. H p. CO 2 HCO 3 Интерпретация 2 7. 41 40 24 норма 3 7. 5 42 35 метаболический алкалоз 4 6. 72 40 5 метаболический ацидоз 5 7. 26 63 25 дыхательный ацидоз 1 7. 52 18 25 дыхательный алкалоз
ОТВЕТ! 1 p. H p. CO 2 HCO 3 Интерпретация 2 7. 41 40 24 норма 3 7. 5 42 35 метаболический алкалоз 4 6. 72 40 5 метаболический ацидоз 5 7. 26 63 25 дыхательный ацидоз 1 7. 52 18 25 дыхательный алкалоз
 ПОМОЩЬ!
ПОМОЩЬ!
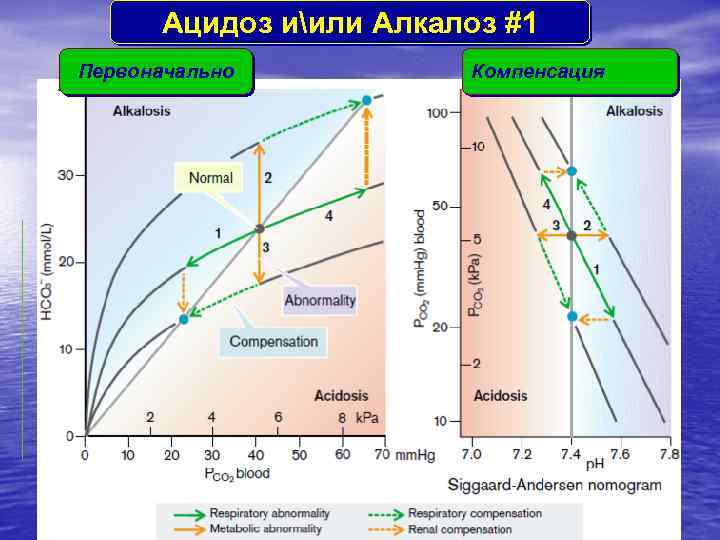 Aцидоз иили Aлкалоз #1 Первоначально Компенсация
Aцидоз иили Aлкалоз #1 Первоначально Компенсация
 Aцидоз иили Aлкалоз #2
Aцидоз иили Aлкалоз #2
 Aцидоз иили Aлкалоз #3 9 состояний Ван-Слайка
Aцидоз иили Aлкалоз #3 9 состояний Ван-Слайка
![ГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРОЯВЛЕНИЯ: ПРИЧИНА: СЛЕДСТВИЕ: первичное изменение ра. СО 2 изменение [НСО 3]/[Н ГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРОЯВЛЕНИЯ: ПРИЧИНА: СЛЕДСТВИЕ: первичное изменение ра. СО 2 изменение [НСО 3]/[Н](https://present5.com/presentation/-59738726_452893527/image-33.jpg) ГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРОЯВЛЕНИЯ: ПРИЧИНА: СЛЕДСТВИЕ: первичное изменение ра. СО 2 изменение [НСО 3]/[Н 2 СО 3] АЦИДОЗ: р. Н ра. СО 2 [Н 2 СО 3] [НСО 3 ] (реакция компенсации) АЛКАЛОЗ: р. Н ра. СО 2 [Н 2 СО 3] [НСО 3 ] (реакция компенсации)
ГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРОЯВЛЕНИЯ: ПРИЧИНА: СЛЕДСТВИЕ: первичное изменение ра. СО 2 изменение [НСО 3]/[Н 2 СО 3] АЦИДОЗ: р. Н ра. СО 2 [Н 2 СО 3] [НСО 3 ] (реакция компенсации) АЛКАЛОЗ: р. Н ра. СО 2 [Н 2 СО 3] [НСО 3 ] (реакция компенсации)
![НЕГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРИЧИНА: ПРОЯВЛЕНИЯ: первичное изменение [НСО 3 ]/[Н 2 СО 3] АЦИДОЗ: НЕГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРИЧИНА: ПРОЯВЛЕНИЯ: первичное изменение [НСО 3 ]/[Н 2 СО 3] АЦИДОЗ:](https://present5.com/presentation/-59738726_452893527/image-34.jpg) НЕГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРИЧИНА: ПРОЯВЛЕНИЯ: первичное изменение [НСО 3 ]/[Н 2 СО 3] АЦИДОЗ: р. Н [НСО 3 ] ! р. СО 2 (реакция компенсации) АЛКАЛОЗ: р. Н [НСО 3 ] ! р. СО 2 (реакция компенсации)
НЕГАЗОВЫЕ НАРУШЕНИЯ КЩР ПРИЧИНА: ПРОЯВЛЕНИЯ: первичное изменение [НСО 3 ]/[Н 2 СО 3] АЦИДОЗ: р. Н [НСО 3 ] ! р. СО 2 (реакция компенсации) АЛКАЛОЗ: р. Н [НСО 3 ] ! р. СО 2 (реакция компенсации)
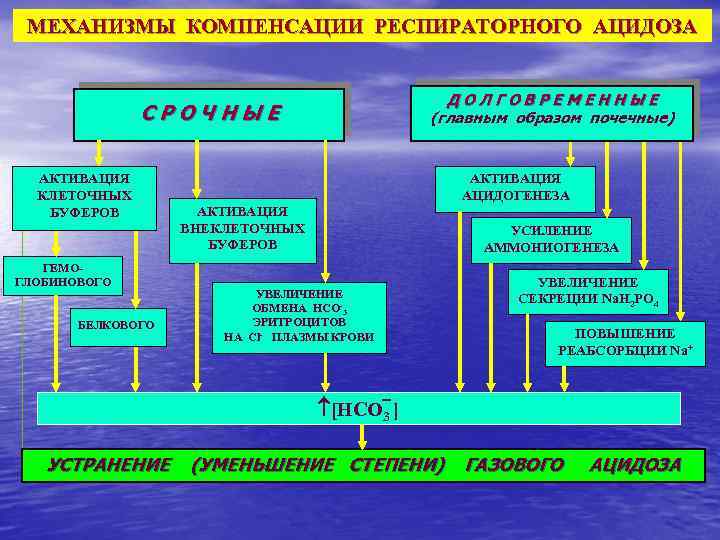 МЕХАНИЗМЫ КОМПЕНСАЦИИ РЕСПИРАТОРНОГО АЦИДОЗА ДОЛГОВРЕМЕННЫЕ (главным образом почечные) СРОЧНЫЕ АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРОВ ГЕМОГЛОБИНОВОГО БЕЛКОВОГО АКТИВАЦИЯ АЦИДОГЕНЕЗА АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРОВ УСИЛЕНИЕ АММОНИОГЕНЕЗА УВЕЛИЧЕНИЕ ОБМЕНА НСО-3 ЭРИТРОЦИТОВ НА Cl- ПЛАЗМЫ КРОВИ УВЕЛИЧЕНИЕ СЕКРЕЦИИ Nа. H 2 PO 4 ПОВЫШЕНИЕ РЕАБСОРБЦИИ Nа+ [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) ГАЗОВОГО АЦИДОЗА
МЕХАНИЗМЫ КОМПЕНСАЦИИ РЕСПИРАТОРНОГО АЦИДОЗА ДОЛГОВРЕМЕННЫЕ (главным образом почечные) СРОЧНЫЕ АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРОВ ГЕМОГЛОБИНОВОГО БЕЛКОВОГО АКТИВАЦИЯ АЦИДОГЕНЕЗА АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРОВ УСИЛЕНИЕ АММОНИОГЕНЕЗА УВЕЛИЧЕНИЕ ОБМЕНА НСО-3 ЭРИТРОЦИТОВ НА Cl- ПЛАЗМЫ КРОВИ УВЕЛИЧЕНИЕ СЕКРЕЦИИ Nа. H 2 PO 4 ПОВЫШЕНИЕ РЕАБСОРБЦИИ Nа+ [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) ГАЗОВОГО АЦИДОЗА
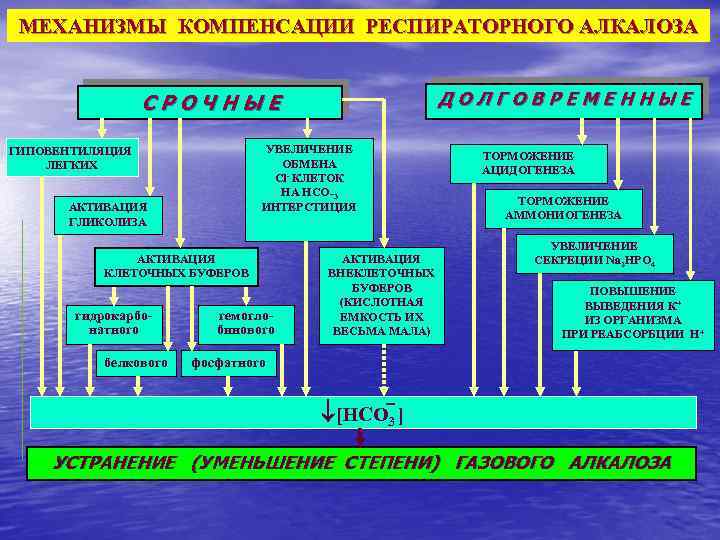 МЕХАНИЗМЫ КОМПЕНСАЦИИ РЕСПИРАТОРНОГО АЛКАЛОЗА ДОЛГОВРЕМЕННЫЕ СРОЧНЫЕ УВЕЛИЧЕНИЕ ОБМЕНА Cl- КЛЕТОК НА НСО_3 ИНТЕРСТИЦИЯ ГИПОВЕНТИЛЯЦИЯ ЛЕГКИХ АКТИВАЦИЯ ГЛИКОЛИЗА АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРОВ гидрокарбонатного белкового гемоглобинового АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРОВ (КИСЛОТНАЯ ЕМКОСТЬ ИХ ВЕСЬМА МАЛА) ТОРМОЖЕНИЕ АЦИДОГЕНЕЗА ТОРМОЖЕНИЕ АММОНИОГЕНЕЗА УВЕЛИЧЕНИЕ СЕКРЕЦИИ Nа 2 HPO 4 ПОВЫШЕНИЕ ВЫВЕДЕНИЯ К+ ИЗ ОРГАНИЗМА ПРИ РЕАБСОРБЦИИ Н+ фосфатного [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) ГАЗОВОГО АЛКАЛОЗА
МЕХАНИЗМЫ КОМПЕНСАЦИИ РЕСПИРАТОРНОГО АЛКАЛОЗА ДОЛГОВРЕМЕННЫЕ СРОЧНЫЕ УВЕЛИЧЕНИЕ ОБМЕНА Cl- КЛЕТОК НА НСО_3 ИНТЕРСТИЦИЯ ГИПОВЕНТИЛЯЦИЯ ЛЕГКИХ АКТИВАЦИЯ ГЛИКОЛИЗА АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРОВ гидрокарбонатного белкового гемоглобинового АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРОВ (КИСЛОТНАЯ ЕМКОСТЬ ИХ ВЕСЬМА МАЛА) ТОРМОЖЕНИЕ АЦИДОГЕНЕЗА ТОРМОЖЕНИЕ АММОНИОГЕНЕЗА УВЕЛИЧЕНИЕ СЕКРЕЦИИ Nа 2 HPO 4 ПОВЫШЕНИЕ ВЫВЕДЕНИЯ К+ ИЗ ОРГАНИЗМА ПРИ РЕАБСОРБЦИИ Н+ фосфатного [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) ГАЗОВОГО АЛКАЛОЗА
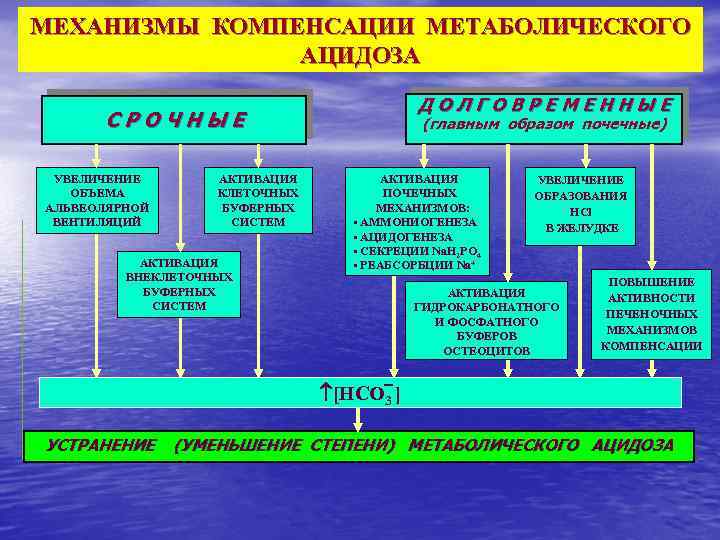 МЕХАНИЗМЫ КОМПЕНСАЦИИ МЕТАБОЛИЧЕСКОГО АЦИДОЗА ДОЛГОВРЕМЕННЫЕ СРОЧНЫЕ УВЕЛИЧЕНИЕ ОБЪЕМА АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИЙ АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ (главным образом почечные) АКТИВАЦИЯ ПОЧЕЧНЫХ МЕХАНИЗМОВ: • АММОНИОГЕНЕЗА • АЦИДОГЕНЕЗА • СЕКРЕЦИИ Nа. H 2 PO 4 • РЕАБСОРБЦИИ Nа+ УВЕЛИЧЕНИЕ ОБРАЗОВАНИЯ HCl В ЖЕЛУДКЕ АКТИВАЦИЯ ГИДРОКАРБОНАТНОГО И ФОСФАТНОГО БУФЕРОВ ОСТЕОЦИТОВ ПОВЫШЕНИЕ АКТИВНОСТИ ПЕЧЕНОЧНЫХ МЕХАНИЗМОВ КОМПЕНСАЦИИ [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) МЕТАБОЛИЧЕСКОГО АЦИДОЗА
МЕХАНИЗМЫ КОМПЕНСАЦИИ МЕТАБОЛИЧЕСКОГО АЦИДОЗА ДОЛГОВРЕМЕННЫЕ СРОЧНЫЕ УВЕЛИЧЕНИЕ ОБЪЕМА АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИЙ АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ (главным образом почечные) АКТИВАЦИЯ ПОЧЕЧНЫХ МЕХАНИЗМОВ: • АММОНИОГЕНЕЗА • АЦИДОГЕНЕЗА • СЕКРЕЦИИ Nа. H 2 PO 4 • РЕАБСОРБЦИИ Nа+ УВЕЛИЧЕНИЕ ОБРАЗОВАНИЯ HCl В ЖЕЛУДКЕ АКТИВАЦИЯ ГИДРОКАРБОНАТНОГО И ФОСФАТНОГО БУФЕРОВ ОСТЕОЦИТОВ ПОВЫШЕНИЕ АКТИВНОСТИ ПЕЧЕНОЧНЫХ МЕХАНИЗМОВ КОМПЕНСАЦИИ [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) МЕТАБОЛИЧЕСКОГО АЦИДОЗА
 МЕХАНИЗМЫ КОМПЕНСАЦИИ МЕТАБОЛИЧЕСКОГО АЛКАЛОЗА СРОЧНЫЕ АКТИВАЦИЯ КЛЕТОЧНЫХ МЕХАНИЗМОВ гликолиза ДОЛГОВРЕМЕННЫЕ СНИЖЕНИЕ ОБЪЕМА АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИИ АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРОВ (КИСЛОТНАЯ ЕМКОСТЬ ИХ ВЕСЬМА МАЛА) белкового буфера УВЕЛИЧЕНИЕ ВЫВЕДЕНИЯ ПОЧКАМИ ИЗБЫТКА HCO 3_ цикла трикарбоновых кислот увеличение обмена Cl_ клеток на HCO_3 межклеточной среды [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) МЕТАБОЛИЧЕСКОГО АЛКАЛОЗА
МЕХАНИЗМЫ КОМПЕНСАЦИИ МЕТАБОЛИЧЕСКОГО АЛКАЛОЗА СРОЧНЫЕ АКТИВАЦИЯ КЛЕТОЧНЫХ МЕХАНИЗМОВ гликолиза ДОЛГОВРЕМЕННЫЕ СНИЖЕНИЕ ОБЪЕМА АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИИ АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРОВ (КИСЛОТНАЯ ЕМКОСТЬ ИХ ВЕСЬМА МАЛА) белкового буфера УВЕЛИЧЕНИЕ ВЫВЕДЕНИЯ ПОЧКАМИ ИЗБЫТКА HCO 3_ цикла трикарбоновых кислот увеличение обмена Cl_ клеток на HCO_3 межклеточной среды [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) МЕТАБОЛИЧЕСКОГО АЛКАЛОЗА
 ВИДЫ ВЫДЕЛИТЕЛЬНОГО АЦИДОЗА ПОЧЕЧНЫЙ накопление в организме кислот потеря им оснований КИШЕЧНЫЙ потеря организмом оснований ГИПЕРСАЛИВАЦИОННЫЙ потеря организмом оснований ПРИМЕРЫ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ И ВОЗДЕЙСТВИЙ, ВЫЗЫВАЮЩИХ ВЫДЕЛИТЕЛЬНЫЙ АЦИДОЗ: почечная недостаточность интоксикация сульфаниламидами ”обессоливающий” нефрит гипоксия ткани почек диарея фистула тонкого кишечника открытая рана тонкого кишечника рвота кишечным содержимым стоматиты отравление никотином, препаратами ртути токсикоз беременных гельминтоз
ВИДЫ ВЫДЕЛИТЕЛЬНОГО АЦИДОЗА ПОЧЕЧНЫЙ накопление в организме кислот потеря им оснований КИШЕЧНЫЙ потеря организмом оснований ГИПЕРСАЛИВАЦИОННЫЙ потеря организмом оснований ПРИМЕРЫ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ И ВОЗДЕЙСТВИЙ, ВЫЗЫВАЮЩИХ ВЫДЕЛИТЕЛЬНЫЙ АЦИДОЗ: почечная недостаточность интоксикация сульфаниламидами ”обессоливающий” нефрит гипоксия ткани почек диарея фистула тонкого кишечника открытая рана тонкого кишечника рвота кишечным содержимым стоматиты отравление никотином, препаратами ртути токсикоз беременных гельминтоз
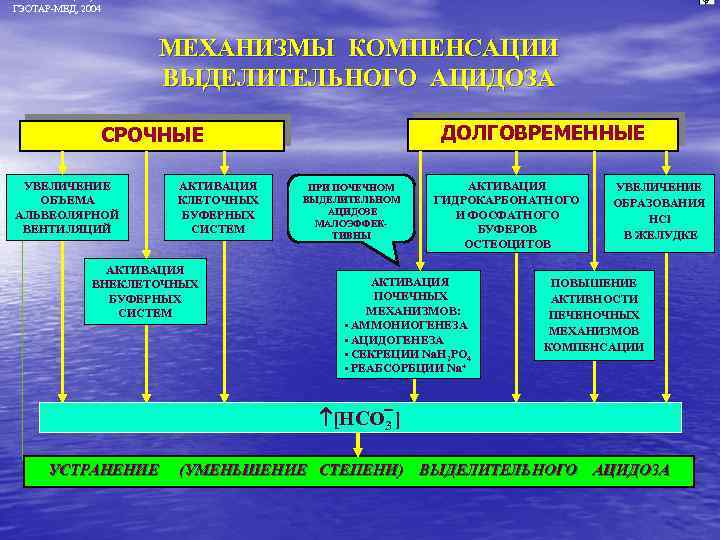 ГЭОТАР-МЕД, 2004 МЕХАНИЗМЫ КОМПЕНСАЦИИ ВЫДЕЛИТЕЛЬНОГО АЦИДОЗА ДОЛГОВРЕМЕННЫЕ СРОЧНЫЕ УВЕЛИЧЕНИЕ ОБЪЕМА АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИЙ АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ ПРИ ПОЧЕЧНОМ ВЫДЕЛИТЕЛЬНОМ АЦИДОЗЕ МАЛОЭФФЕКТИВНЫ АКТИВАЦИЯ ГИДРОКАРБОНАТНОГО И ФОСФАТНОГО БУФЕРОВ ОСТЕОЦИТОВ АКТИВАЦИЯ ПОЧЕЧНЫХ МЕХАНИЗМОВ: • АММОНИОГЕНЕЗА • АЦИДОГЕНЕЗА • СЕКРЕЦИИ Nа. H 2 PO 4 • РЕАБСОРБЦИИ Nа+ УВЕЛИЧЕНИЕ ОБРАЗОВАНИЯ HCl В ЖЕЛУДКЕ ПОВЫШЕНИЕ АКТИВНОСТИ ПЕЧЕНОЧНЫХ МЕХАНИЗМОВ КОМПЕНСАЦИИ [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) ВЫДЕЛИТЕЛЬНОГО АЦИДОЗА
ГЭОТАР-МЕД, 2004 МЕХАНИЗМЫ КОМПЕНСАЦИИ ВЫДЕЛИТЕЛЬНОГО АЦИДОЗА ДОЛГОВРЕМЕННЫЕ СРОЧНЫЕ УВЕЛИЧЕНИЕ ОБЪЕМА АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИЙ АКТИВАЦИЯ КЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ АКТИВАЦИЯ ВНЕКЛЕТОЧНЫХ БУФЕРНЫХ СИСТЕМ ПРИ ПОЧЕЧНОМ ВЫДЕЛИТЕЛЬНОМ АЦИДОЗЕ МАЛОЭФФЕКТИВНЫ АКТИВАЦИЯ ГИДРОКАРБОНАТНОГО И ФОСФАТНОГО БУФЕРОВ ОСТЕОЦИТОВ АКТИВАЦИЯ ПОЧЕЧНЫХ МЕХАНИЗМОВ: • АММОНИОГЕНЕЗА • АЦИДОГЕНЕЗА • СЕКРЕЦИИ Nа. H 2 PO 4 • РЕАБСОРБЦИИ Nа+ УВЕЛИЧЕНИЕ ОБРАЗОВАНИЯ HCl В ЖЕЛУДКЕ ПОВЫШЕНИЕ АКТИВНОСТИ ПЕЧЕНОЧНЫХ МЕХАНИЗМОВ КОМПЕНСАЦИИ [НСО 3 ] УСТРАНЕНИЕ (УМЕНЬШЕНИЕ СТЕПЕНИ) ВЫДЕЛИТЕЛЬНОГО АЦИДОЗА
 ВИДЫ ВЫДЕЛИТЕЛЬНОГО АЛКАЛОЗА ЖЕЛУДОЧНЫЙ потеря HCl желудочного сока ПОЧЕЧНЫЙ увеличение реабсорбции оснований повышение выведения хлоридов, К+ усиление экскреции Н+ в почках КИШЕЧНЫЙ ДЕГИДРАТАЦИОННЫЙ (потеря Cl-) увеличение выведения К+ через кишечник ПРИМЕРЫ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ И ВОЗДЕЙСТВИЙ, ВЫЗЫВАЮЩИХ ВЫДЕЛИТЕЛЬНЫЙ АЛКАЛОЗ токсикоз беременных длительное пилороспазм применение пилоростеноз диуретиков, кишечная непроходимость. антибиотиков, Сопровождается повторной нитратов рвотой желуд. содержимым злоупотребление слабительными повторное применение клизм · длительное интенсивное потовыделение
ВИДЫ ВЫДЕЛИТЕЛЬНОГО АЛКАЛОЗА ЖЕЛУДОЧНЫЙ потеря HCl желудочного сока ПОЧЕЧНЫЙ увеличение реабсорбции оснований повышение выведения хлоридов, К+ усиление экскреции Н+ в почках КИШЕЧНЫЙ ДЕГИДРАТАЦИОННЫЙ (потеря Cl-) увеличение выведения К+ через кишечник ПРИМЕРЫ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ И ВОЗДЕЙСТВИЙ, ВЫЗЫВАЮЩИХ ВЫДЕЛИТЕЛЬНЫЙ АЛКАЛОЗ токсикоз беременных длительное пилороспазм применение пилоростеноз диуретиков, кишечная непроходимость. антибиотиков, Сопровождается повторной нитратов рвотой желуд. содержимым злоупотребление слабительными повторное применение клизм · длительное интенсивное потовыделение



