07 Лекция Карбоновые кислоты.ppt
- Количество слайдов: 85

Лекция 7 Карбоновые кислоты и их функциональные производные. Жиры, фосфолипиды. Реакции SN 1

Карбоновые кислоты – органические соединения, содержащие –СООН- карбоксильную группу. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ КЛАССИФИКАЦИЯ: а) по строению углеводородного радикала: - предельные (уксусная, стеариновая) - непредельные (акриловая, олеиновая, линолевая) - ароматические (бензойная, фенилуксусная) - гетероциклические (никотиновая) - алициклические б) по числу карбоксильных групп: - монокарбоновые (муравьиная) - дикарбоновые (щавелевая) - поликарбоновые (аконитовая) 2

Предельные монокарбоновые кислоты 2. 3. 4. 5. 6. 1. HCOOH - муравьиная кислота метановая CH 3 COOH - уксусная кислота этановая CH 3 CH 2 COOH - пропионовая пропановая CH 3(CH 2)2 COOH - масляная бутановая CH 3(CH 2)3 COOH - валериановая пентановая CH 3(CH 2)4 COOH - капроновая гексановая C 15 H 31 COOH CH 3(CH 2)14 COOH - пальмитиновая гексадекановая C 17 H 35 COOH CH 3(CH 2)16 COOH -стеариновая октадекановая 3

Предельные дикарбоновые кислоты HOOC – COOH щавелевая этандиовая HOOC – CH 2 – COOH малоновая пропандиовая HOOC – (CH 2)2 – COOH янтарная HOOC – (CH 2)3 – COOH глутаровая пентандиовая HOOC – (CH 2)4 – COOH адипиновая гександиовая бутандиовая 4

Непредельные монокарбоновые кислоты CH 2 = CH – COOH акриловая пропеновая кислота CH 2 = CH –CH 2 - COOH винилуксусная бутен-3 -овая CH 3 - CH =CH- COOH кротоновая (trans) бутен-2 -овая Изокротоновая (cis) 5
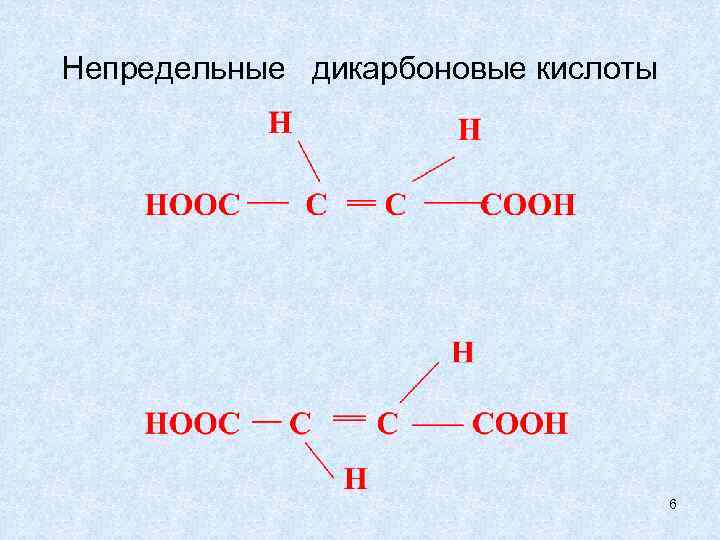
Непредельные дикарбоновые кислоты 6
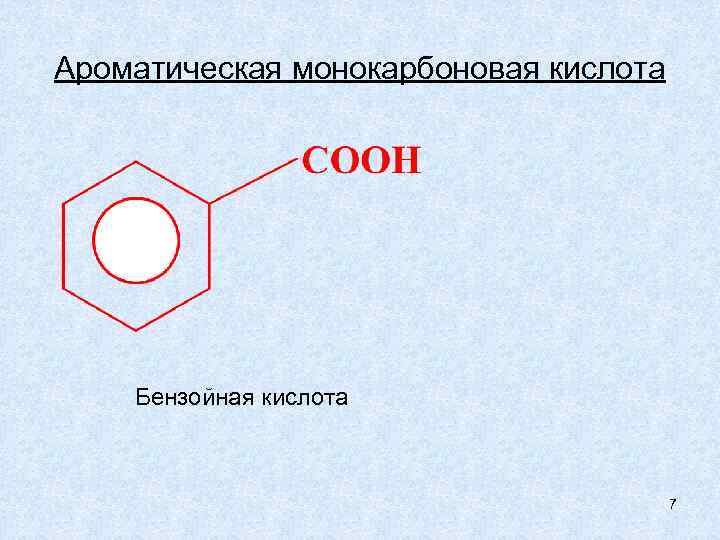
Ароматическая монокарбоновая кислота Бензойная кислота 7
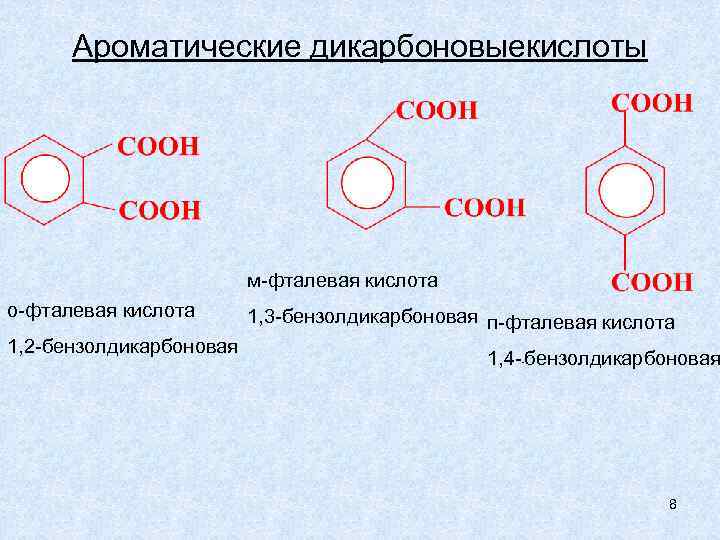
Ароматические дикарбоновыекислоты м-фталевая кислота о-фталевая кислота 1, 2 -бензолдикарбоновая 1, 3 -бензолдикарбоновая п-фталевая кислота 1, 4 - бензолдикарбоновая - 8
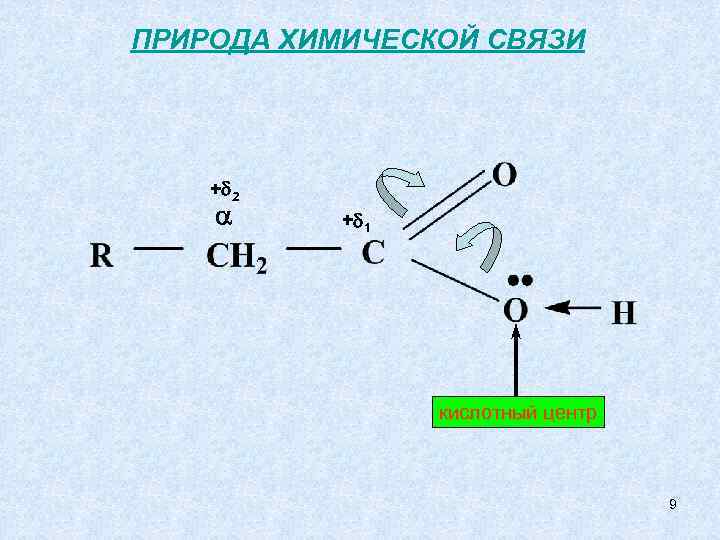
ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ + 2 + 1 кислотный центр 9

Большинство химических реакций карбоновых кислот можно разделить на 4 типа: I. Реакции, связанные с разрывом связи О-Н кислотные свойства, образование солей. II. Реакции SN – образование сложных эфиров, амидов, ангидридов и т. д. III. Реакции декарбоксилирования (потеря СО 2) IV. Реакции с участием R (особенно по α-с-атому) 10
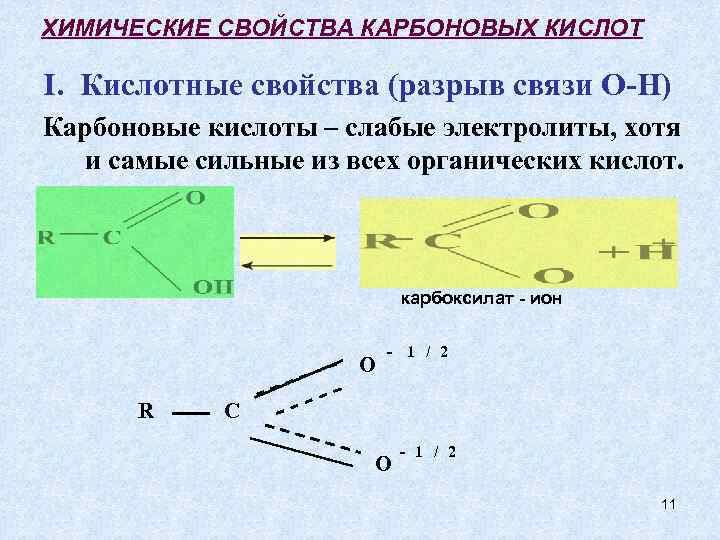
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ I. Кислотные свойства (разрыв связи О-Н) Карбоновые кислоты – слабые электролиты, хотя и самые сильные из всех органических кислот. карбоксилат - ион O R - 1 / 2 C O - 1 / 2 11

Сравнение кислотности 1. 2. 3. В монокарбоновых кислотах на кислотность влияют заместители в углеводородном радикале: ЭА – усиливают, ЭД – ослабляют кислотность. Ароматические кислоты обладают большими кислотными свойствами, чем алифатические из -за участия – СООН – группы в р – сопряжении с электронами бензольного кольца. Двухосновные кислоты более сильные, чем монокарбоновые из-за взаимного влияния СООН- групп, причем это влияние значительнее, если группы расположены близко друг к другу. 12

В монокарбоновых кислотах: ЭА 1) кислотные ЭА свойства, - I эффект трихлоруксусная кислота р. К = 0, 66 + I эффект > – усиливают ЭД – ослабляют > + I эффект уксусная кислота р. К = 4, 75 ЭД триметилуксусная кислота р. К = 5, 03 13
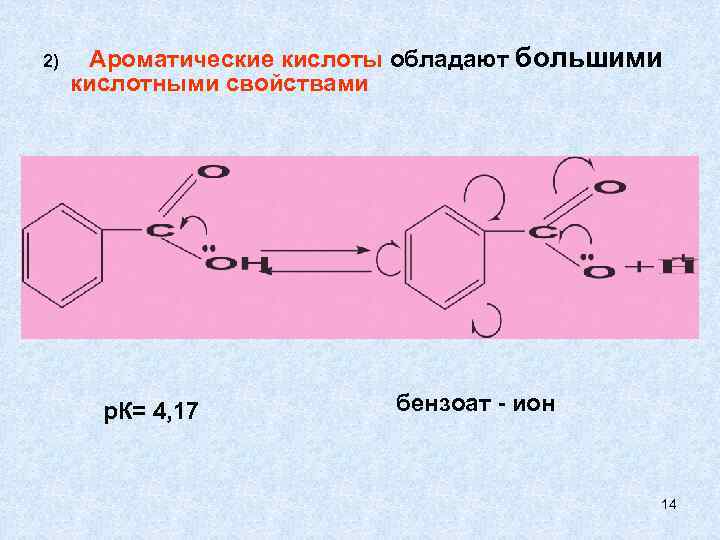
2) Ароматические кислоты обладают большими кислотными свойствами р. К= 4, 17 бензоат - ион 14

3) Двухосновные кислоты более сильные, чем монокарбоновые из-за взаимного влияния СООН- групп. - щавелевая кислота, этандиовая соли – оксалаты - малоновая кислота, р. К= 1, 27 р. К = 2, 86 пропандиовая участвует в синтезе барбитуратов, соли - малонаты Чем дальше СООН – группы друг от друга, тем меньше их взаимное влияние (у янтарной кислоты р. К= 4, 21)! Две СООН – группы влияют не только на кислотные свойства, но и придают особую специфичность поведению этих кислот при нагревании. 15
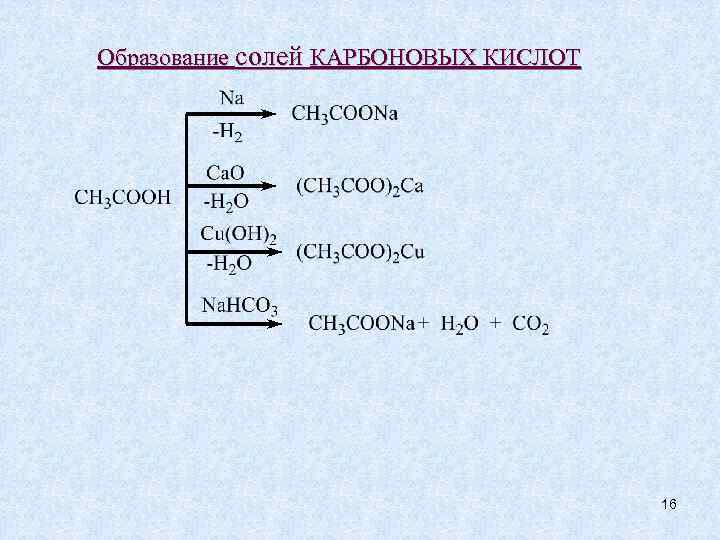
Образование солей КАРБОНОВЫХ КИСЛОТ 16

II. Реакции SN – образование функциональных производных При замещении группы ОН в карбоновых кислотах образуются соединения с общей формулой , получившие название функциональных производных. Все функциональные производные вступают в реакции SN, превращаясь друг в друга. Если Х - Г - галогенангидрид - OR - сложный эфир - OCOR - ангидрид - NH 2 - амиды - NH-C-NH 2 - уреиды || O 17
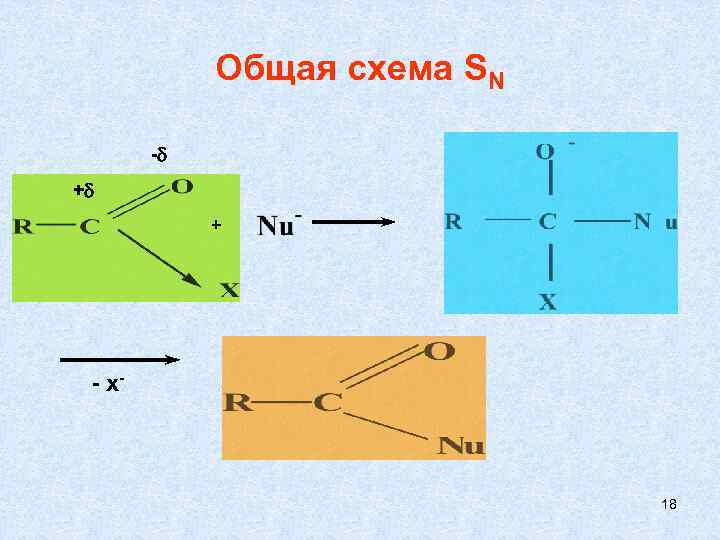
Общая схема SN - + + - х- 18
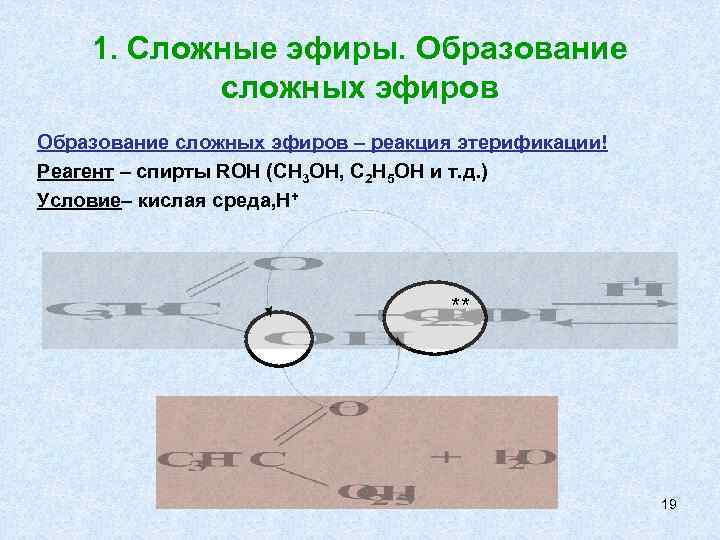
1. Сложные эфиры. Образование сложных эфиров – реакция этерификации! Реагент – спирты ROH (CH 3 OH, C 2 H 5 OH и т. д. ) Условие– кислая среда, Н+ ** 19
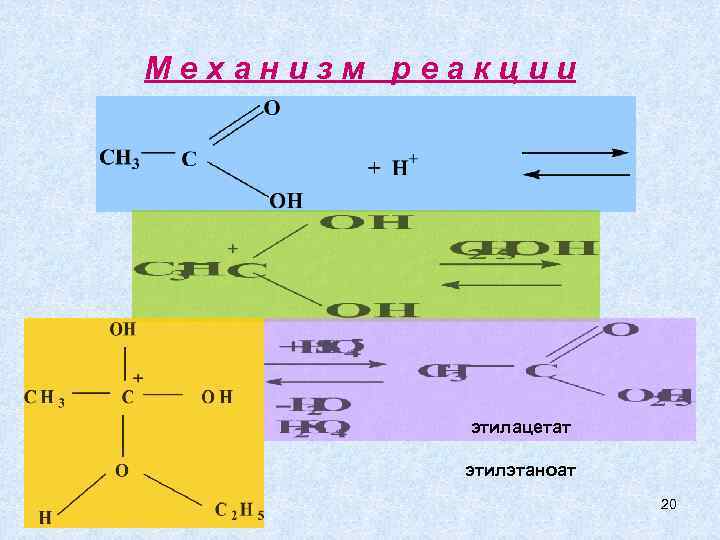
Механизм реакции этилацетат этилэтаноат 20
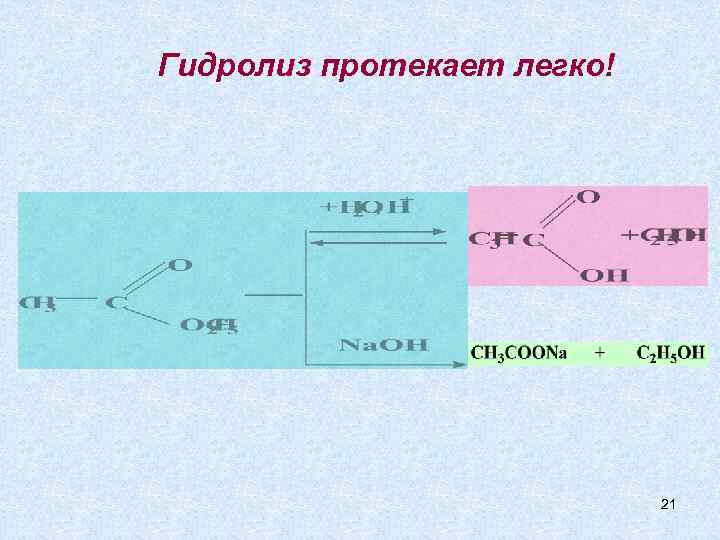
Гидролиз протекает легко! 21
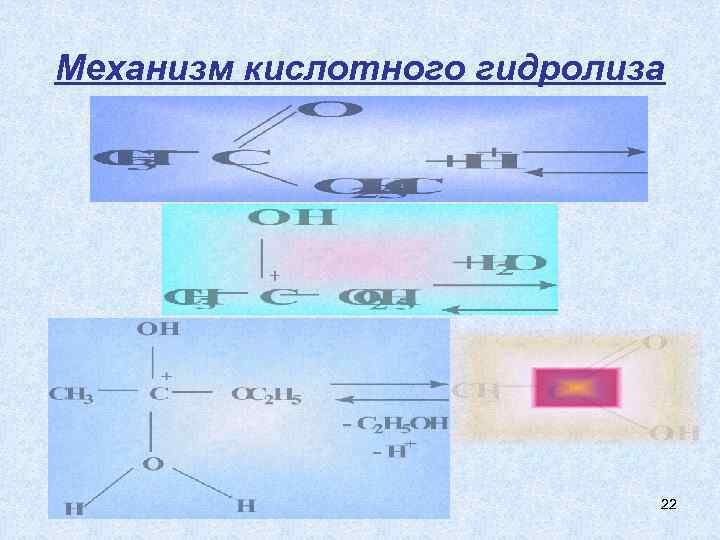
Механизм кислотного гидролиза 22

Механизм щелочного гидролиза Причина необратимости гидролиза в щелочной среде - образование стабильного карбоксилат – иона. 23

ЗНАЧЕНИЕ СЛОЖНЫХ ЭФИРОВ 1) Распространены в живой природе – входят в состав цветов, ягод, фруктов, определяя аромат. пентилацетат – банановый этилбутират – абрикосовый бензилацетат жасминовый 24
6. 5. Пентилацетат 7. Сложные эфиры, имеющие фруктовый запах Метилантранилат Октилацетат 25
10. Этилбутаноат 11. Изопентилацетат 26
8. Метилсалицилат 9. Этилацетат (растворитель для удаления маникюрного лака) 27
2) Многие лекарственные препараты – это сложные эфиры. фенилсалицилат салол 28
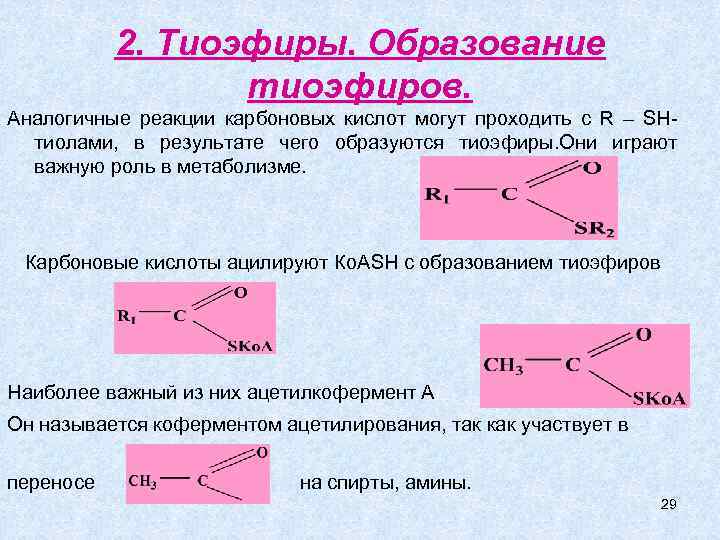
2. Тиоэфиры. Образование тиоэфиров. Аналогичные реакции карбоновых кислот могут проходить с R – SHтиолами, в результате чего образуются тиоэфиры. Они играют важную роль в метаболизме. Карбоновые кислоты ацилируют Ко. АSH с образованием тиоэфиров Наиболее важный из них ацетилкофермент А Он называется коферментом ацетилирования, так как участвует в переносе на спирты, амины. 29
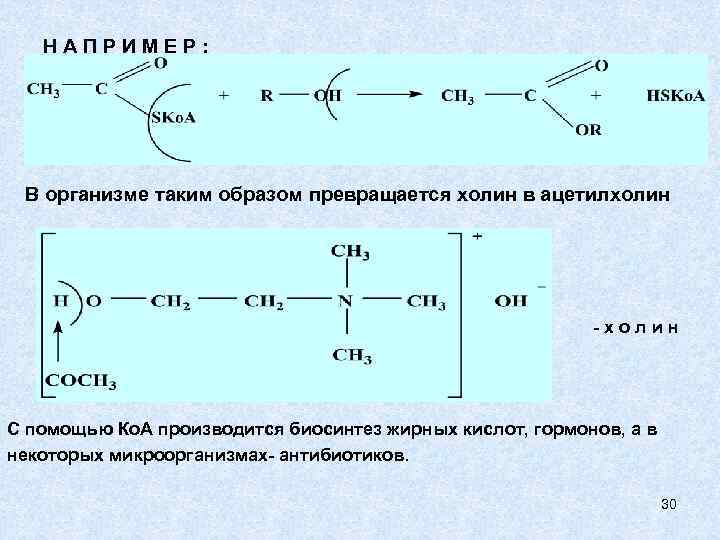
НАПРИМЕР: В организме таким образом превращается холин в ацетилхолин -холин С помощью Ко. А производится биосинтез жирных кислот, гормонов, а в некоторых микроорганизмах- антибиотиков. 30
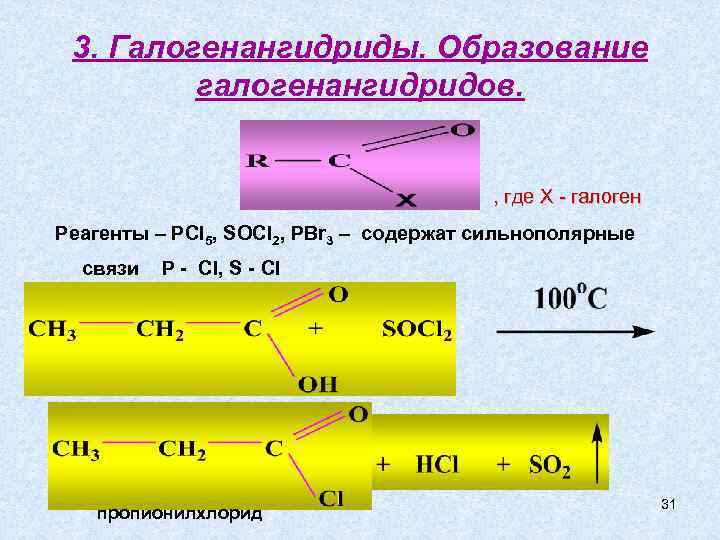
3. Галогенангидриды. Образование галогенангидридов. , где Х - галоген Реагенты – РCl 5, SOCl 2, PBr 3 – содержат сильнополярные связи Р - Cl, S - Cl пропионилхлорид 31

Хлорангидриды или ацилхлориды простых карбоновых кислот – жидкости, часто лакриматоры (вызывают слёзы). 32
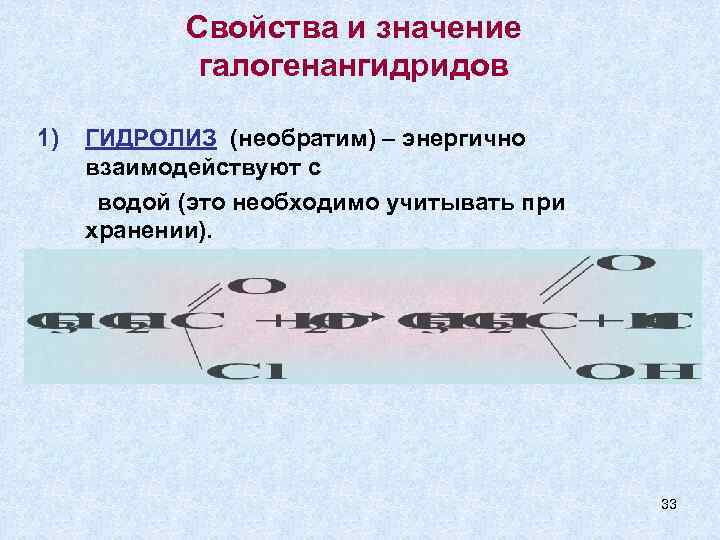
Свойства и значение галогенангидридов 1) ГИДРОЛИЗ (необратим) – энергично взаимодействуют с водой (это необходимо учитывать при хранении). 33

2) АЦИЛИРОВАНИЕ (ВВЕДЕНИЕ АЦИЛА) а) в ароматическое кольцо б) для защиты NH 2 ацетанилид Галогенангидриды обладают самой большой ацилирующей способностью среди функциональных производных! 34

Ряд по убыванию ацилирующей способности > > > 35
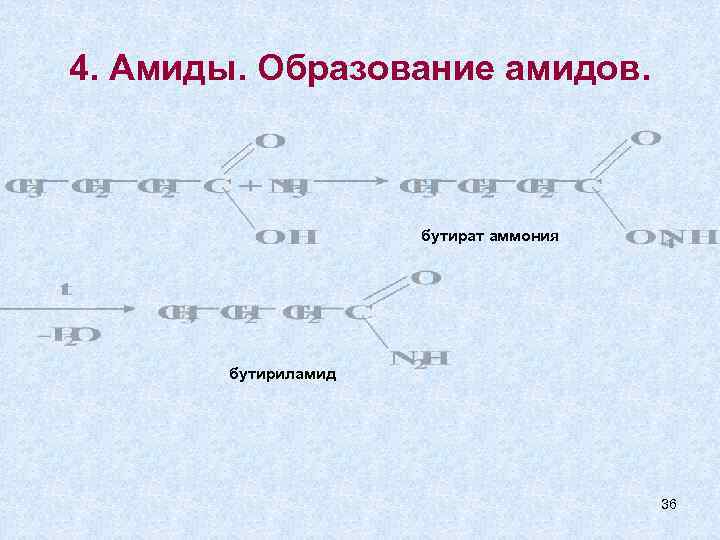
4. Амиды. Образование амидов. бутират аммония бутириламид 36

Амиды содержат амидную группировку, которая встречается в пептидах и белках! а) за счет р - сопряжения геометрия близка к плоской б) основные свойства азота понижены 37
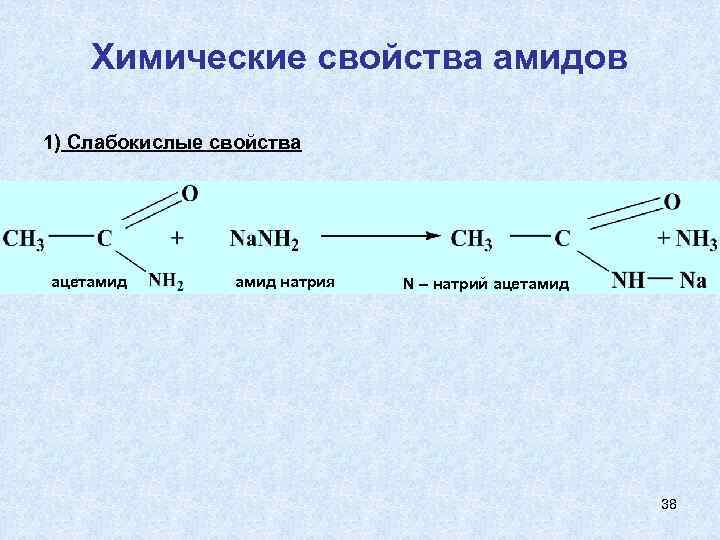
Химические свойства амидов 1) Слабокислые свойства ацетамид натрия N – натрий ацетамид 38
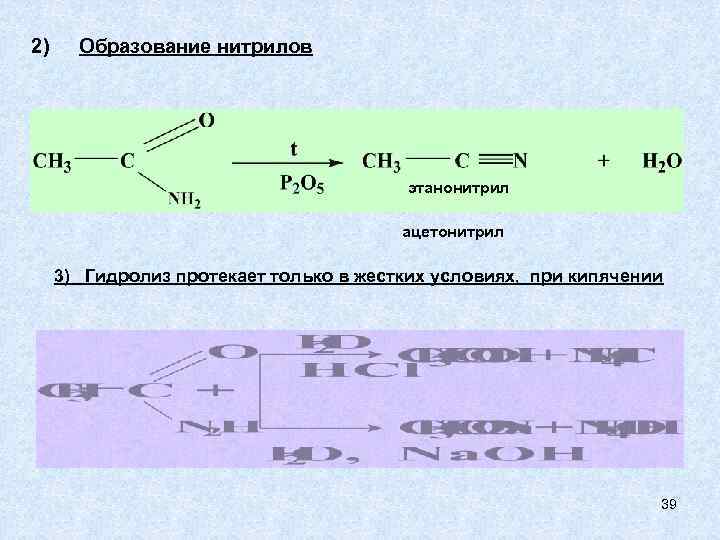
2) Образование нитрилов этанонитрил ацетонитрил 3) Гидролиз протекает только в жестких условиях, при кипячении 39
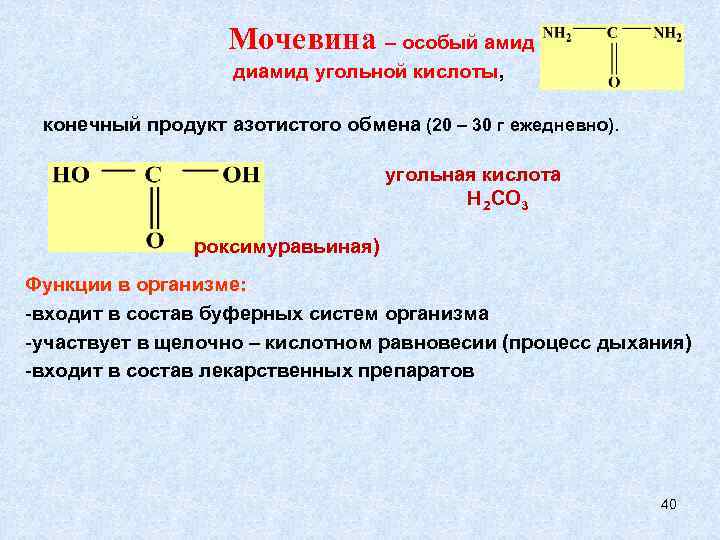
Мочевина – особый амид диамид угольной кислоты, конечный продукт азотистого обмена (20 – 30 г ежедневно). угольная кислота Н 2 СО 3 роксимуравьиная) Функции в организме: -входит в состав буферных систем организма -участвует в щелочно – кислотном равновесии (процесс дыхания) -входит в состав лекарственных препаратов 40
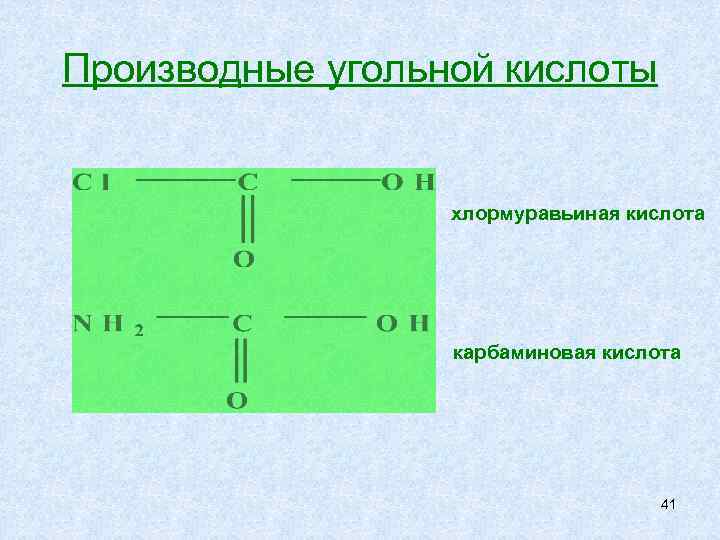
Производные угольной кислоты хлормуравьиная кислота карбаминовая кислота 41
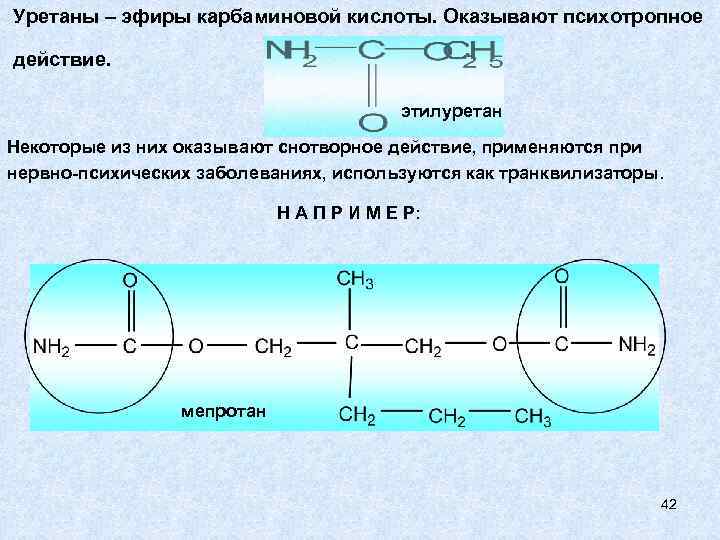
Уретаны – эфиры карбаминовой кислоты. Оказывают психотропное действие. этилуретан Некоторые из них оказывают снотворное действие, применяются при нервно-психических заболеваниях, используются как транквилизаторы. Н А П Р И М Е Р: мепротан 42
Уретаны – эфиры карбаминовой кислоты. Оказывают психотропное действие. Некоторые из них обладают снотворным эффектом, применяются при нервно -психических заболеваниях, используются как транквилизаторы. 43
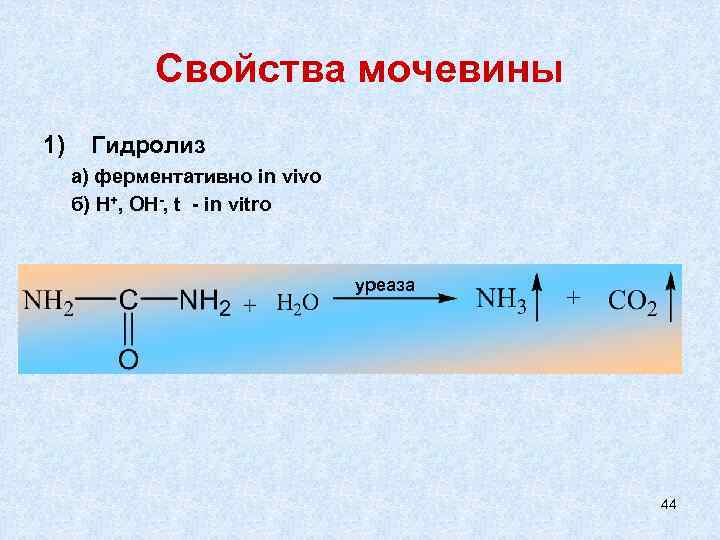
Свойства мочевины 1) Гидролиз а) ферментативно in vivo б) Н+, ОН-, t - in vitro уреаза 44
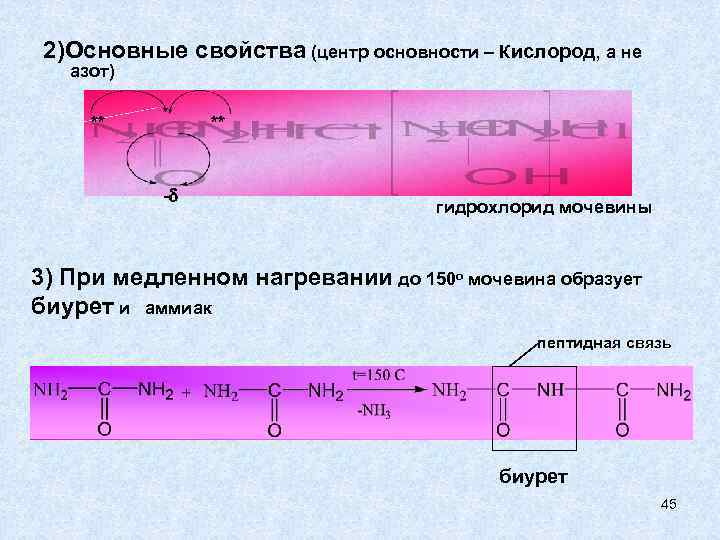
2)Основные свойства (центр основности – Кислород, а не азот) ** ** - гидрохлорид мочевины 3) При медленном нагревании до 150 о мочевина образует биурет и аммиак пептидная связь биурет 45
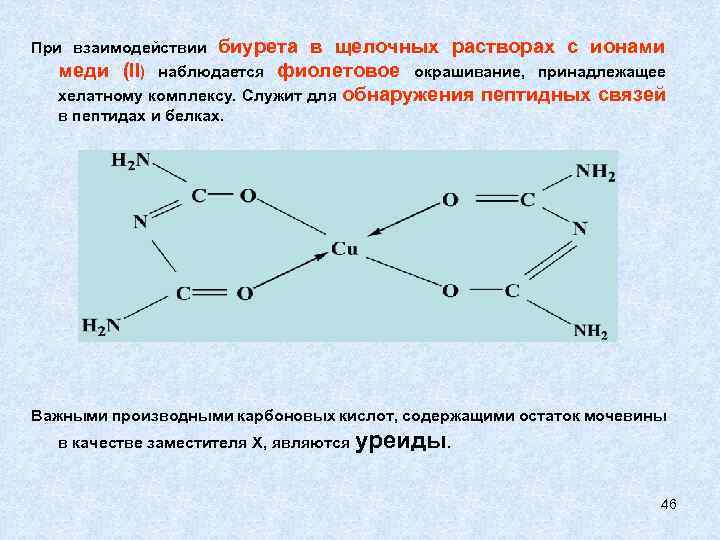
При взаимодействии биурета в щелочных растворах с ионами меди (II) наблюдается фиолетовое окрашивание, принадлежащее хелатному комплексу. Служит для в пептидах и белках. обнаружения пептидных связей Важными производными карбоновых кислот, содержащими остаток мочевины в качестве заместителя Х, являются уреиды. 46

5. Уреиды. Образование уреидов. - бромизовалерьяновая кислота уреид - бромизовалерьяновой кислоты Лекарственный препарат – бромизовал, бромурал – лёгкое снотворное: бром оказывает угнетающее действие на ЦНС, мочевина – смягчающее действие. 47
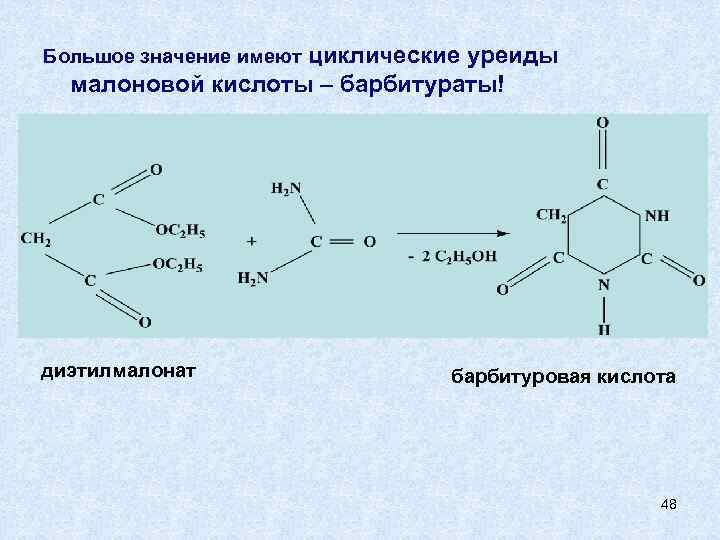
Большое значение имеют циклические уреиды малоновой кислоты – барбитураты! диэтилмалонат барбитуровая кислота 48
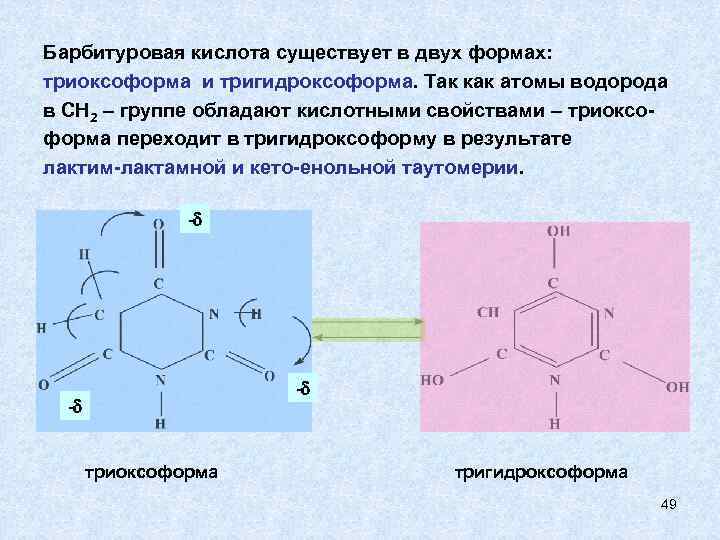
Барбитуровая кислота существует в двух формах: триоксоформа и тригидроксоформа. Так как атомы водорода в СН 2 – группе обладают кислотными свойствами – триоксоформа переходит в тригидроксоформу в результате лактим-лактамной и кето-енольной таутомерии. - - - триоксоформа тригидроксоформа 49
Лекарственные препараты (барбитураты) 50

Действие на организм • Барбитуровая кислота не оказывает ни снотворного ни наркотического действия; этой способностью обладают её производные • Барбитураты оказывают тормозящие влияние на ЦНС и используются в медицине в качестве успокаивающих средств, снотворных, противосудорожных средств( бензонал, бензобамил) и средств для наркоза( гексенал, тиопенталнатрий) 51

• Сон вызываемый барбитуратами отличается от естественного сна. Они облегчают засыпание, но укорачивают фазу интенсивного сна • В механизме действия барбитуратов играет роль их влияние на метаболические процессы мозга и на синоптическую передачу нервных импульсов, оказывают стимулирующие влияние на систему тормозного медиатора – ГАМК(гамма-аминомаслянной кислоты). 52
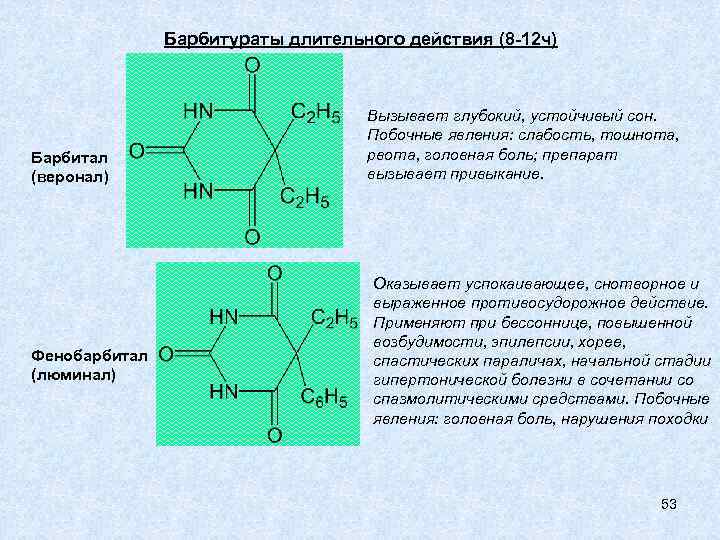
Барбитураты длительного действия (8 -12 ч) Барбитал (веронал) Фенобарбитал (люминал) Вызывает глубокий, устойчивый сон. Побочные явления: слабость, тошнота, рвота, головная боль; препарат вызывает привыкание. Оказывает успокаивающее, снотворное и выраженное противосудорожное действие. Применяют при бессоннице, повышенной возбудимости, эпилепсии, хорее, спастических параличах, начальной стадии гипертонической болезни в сочетании со спазмолитическими средствами. Побочные явления: головная боль, нарушения походки 53
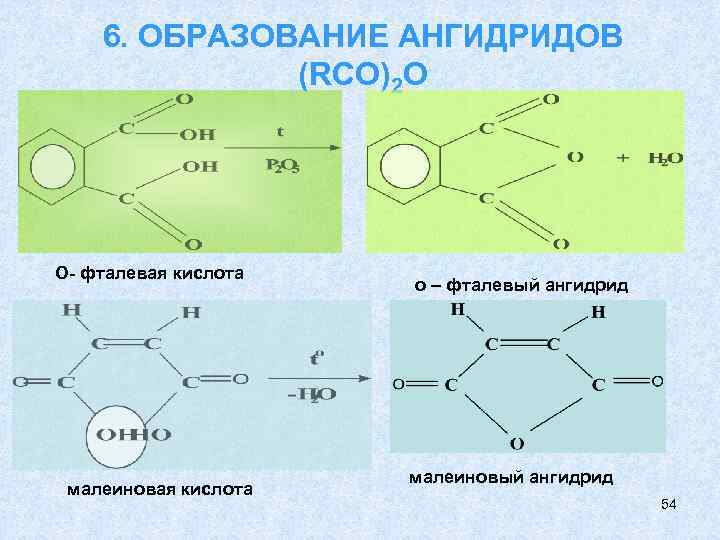
6. ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2 O О- фталевая кислота малеиновая кислота о – фталевый ангидрид малеиновый ангидрид 54
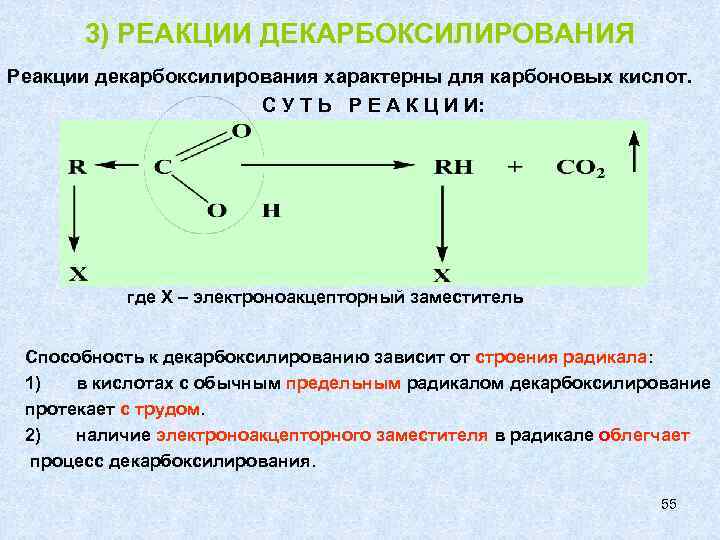
3) РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ Реакции декарбоксилирования характерны для карбоновых кислот. С У Т Ь Р Е А К Ц И И: где Х – электроноакцепторный заместитель Способность к декарбоксилированию зависит от строения радикала: 1) в кислотах с обычным предельным радикалом декарбоксилирование протекает с трудом. 2) наличие электроноакцепторного заместителя в радикале облегчает процесс декарбоксилирования. 55
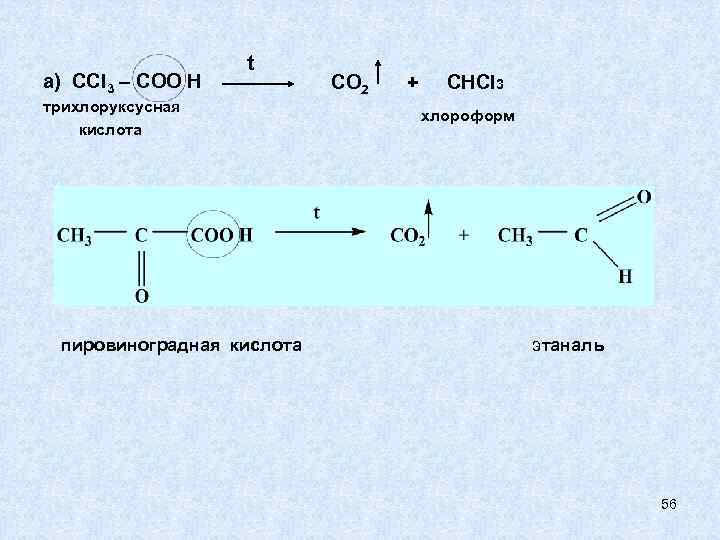
а) ССl 3 – COO H t трихлоруксусная кислота пировиноградная кислота CO 2 + CHCl 3 хлороформ этаналь 56
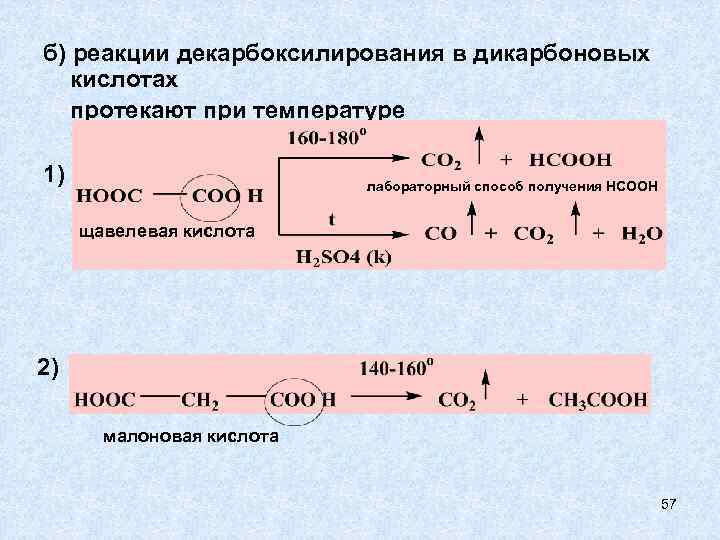
б) реакции декарбоксилирования в дикарбоновых кислотах протекают при температуре 1) лабораторный способ получения НСООН щавелевая кислота 2) малоновая кислота 57
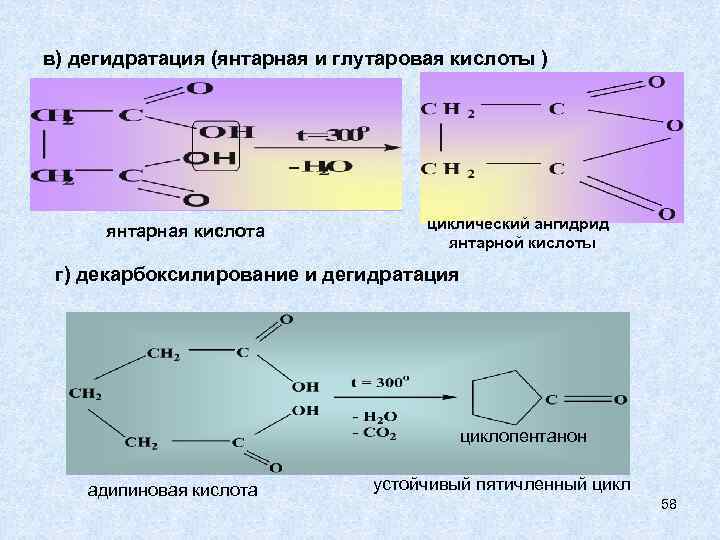
в) дегидратация (янтарная и глутаровая кислоты ) янтарная кислота циклический ангидрид янтарной кислоты г) декарбоксилирование и дегидратация циклопентанон адипиновая кислота устойчивый пятичленный цикл 58
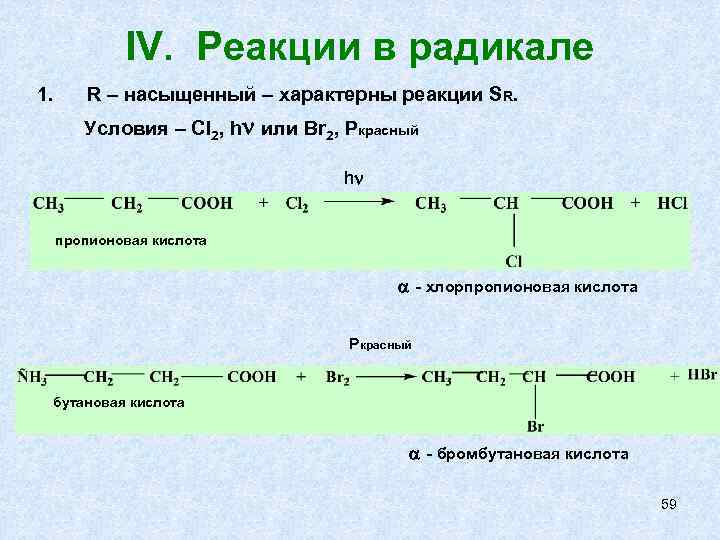
IV. Реакции в радикале 1. R – насыщенный – характерны реакции SR. Условия – Cl 2, h или Br 2, Pкрасный h пропионовая кислота - хлорпропионовая кислота Pкрасный бутановая кислота - бромбутановая кислота 59
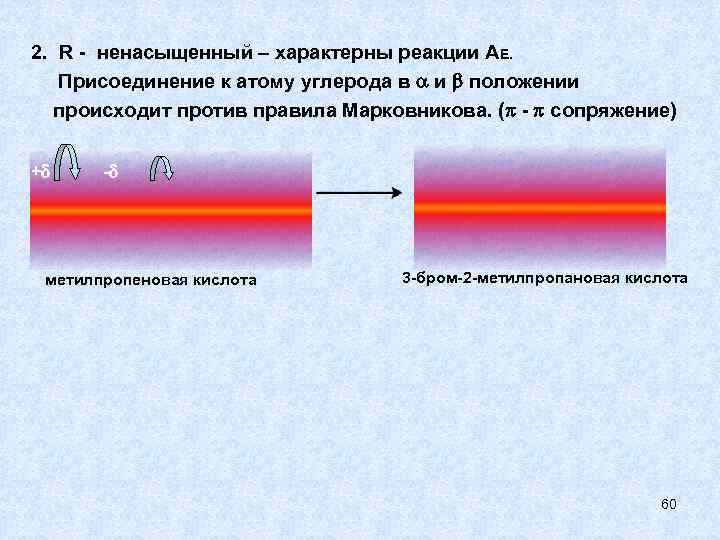
2. R - ненасыщенный – характерны реакции АЕ. Присоединение к атому углерода в и положении происходит против правила Марковникова. ( - сопряжение) + - метилпропеновая кислота 3 -бром-2 -метилпропановая кислота 60
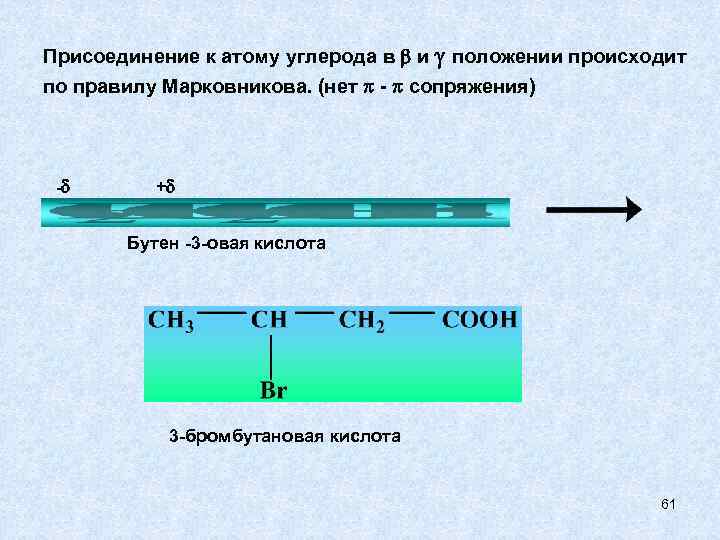
Присоединение к атому углерода в и положении происходит по правилу Марковникова. (нет - сопряжения) - + Бутен -3 -овая кислота 3 -бромбутановая кислота 61
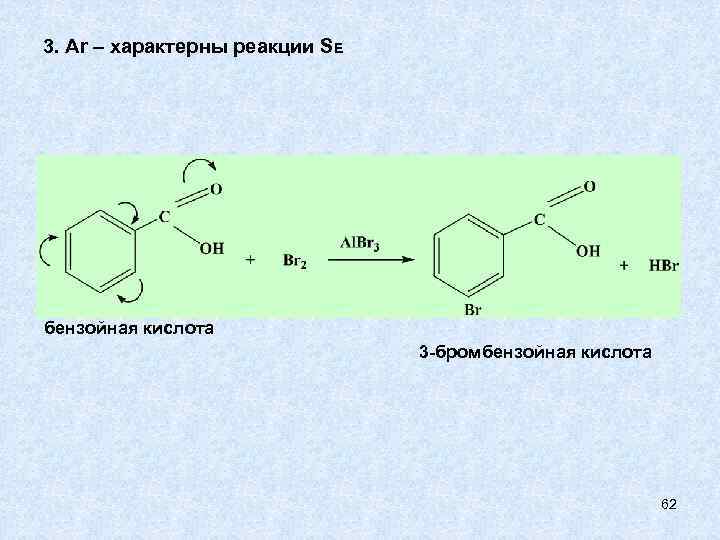
3. Ar – характерны реакции SE бензойная кислота 3 -бромбензойная кислота 62

НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ 1)Фумаровая – trans – бутендиовая , распространена в природе. Участвует в цикле трикарбоновых кислот, являясь промежуточным звеном. Получается в организме из янтарной и затем при гидратации образует яблочную. 2) Малеиновая – cis- бутендиовая – менее устойчивая, легко превращается в малеиновый ангидрид. 63
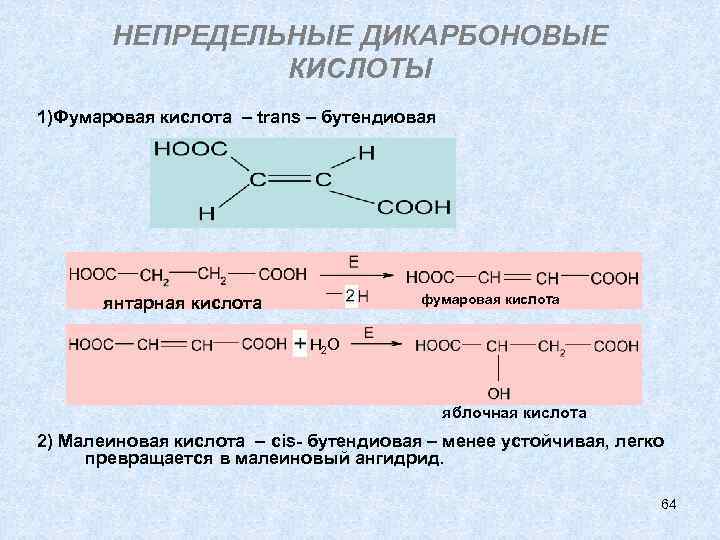
НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ 1)Фумаровая кислота – trans – бутендиовая фумаровая кислота янтарная кислота Н 2 О яблочная кислота 2) Малеиновая кислота – cis- бутендиовая – менее устойчивая, легко превращается в малеиновый ангидрид. 64
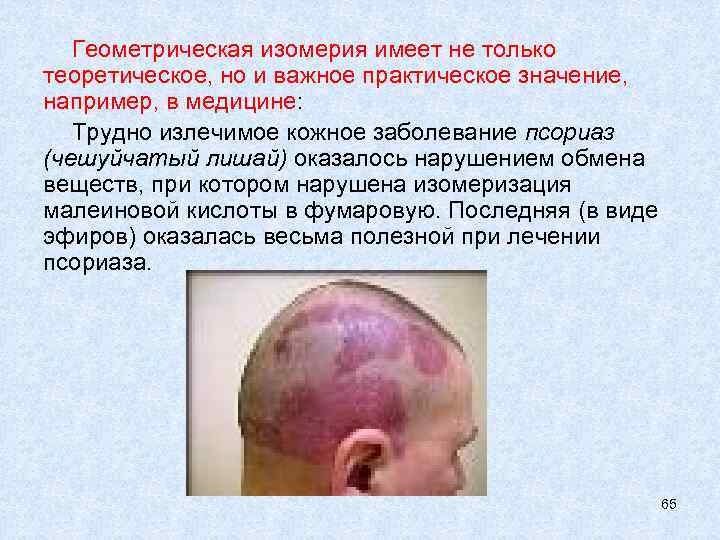
Геометрическая изомерия имеет не только теоретическое, но и важное практическое значение, например, в медицине: Трудно излечимое кожное заболевание псориаз (чешуйчатый лишай) оказалось нарушением обмена веществ, при котором нарушена изомеризация малеиновой кислоты в фумаровую. Последняя (в виде эфиров) оказалась весьма полезной при лечении псориаза. 65

Медико-биологическое значение Муравьиная кислота содержится в крапиве и выделениях желез муравьев; обладает раздражающим действием на кожу, может вызвать ожоги. Уксусная кислота – продукт уксусного брожения сахаров. В медицине применяется в виде солей. Ацетат калия СН 3 СООК – умеренное диуретическое средство; ацетат свинца (II) (CH 3 COO)2 Pb. 3 H 2 O – вяжущее средство, применяется при воспалительном заболевании кожи и слизистых оболочек. Уксусная кислота используется для консервирования продуктов. Масляная кислота имеет неприятный запах, содержится в прогоркшем масле и поте. Изовалериановая кислота находится в корнях валерианы; входит в состав валидола, настоек валерианы. Оказывает успокаивающее действие. Бензоат натрия – отхаркивающее и слабо дезинфицирующее средство. 66

Жиры. Фосфолипиды Липиды – большая и довольно разнообразная группа веществ, выполняющая чрезвычайно важные функции в организме: - Липиды – структурные компоненты клеточных мембран - Выполняют защитную функцию - В форме липидов транспортируется и запасается энергетическое топливо 67
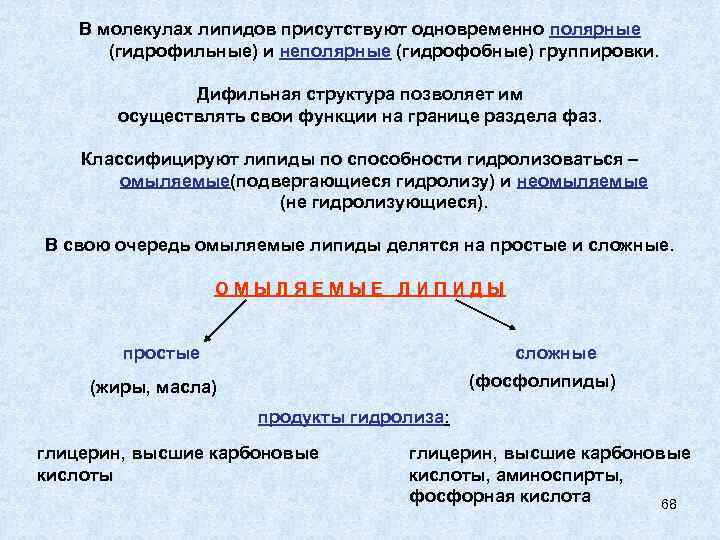
В молекулах липидов присутствуют одновременно полярные (гидрофильные) и неполярные (гидрофобные) группировки. Дифильная структура позволяет им осуществлять свои функции на границе раздела фаз. Классифицируют липиды по способности гидролизоваться – омыляемые(подвергающиеся гидролизу) и неомыляемые (не гидролизующиеся). В свою очередь омыляемые липиды делятся на простые и сложные. ОМЫЛЯЕМЫЕ ЛИПИДЫ простые сложные (фосфолипиды) (жиры, масла) продукты гидролиза: глицерин, высшие карбоновые кислоты, аминоспирты, фосфорная кислота 68
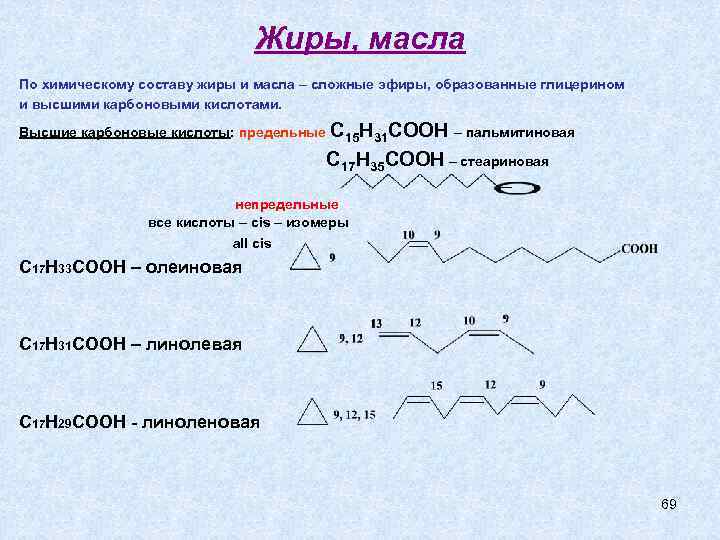
Жиры, масла По химическому составу жиры и масла – сложные эфиры, образованные глицерином и высшими карбоновыми кислотами. Высшие карбоновые кислоты: предельные С 15 Н 31 СООН – пальмитиновая С 17 Н 35 СООН – стеариновая непредельные все кислоты – cis – изомеры all cis С 17 Н 33 СООН – олеиновая С 17 Н 31 СООН – линолевая С 17 Н 29 СООН - линоленовая 69
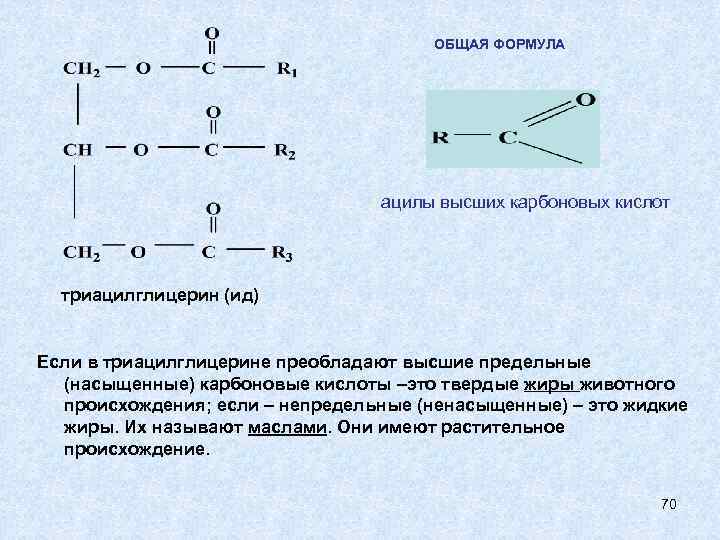
ОБЩАЯ ФОРМУЛА ацилы высших карбоновых кислот триацилглицерин (ид) Если в триацилглицерине преобладают высшие предельные (насыщенные) карбоновые кислоты –это твердые жиры животного происхождения; если – непредельные (ненасыщенные) – это жидкие жиры. Их называют маслами. Они имеют растительное происхождение. 70

ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ Из химических свойств особенно интересны гидрирование (присоединение) по двойной связи жидких жиров и гидролиз жиров. 1) Гидрирование или гидрогенизация для получения твердых жиров из масел 2) Гидролиз имеет большое значение в технологических и биохимических процессах При гидролизе фосфолипидов получается больше веществ, чем при гидролизе жиров: кроме высших карбоновых кислот и глицерина, образуются Н 3 РО 4 и аминоспирты, то есть 4 типа разных веществ. 71
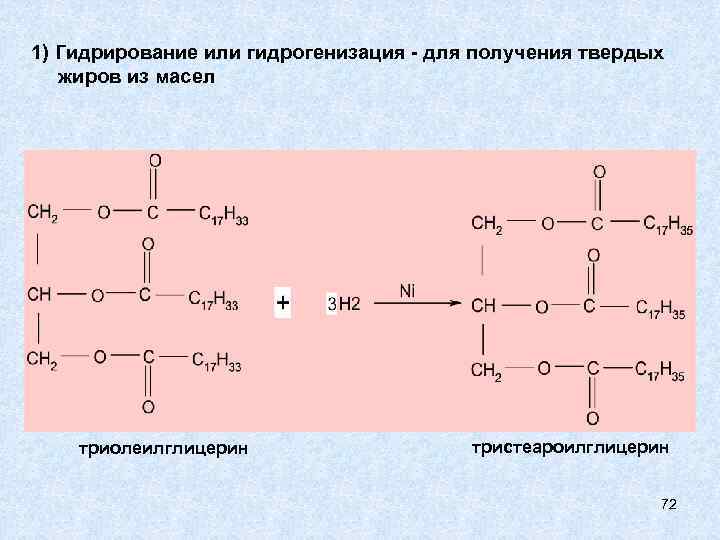
1) Гидрирование или гидрогенизация - для получения твердых жиров из масел триолеилглицерин тристеароилглицерин 72
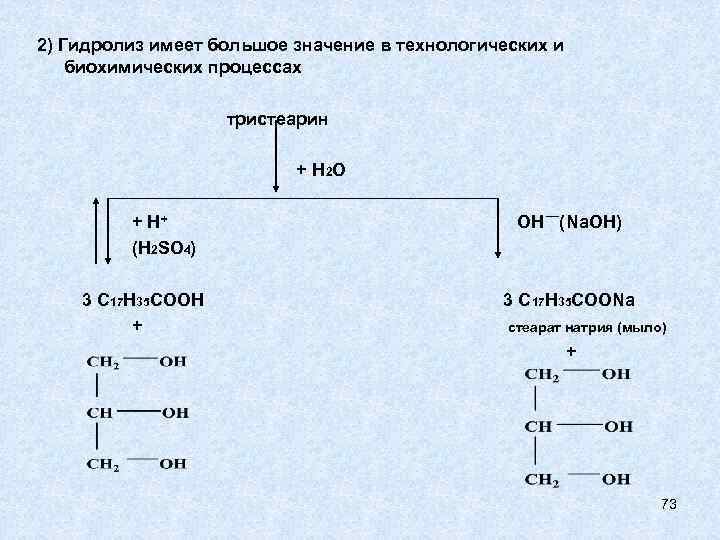
2) Гидролиз имеет большое значение в технологических и биохимических процессах тристеарин + Н 2 О + Н+ (H 2 SO 4) 3 С 17 Н 35 СООН + ОН (Na. OH) 3 С 17 Н 35 СООNa стеарат натрия (мыло) + 73
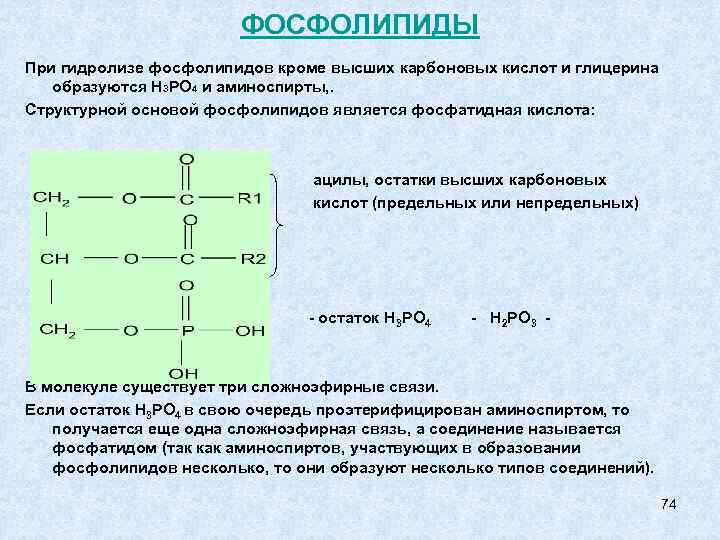
ФОСФОЛИПИДЫ При гидролизе фосфолипидов кроме высших карбоновых кислот и глицерина образуются Н 3 РО 4 и аминоспирты, . Структурной основой фосфолипидов является фосфатидная кислота: ацилы, остатки высших карбоновых кислот (предельных или непредельных) - остаток Н 3 РО 4 - Н 2 РО 3 - В молекуле существует три сложноэфирные связи. Если остаток Н 3 РО 4 в свою очередь проэтерифицирован аминоспиртом, то получается еще одна сложноэфирная связь, а соединение называется фосфатидом (так как аминоспиртов, участвующих в образовании фосфолипидов несколько, то они образуют несколько типов соединений). 74
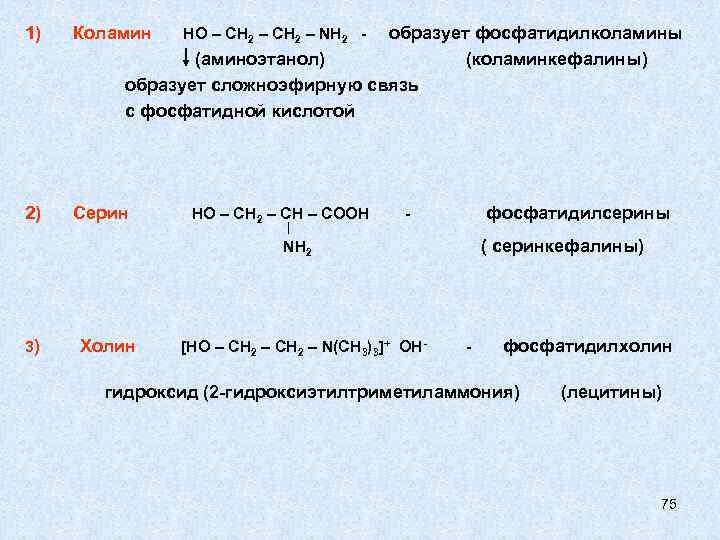
1) Коламин 2) Серин образует фосфатидилколамины (аминоэтанол) (коламинкефалины) образует сложноэфирную связь с фосфатидной кислотой НО – СН 2 – NH 2 - НО – СН 2 – СН – СООН фосфатидилсерины - ( серинкефалины) NH 2 3) Холин [НО – СН 2 – N(CH 3)3]+ ОН- - фосфатидилхолин гидроксид (2 -гидроксиэтилтриметиламмония) (лецитины) 75
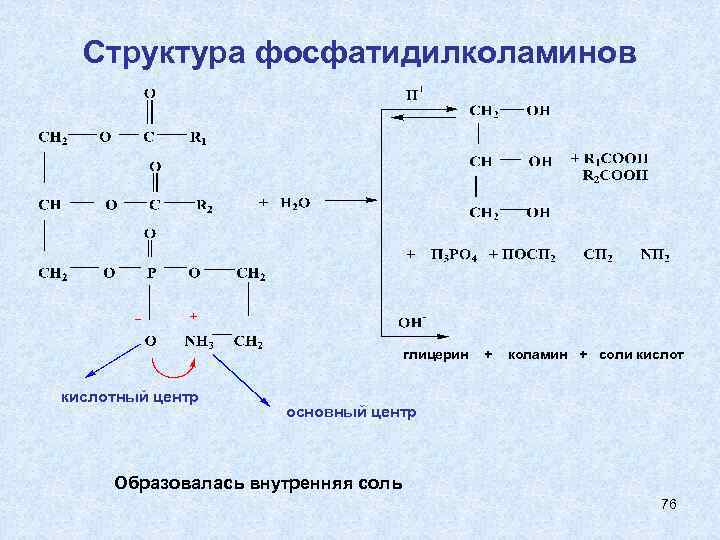
Структура фосфатидилколаминов глицерин кислотный центр + коламин + соли кислот основный центр Образовалась внутренняя соль 76
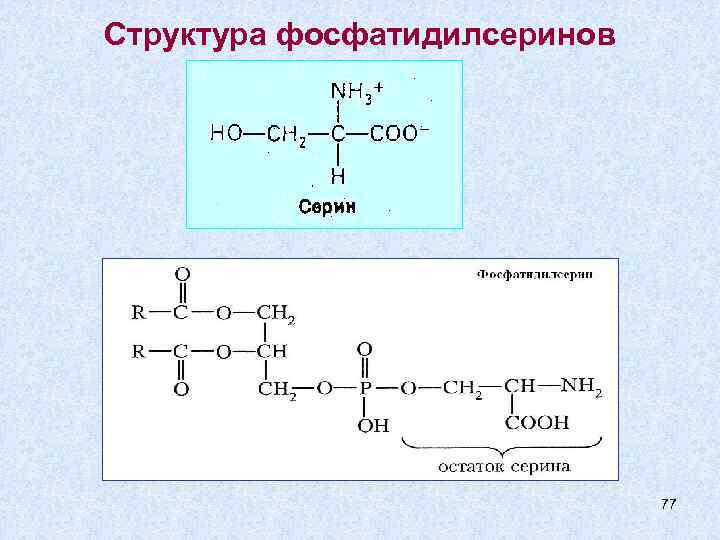
Структура фосфатидилсеринов 77
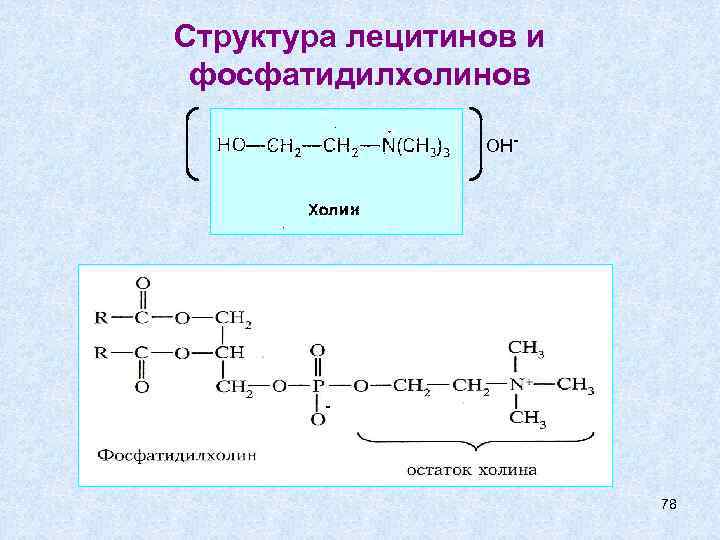
Структура лецитинов и фосфатидилхолинов OH- - 78

Фосфатидилхолины Наиболее распространенные глицерофосфолипиды – это фосфатидилхолины (лецитины). Лецитины - сложные эфиры глицерина с фосфорилхолином и двумя остатками жирных кислот, из которых одна ненасыщенная; содержатся во всех клетках, преимущественно в биологических мембранах, участвуя в процессах переноса через них различных веществ. 79
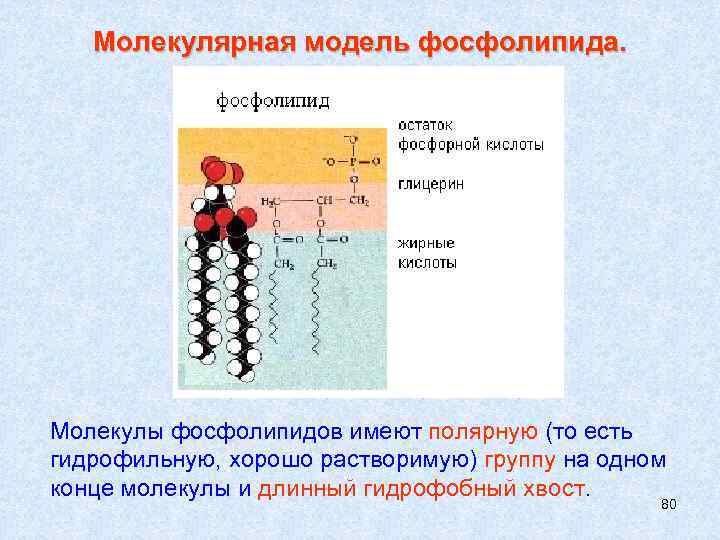
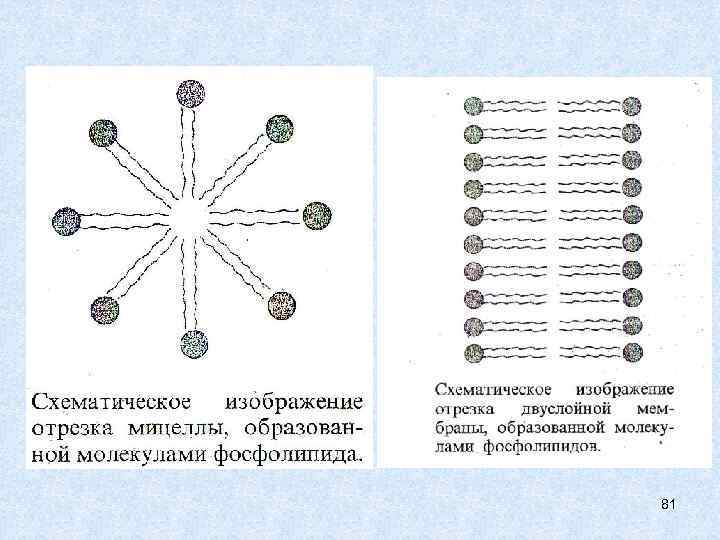
Молекулярная модель фосфолипида. Молекулы фосфолипидов имеют полярную (то есть гидрофильную, хорошо растворимую) группу на одном конце молекулы и длинный гидрофобный хвост. 80
81

Значение жирных кислот липидов Особо следует подчеркнуть роль полиненасыщенных линолевой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей в количестве около 5 г в сутки). Эти кислоты содержатся в основном в растительных маслах. Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза, для профилактики и лечения которого применяется линетол – смесь этиловых эфиров высших жирных непредельных кислот. 82

Простые липиды К простым омыляемым липидам относятся воска, жиры, масла. Воска – сложные эфиры высших жирных кислот и высших одноатомных спиртов. Они образуют защитную смазку на коже человека и животных и предохраняют растения от высыхания. Примером служит цетиловый эфир пальмитиновой кислоты. 83

Другой эфир пальмитиновой кислоты – мирицилпальмитат – содержится в пчелином воске. 84

СПАСИБО ЗА ВНИМАНИЕ! 85
07 Лекция Карбоновые кислоты.ppt