лекция 7 галог. продолжение. спирты.ppt
- Количество слайдов: 16
 Лекция 7 Галогенпроизводные Спирты
Лекция 7 Галогенпроизводные Спирты
 Некоторые реакции галогенпроизводных Получение спиртов, простых и сложных эфиров n n Нуклеофильных свойств воды и спиртов, как правило, не хватает для осуществления замещения галогена. Для получения спиртов из галогенпроизводных используют разбавленные водные растворы щелочей – нуклеофилом в этом случае выступает гораздо более активный гидроксил анион (ОН-).
Некоторые реакции галогенпроизводных Получение спиртов, простых и сложных эфиров n n Нуклеофильных свойств воды и спиртов, как правило, не хватает для осуществления замещения галогена. Для получения спиртов из галогенпроизводных используют разбавленные водные растворы щелочей – нуклеофилом в этом случае выступает гораздо более активный гидроксил анион (ОН-).
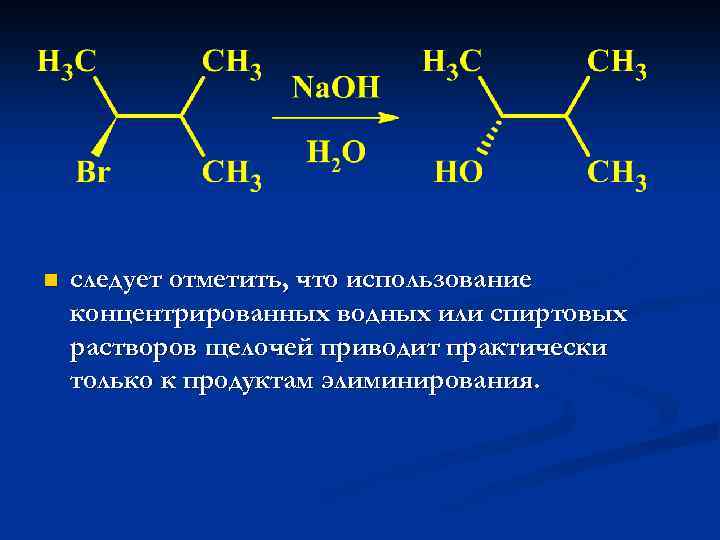 n следует отметить, что использование концентрированных водных или спиртовых растворов щелочей приводит практически только к продуктам элиминирования.
n следует отметить, что использование концентрированных водных или спиртовых растворов щелочей приводит практически только к продуктам элиминирования.
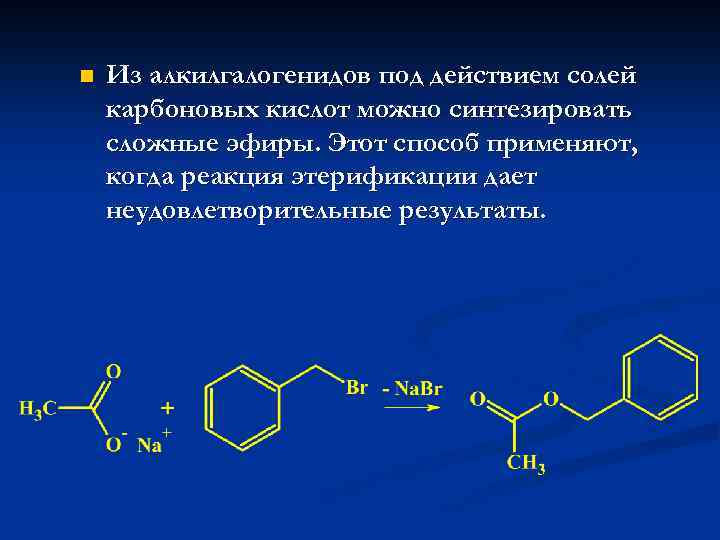 n Из алкилгалогенидов под действием солей карбоновых кислот можно синтезировать сложные эфиры. Этот способ применяют, когда реакция этерификации дает неудовлетворительные результаты.
n Из алкилгалогенидов под действием солей карбоновых кислот можно синтезировать сложные эфиры. Этот способ применяют, когда реакция этерификации дает неудовлетворительные результаты.
 Получение алкенов. n n n Использование в качестве оснований алкоголятов щелочных металлов приводит к образованию алкенов с высокими выходами. При использовании компактных оснований, таких как метилат натрия (Na. OCH 3) продукты элиминирования получаются по правилу Зайцева (из возможных образуется наиболее разветвленный алкен). Использование разветвленных, пространственно затрудненных оснований приводит к преимущественному образованию алкенов по правилу Гофмана (образуется наименее замещенный алкен).
Получение алкенов. n n n Использование в качестве оснований алкоголятов щелочных металлов приводит к образованию алкенов с высокими выходами. При использовании компактных оснований, таких как метилат натрия (Na. OCH 3) продукты элиминирования получаются по правилу Зайцева (из возможных образуется наиболее разветвленный алкен). Использование разветвленных, пространственно затрудненных оснований приводит к преимущественному образованию алкенов по правилу Гофмана (образуется наименее замещенный алкен).
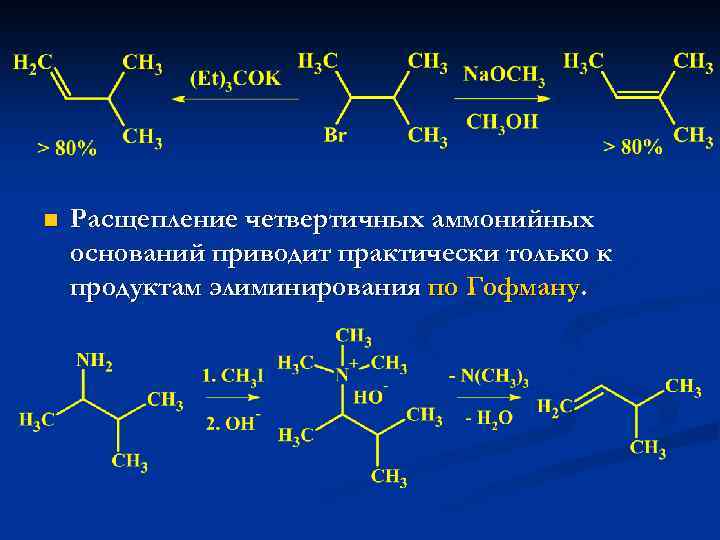 n Расщепление четвертичных аммонийных оснований приводит практически только к продуктам элиминирования по Гофману.
n Расщепление четвертичных аммонийных оснований приводит практически только к продуктам элиминирования по Гофману.
 Образование реактивов Гриньяра и литийорганичеких соединений (обращение полярности). n Многие алкилгалогениды реагируют с металлическим магнием в диэтиловом эфире или ТГФ без доступа влаги с образованием алкилмагнийгалогенидов – реактивов Гриньяра.
Образование реактивов Гриньяра и литийорганичеких соединений (обращение полярности). n Многие алкилгалогениды реагируют с металлическим магнием в диэтиловом эфире или ТГФ без доступа влаги с образованием алкилмагнийгалогенидов – реактивов Гриньяра.
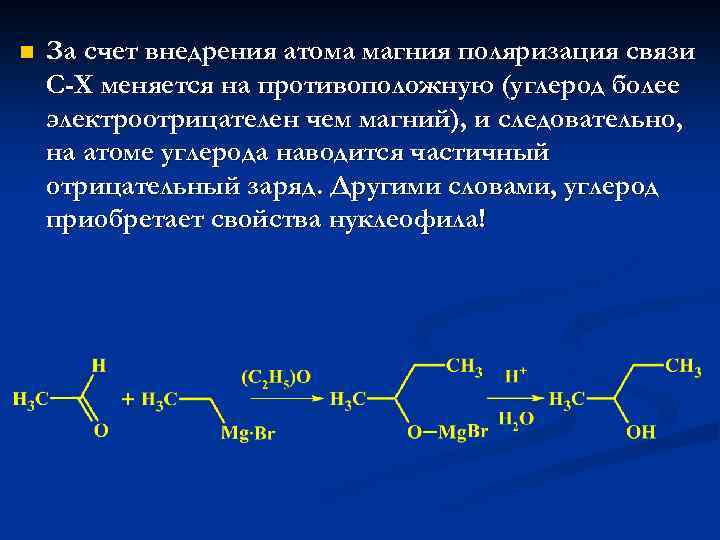 n За счет внедрения атома магния поляризация связи С-Х меняется на противоположную (углерод более электроотрицателен чем магний), и следовательно, на атоме углерода наводится частичный отрицательный заряд. Другими словами, углерод приобретает свойства нуклеофила!
n За счет внедрения атома магния поляризация связи С-Х меняется на противоположную (углерод более электроотрицателен чем магний), и следовательно, на атоме углерода наводится частичный отрицательный заряд. Другими словами, углерод приобретает свойства нуклеофила!
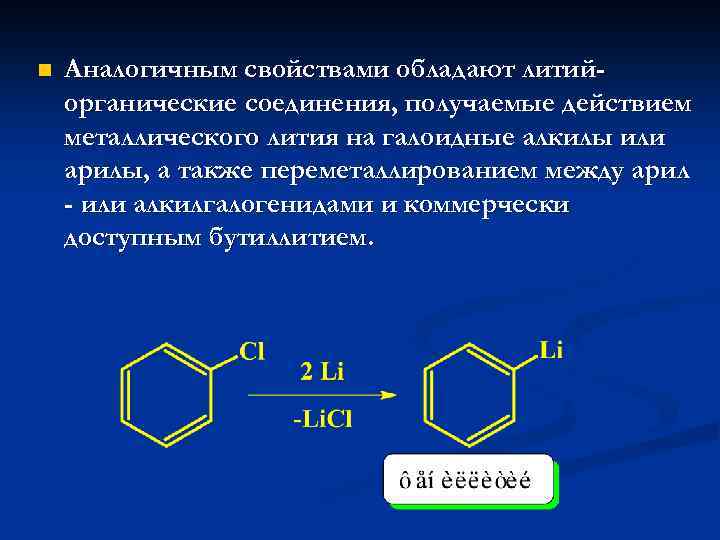 n Аналогичным свойствами обладают литийорганические соединения, получаемые действием металлического лития на галоидные алкилы или арилы, а также переметаллированием между арил - или алкилгалогенидами и коммерчески доступным бутиллитием.
n Аналогичным свойствами обладают литийорганические соединения, получаемые действием металлического лития на галоидные алкилы или арилы, а также переметаллированием между арил - или алкилгалогенидами и коммерчески доступным бутиллитием.
 Спирты фенолы и простые эфиры n Спирты фенолы и простые эфиры, формально можно считать производными воды, где один из водородов замещен на органический радикал (спирты и фенолы), или оба водорода замещены (простые эфиры).
Спирты фенолы и простые эфиры n Спирты фенолы и простые эфиры, формально можно считать производными воды, где один из водородов замещен на органический радикал (спирты и фенолы), или оба водорода замещены (простые эфиры).
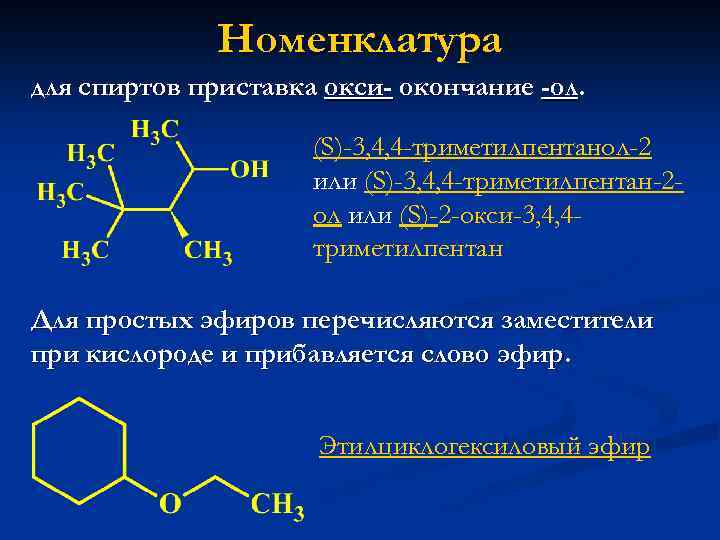 Номенклатура для спиртов приставка окси- окончание -ол. (S)-3, 4, 4 -триметилпентанол-2 или (S)-3, 4, 4 -триметилпентан-2 ол или (S)-2 -окси-3, 4, 4 триметилпентан Для простых эфиров перечисляются заместители при кислороде и прибавляется слово эфир. Этилциклогексиловый эфир
Номенклатура для спиртов приставка окси- окончание -ол. (S)-3, 4, 4 -триметилпентанол-2 или (S)-3, 4, 4 -триметилпентан-2 ол или (S)-2 -окси-3, 4, 4 триметилпентан Для простых эфиров перечисляются заместители при кислороде и прибавляется слово эфир. Этилциклогексиловый эфир
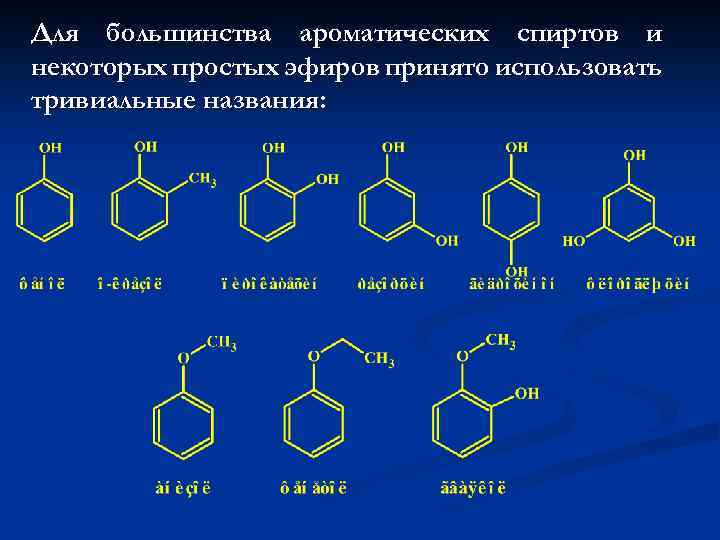 Для большинства ароматических спиртов и некоторых простых эфиров принято использовать тривиальные названия:
Для большинства ароматических спиртов и некоторых простых эфиров принято использовать тривиальные названия:
 n n Спирты дополнительно подразделяются на одноатомные (молекула содержит одну группу ОН), двухатомные и многоатомные (содержат две и более -ОН групп соответственно). Простейшим двухатомным спиртом является этандиол-1, 2 (этиленгликоль), а трехатомных – пропантриол 1, 2, 3 (глицерин). Также спирты подразделяют по степени замещенности атома углерода, с которым связана гидроксильная группа – первичные, вторичные и третичные. Эта дополнительная градация используется, потому что химические свойства спиртов в зависимости от замещенности сильно отличаются.
n n Спирты дополнительно подразделяются на одноатомные (молекула содержит одну группу ОН), двухатомные и многоатомные (содержат две и более -ОН групп соответственно). Простейшим двухатомным спиртом является этандиол-1, 2 (этиленгликоль), а трехатомных – пропантриол 1, 2, 3 (глицерин). Также спирты подразделяют по степени замещенности атома углерода, с которым связана гидроксильная группа – первичные, вторичные и третичные. Эта дополнительная градация используется, потому что химические свойства спиртов в зависимости от замещенности сильно отличаются.
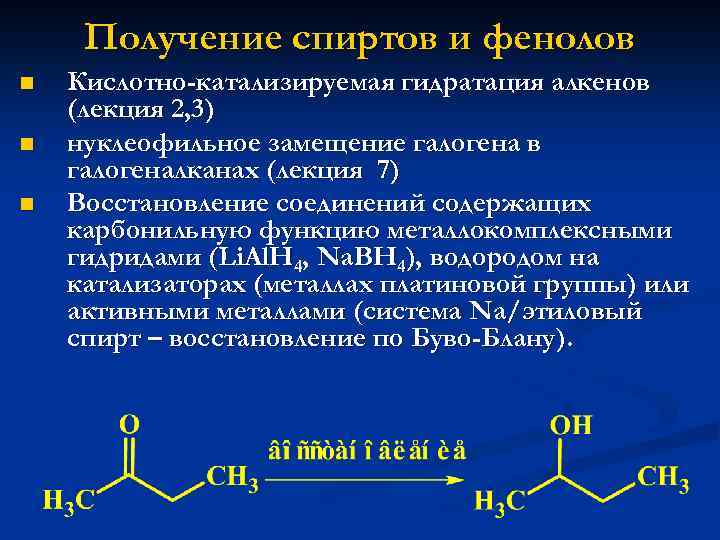 Получение спиртов и фенолов n n n Кислотно-катализируемая гидратация алкенов (лекция 2, 3) нуклеофильное замещение галогена в галогеналканах (лекция 7) Восстановление соединений содержащих карбонильную функцию металлокомплексными гидридами (Li. Al. H 4, Na. BH 4), водородом на катализаторах (металлах платиновой группы) или активными металлами (система Na/этиловый спирт – восстановление по Буво-Блану).
Получение спиртов и фенолов n n n Кислотно-катализируемая гидратация алкенов (лекция 2, 3) нуклеофильное замещение галогена в галогеналканах (лекция 7) Восстановление соединений содержащих карбонильную функцию металлокомплексными гидридами (Li. Al. H 4, Na. BH 4), водородом на катализаторах (металлах платиновой группы) или активными металлами (система Na/этиловый спирт – восстановление по Буво-Блану).
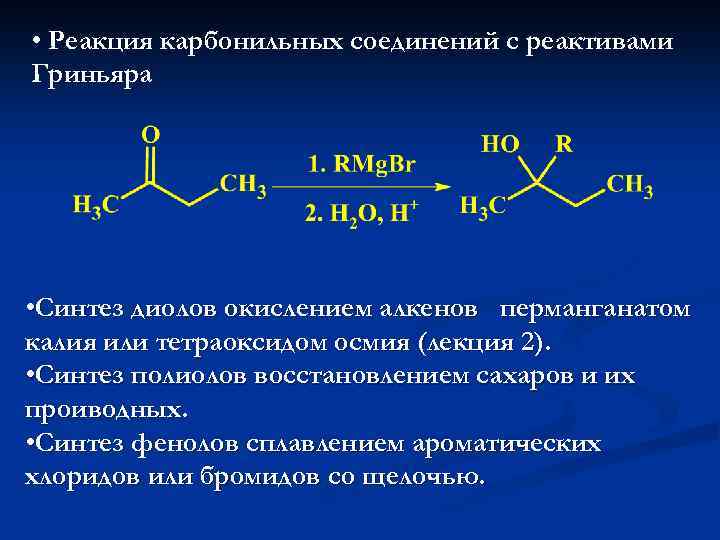 • Реакция карбонильных соединений с реактивами Гриньяра • Синтез диолов окислением алкенов перманганатом калия или тетраоксидом осмия (лекция 2). • Синтез полиолов восстановлением сахаров и их проиводных. • Синтез фенолов сплавлением ароматических хлоридов или бромидов со щелочью.
• Реакция карбонильных соединений с реактивами Гриньяра • Синтез диолов окислением алкенов перманганатом калия или тетраоксидом осмия (лекция 2). • Синтез полиолов восстановлением сахаров и их проиводных. • Синтез фенолов сплавлением ароматических хлоридов или бромидов со щелочью.
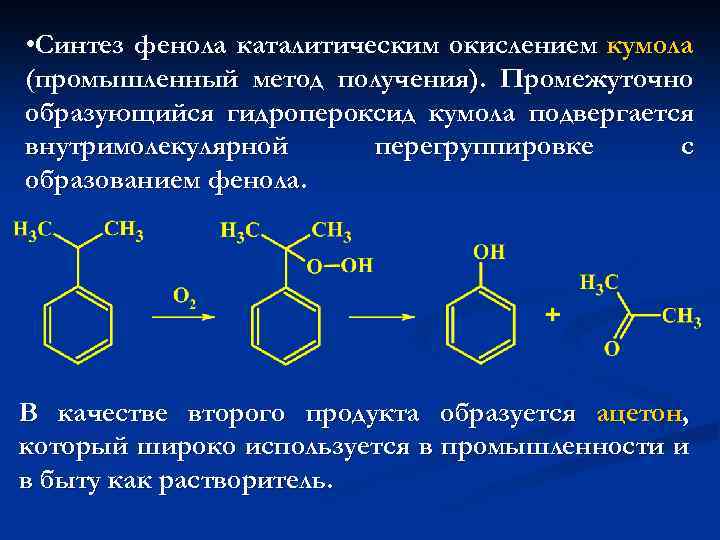 • Синтез фенола каталитическим окислением кумола (промышленный метод получения). Промежуточно образующийся гидропероксид кумола подвергается внутримолекулярной перегруппировке с образованием фенола. В качестве второго продукта образуется ацетон, который широко используется в промышленности и в быту как растворитель.
• Синтез фенола каталитическим окислением кумола (промышленный метод получения). Промежуточно образующийся гидропероксид кумола подвергается внутримолекулярной перегруппировке с образованием фенола. В качестве второго продукта образуется ацетон, который широко используется в промышленности и в быту как растворитель.


