Lektsia_7V_OP_OKh_Obob_ch_1.pptx
- Количество слайдов: 28
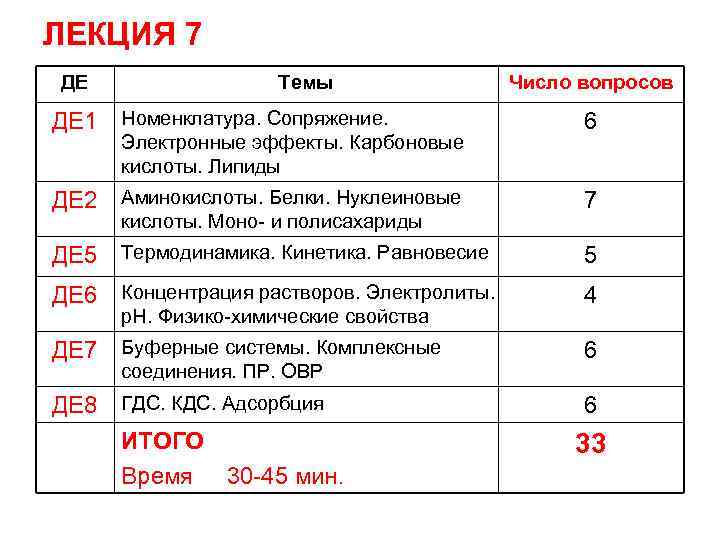 ЛЕКЦИЯ 7 ДЕ Темы Число вопросов ДЕ 1 Номенклатура. Сопряжение. 6 ДЕ 2 Аминокислоты. Белки. Нуклеиновые 7 ДЕ 5 Термодинамика. Кинетика. Равновесие 5 ДЕ 6 Концентрация растворов. Электролиты. 4 ДЕ 7 Буферные системы. Комплексные 6 ДЕ 8 ГДС. КДС. Адсорбция ИТОГО Время 30 -45 мин. 6 Электронные эффекты. Карбоновые кислоты. Липиды кислоты. Моно- и полисахариды р. Н. Физико-химические свойства соединения. ПР. ОВР 33
ЛЕКЦИЯ 7 ДЕ Темы Число вопросов ДЕ 1 Номенклатура. Сопряжение. 6 ДЕ 2 Аминокислоты. Белки. Нуклеиновые 7 ДЕ 5 Термодинамика. Кинетика. Равновесие 5 ДЕ 6 Концентрация растворов. Электролиты. 4 ДЕ 7 Буферные системы. Комплексные 6 ДЕ 8 ГДС. КДС. Адсорбция ИТОГО Время 30 -45 мин. 6 Электронные эффекты. Карбоновые кислоты. Липиды кислоты. Моно- и полисахариды р. Н. Физико-химические свойства соединения. ПР. ОВР 33
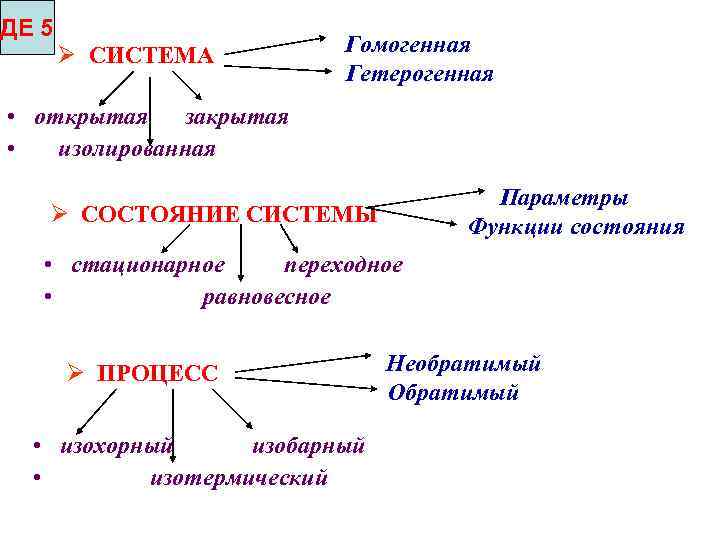 ДЕ 5 СИСТЕМА Гомогенная Гетерогенная • открытая закрытая • изолированная Параметры Функции состояния СОСТОЯНИЕ СИСТЕМЫ • стационарное переходное • равновесное ПРОЦЕСС • изохорный изобарный • изотермический Необратимый Обратимый
ДЕ 5 СИСТЕМА Гомогенная Гетерогенная • открытая закрытая • изолированная Параметры Функции состояния СОСТОЯНИЕ СИСТЕМЫ • стационарное переходное • равновесное ПРОЦЕСС • изохорный изобарный • изотермический Необратимый Обратимый
 Термодинамическая система – это тело(вещество) или группа тел (веществ), отделенных от окружающей среды границей раздела гомогенная, гетерогенная, открытая, закрытая, изолированная Е Е = const m = const Возможен обмен энергией с окружающей средой m = const E = const Возможен лишь переход одного вида энергии в другой Окружающая среда m Е Е = const m = const Возможен обмен веществом и энергией с окружающей средой
Термодинамическая система – это тело(вещество) или группа тел (веществ), отделенных от окружающей среды границей раздела гомогенная, гетерогенная, открытая, закрытая, изолированная Е Е = const m = const Возможен обмен энергией с окружающей средой m = const E = const Возможен лишь переход одного вида энергии в другой Окружающая среда m Е Е = const m = const Возможен обмен веществом и энергией с окружающей средой
 Процесс (обратимый, необратимый): • изохорный (V=const, ΔV=0), • изобарный (P=const, ΔP=0), • изотермический (T=const, ΔT=0)
Процесс (обратимый, необратимый): • изохорный (V=const, ΔV=0), • изобарный (P=const, ΔP=0), • изотермический (T=const, ΔT=0)
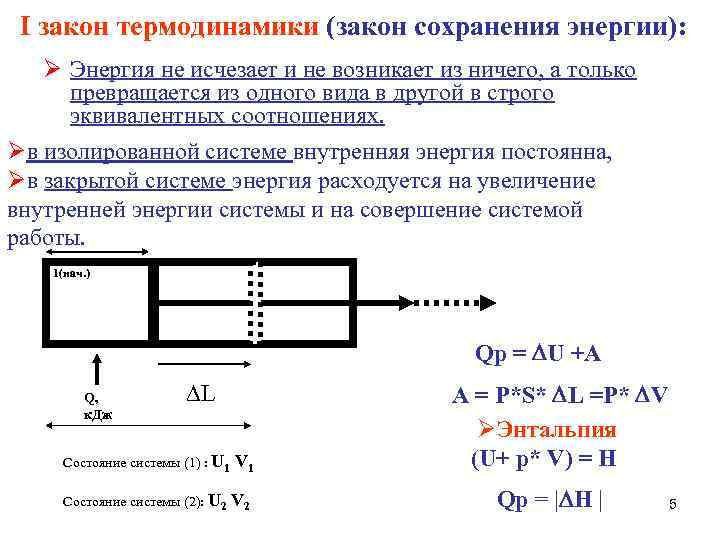 I закон термодинамики (закон сохранения энергии): Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях. в изолированной системе внутренняя энергия постоянна, в закрытой системе энергия расходуется на увеличение внутренней энергии системы и на совершение системой работы. 1(нач. ) Qp = U +A Q, к. Дж L Состояние системы (1) : U 1 V 1 Состояние системы (2): U 2 V 2 А = Р*S* L =P* V Энтальпия (U+ p* V) = H Qp = | H | 5
I закон термодинамики (закон сохранения энергии): Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях. в изолированной системе внутренняя энергия постоянна, в закрытой системе энергия расходуется на увеличение внутренней энергии системы и на совершение системой работы. 1(нач. ) Qp = U +A Q, к. Дж L Состояние системы (1) : U 1 V 1 Состояние системы (2): U 2 V 2 А = Р*S* L =P* V Энтальпия (U+ p* V) = H Qp = | H | 5
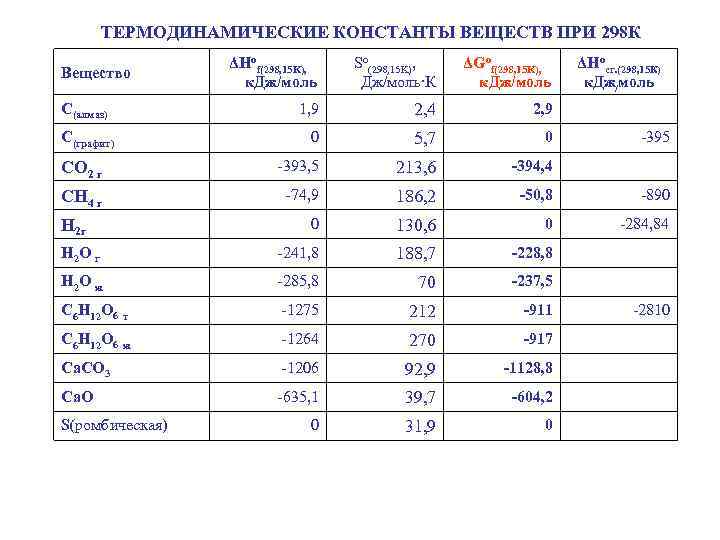 ТЕРМОДИНАМИЧЕСКИЕ КОНСТАНТЫ ВЕЩЕСТВ ПРИ 298 К ΔНоf(298, 15 K), к. Дж/моль So(298, 15 K), Дж/моль·К ΔGof(298, 15 K), к. Дж/моль 1, 9 2, 4 2, 9 0 5, 7 0 СО 2 г -393, 5 213, 6 -394, 4 СН 4 г -74, 9 186, 2 -50, 8 -890 0 130, 6 0 -284, 84 Н 2 О г -241, 8 188, 7 -228, 8 Н 2 О ж -285, 8 70 -237, 5 С 6 Н 12 О 6 т -1275 212 -911 С 6 Н 12 О 6 ж -1264 270 -917 Са. СО 3 -1206 92, 9 -1128, 8 Са. О -635, 1 39, 7 -604, 2 0 31, 9 0 Вещество С(алмаз) С(графит) Н 2 г S(ромбическая) ΔНосг. (298, 15 К) к. Дж/моль -395 -2810
ТЕРМОДИНАМИЧЕСКИЕ КОНСТАНТЫ ВЕЩЕСТВ ПРИ 298 К ΔНоf(298, 15 K), к. Дж/моль So(298, 15 K), Дж/моль·К ΔGof(298, 15 K), к. Дж/моль 1, 9 2, 4 2, 9 0 5, 7 0 СО 2 г -393, 5 213, 6 -394, 4 СН 4 г -74, 9 186, 2 -50, 8 -890 0 130, 6 0 -284, 84 Н 2 О г -241, 8 188, 7 -228, 8 Н 2 О ж -285, 8 70 -237, 5 С 6 Н 12 О 6 т -1275 212 -911 С 6 Н 12 О 6 ж -1264 270 -917 Са. СО 3 -1206 92, 9 -1128, 8 Са. О -635, 1 39, 7 -604, 2 0 31, 9 0 Вещество С(алмаз) С(графит) Н 2 г S(ромбическая) ΔНосг. (298, 15 К) к. Дж/моль -395 -2810
 Термохимические и термодинамические уравнения • Термохимические уравнения: • Pb(к) + O 2 (г) = Pb. O 2 (к) + Q(x) • Pb(к) + O 2 (г) = Pb. O 2 (к) + 276, 6 к. Дж Термодинамические уравнения: Pb(к) + O 2 (г) = Pb. O 2 (к) ΔН 0 х. р = - 276, 6 к. Дж (экзотермическая реакция)
Термохимические и термодинамические уравнения • Термохимические уравнения: • Pb(к) + O 2 (г) = Pb. O 2 (к) + Q(x) • Pb(к) + O 2 (г) = Pb. O 2 (к) + 276, 6 к. Дж Термодинамические уравнения: Pb(к) + O 2 (г) = Pb. O 2 (к) ΔН 0 х. р = - 276, 6 к. Дж (экзотермическая реакция)
 Следствия из закона Гесса: 1 -ое следствие - Закон Лавуазье-Лапласа: ΔНоразл = - ΔНообр. 2 -ое следствие: стандартная энтальпия реакции равна разности между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов): • ΔНор-и = ∑ νiΔНоf 298 прод. - ∑ νi ΔНоf 298 исх. 3 -ье следствие: стандартная : энтальпия реакции равна разности между суммой стандартных энтальпий сгорания исходных веществ и суммой стандартных энтальпий сгорания продуктов реакции (с учетом стехиометрических коэффициентов). • ΔНо 298 р-и = ∑ νi ΔНо сг. 298 (исх. в-в) - ∑ νi ΔНо сг. 298 (прод. р-и).
Следствия из закона Гесса: 1 -ое следствие - Закон Лавуазье-Лапласа: ΔНоразл = - ΔНообр. 2 -ое следствие: стандартная энтальпия реакции равна разности между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов): • ΔНор-и = ∑ νiΔНоf 298 прод. - ∑ νi ΔНоf 298 исх. 3 -ье следствие: стандартная : энтальпия реакции равна разности между суммой стандартных энтальпий сгорания исходных веществ и суммой стандартных энтальпий сгорания продуктов реакции (с учетом стехиометрических коэффициентов). • ΔНо 298 р-и = ∑ νi ΔНо сг. 298 (исх. в-в) - ∑ νi ΔНо сг. 298 (прод. р-и).
 Организм человека – система открытая, гетерогенная, может находиться в 3 состояниях: - стационарном(нормальная жизнедеятельность), - переходном(заболевание), - равновесном(смерть) В стационарном состоянии процессы в организме изобарно-изотермические
Организм человека – система открытая, гетерогенная, может находиться в 3 состояниях: - стационарном(нормальная жизнедеятельность), - переходном(заболевание), - равновесном(смерть) В стационарном состоянии процессы в организме изобарно-изотермические
 Основа биоэнергетики - Химическая термодинамика
Основа биоэнергетики - Химическая термодинамика
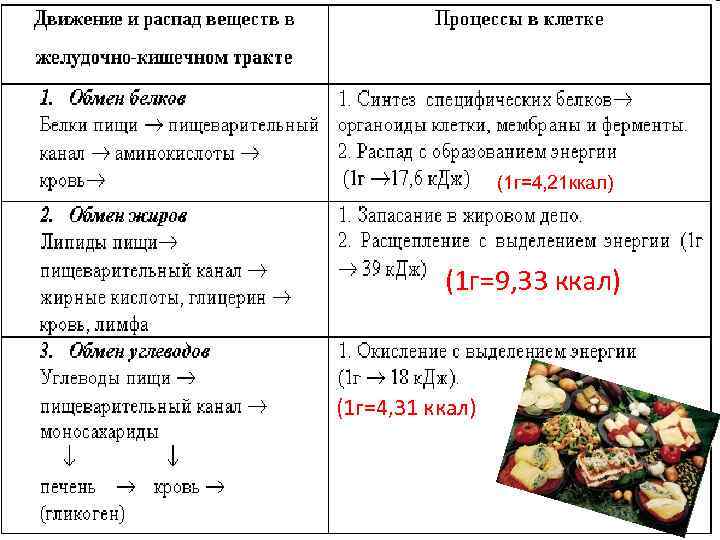 (1 г=4, 21 ккал) (1 г=9, 33 ккал) (1 г=4, 31 ккал)
(1 г=4, 21 ккал) (1 г=9, 33 ккал) (1 г=4, 31 ккал)
 Второй закон термодинамики определяет направление самопроизвольного процесса Самопроизвольный процесс – процесс, который совершается в системе без затрат работы извне и который уменьшает работоспособность системы. • В изолированной системе самопроизвольно совершаются только необратимые процессы, при которых энтропия возрастает. • В неизолированных системах имеется 2 тенденции: стремление системы существовать при минимальном запасе энергии, стремление системы к реализации в большем количестве возможных состояний т. е. к максимуму энтропии.
Второй закон термодинамики определяет направление самопроизвольного процесса Самопроизвольный процесс – процесс, который совершается в системе без затрат работы извне и который уменьшает работоспособность системы. • В изолированной системе самопроизвольно совершаются только необратимые процессы, при которых энтропия возрастает. • В неизолированных системах имеется 2 тенденции: стремление системы существовать при минимальном запасе энергии, стремление системы к реализации в большем количестве возможных состояний т. е. к максимуму энтропии.
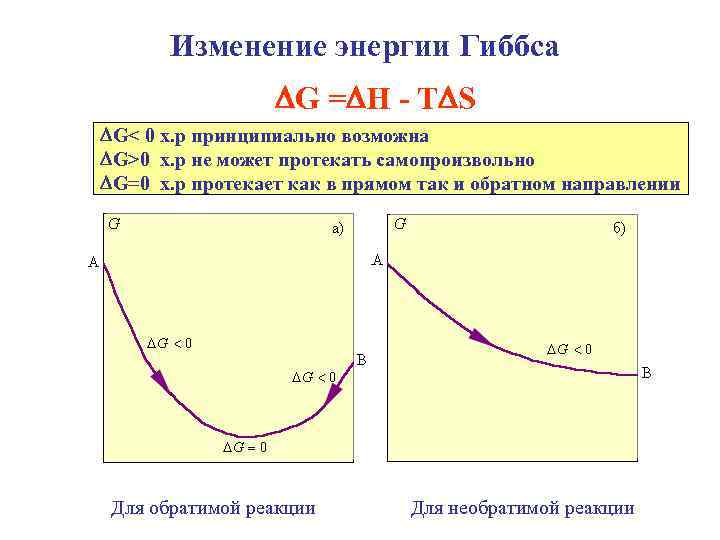 Изменение энергии Гиббса G = H - T S G< 0 х. р принципиально возможна G>0 х. р не может протекать самопроизвольно G=0 х. р протекает как в прямом так и обратном направлении Для обратимой реакции Для необратимой реакции
Изменение энергии Гиббса G = H - T S G< 0 х. р принципиально возможна G>0 х. р не может протекать самопроизвольно G=0 х. р протекает как в прямом так и обратном направлении Для обратимой реакции Для необратимой реакции
 Укажите системы, в которых возможно термодинамическое равновесие : 1) 2 N 2 (г) + О 2(г) = 2 N 2 O (г) , ΔH > 0 2) 2 NO(г) + О 2 (г) = 2 NO 2 (к) , ΔH < 0 3) NO(г) + NO 2 (г) = N 2 O 3 (к) , ΔH < 0 4) N 2 (г) + 2 О 2 (г) = 2 NO 2 (г) , ΔH > 0
Укажите системы, в которых возможно термодинамическое равновесие : 1) 2 N 2 (г) + О 2(г) = 2 N 2 O (г) , ΔH > 0 2) 2 NO(г) + О 2 (г) = 2 NO 2 (к) , ΔH < 0 3) NO(г) + NO 2 (г) = N 2 O 3 (к) , ΔH < 0 4) N 2 (г) + 2 О 2 (г) = 2 NO 2 (г) , ΔH > 0
 Закон действующих масс. Химическое равновесие а. А(г) + b. B(г) ↔ l. L(г) + d. D(г) . Закон действующих масс для равновесия: G=0 х. р протекает как в прямом так и обратном направлении
Закон действующих масс. Химическое равновесие а. А(г) + b. B(г) ↔ l. L(г) + d. D(г) . Закон действующих масс для равновесия: G=0 х. р протекает как в прямом так и обратном направлении
 Французский физико-химик Ле Шателье (1850 -1936) Принцип Ле-Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Французский физико-химик Ле Шателье (1850 -1936) Принцип Ле-Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
 ЗАКОН ВАНТ-ГОФФА • ЗАДАЧА 1. Скорость реакции увеличилась в 2 раза при увеличении температуры на 10 о. Чему равен температурный коэффициент? Как изменится скорость реакции при повышении температуры от 220 до 260 о. С ? • ЗАДАЧА 2. При температуре 220 о реакция заканчивается за 8 минут. За какое время произойдет реакция при температуре 260 о. С, если γ = 2?
ЗАКОН ВАНТ-ГОФФА • ЗАДАЧА 1. Скорость реакции увеличилась в 2 раза при увеличении температуры на 10 о. Чему равен температурный коэффициент? Как изменится скорость реакции при повышении температуры от 220 до 260 о. С ? • ЗАДАЧА 2. При температуре 220 о реакция заканчивается за 8 минут. За какое время произойдет реакция при температуре 260 о. С, если γ = 2?
 ДЕ 5: Основные законы : 1. I закон термодинамики 2. II закон термодинамики 3. Закон Гесса и следствия 4. Изобарно-изотермический потенциал. Критерии самопроизвольных процессов 5. Закон действующих масс 6. Принцип Ле Шателье 7. Закон Вант Гоффа
ДЕ 5: Основные законы : 1. I закон термодинамики 2. II закон термодинамики 3. Закон Гесса и следствия 4. Изобарно-изотермический потенциал. Критерии самопроизвольных процессов 5. Закон действующих масс 6. Принцип Ле Шателье 7. Закон Вант Гоффа
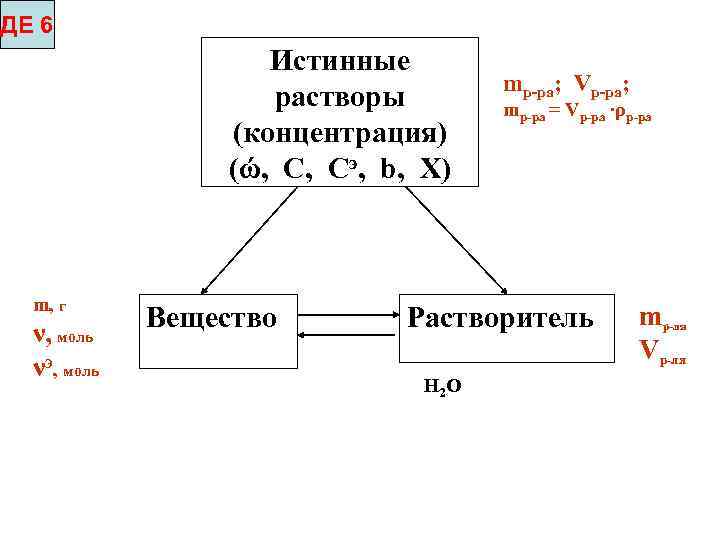 ДЕ 6 Истинные растворы (концентрация) (ώ, С, Сэ, b, Х) m, г ν, моль νэ, моль Вещество mр-ра; Vp-pa; mр-ра = Vp-pa ∙ρp-pa Растворитель Н 2 О mр-ля Vр-ля
ДЕ 6 Истинные растворы (концентрация) (ώ, С, Сэ, b, Х) m, г ν, моль νэ, моль Вещество mр-ра; Vp-pa; mр-ра = Vp-pa ∙ρp-pa Растворитель Н 2 О mр-ля Vр-ля
![Ионное произведение воды Kw = [H+][OH-] = f(T) Kw = 10 -14 (t = Ионное произведение воды Kw = [H+][OH-] = f(T) Kw = 10 -14 (t =](https://present5.com/presentation/10409068_143272301/image-20.jpg) Ионное произведение воды Kw = [H+][OH-] = f(T) Kw = 10 -14 (t = 25 o. C) р. Н = -lg СН+ ; p. OH = -lg СОН- р. Н + р. ОН = 14 (25 o. C) t = 25 o. C р. Н = р. ОН = 7; р. Н + р. ОН = 13, 61 (37 о. С) t = 37 о. С р. Н = р. ОН = 6, 805
Ионное произведение воды Kw = [H+][OH-] = f(T) Kw = 10 -14 (t = 25 o. C) р. Н = -lg СН+ ; p. OH = -lg СОН- р. Н + р. ОН = 14 (25 o. C) t = 25 o. C р. Н = р. ОН = 7; р. Н + р. ОН = 13, 61 (37 о. С) t = 37 о. С р. Н = р. ОН = 6, 805
 Теория электролитической диссоциации Электролиты сильные ( > 33 %). средние (3 < 33 %) Сильные: Na. Cl Na+ + Cl. HCl H+ + Cl- Слабые: CН 3 СООН NH 4 OH слабые ( 3 %) Н+ + CН 3 СООNH 4+ + OH- Закон Оствальда a = f *C р. Н = - lg C H+ р. Н = 0, 5( р. К + р. Ск )
Теория электролитической диссоциации Электролиты сильные ( > 33 %). средние (3 < 33 %) Сильные: Na. Cl Na+ + Cl. HCl H+ + Cl- Слабые: CН 3 СООН NH 4 OH слабые ( 3 %) Н+ + CН 3 СООNH 4+ + OH- Закон Оствальда a = f *C р. Н = - lg C H+ р. Н = 0, 5( р. К + р. Ск )
 Осмос в дисперсных системах • Осмос – это диффузия растворителя через полупроницаемую мембрану в раствор с большей концентрацией • Осмотическое давление это величина гидравлического давления, которое необходимо приложить к раствору, чтобы осмос прекратился Уравнение Вант-Гоффа: π = C∙R∙T (для неэлектролитов). π = i∙C∙R∙T (для электролитов) i = 1 + α(n – 1) 2 - концентрированный раствор 3 - растворитель 4 - мембрана i - изотонический коэффициент α – степень ионизации электролита n – число ч-ц, которые образуются при ионизации π – осмотическое давление, н/м 2 (Па); С– молярная концентрация, моль/л; R– газовая постоянная(8, 3 Дж/моль∙К); Т– температура, К.
Осмос в дисперсных системах • Осмос – это диффузия растворителя через полупроницаемую мембрану в раствор с большей концентрацией • Осмотическое давление это величина гидравлического давления, которое необходимо приложить к раствору, чтобы осмос прекратился Уравнение Вант-Гоффа: π = C∙R∙T (для неэлектролитов). π = i∙C∙R∙T (для электролитов) i = 1 + α(n – 1) 2 - концентрированный раствор 3 - растворитель 4 - мембрана i - изотонический коэффициент α – степень ионизации электролита n – число ч-ц, которые образуются при ионизации π – осмотическое давление, н/м 2 (Па); С– молярная концентрация, моль/л; R– газовая постоянная(8, 3 Дж/моль∙К); Т– температура, К.
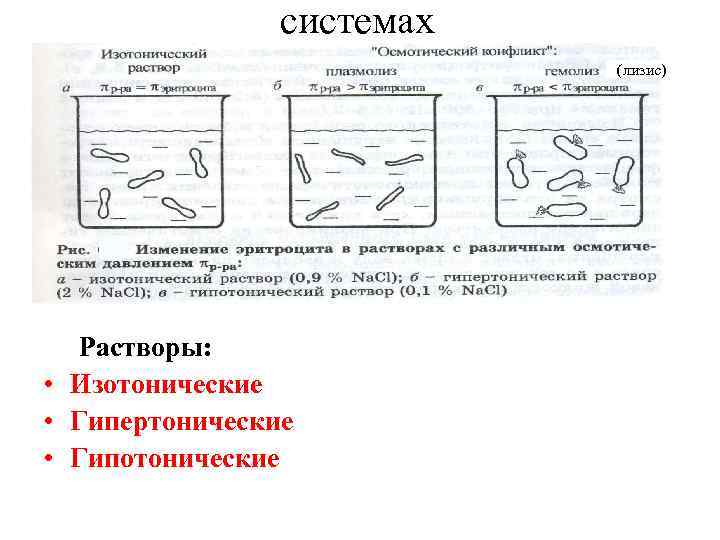 системах (лизис) Растворы: • Изотонические • Гипертонические • Гипотонические
системах (лизис) Растворы: • Изотонические • Гипертонические • Гипотонические
 ДЕ 6: Состав и свойства растворов электролитов Состав: виды растворов концентраций Свойства растворов: ТЭД(ДС), осмос(ДСреда)
ДЕ 6: Состав и свойства растворов электролитов Состав: виды растворов концентраций Свойства растворов: ТЭД(ДС), осмос(ДСреда)
 ДЕ 7 Буферные системы (или буферы) – - это растворы, обладающие свойством сохранять постоянство концентрации водородных ионов (р. Н) при добавлении небольших количеств кислот, щелочей или при разбавлении. I тип - растворы, содержащие слабую кислоту(донор протона) и соль этой кислоты(акцептор протона) II тип - растворы, содержащие слабое основание(акцептор протона) и соль этого основания(донор протона)
ДЕ 7 Буферные системы (или буферы) – - это растворы, обладающие свойством сохранять постоянство концентрации водородных ионов (р. Н) при добавлении небольших количеств кислот, щелочей или при разбавлении. I тип - растворы, содержащие слабую кислоту(донор протона) и соль этой кислоты(акцептор протона) II тип - растворы, содержащие слабое основание(акцептор протона) и соль этого основания(донор протона)
 РАСЧЕТ р. Н БУФЕРНЫХ СИСТЕМ ведется по формулам: (уравнения Гендерсона – Гассельбаха) - для систем I типа - для систем II типа
РАСЧЕТ р. Н БУФЕРНЫХ СИСТЕМ ведется по формулам: (уравнения Гендерсона – Гассельбаха) - для систем I типа - для систем II типа
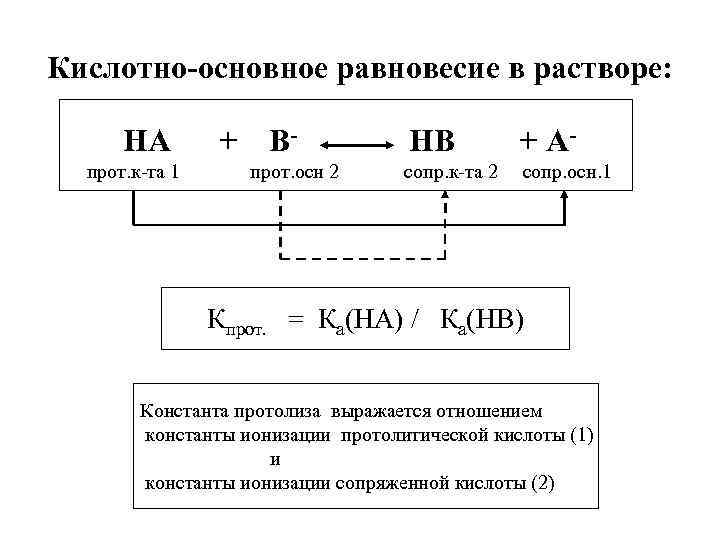 Кислотно-основное равновесие в растворе: HA прот. к-та 1 + Bпрот. осн 2 HB + A- сопр. к-та 2 сопр. осн. 1 Кпрот. = Ка(НА) / Ка(НВ) Константа протолиза выражается отношением константы ионизации протолитической кислоты (1) и константы ионизации сопряженной кислоты (2)
Кислотно-основное равновесие в растворе: HA прот. к-та 1 + Bпрот. осн 2 HB + A- сопр. к-та 2 сопр. осн. 1 Кпрот. = Ка(НА) / Ка(НВ) Константа протолиза выражается отношением константы ионизации протолитической кислоты (1) и константы ионизации сопряженной кислоты (2)
 Буферная емкость – величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей (моль-экв/л) • если с = к, • если с > к, • если с < к, • Во = Вк (р. Н = р. Ка) Вк > Во Во > Вк Зона буферного действия р. Н = р. Ка ± 1
Буферная емкость – величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей (моль-экв/л) • если с = к, • если с > к, • если с < к, • Во = Вк (р. Н = р. Ка) Вк > Во Во > Вк Зона буферного действия р. Н = р. Ка ± 1


