Лекция 7б. Обмен аминокислот .ppt
- Количество слайдов: 38

Лекция 7 б Обмен аминокислот

• С пищей в сутки поступает около 100 г белков; • Расщепление белков в процессе пищеварения происходит под действием протеолитических ферментов; • В конечном итоге пищевые белки превращаются в аминокислоты 20 разновидностей.

• Бόльшая часть аминокислот используется для синтеза белков; • Помимо синтеза белков аминокислоты еще используются для синтеза различных небелковых соединений, имеющих важное биологическое значение; • Так, из аминокислот синтезируется глюкоза, азотистые основания, небелковая часть гемоглобина - гем, гормоны - адреналин и тироксин и очень важные соединения, участвующие в энергообеспечении мышечной работы – креатин и карнитин.

Часть аминокислот подвергается распаду и превращаются в конечные продукты: CO 2, H 2 O и NH 3; Распад начинается с реакций, общих для большинства аминокислот: v Декарбоксилирование аминокислот v Дезаминирование аминокислот v. Трансаминирование (переаминирование)

Декарбоксилирование аминокислот • Декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа: R R H – C – NH 2 - СО 2 COOH H Аминокислота • Это Амин превращение аминокислот обычно протекает с очень низкой скоростью и аминов образуется мало; • Но некоторые амины, находясь в очень низкой концентрации, обладают высокой биологической активностью и влияют на различные функции организма.

• Очень активным биогенным амином является гистамин, образующийся при декарбоксилировании аминокислоты гистидина; • Биологическая активность гистамина проявляется в том, что под его воздействием расширяются кровеносные сосуды, в первую очередь, мелкие, что приводит к снижению кровяного давления; увеличивается секреция желудочного сока; • Кроме этого гистамин участвует в формировании болевых ощущений и в развитии аллергических реакций.

• Однако серьезной опасности для организма биогенные амины не представляют, так как в организме имеются ферменты, разрушающие и обезвреживающие амины; • Поэтому проявление биологической активности аминов возможно лишь при их значительной выработке или при снижении активности ферментов, вызывающих их детоксикацию.

Дезаминирование аминокислот • Отщепление от аминокислоты аминогруппы в виде аммиака: R H – C – NH 2 COOH Аминокислота + ½ О 2 - NH 3 R C=O COOH α - кетокислота • Это превращение аминокислот также протекает с очень низкой скоростью;

И только одна аминокислота – глутаминовая дезаминируется с высокой скоростью вследствие наличия в организме активного фермента, вызывающего дезаминирование только этой аминокислоты.

б) Трансаминирование является составной частью косвенного (непрямого) дезаминирования аминокислот - процесса, с которого начинается распад большинства аминокислот;
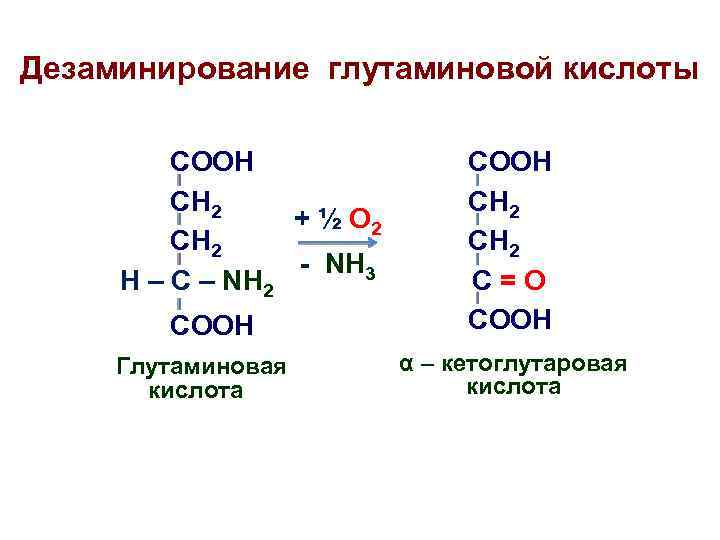
Дезаминирование глутаминовой кислоты COOH CH 2 + ½ О 2 CH 2 - NH 3 H – C – NH 2 COOH Глутаминовая кислота COOH CH 2 C=O COOH α – кетоглутаровая кислота

Трансаминирование (переаминирование) • Реакция между аминокислотами и кетокислотами; • В ходе этой реакции ее участники обмениваются функциональными группами, в результате чего аминокислота превращается в -кетокислоту, а кетокислота становится аминокислотой
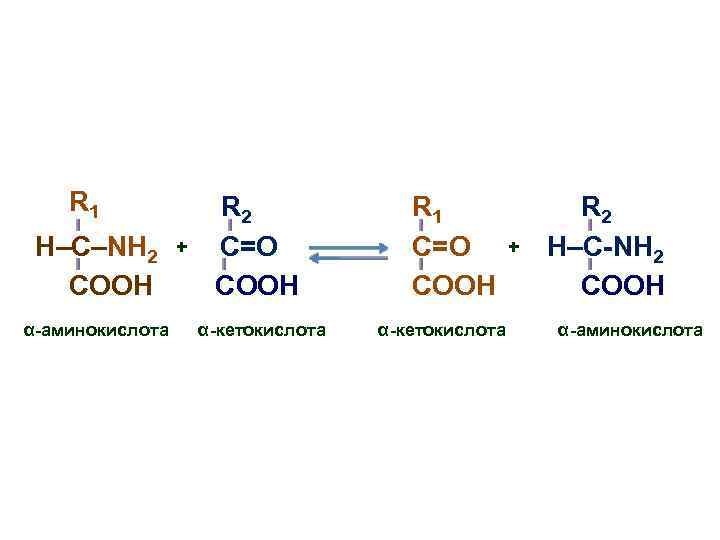
R 1 H–C–NH 2 COOH α-аминокислота + R 2 C=О COOH α-кетокислота R 1 C=О COOH α-кетокислота + R 2 H–C-NH 2 COOH α-аминокислота

Трансаминированию подвергаются все аминокислоты; В этой реакции участвует кофермент - фосфопиридоксаль, для образования которого необходим витамин В 6 – пиридоксин; Трансаминирование - это главное превращение аминокислот в организме, так как его скорость значительно выше, чем у реакций декарбоксилирования и дезаминирования.

Трансаминирование выполняет две основные функции: а) За счет трансаминирования одни аминокислоты могут превращаться в другие: • При этом общее количество аминокислот не меняется, но изменяется соотношение между ними; • С пищей в организм поступают чужеродные белки, у которых аминокислоты находятся в иных пропорциях по сравнению с белками организма; • Путем трансаминирования происходит корректировка аминокислотного состава организма.

• На первой стадии этого процесса аминокислоты вступают в реакцию трансаминирования с -кетоглутаровой кислотой ( -кетокислота); • Аминокислоты при этом превращаются в -кетокислоты, а -кетоглутаровая кислота переходит в глутаминовую кислоту (аминокислота).

• На второй стадии появившаяся глутаминовая кислота подвергается дезаминированию, от нее отщепляется NH 3 и снова образуется -кетоглутаровая кислота.
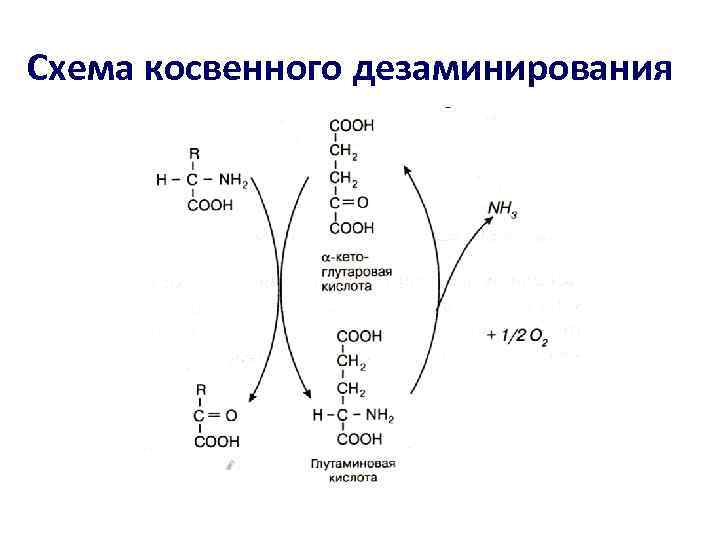
Схема косвенного дезаминирования
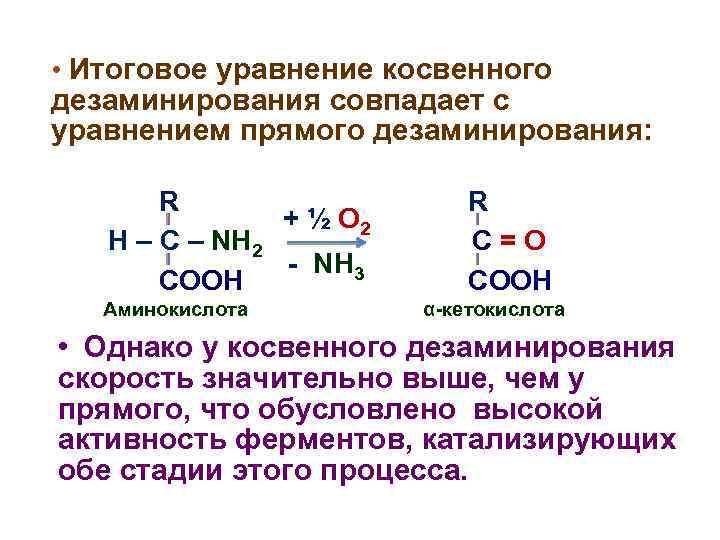
• Итоговое уравнение косвенного дезаминирования совпадает с уравнением прямого дезаминирования: R + ½ О 2 H – C – NH 2 - NH 3 COOH Аминокислота R C=O COOH α-кетокислота • Однако у косвенного дезаминирования скорость значительно выше, чем у прямого, что обусловлено высокой активность ферментов, катализирующих обе стадии этого процесса.

• Образовавшиеся -кетокислоты далее подвергаются глубокому распаду и превращаются в конечные продукты CO 2 и H 2 O; • Для каждой из 20 кетокислот (их образуется столько же, сколько имеется видов аминокислот) имеются свои специфические пути распада;

• Второй продукт косвенного дезаминирования аминокислот – аммиак; • Для организма аммиак является высоко токсичным; • Поэтому в организме имеются молекулярные механизмы его обезвреживания.
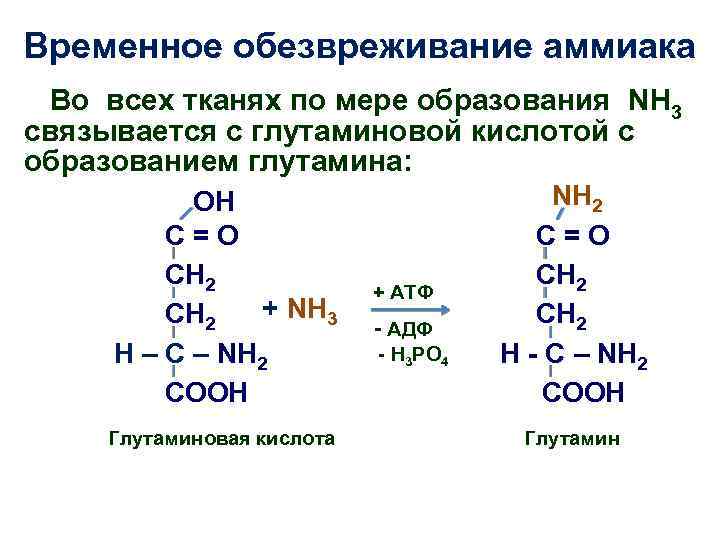
Временное обезвреживание аммиака Во всех тканях по мере образования NH 3 связывается с глутаминовой кислотой с образованием глутамина: ОН C=O CH 2 + NH 3 CH 2 H – C – NH 2 COOH Глутаминовая кислота + АТФ - АДФ - Н 3 РО 4 NH 2 C=O CH 2 H - C – NH 2 COOH Глутамин

• С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и NH 3; • Образовавшаяся глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака; • Освободившийся аммиак, а также углекислый газ в печени используются для синтеза мочевины.

• Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии; • В синтезе мочевины очень важное участие принимает аминокислота орнитин; • Эта аминокислота не входит в состав белков; • Образуется орнитин из другой аминокислоты – аргинина, который присутствует в белках; • В связи с важной ролью орнитина синтез мочевины получил название «орнитиновый цикл» .
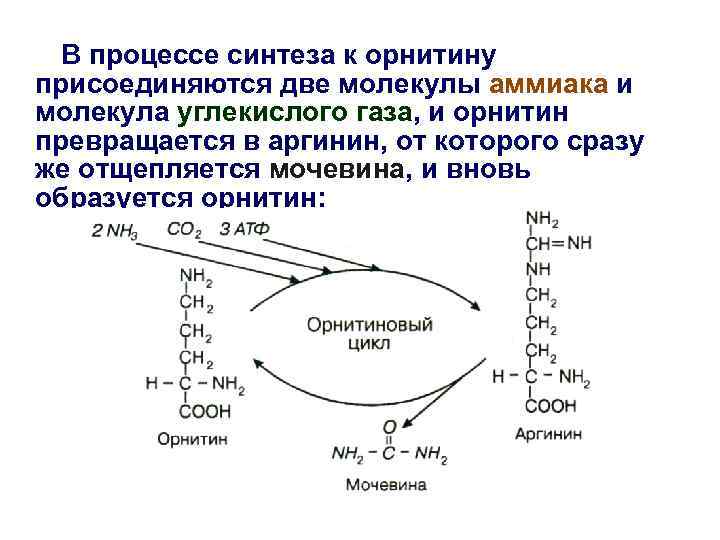
В процессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в аргинин, от которого сразу же отщепляется мочевина, и вновь образуется орнитин:

• Синтез мочевины – это окончательное обезвреживание аммиака; . • Из печени с кровью мочевина поступает в почки и выделяется с мочой; • В сутки образуется 20 -35 г мочевины; • Выделение мочевины с мочой характеризует скорость распада белков в организме.
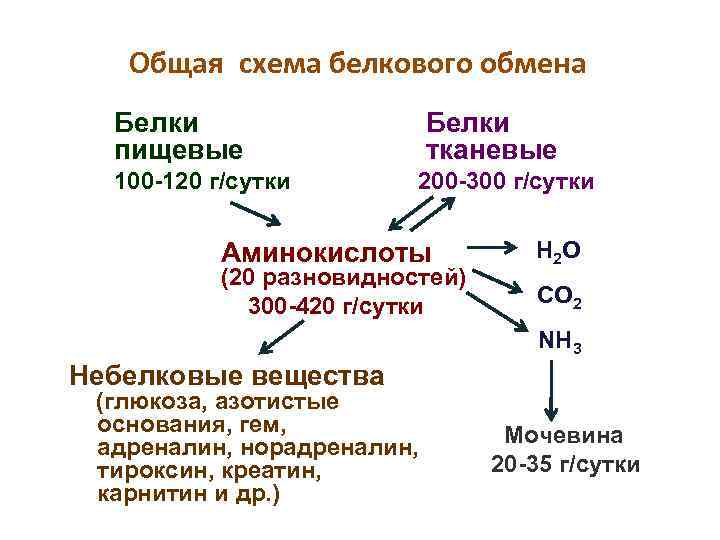
Общая схема белкового обмена Белки пищевые 100 -120 г/сутки Белки тканевые 200 -300 г/сутки Аминокислоты (20 разновидностей) 300 -420 г/сутки Н 2 О CО 2 NH 3 Небелковые вещества (глюкоза, азотистые основания, гем, адреналин, норадреналин, тироксин, креатин, карнитин и др. ) Мочевина 20 -35 г/сутки

Тест 1 Основным превращением аминокислот в организме является реакция: а) дезаминирования б) декарбоксилирования в) изомеризации г) трансаминирования

Тест 2 В организме дезаминированию преимущественно подвергается аминокислота: а) аланин б) глицин в) глутаминовая кислота г) цистеин

Тест 3 При декарбоксилировании аминокислот образуется: а) аммиак б) ацетон в) лактат г) углекислый газ

Тест 4 В процессе трансаминирования аминогруппа переносится: а) от амина на аминокислоту б) от амина на -кетокислоту в) от аммиака на аминокислоту г) от аминокислоты на - кетокислоту

Тест 5 При трансаминировании аминокислоты превращаются: а) в жирные кислоты б) в кетокислоты в) в молочную кислоту г) в углекислый газ и воду

Тест 6 Биогенные амины в организме образуются в реакции: а) дезаминирования б) декарбоксилирования в) изомеризации г) трансаминирования

Тест 7 Углекислый газ при распаде аминокислот образуется путем: а) дезаминирования б) декарбоксилирования в) окисления г) трансаминирования

Тест 8 Аммиак образуется при дезаминировании: а) б) в) г) аминокислот ацетил-Ко. А кетокислот кетоновых тел

Тест 9 При временном обезвреживании аммиака образуется: а) глутамин б) глутаминовая кислота в) мочевая кислота г) мочевина

Тест 10 Специфическим продуктом распада белков является: а) ацетоуксусная кислота б) молочная кислота в) мочевая кислота г) мочевина

Тест 11 При обычном питании в сутки выделяется мочевины: а) 10 -15 г б) 20 -30 г в) 50 -60 г г) 90 -100 г
Лекция 7б. Обмен аминокислот .ppt