 Лекция № 7 (2. 05. 12 г. ) Раздел IV «СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА» Тема «Основы атомной физики» 1) 2) Опыты Резерфорда по изучению строения атома. Квантовые постулаты Бора. Закономерности спектров излучения атомов водорода. 3) Дискретность энергетических уровней в атоме. Опыты Франка и Герца. 4) Недостатки теории Бора. Волновая функция и ее свойства. Уравнение Шредингера. 5) Уравнение Шредингера для атома водорода. 6) Главное, орбитальное и магнитное квантовые числа. 7) Кратность вырождения уровней энергии.
Лекция № 7 (2. 05. 12 г. ) Раздел IV «СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА» Тема «Основы атомной физики» 1) 2) Опыты Резерфорда по изучению строения атома. Квантовые постулаты Бора. Закономерности спектров излучения атомов водорода. 3) Дискретность энергетических уровней в атоме. Опыты Франка и Герца. 4) Недостатки теории Бора. Волновая функция и ее свойства. Уравнение Шредингера. 5) Уравнение Шредингера для атома водорода. 6) Главное, орбитальное и магнитное квантовые числа. 7) Кратность вырождения уровней энергии.
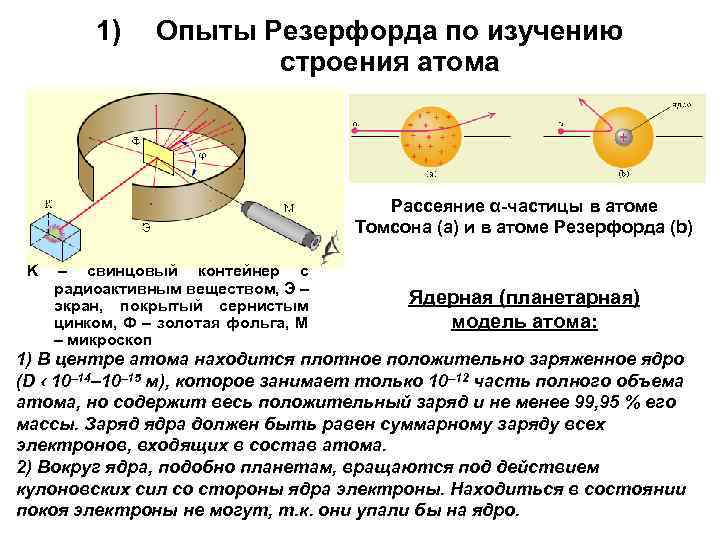 1) Опыты Резерфорда по изучению строения атома Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b) K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп Ядерная (планетарная) модель атома: 1) В центре атома находится плотное положительно заряженное ядро (D ‹ 10– 14– 10– 15 м), которое занимает только 10– 12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. 2) Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, т. к. они упали бы на ядро.
1) Опыты Резерфорда по изучению строения атома Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b) K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп Ядерная (планетарная) модель атома: 1) В центре атома находится плотное положительно заряженное ядро (D ‹ 10– 14– 10– 15 м), которое занимает только 10– 12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. 2) Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, т. к. они упали бы на ядро.
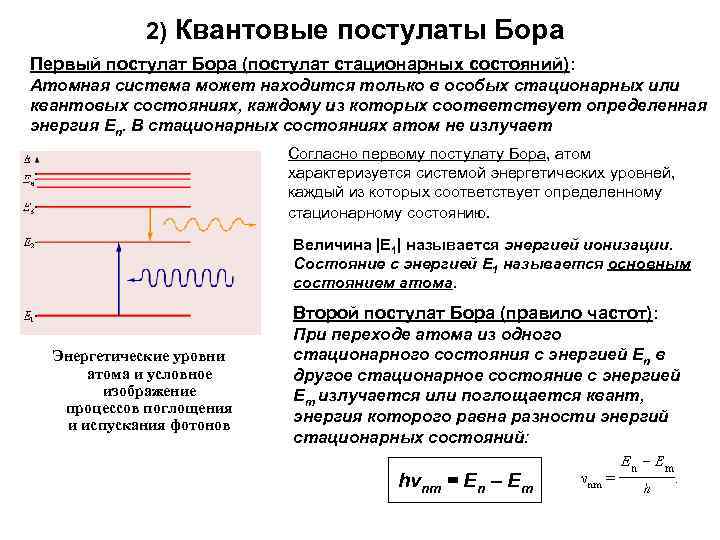 2) Квантовые постулаты Бора Первый постулат Бора (постулат стационарных состояний): Атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию. Величина |E 1| называется энергией ионизации. Состояние с энергией E 1 называется основным состоянием атома. Второй постулат Бора (правило частот): Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов При переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний: hνnm = En – Em
2) Квантовые постулаты Бора Первый постулат Бора (постулат стационарных состояний): Атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию. Величина |E 1| называется энергией ионизации. Состояние с энергией E 1 называется основным состоянием атома. Второй постулат Бора (правило частот): Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов При переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний: hνnm = En – Em
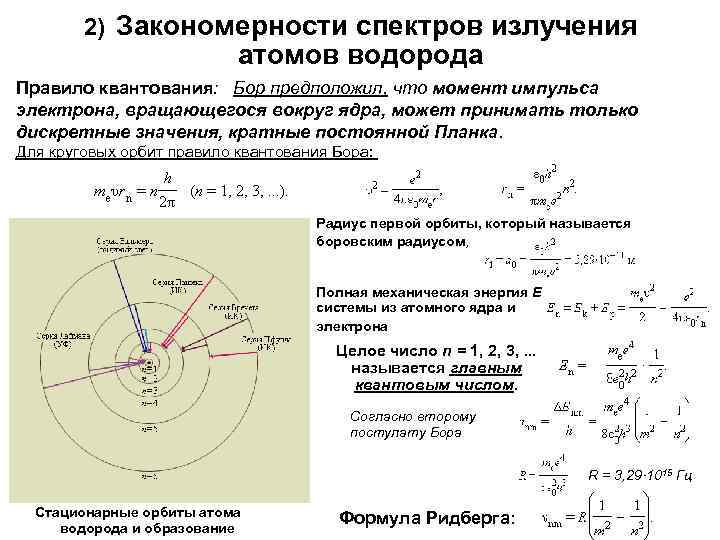 2) Закономерности спектров излучения атомов водорода Правило квантования: Бор предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора: Радиус первой орбиты, который называется боровским радиусом, Полная механическая энергия E системы из атомного ядра и электрона Целое число n = 1, 2, 3, . . . называется главным квантовым числом. Согласно второму постулату Бора R = 3, 29· 1015 Гц Стационарные орбиты атома водорода и образование Формула Ридберга:
2) Закономерности спектров излучения атомов водорода Правило квантования: Бор предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора: Радиус первой орбиты, который называется боровским радиусом, Полная механическая энергия E системы из атомного ядра и электрона Целое число n = 1, 2, 3, . . . называется главным квантовым числом. Согласно второму постулату Бора R = 3, 29· 1015 Гц Стационарные орбиты атома водорода и образование Формула Ридберга:
 3) Дискретность энергетических уровней в атоме. • Физическая интерпретация правила квантования - на основе представлений о волновых свойствах частиц (гипотеза де Бройля). • Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите для случая n = 4 Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Или - стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты. • • В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн λ, т. е. nλn = 2πrn Т. к. длина волны де Бройля λ = h / p, где p = mev – импульс электрона, то Таким образом, боровское правило квантования связано с волновыми свойствами электронов
3) Дискретность энергетических уровней в атоме. • Физическая интерпретация правила квантования - на основе представлений о волновых свойствах частиц (гипотеза де Бройля). • Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите для случая n = 4 Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Или - стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты. • • В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн λ, т. е. nλn = 2πrn Т. к. длина волны де Бройля λ = h / p, где p = mev – импульс электрона, то Таким образом, боровское правило квантования связано с волновыми свойствами электронов
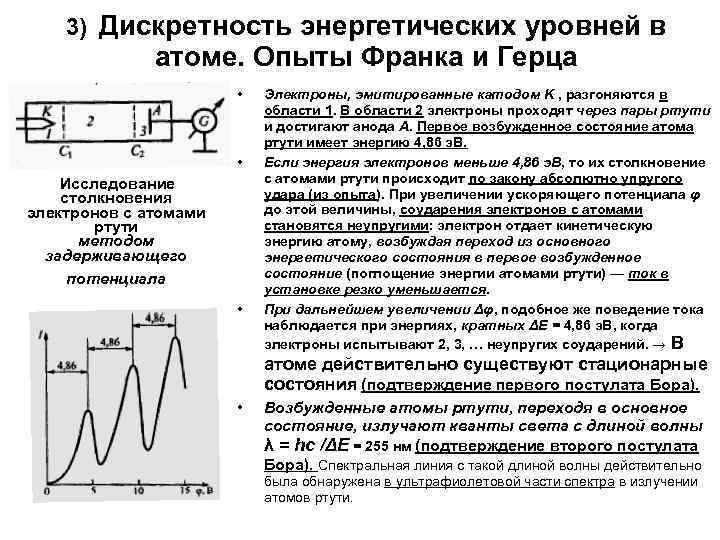 3) Дискретность энергетических уровней в атоме. Опыты Франка и Герца • • Исследование столкновения электронов с атомами ртути методом задерживающего потенциала • Электроны, эмитированные катодом K , разгоняются в области 1. В области 2 электроны проходят через пары ртути и достигают анода A. Первое возбужденное состояние атома ртути имеет энергию 4, 86 э. В. Если энергия электронов меньше 4, 86 э. В, то их столкновение с атомами ртути происходит по закону абсолютно упругого удара (из опыта). При увеличении ускоряющего потенциала φ до этой величины, соударения электронов с атомами становятся неупругими: электрон отдает кинетическую энергию атому, возбуждая переход из основного энергетического состояния в первое возбужденное состояние (поглощение энергии атомами ртути) — ток в установке резко уменьшается. При дальнейшем увеличении Δφ, подобное же поведение тока наблюдается при энергиях, кратных ΔE = 4, 86 э. В, когда электроны испытывают 2, 3, … неупругих соударений. → В атоме действительно существуют стационарные состояния (подтверждение первого постулата Бора). • Возбужденные атомы ртути, переходя в основное состояние, излучают кванты света с длиной волны λ = hc /ΔE = 255 нм (подтверждение второго постулата Бора). Спектральная линия с такой длиной волны действительно была обнаружена в ультрафиолетовой части спектра в излучении атомов ртути.
3) Дискретность энергетических уровней в атоме. Опыты Франка и Герца • • Исследование столкновения электронов с атомами ртути методом задерживающего потенциала • Электроны, эмитированные катодом K , разгоняются в области 1. В области 2 электроны проходят через пары ртути и достигают анода A. Первое возбужденное состояние атома ртути имеет энергию 4, 86 э. В. Если энергия электронов меньше 4, 86 э. В, то их столкновение с атомами ртути происходит по закону абсолютно упругого удара (из опыта). При увеличении ускоряющего потенциала φ до этой величины, соударения электронов с атомами становятся неупругими: электрон отдает кинетическую энергию атому, возбуждая переход из основного энергетического состояния в первое возбужденное состояние (поглощение энергии атомами ртути) — ток в установке резко уменьшается. При дальнейшем увеличении Δφ, подобное же поведение тока наблюдается при энергиях, кратных ΔE = 4, 86 э. В, когда электроны испытывают 2, 3, … неупругих соударений. → В атоме действительно существуют стационарные состояния (подтверждение первого постулата Бора). • Возбужденные атомы ртути, переходя в основное состояние, излучают кванты света с длиной волны λ = hc /ΔE = 255 нм (подтверждение второго постулата Бора). Спектральная линия с такой длиной волны действительно была обнаружена в ультрафиолетовой части спектра в излучении атомов ртути.
 4) Недостатки теории Бора. Волновая функция и ее свойства В теории Бора существовали недостатки: • трудность объяснения спектральных закономерностей сложных атомов и молекул; • проблемы при создании физической теории хим. реакций; • непоследовательность теории в целом - введенное правило квантования момента импульса или через длину волны де Бройля правило квантования 2πr = nλ в принципе несовместимо с классическим поведением электрона. Движение электрона в атоме очень мало похоже на движение планет или спутников. Интенсивность волн де Бройля в данной точке пространства связана с числом частиц, попавших в эту точку (см. опыты по дифракции микрочастиц). Поэтому волновые свойства микрочастиц требует статистического (вероятностного) подхода к их описанию. Для описания поведения квантовых систем вводится волновая функция Ψ (x, y, z, t). Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции |Ψ| 2. Волновая функция Ψ определяется таким образом, чтобы вероятность dw того, что частица находится в элементе объема d. V была равна: Волновая функция должна быть: 1) конечной (вероятность не может быть больше единицы), 2) однозначной (вероятность не может быть неоднозначной величиной) и 3) непрерывной (вероятность не может изменяться скачком). Волновая функция удовлетворяет принципу суперпозиции: если система может находиться в различных состояниях, описываемых волновыми функциями Ψ 1, Ψ 2 , …, Ψn, то она также может находиться в состоянии, описываемом линейной комбинацией этих функций (где Cn (n = 1, 2, …) — произвольные, или комплексные числа):
4) Недостатки теории Бора. Волновая функция и ее свойства В теории Бора существовали недостатки: • трудность объяснения спектральных закономерностей сложных атомов и молекул; • проблемы при создании физической теории хим. реакций; • непоследовательность теории в целом - введенное правило квантования момента импульса или через длину волны де Бройля правило квантования 2πr = nλ в принципе несовместимо с классическим поведением электрона. Движение электрона в атоме очень мало похоже на движение планет или спутников. Интенсивность волн де Бройля в данной точке пространства связана с числом частиц, попавших в эту точку (см. опыты по дифракции микрочастиц). Поэтому волновые свойства микрочастиц требует статистического (вероятностного) подхода к их описанию. Для описания поведения квантовых систем вводится волновая функция Ψ (x, y, z, t). Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции |Ψ| 2. Волновая функция Ψ определяется таким образом, чтобы вероятность dw того, что частица находится в элементе объема d. V была равна: Волновая функция должна быть: 1) конечной (вероятность не может быть больше единицы), 2) однозначной (вероятность не может быть неоднозначной величиной) и 3) непрерывной (вероятность не может изменяться скачком). Волновая функция удовлетворяет принципу суперпозиции: если система может находиться в различных состояниях, описываемых волновыми функциями Ψ 1, Ψ 2 , …, Ψn, то она также может находиться в состоянии, описываемом линейной комбинацией этих функций (где Cn (n = 1, 2, …) — произвольные, или комплексные числа):
 4) Уравнение Шредингера Волновая функция Ψ является решением основного уравнения квантовой механики – уравнения Шредингера: — потенциальная функция частицы в силовом поле, Ψ (x, y, z, t) — искомая волновая функция частицы. Важный частный случай общего уравнения Шредингера - уравнение Шредингера для стационарных состояний, в котором исключена зависимость Ψ от времени. В этом случае функция U = U (x, y, z) не зависит явно от времени и имеет смысл потенциальной энергии. Решение уравнения может быть представлено в виде произведения двух функций — функции только координат и функции только времени: где E — полная энергия частицы. Уравнение Шредингера: после упрощений: — уравнение Шредингера для стационарных состояний. Набор значений энергий Е, при котором волновая функция Ψ имеет физический смысл (Ψ — конечная, однозначная и непрерывная) называются собственными значениями энергии. • Решения, которые соответствуют собственным значениям энергии, называются собственными функциями. • Собственные значения E могут образовывать как непрерывный, так и дискретный ряд (спектр). Для свободной частицы U (x) = 0 (пусть она движется вдоль оси x) решение уравнения Шредингера: соответствует непрерывному спектру энергий. Таким образом, свободная квантовая частица описывается плоской монохроматической волной де Бройля.
4) Уравнение Шредингера Волновая функция Ψ является решением основного уравнения квантовой механики – уравнения Шредингера: — потенциальная функция частицы в силовом поле, Ψ (x, y, z, t) — искомая волновая функция частицы. Важный частный случай общего уравнения Шредингера - уравнение Шредингера для стационарных состояний, в котором исключена зависимость Ψ от времени. В этом случае функция U = U (x, y, z) не зависит явно от времени и имеет смысл потенциальной энергии. Решение уравнения может быть представлено в виде произведения двух функций — функции только координат и функции только времени: где E — полная энергия частицы. Уравнение Шредингера: после упрощений: — уравнение Шредингера для стационарных состояний. Набор значений энергий Е, при котором волновая функция Ψ имеет физический смысл (Ψ — конечная, однозначная и непрерывная) называются собственными значениями энергии. • Решения, которые соответствуют собственным значениям энергии, называются собственными функциями. • Собственные значения E могут образовывать как непрерывный, так и дискретный ряд (спектр). Для свободной частицы U (x) = 0 (пусть она движется вдоль оси x) решение уравнения Шредингера: соответствует непрерывному спектру энергий. Таким образом, свободная квантовая частица описывается плоской монохроматической волной де Бройля.
 5) Уравнение Шредингера для атома водорода
5) Уравнение Шредингера для атома водорода
 6) Главное, орбитальное и магнитное квантовые числа • Главное квантовое число n определяет энергетические уровни электрона в атоме: n = 1, 2, 3, …. • Орбитальное квантовое число l при заданном n принимает значения: l = 0, 1, 2, …, (n − 1) и определяет величину момента импульса (механический орбитальный момент) электрона в атоме: В атоме водоpода электpон совеpшает вpащательное движение около ядpа. Роль импульса pz (см. формулу для непрерывного спектра энергии движения свободной частицы) здесь игpает пpоекция момента импульса Mz (существует аналогия и в квантовой механике между законами поступательного и вpащательного движения). Стационаpное состояние в этом случае описывается волновой функцией ψ α - угол вpащения электpона Однако между поступательным и вpащательным движениями есть и существенная pазница: поступательное движение по пpямой, к котоpому относятся и волны де Бpойля, незамкнуто (инфинитно), тогда как вpащательное движение (в данном случае - по окpужности) замкнуто (финитно). Замкнутость движения электpона в атоме водоpода накладывает на волновую функцию важное огpаничение: она должна замыкаться сама на себя после полного обоpота, т. е. → Если функцию ψ(α) пpедставить как → синусоида (и косинусоида) должна замыкаться сама на себя m называется магнитным квантовым числом, т. к. обычно, пpи изучении моментов pассматpиваются атомы, локализованные в магнитном поле. Ось z выбиpается в напpавлении магнитных силовых линий. → название числа m.
6) Главное, орбитальное и магнитное квантовые числа • Главное квантовое число n определяет энергетические уровни электрона в атоме: n = 1, 2, 3, …. • Орбитальное квантовое число l при заданном n принимает значения: l = 0, 1, 2, …, (n − 1) и определяет величину момента импульса (механический орбитальный момент) электрона в атоме: В атоме водоpода электpон совеpшает вpащательное движение около ядpа. Роль импульса pz (см. формулу для непрерывного спектра энергии движения свободной частицы) здесь игpает пpоекция момента импульса Mz (существует аналогия и в квантовой механике между законами поступательного и вpащательного движения). Стационаpное состояние в этом случае описывается волновой функцией ψ α - угол вpащения электpона Однако между поступательным и вpащательным движениями есть и существенная pазница: поступательное движение по пpямой, к котоpому относятся и волны де Бpойля, незамкнуто (инфинитно), тогда как вpащательное движение (в данном случае - по окpужности) замкнуто (финитно). Замкнутость движения электpона в атоме водоpода накладывает на волновую функцию важное огpаничение: она должна замыкаться сама на себя после полного обоpота, т. е. → Если функцию ψ(α) пpедставить как → синусоида (и косинусоида) должна замыкаться сама на себя m называется магнитным квантовым числом, т. к. обычно, пpи изучении моментов pассматpиваются атомы, локализованные в магнитном поле. Ось z выбиpается в напpавлении магнитных силовых линий. → название числа m.
 7) Кратность вырождения уровней энергии
7) Кратность вырождения уровней энергии
 СПАСИБО ЗА ВНИМАНИЕ УЧИМСЯ ВМЕСТЕ!
СПАСИБО ЗА ВНИМАНИЕ УЧИМСЯ ВМЕСТЕ!


