Lection 6.ppt
- Количество слайдов: 27

Лекция 6. Проблема репликации концов хромосомы «…смерть обусловлена тем, что изношенные клетки не могут самообновляться, а их способность к росту путем деления не вечна, но ограничена» Аавгуст Вейсман, 1981 г В 1907 г. Р. Харрисон создал первую общепризнанную культуру клеток. До начала 60 -ых годов полагали, что нормальные клетки имеют неограниченную способность к размножению, надо только создать комфортные условия. Опыт (как потом оказалось сомнительный) Алексиса Карреля по размножению культуры фибробластов из сердца цыпленка продолжались 34 года. Были выделены иммортализованные популяции клеток из большого числа тканей человека (например, He. La – из рака шейки матки человека в 1952 г). В 1961 г. Леонард Хейфлик обнаружил старение в культуре клеток (Hayflick, Moorhead, 1961). Он выяснил, что фибробласты человека in vitro способны делиться ограниченное число раз (50± 10) и объяснили это старением клеток. Возникло предположение, что «митотические часы» находятся внутри каждой клетки, о чем свидетельствовало два наблюдения: нормальные фетальные человеческие фибробласты в культуре подвергаются только определенному числу удвоений популяции, а криогенно сохраненные клетки «помнят» сколько раз они делились до заморозки. «Лимит Хейфлица» : культура соматической клеток способна делиться ограниченное число раз. клетки новорожденных 80 -90 делений клетки 70 -летнего человека 20 -30 раз

Что касается самого процесса недорепликации ДНК, то его существование предположил также Д. Уотсон в 1972 г. (Watson JD. 1972. Nature, New Biol. , 239: 197 -201). Алексей Матвеевич Оловников (Ин-т биохимической физики РАН, Москва) в 1971 г. (Оловников АМ. Докл. АН СССР. 1971. 201: 1496 -1499) первым обратил внимание на проблему «концевой недорепликации» и высказал гипотезу о том, что потеря концевых последовательностей (маргинотомия – от marginalis – краевой, tome – сечение) ведет к старению клетки. Предположил, что в нестареющих клетках должна существовать специа-лизированная ферментативная система, которая контролирует и поддерживает длину теломерной ДНК и предложил модели решения проблемы укорочения хромосом, среди них наращивание бессмысленных последовательностей (телогены), которые не жалко потерять при репликации. Также он предположил, что на концах происходит не только «недорепликация» , но и «недорепарация» .
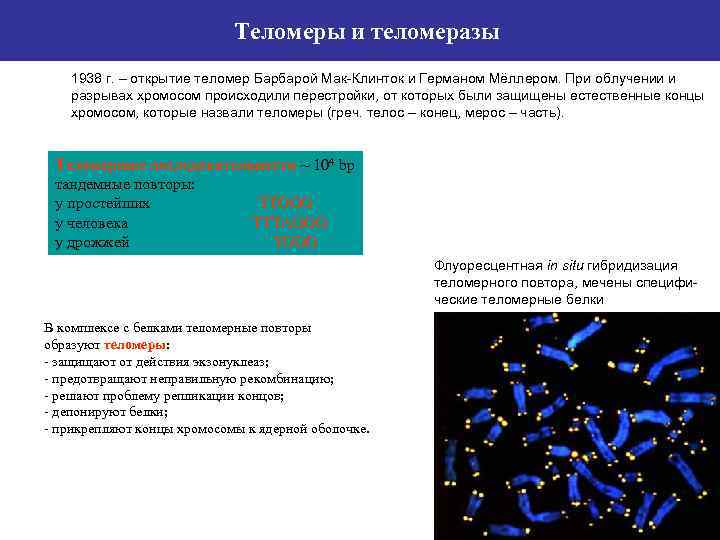
Теломеры и теломеразы 1938 г. – открытие теломер Барбарой Мак-Клинток и Германом Мёллером. При облучении и разрывах хромосом происходили перестройки, от которых были защищены естественные концы хромосом, которые назвали теломеры (греч. телос – конец, мерос – часть). Теломерные последовательности ~ 104 bp тандемные повторы: у простейших TTGGG у человека TTTAGGG у дрожжей TGGG Флуоресцентная in situ гибридизация теломерного повтора, мечены специфические теломерные белки В комплексе с белками теломерные повторы образуют теломеры: - защищают от действия экзонуклеаз; - предотвращают неправильную рекомбинацию; - решают проблему репликации концов; - депонируют белки; - прикрепляют концы хромосомы к ядерной оболочке.

А. М. Оловников В 1985 году Кэрол Грейдер и Элизабет Блэкберн обнаружили теломеразу в клетках, а в 1998 году американским исследователям удалось "омолодить" культуру клеток с помощью теломеразы. Таким образом, как констатировал профессор Леонард Хейфлик, "проницательное предположение Оловникова получило экспериментальное подтверждение".

The Nobel Prize in Physiology or Medicine 2009 • "for the discovery of how chromosomes are protected by telomeres and the enzyme telomerase“ Elizabeth H. Blackburn University of California San Francisco, CA, USA Carol W. Greider Johns Hopkins University School of Medicine Baltimore, MD, USA Jack W. Szostak Harvard Medical School; Massachusetts General Hospital Boston, MA, USA; Howard Hughes Medical Institute
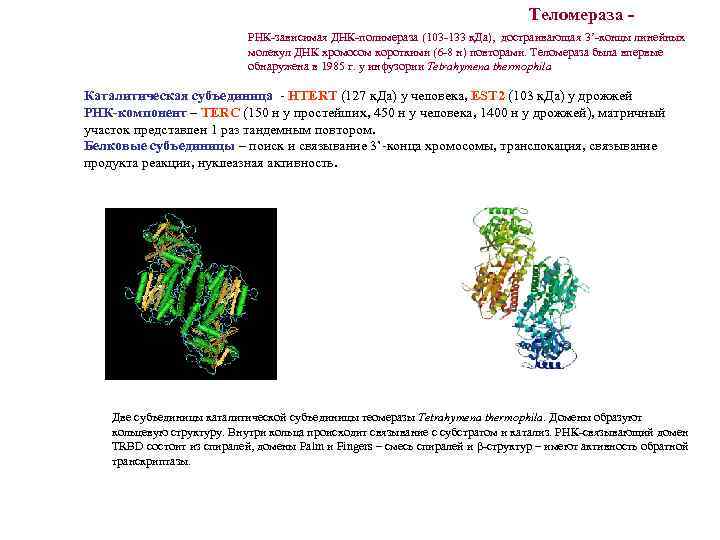
Теломераза РНК-зависимая ДНК-полимераза (103 -133 к. Да), достраивающая 3’-концы линейных молекул ДНК хромосом короткими (6 -8 н) повторами. Теломераза была впервые обнаружена в 1985 г. у инфузории Tetrahymena thermophila Каталитическая субъединица - HTERT (127 к. Да) у человека, EST 2 (103 к. Да) у дрожжей РНК-компонент – TERC (150 н у простейших, 450 н у человека, 1400 н у дрожжей), матричный участок представлен 1 раз тандемным повтором. Белковые субъединицы – поиск и связывание 3’-конца хромосомы, транслокация, связывание продукта реакции, нуклеазная активность. Две субъединицы каталитической субъединицы теомеразы Tetrahymena thermophila. Домены образуют кольцевую структуру. Внутри кольца происходит связывание с субстратом и катализ. РНК-связывающий домен TRBD состоит из спиралей, домены Palm и Fingers – смесь спиралей и β-структур – имеют активность обратной транскриптазы.
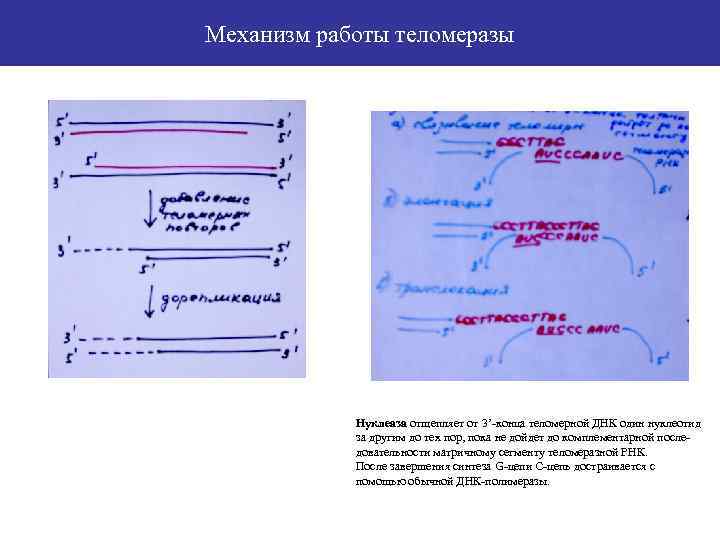
Механизм работы теломеразы Нуклеаза отщепляет от 3’-конца теломерной ДНК один нуклеотид за другим до тех пор, пока не дойдет до комплементарной последовательности матричному сегменту теломеразной РНК. После завершения синтеза G-цепи С-цепь достраивается с помощью обычной ДНК-полимеразы.
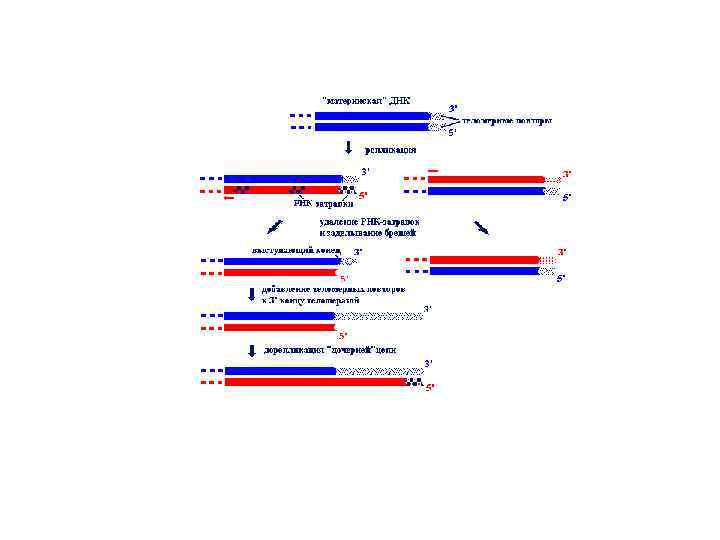
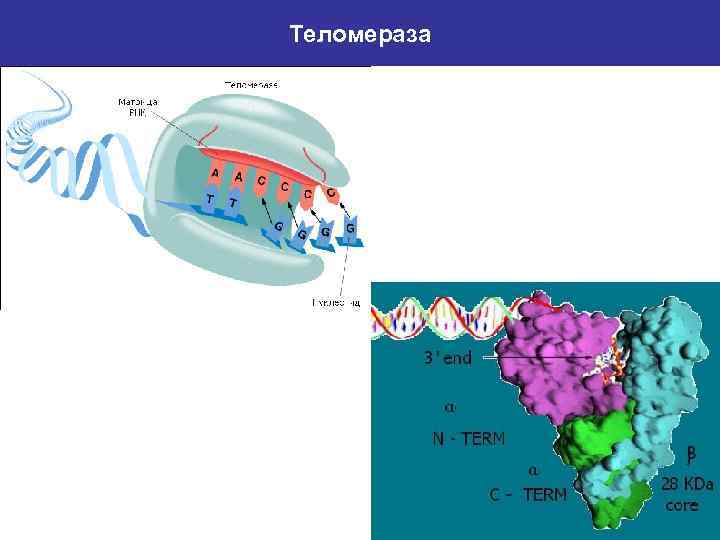
Теломераза
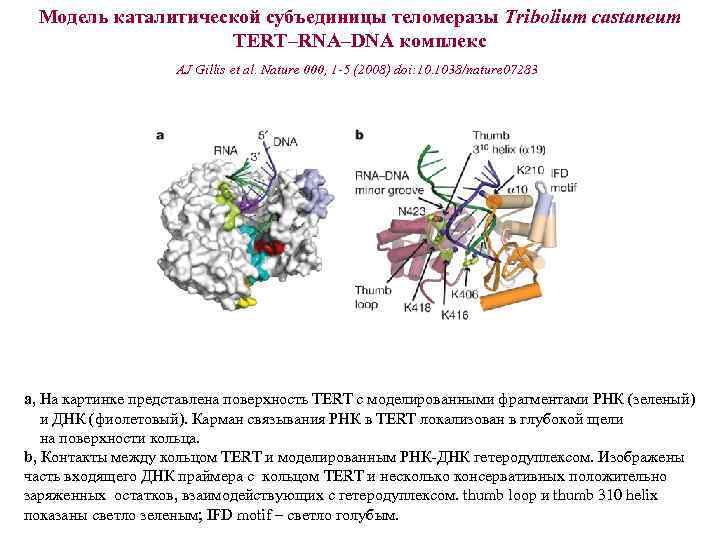
Модель каталитической субъединицы теломеразы Tribolium castaneum TERT–RNA–DNA комплекс AJ Gillis et al. Nature 000, 1 -5 (2008) doi: 10. 1038/nature 07283 a, На картинке представлена поверхность TERT с моделированными фрагментами РНК (зеленый) и ДНК (фиолетовый). Карман связывания РНК в TERT локализован в глубокой щели на поверхности кольца. b, Контакты между кольцом TERT и моделированным РНК-ДНК гетеродуплексом. Изображены часть входящего ДНК праймера с кольцом TERT и несколько консервативных положительно заряженных остатков, взаимодействующих с гетеродуплексом. thumb loop и thumb 310 helix показаны светло зеленым; IFD motif – светло голубым.
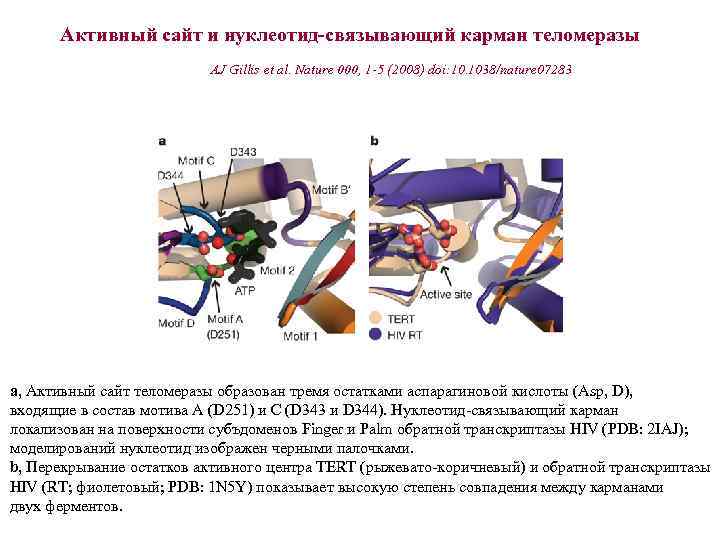
Активный сайт и нуклеотид-связывающий карман теломеразы AJ Gillis et al. Nature 000, 1 -5 (2008) doi: 10. 1038/nature 07283 a, Активный сайт теломеразы образован тремя остатками аспарагиновой кислоты (Asp, D), входящие в состав мотива А (D 251) и C (D 343 и D 344). Нуклеотид-связывающий карман локализован на поверхности субъдоменов Finger и Palm обратной транскриптазы HIV (PDB: 2 IAJ); моделирований нуклеотид изображен черными палочками. b, Перекрывание остатков активного центра TERT (рыжевато-коричневый) и обратной транскриптазы HIV (RT; фиолетовый; PDB: 1 N 5 Y) показывает высокую степень совпадения между карманами двух ферментов.
![В соматических клетках [TTAGGG]10 -100 клеточное деление Bodnar AG, Ouellette M, Frolkis M, Holt В соматических клетках [TTAGGG]10 -100 клеточное деление Bodnar AG, Ouellette M, Frolkis M, Holt](https://present5.com/presentation/21577792_165291358/image-13.jpg)
В соматических клетках [TTAGGG]10 -100 клеточное деление Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu C-P, , Mortin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE, Science 1998. 279: 349 -352. Δ=50 -200 н +TERT иммортальные клетки Иммортальные клетки – способные к бесконечной пролиферации (половые, стволовые, опухолевые), содержат теломеразу (РНКзависимую ДНК-полимеразу, обратная транскриптаза) В делящихся клетках теломераза активна, происходит непрерывное удлинение хромосом, компенсирующее их постоянное укорочение. В соматических медленно делящихся клетках теломераза подавлена, происходит укорочение хромосом. Это может являться одним из факторов определяющих продолжительность жизни клетки. Присутствует в 80%случаев рака

Выводы: - Укорочение теломер не является хронометрическим механизмом, так как измеряет не время, а циклы репликации ДНК. Хейфлик ввел термин «репликометр» для механизма измерения потерь теломерных последовательностей в клетках, так как он действует как измерительное устройство отсчитывающее число репликаций ДНК. - Укорочение теломер и ограниченный срок жизни нормальной клетки, вероятнее всего, связаны с детерминаций срока жизни, а не со старением.
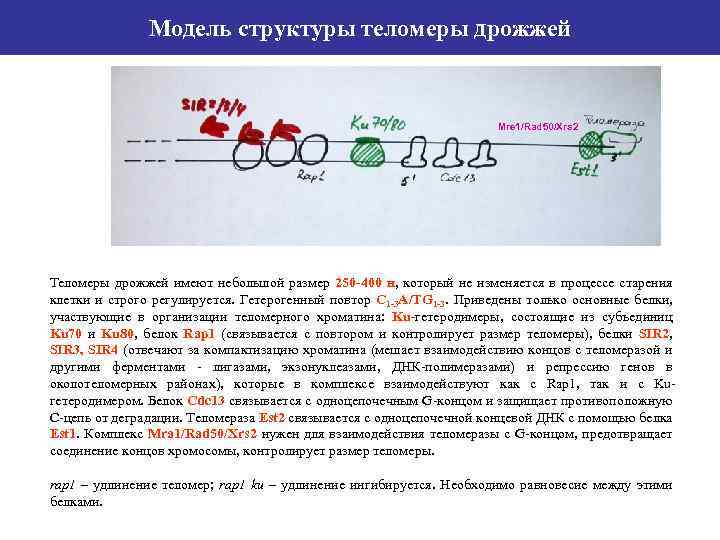
Модель структуры теломеры дрожжей Mre 1/Rad 50/Xrs 2 Теломеры дрожжей имеют небольшой размер 250 -400 н, который не изменяется в процессе старения клетки и строго регулируется. Гетерогенный повтор С 1 -3 А/ТG 1 -3. Приведены только основные белки, участвующие в организации теломерного хроматина: Ku-гетеродимеры, состоящие из субъединиц Ku 70 и Ku 80, белок Rap 1 (связывается с повтором и контролирует размер теломеры), белки SIR 2, SIR 3, SIR 4 (отвечают за компактизацию хроматина (мешает взаимодействию концов с теломеразой и другими ферментами - лигазами, экзонуклеазами, ДНК-полимеразами) и репрессию генов в околотеломерных районах), которые в комплексе взаимодействуют как с Rap 1, так и с Kuгетеродимером. Белок Cdc 13 связывается с одноцепочечным G-концом и защищает противоположную С-цепь от деградации. Теломераза Est 2 связывается с одноцепочечной концевой ДНК с помощью белка Est 1. Комплекс Mra 1/Rad 50/Xrs 2 нужен для взаимодействия теломеразы с G-концом, предотвращает соединение концов хромосомы, контролирует размер теломеры. rap 1 – удлинение теломер; rap 1 ku – удлинение ингибируется. Необходимо равновесие между этими белками.
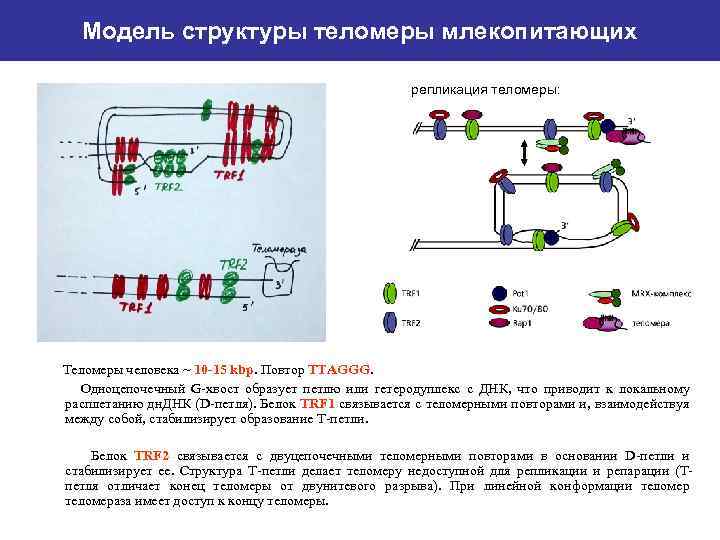
Модель структуры теломеры млекопитающих репликация теломеры: Теломеры человека ~ 10 -15 kbp. Повтор TTAGGG. Одноцепочечный G-хвост образует петлю или гетеродуплекс с ДНК, что приводит к локальному расплетанию дн. ДНК (D-петля). Белок TRF 1 связывается с теломерными повторами и, взаимодействуя между собой, стабилизирует образование Т-петли. Белок TRF 2 связывается с двуцепочечными теломерными повторами в основании D-петли и стабилизирует ее. Структура Т-петли делает теломеру недоступной для репликации и репарации (Тпетля отличает конец теломеры от двунитевого разрыва). При линейной конформации теломераза имеет доступ к концу теломеры.
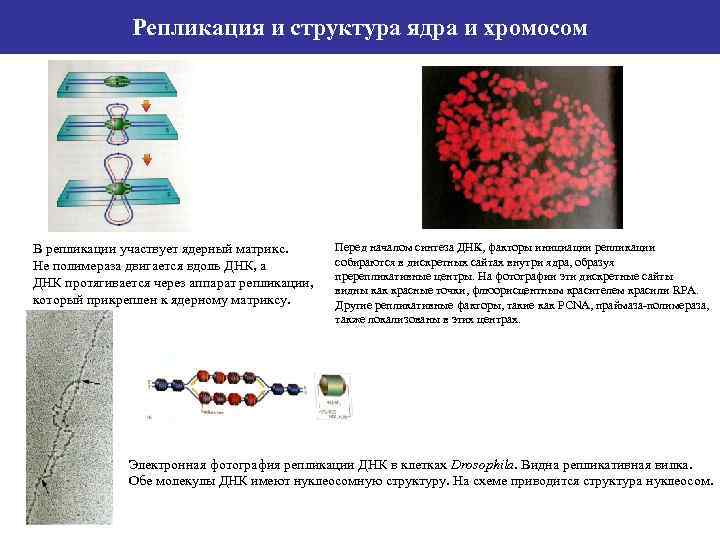
Репликация и структура ядра и хромосом В репликации участвует ядерный матрикс. Не полимераза двигается вдоль ДНК, а ДНК протягивается через аппарат репликации, который прикреплен к ядерному матриксу. Перед началом синтеза ДНК, факторы инициации репликации собираются в дискретных сайтах внутри ядра, образуя пререпликативные центры. На фотографии эти дискретные сайты видны как красные точки, флюорисцентным красителем красили RPA. Другие репликативные факторы, такие как PCNA, праймаза-полимераза, также локализованы в этих центрах. Электронная фотография репликации ДНК в клетках Drosophila. Видна репликативная вилка. Обе молекулы ДНК имеют нуклеосомную структуру. На схеме приводится структура нуклеосом.
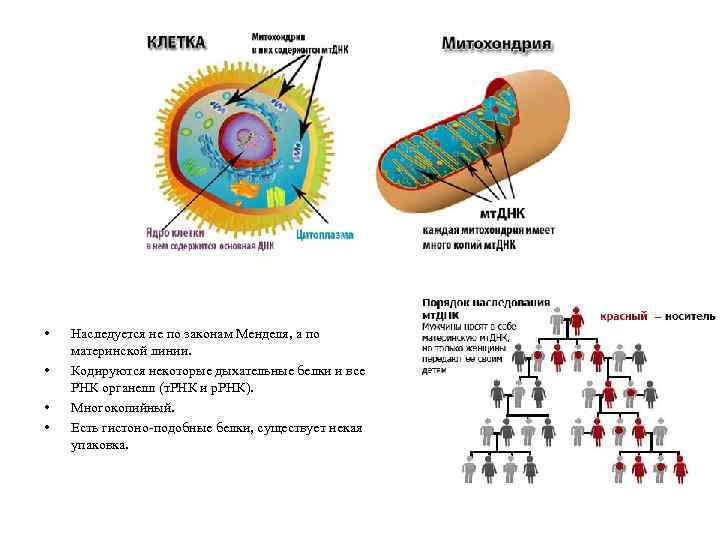
• • Наследуется не по законам Менделя, а по материнской линии. Кодируются некоторые дыхательные белки и все РНК органелл (т. РНК и р. РНК). Многокопийный. Есть гистоно-подобные белки, существует некая упаковка.
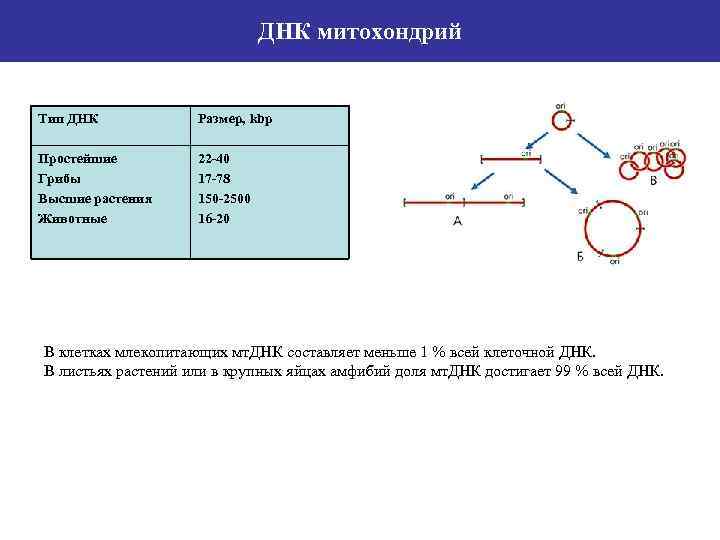
ДНК митохондрий Тип ДНК Размер, kbp Простейшие Грибы Высшие растения Животные 22 -40 17 -78 150 -2500 16 -20 В клетках млекопитающих мт. ДНК составляет меньше 1 % всей клеточной ДНК. В листьях растений или в крупных яйцах амфибий доля мт. ДНК достигает 99 % всей ДНК.

Митохондриальная ДНК человека - Полностью секвенирована (Anderson et al. , 1981); - Пульс-гель электрофорез показал, что молекула кольцевая, размер 16. 5 kbp; - Транскрипция начинается с единственного промотора в каждой цепи (LSP – lightstrand promotor, HSP – heavy-strand promotor); это некодирующая область; - Репликация однонаправленна и асинхронна, нити имеют разные сайты начала репликации (OH, OL). ОН локализован в области D-петли, имеющей консервативные блоки CSB I, CSB II и CSB III. OL локализован на большом расстоянии от ОН и ограничивается областью 30 bp внутри кластера генов т. РНК.
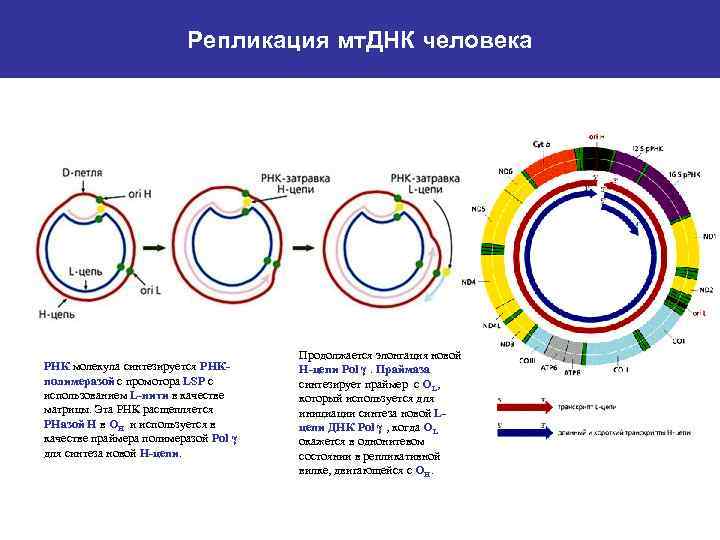
Репликация мт. ДНК человека РНК молекула синтезируется РНКполимеразой с промотора LSP с использованием L-нити в качестве матрицы. Эта РНК расщепляется РНазой Н в ОН и используется в качестве праймера полимеразой Pol γ для синтеза новой Н-цепи. Продолжается элонгация новой Н-цепи Pol γ. Праймаза синтезирует праймер с OL, который используется для инициации синтеза новой Lцепи ДНК Pol γ , когда OL окажется в однонитевом состоянии в репликативной вилке, двигающейся с OH.
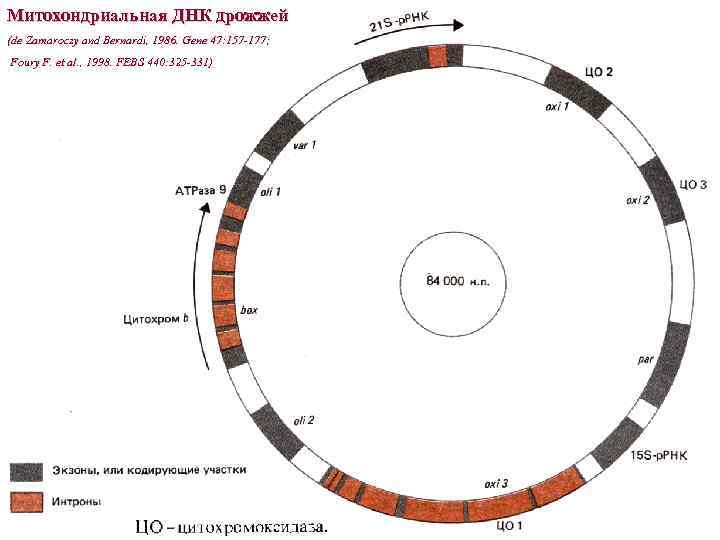
Митохондриальная ДНК дрожжей (de Zamaroczy and Bernardi, 1986. Gene 47: 157 -177; Foury F. et al. , 1998. FEBS 440: 325 -331)

• Митохондриальный геном дрожжей: - Частично секвенирован (de Zamaroczy and Bernardi, 1986); - Полная длина 85. 8 kbp определена для штамма FY 1679 (Foury et al. , 1998); - Микроскопирование показало, что молекулы как кольцевые (функциональная единица), так и линейные размером 60 kbp-1 Mbp (репликативные интермедианты) (Bendich, 1996); - 19 функциональных сайтов инициации транскрипции; - Репликация зависит от транскрипции, двунаправленная, 7 -8 ori репликации (активных 3 -4), длиной 300 bp, имеют 3 GC-богатых кластера (А, В, С). Сайт инициации транскрипции (r) обнаруживается ниже С-кластера в активных ori. - 50 -100 нулеоидов, состоящих из белок-ДНК комплексов; в одном нуклеоиде 3 -4 копии мт. ДНК и более 20 белков; размер нуклеоида 20 -50 нм. r

оri репликации мт. ДНК дрожжей (Baldacci and Bernardi, EMBO J. 1982: 987 -994) оri ~300 bp, состоит из 3 GC-богатых кластеров (А, В, С), разделенных АТ-богатыми участками. Участок А - В может принимать вторичную структуру, С-кластер имеет схожую последовательность с ori H-нити человека.

Сайт начала транскрипции локализован в АТ-богатой области, примыкающей к Скластеру
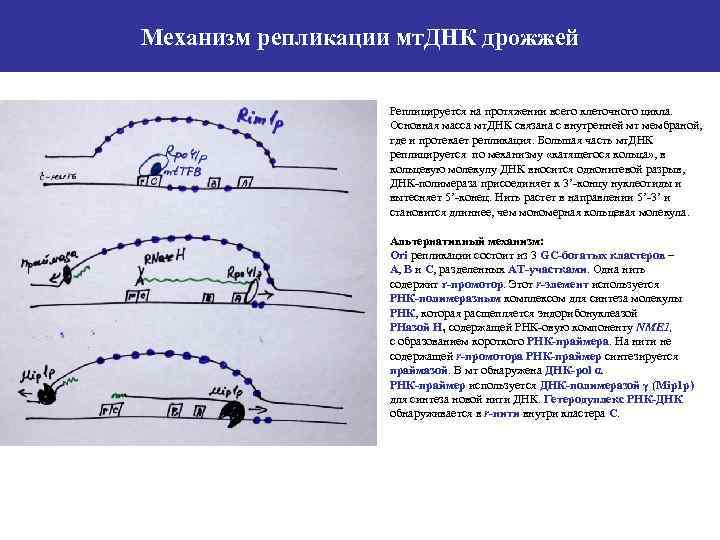
Механизм репликации мт. ДНК дрожжей Реплицируется на протяжении всего клеточного цикла. Основная масса мт. ДНК связана с внутренней мт мембраной, где и протекает репликация. Большая часть мт. ДНК реплицируется по механизму «катящегося кольца» , в кольцевую молекулу ДНК вносится однонитевой разрыв, ДНК-полимераза присоединяет к 3’-концу нуклеотиды и вытесняет 5’-конец. Нить растет в направлении 5’-3’ и становится длиннее, чем мономерная кольцевая молекула. Альтернативный механизм: Ori репликации состоит из 3 GC-богатых кластеров – А, В и С, разделенных АТ-участками. Одна нить содержит r-промотор. Этот r-элемент используется РНК-полимеразным комплексом для синтеза молекулы РНК, которая расщепляется эндорибонуклеазой РНазой Н, содержащей РНК-овую компоненту NME 1, с образованием короткого РНК-праймера. На нити не содержащей r-промотора РНК-праймер синтезируется праймазой. В мт обнаружена ДНК-pol α. РНК-праймер используется ДНК-полимеразой γ (Mip 1 p) для синтеза новой нити ДНК. Гетеродуплекс РНК-ДНК обнаруживается в r-нити внутри кластера С.
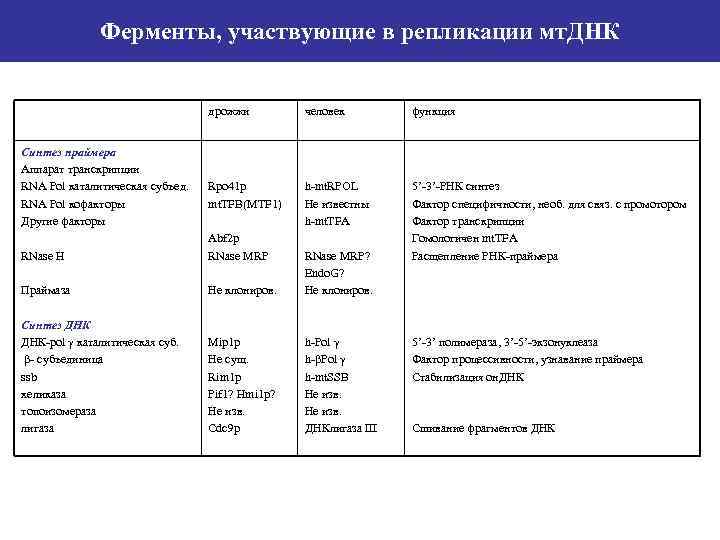
Ферменты, участвующие в репликации мт. ДНК дрожжи Синтез праймера Аппарат транскрипции RNA Pol каталитическая субъед. RNA Pol кофакторы Другие факторы человек функция Rpo 41 p mt. TFB(MTF 1) h-mt. RPOL Не известны h-mt. TFA 5’-3’-РНК синтез Фактор специфичности, необ. для связ. с промотором Фактор транскрипции Гомологичен mt. TFA Расщепление РНК-праймера RNase H Abf 2 p RNase MRP Праймаза Не клониров. RNase MRP? Endo. G? Не клониров. Синтез ДНК-pol γ каталитическая суб. β- субъединица ssb хеликаза топоизомераза лигаза Mip 1 p Не сущ. Rim 1 p Pif 1? Hmi 1 p? Не изв. Cdc 9 p h-Pol γ h-βPol γ h-mt. SSB Не изв. ДНКлигаза III 5’-3’ полимераза, 3’-5’-экзонуклеаза Фактор процессивности, узнавание праймера Стабилизация он. ДНК Сшивание фрагментов ДНК
Lection 6.ppt