
Лекція № 6 Ферменти. Гормони Викладач: к. б. н. , доц. Кліх Лариса Володимирівна

План 1. Ферменти. 1. 1. Історія вчення про ферменти. 1. 2. Методи виділення і очистки ферментів. 1. 3. Властивості ферментів. 1. 4. Хімічна природа ферментів. 1. 5. Ізоферменти. 1. 6. Механізм дії ферментів. 1. 7. Номенклатура і класифікація ферментів. 1. 8. Біосинтез і клітинна локалізація ферментів.

Рекомендована література l Кононський О. І. Біохімія тварин - Київ. – Вища школа. – 2004 р. – 564 с.
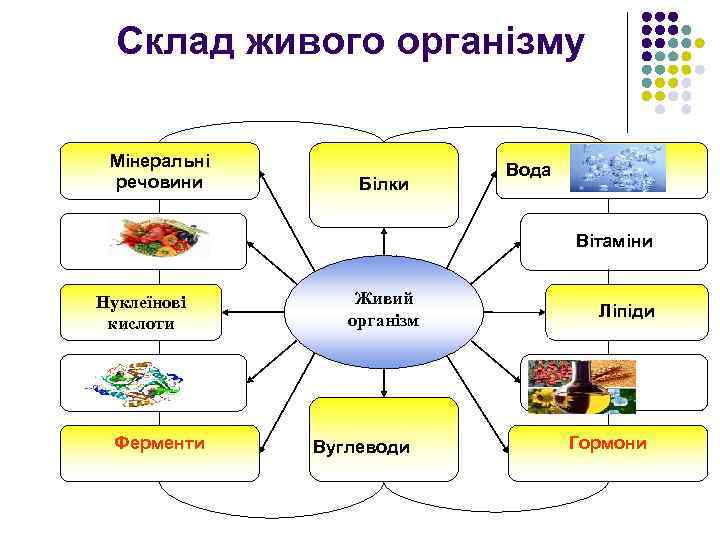
Склад живого організму Мінеральні речовини Білки Вода Вітаміни Нуклеїнові кислоти Ферменти Живий організм Вуглеводи Ліпіди Гормони

Ферменти (от лат. «fermentum» — бродіння, закваска), (ензими) – біологічні каталізатори білкової природи.

Історія відкриття ферментів Перші відомості про ферменти як про речовини, які впливають на спиртове бродіння, з’явилися на початку 18 ст. у роботах німецького вченого Лібавія і голандського вченого Ван Гельмонта. У 1836 році Шванн виявив у шлунковому соці фермент трипсин. У 1837 році Берцеліус порівняв фермент з неорганічними каталізаторами. У 1894 році Е. Фішер запропонував гіпотезу, яка пояснювала специфічність ферментів и отримала назву “ключа і замка”. На початку 20 ст. І. Павлов довів, що ферменти можуть існувати в організмі в неактивній формі – у вигляді проформентів. У 1913 році Міхаеліс і Ментен розробили теорію механізму дії ферментів. У 1926 році вперше був отриманий фермент уреаза у кристалічному вигляді.

Історія відкриття ферментів l l l Термін «фермент» був запропонований у 17 столітті хіміком ван Гельмонтом для опису механізмів травлення. На початку 19 століття було відомо, що м'ясо перетравлюється шлунковим соком, а крохмаль перетворюється на цукор під дією слини. Проте механізм цих явищ був ще невідомий. В 19 столітті Луї Пастер, вивчаючи перетворення вуглеводів в етиловий спирт під дією дріжджів, дійшов до висновку, що цей процес (бродіння) каталізується якоюсь «життєвою силою» , що знаходиться в дріжджових клітинах. Понад сто років тому терміни «фермент» і «ензим» відображали різні погляди Луї Пастера з одного боку та Марселена Бертло і Юстуса Лібіха з іншого в теоретичній суперечці про природу спиртового бродіння. Власне «ферментами» (від лат. fermentum — «закваска» ) називали «організовані ферменти» (тобто саме живі мікроорганізми), а термін «ензим» (від грец. ἐν- — «в-» і ζύμη — «дріжджі» , «закваска» ), запропонований 1876 року В. Кюне для «неорганізованих ферментів» , що секретуються клітинами, наприклад, до шлунку (пепсин) або кишечника (трипсин, амілаза). За два роки по смерті Пастера 1897 року Едуард Бюхнер опублікував роботу «Спиртове бродіння без дріжджових клітин» , в якій експериментально показав, що екстракт клітин дріжджів здійснює спиртове бродіння так само, як і незруйновані дріжджові клітини 1907 року за цю роботу він був удостоєний Нобелівської премії.

ФЕРМЕНТОЛОГЫЯ ЯК НАУКА Ферментологія (ензимологія) – область біохімії, яка стрімко розвивається на сучасному етапі і досягнення якої широко використовуються у практичній медицині, фармації, харчовій промисловості і інш.

Ферме нти або ензи ми - органічні каталізатори білкової або РНК природи, які утворюються в живих організмах, здатних прискорювати перебіг хімічних реакцій в організмі. Терміни «фермент» і «ензим» можна використовувати як синоніми. Наука про ферменти називається ензимологією, а не ферментологією. l

Загальні уявлення про каталіз l Реакція екзергонічна, якщо вільна енергія вихідних речовин вища, ніж у продуктів реакції. l Реакція ендергонічна, якщо вільна енергія вихідних речовин нижча, ніж у продуктів реакції.
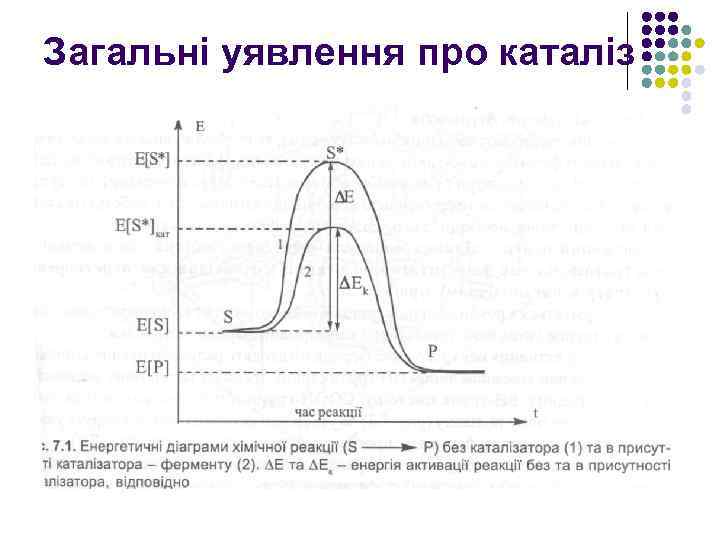
Загальні уявлення про каталіз

ЕНЕРГІЯ АКТИВАЦІЇ Вільною енергією активації називається додаткова кількість енергії, яку необхідно надати молекулам речовини, щоб вони подолали енергетичний бар’єр реакції, тобто вступили в реакцію

Подібні ознаки ферментів і небіологічних каталізаторів l l Вони каталізують тільки енергетично можливі реакції Вони ніколи не змінюють напрям реакції Вони не змінюють рівновагу оборотної реакції, а лише прискорюють її завершення Вони не витрачаються в процесі реакції

Ознаки ферментів, які відрізняють їх від небіологічних каталізаторів l l l Швидкісь ферментативного каталізу набагато вища, ніж небілкового Ферменти мають високу специфічність Ферменти каталізують хімічні реакції у “м’яких” умовах Ферменти є каталізаторами з регульованою активністю Швидкість ферментативної реакції прямопропорційна кількості ферменту
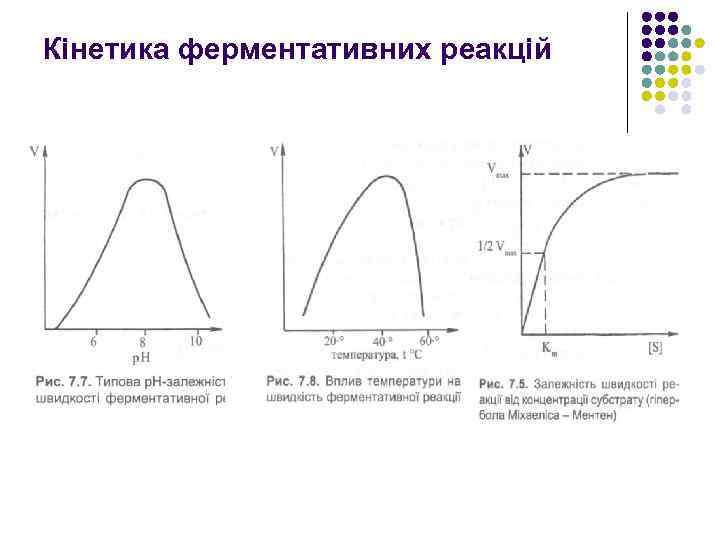
Кінетика ферментативних реакцій

l l l Ферменти каталізують більшість хімічних реакцій, які відбуваються у живих організмах. Вони можуть мати від одного до кількох поліпептидних ланцюгів - субодиниць. Кожен із ферментів має один або більше активних центрів, які визначають специфічність хімічної реакції, що каталізується даним ферментом. Крім активного центру деякі ферменти мають алостеричний центр, який регулює роботу активного центру. Ферментативна реакція також може регулюватися іншими молекулами, як білкової природи, так й іншими - активаторами та інгібіторами. Всі біохімічні реакції відбуваються за участю ферментів за нормальним тиском, температурою, у слабокислому, нейтральному чи слаболужному середовищі. Ферменти РНК-природи називаються рибозимами і вважаються первісною формою ферментів, які були замінені білковими ферментами в процесі еволюції.

Функції ферментів l l Ферменти є біологічними каталізаторами, вони наявні в усіх живих клітинах і сприяють перетворенню одних речовин (субстратів) на інші (продукти). Ферменти виступають в ролі каталізаторів практично в усіх біохімічних реакціях, що відбуваються в живих організмах - ними каталізується близько 4000 окремих біореакцій. Ферменти грають найважливішу роль у всіх процесах життєдіяльності, скеровуючи та регулюючи обмін речовин иорганізму. Для ферментів характерним є те, що їх синтез та каталітична активність контролюється на генетичному рівні, а також за участю низькомолекулярних сполуксубстратів або продуктів реакції.

Функції ферментів l l Подібно до всіх каталізаторів, ферменти прискорюють як пряму, так і зворотну реакцію, знижуючи енергію активації процесу. Хімічна рівновага при цьому не зсувається ні в прямий, ні в зворотний бік. Відмінність ферментів від небілкових каталізаторів полягає у їхній високій специфічності - константа дисоціації деяких субстратів з білком-ферментом може досягати менш ніж 10− 10 моль/л. Ферменти широко використовуються і в народному господарстві - у харчовій, текстильній промисловості, у фармакології.

Класифікація ферментів За типом реакцій, що каталізують, ферменти підрозділяються на 6 класів згідно з ієрархічною класифікацією ферментів (КФ або EC — Enzyme Commission code). Класифікацію було запропоновано Міжнародним союзом біохімії і молекулярної біології (International Union of Biochemistry and Molecular Biology). Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками. Наприклад, пепсин має код КФ 3. 4. 23. 1.

Класифікація ферментів Перше число описує клас реакцій, що каталізує фермент: l КФ 1: Оксидоредуктази - ферменти, що каталізують окислення або відновлення. Приклад: каталаза, алкогольдегідрогеназа l КФ 2: Трансферази - ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ. l КФ 3: Гідролази - ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза l КФ 4: Ліази - ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів. l КФ 5: Ізомерази - ферменти, що каталізують структурні або геометричні зміни в молекулі субстрата. l КФ 6: Лігази - ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза Будучи каталізаторами, ферменти прискорюють як пряму, так і зворотну реакції, тому, наприклад, ліази здатні каталізувати і зворотну реакцію - приєднання по подвійних зв'язках. Тим не менш напрямок реакції може залучати кілька субстратів і бути таким, що зворотна реакція практично не відбувається.

Найменування ферментів l l l Зазвичай ферменти іменують за типом реакції, яку він каталізує, додаючи суфікс -аза до назви субстрату (наприклад лактаза - фермент, що бере участь в перетворенні лактози). Таким чином, у різних ферментів, що виконують одну функцію, буде однакова назва. Такі ферменти розрізняють по інших властивостях, наприклад, по оптимальному p. H (лужна фосфатаза) або локалізації в клітині (мембранна АТФ-аза).

Номенклатура ферментів Робоча (тривіальна) назва складається з назви субстрату, типу реакції, яку каталізує фермент і закінчення – аза Лактат + дегідрогенізація + аза = лактатдегідрогеназа

Травні ферменти Розрізряють три основні типи травних ферментів: амілаза, протеаза, ліпаза. Амілаза розщеплює вуглеводи і знаходиться у слині , секреті підшлункової залози і у вмісті кишечника. Протеази каталізують перетравлення білків, знаходяться в секркті підшлункової залози і вмісті шлунка. Ліпаза розщеплює жири, знаходиться в шлунковому соці і секреті підшлункової залози.

Класифікація ферментів Назва класу вказує на тип хімічної реакції, яку каталізує фермент: 1. 2. 3. Оксидоредуктази – ферменти, які каталізують окисновідновні реакції (піруватдегідрогеназа) Трансферази – ферменти, які каталізують реакції переносу різних груп від одного субстрату (донор) до іншого (акцептор) (метилтрансфераза, амінотрансфераза) Гідролази – ферменти, які каталізують розрив зв’язків у субстратах з приєднанням води (дипептидаза)

Класифікація ферментів 4. Ліази – ферменти, які каталізують реакції розриву зв’язків у субстраті без приєднання води або окиснення (піруватдекарбоксилаза) 5. Ізомерази – ферменти, які каталізують перетворення в межах однієї молекули (тріозофосфатізомераза) 6. Лігази – ферменти, які каталізують з’єднання двох молекул з використанням енергії фосфатного зв’язку (аспарагінсинтетаза)

Структура і механізм дії ферментів l l l Активність ферментів визначається їхньою тривимірною структурою. Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, який згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і молекула (білкова глобула), що виходить, володіє унікальними властивостями. Кілька білкових ланцюжків можуть об'єднуватися у білковий комплекс. Найбільші рівні структури білків - третинна та четвертинна структури - руйнуються при нагріванні або під дією деяких хімічних речовин. Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або кількома субстратами. Білковий ланцюжок ферменту згортається таким чином, що на поверхні глобули утворюється щілина або западина, до якої приєднуються молекули субстрату. Ця область називається ділянкою (сайтом) зв'язування субстрата. Зазвичай вона збігається з активним центром ферменту або знаходиться поблизу від нього. Деякі ферменти містять також ділянки зв'язування кофакторів або іонів металів. У деяких ферментів присутні також ділянки зв'язування малих молекул, що не беруть безпосередньої участі в реакції і часто, але не обов'язково, є субстратами або продуктами метаболічного шляху, в який входить фермент. Вони зменшують або збільшують активність ферменту, що створює можливість для зворотного зв'язку або регуляції роботи ферменту. Для активних центрів деяких ферментів характерне явище кооперативності.
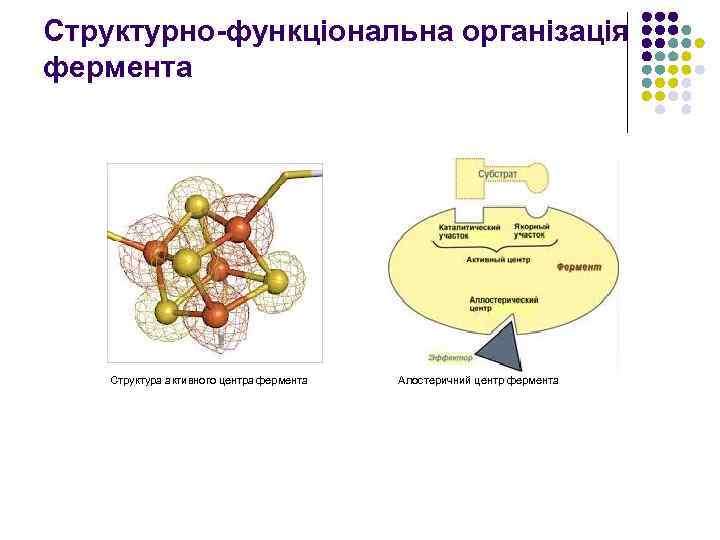
Структурно-функціональна організація фермента Структура активного центра фермента Алостеричний центр фермента
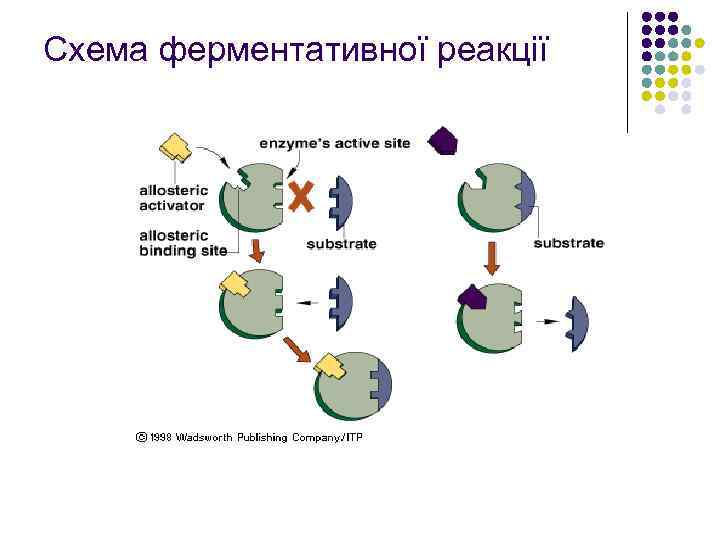
Схема ферментативної реакції

Механізм дії ферментів Ферменти зазвичай проявляють високу специфічність по відношенню до своїх субстратів. Це досягається частковою комплементарністю форми, розподілу зарядів і гідрофобних областей на молекулі субстрата і в ділянці зв'язування субстрата на ферменті. Ферменти демонструють високий рівень стереоспецифічності (просторової специфічності), регіоселектівності (специфічності орієнтації) і хемоселектівності (специфічності до хімічних груп). Модель «ключ-замок» У 1890 році Еміль Фішер припустив, що специфічність ферментів визначається точною відповідністю форми ферменту і субстрату. Таке припущення називається моделлю «ключ-замок» . Фермент з'єднується з субстратом з утворенням короткоживучого фермент-субстратного комплексу. Проте, хоча ця модель пояснює високу специфічність ферментів, вона не пояснює явища стабілізації перехідного стану, який спостерігається на практиці. Модель індукованої відповідності У 1958 році американський дослідник Деніел Кошланд запропонував модифікацію моделі «ключ-замок» . Ферменти, в основному, - не жорсткі, а гнучкі молекули. Активний центр ферменту може змінити конформацію після зв'язування з ним субстата. Бічні групи амінокислот активного центру займають таке положення, яке дозволяє ферменту виконувати свою каталітичну функцію. В деяких випадках молекула субстрата також міняє конформацію після скріплення в активному центрі. На відміну від моделі «ключ-замок» , модель індукованої відповідності пояснює не тільки специфічність ферментів, але і стабілізацію перехідного стану.
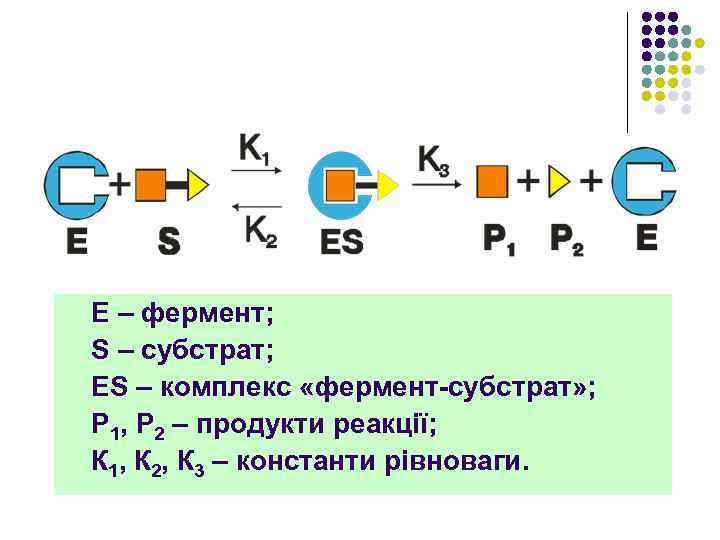
Е – фермент; S – субстрат; ES – комплекс «фермент-субстрат» ; Р 1, Р 2 – продукти реакції; К 1, К 2, К 3 – константи рівноваги.
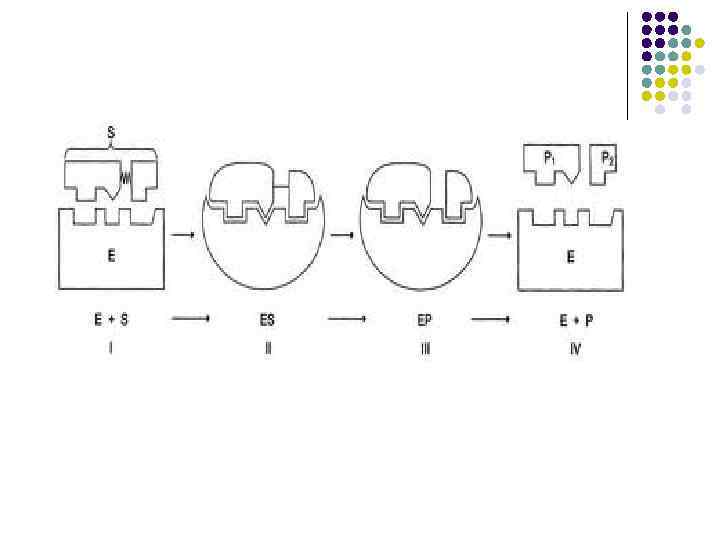
Механізм дії ферментів

ДЯКУЮ ЗА УВАГУ