Лекция 6 Биологически важные реакции карбонильных соединений.


Лекция 6 Биологически важные реакции карбонильных соединений. Реакции нуклеофильного присоединения АN.
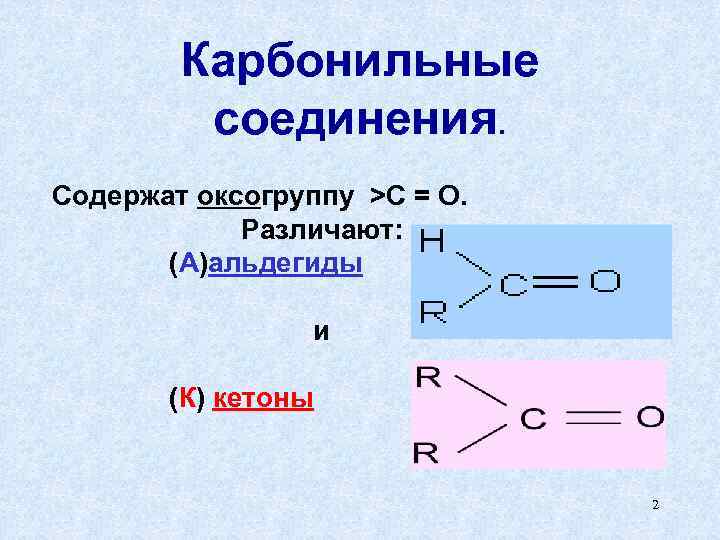
Карбонильные соединения. Содержат оксогруппу >C = O. Различают: (А)альдегиды и (К) кетоны 2

Альдегиды и кетоны В природе широко распространены простые и сложные альдегиды и кетоны. Запах многих из них ассоциируется у нас с продуктами, из которых они были выделены: Ванилин содержится в ванили Коричный альдегид – в корице Цитраль – в лимонном масле Пиридоксаль входит в состав витамина В 6. Он выполняет функцию кофермента при ферментативных процессах транс-аминирования и декарбоксилирования α-аминокислот. 3

Карбонильная группа присутствует во многих биомолекулах, в том числе и в углеводах – глюкозе, фруктозе и др. Именно они содержатся в овощах, фруктах и т. п. . 4

Альдегиды и кетоны В природе широко распространены простые и сложные альдегиды и кетоны. Запах многих из них ассоциируется у нас с продуктами, из которых они были выделены: Ванилин содержится в ванили Коричный альдегид – в корице Цитраль – в лимонном масле Пиридоксаль входит в состав витамина В 6. Он выполняет функцию кофермента при ферментативных процессах транс-аминирования и декарбоксилирования α-аминокислот. 5

Карбонильная группа присутствует во многих биомолекулах, в том числе и в углеводах – глюкозе, фруктозе и др. Именно они содержатся в овощах, фруктах и т. п. . 6
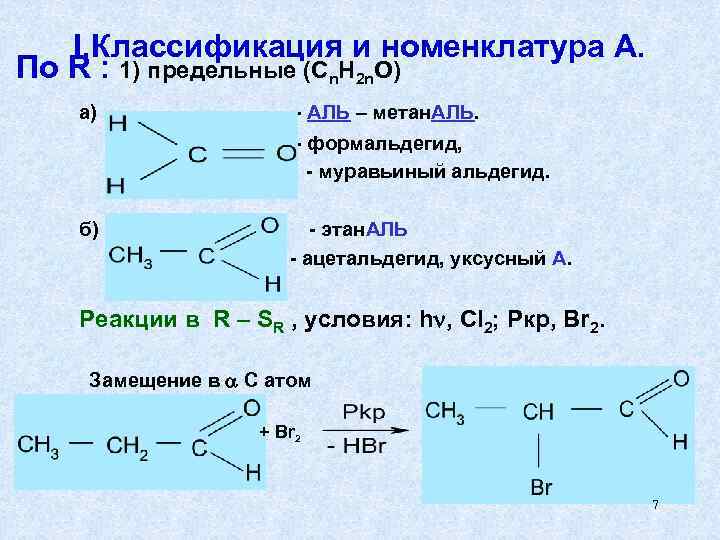
I. Классификация и номенклатура А. По R : 1) предельные (Cn. H 2 n. O) а) - АЛЬ – метан. АЛЬ. - формальдегид, - муравьиный альдегид. б) - этан. АЛЬ - ацетальдегид, уксусный А. Реакции в R – SR , условия: h , Cl 2; Pкр, Br 2. Замещение в С атом + Br 2 7
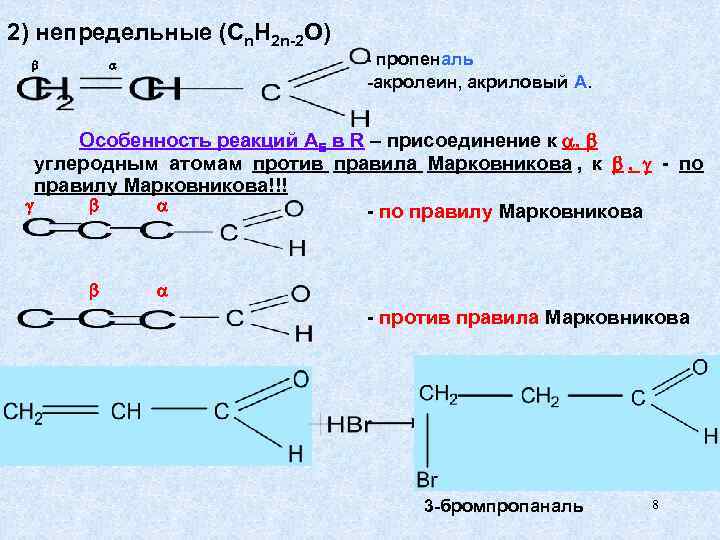
2) непредельные (Cn. H 2 n-2 O) - пропеналь -акролеин, акриловый А. Особенность реакций АE в R – присоединение к , углеродным атомам против правила Марковникова , к , - по правилу Марковникова!!! - по правилу Марковникова - против правила Марковникова 3 -бромпропаналь 8
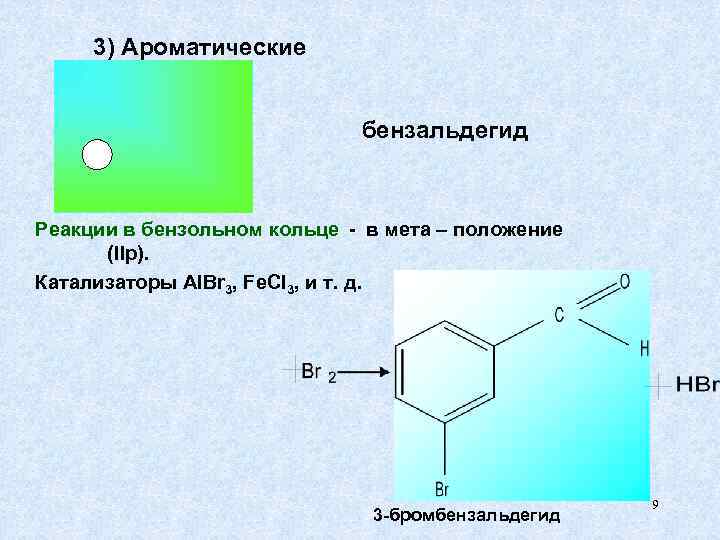
3) Ароматические бензальдегид Реакции в бензольном кольце - в мета – положение (IIр). Катализаторы Al. Br 3, Fe. Cl 3, и т. д. 9 3 -бромбензальдегид
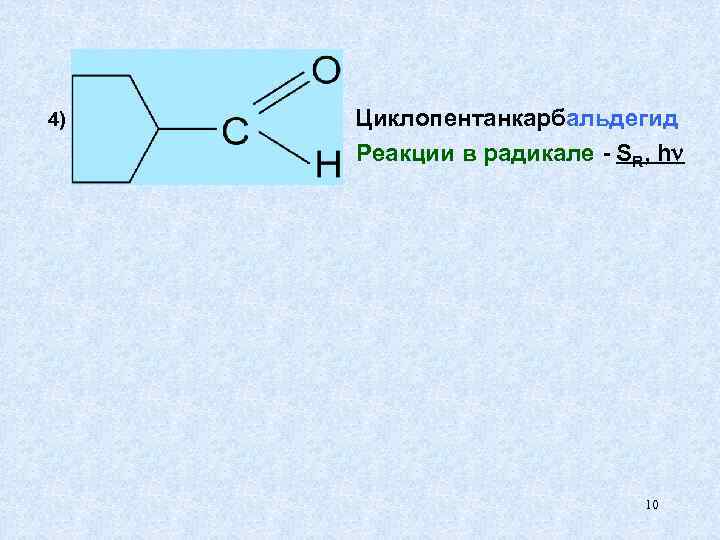
4) Циклопентанкарбальдегид Реакции в радикале - SR, h 10
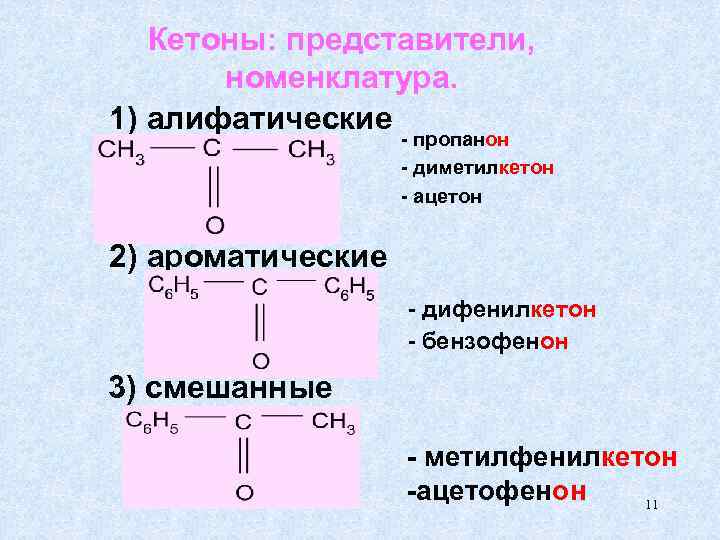
Кетоны: представители, номенклатура. 1) алифатические - пропанон - диметилкетон - ацетон 2) ароматические - дифенилкетон - бензофенон 3) смешанные - метилфенилкетон -ацетофенон 11
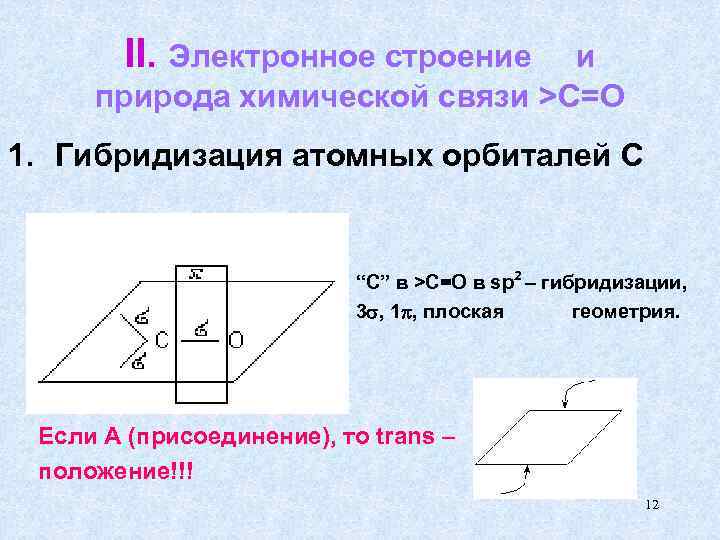
II. Электронное строение и природа химической связи >C=O 1. Гибридизация атомных орбиталей С “С” в >C=O в sp 2 – гибридизации, 3 , 1 , плоская геометрия. Если А (присоединение), то trans – положение!!! 12
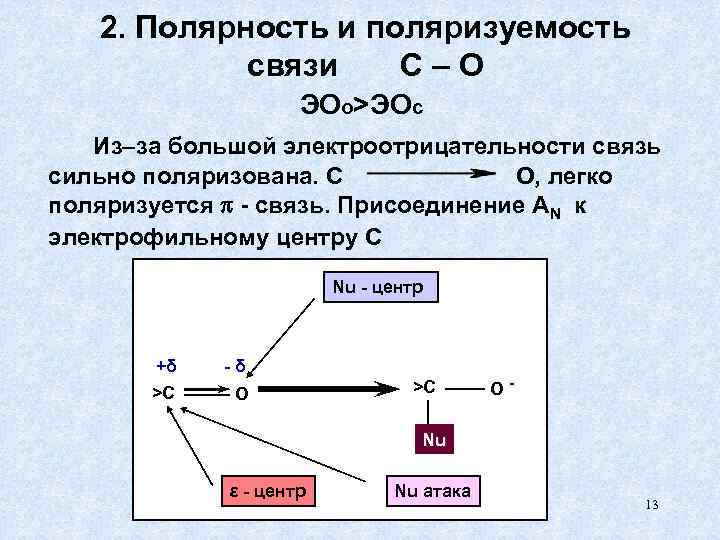
2. Полярность и поляризуемость связи С–О ЭОо>ЭОс Из–за большой электроотрицательности связь сильно поляризована. С О, легко поляризуется - связь. Присоединение AN к электрофильному центру С Nu - центр +δ -δ >С О >С О- Nu ε - центр Nu атака 13
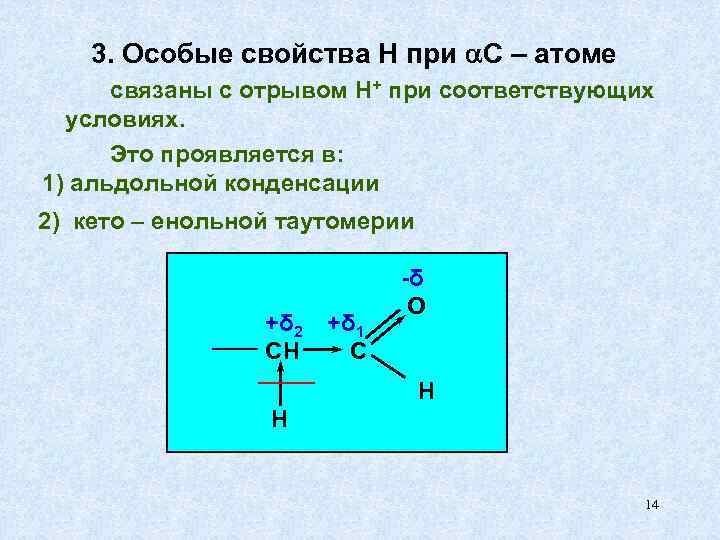
3. Особые свойства Н при С – атоме связаны с отрывом Н+ при соответствующих условиях. Это проявляется в: 1) альдольной конденсации 2) кето – енольной таутомерии -δ О +δ 2 +δ 1 СН С Н 14
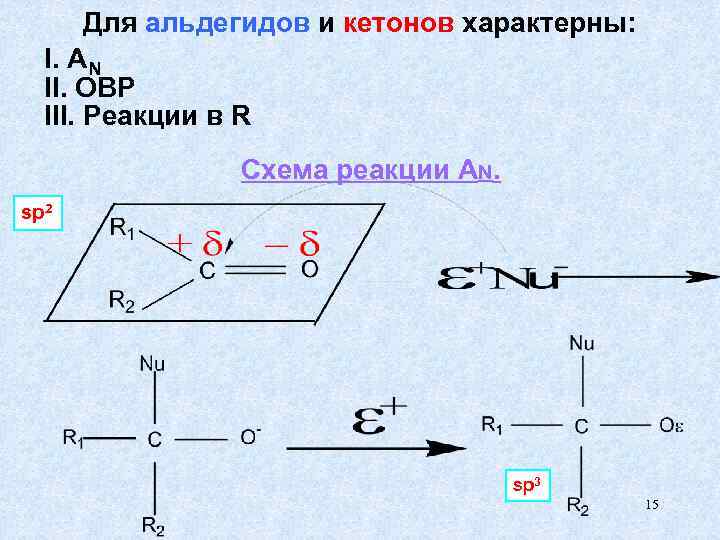
Для альдегидов и кетонов характерны: I. AN II. ОВР III. Реакции в R Схема реакции AN. sp 2 sp 3 15
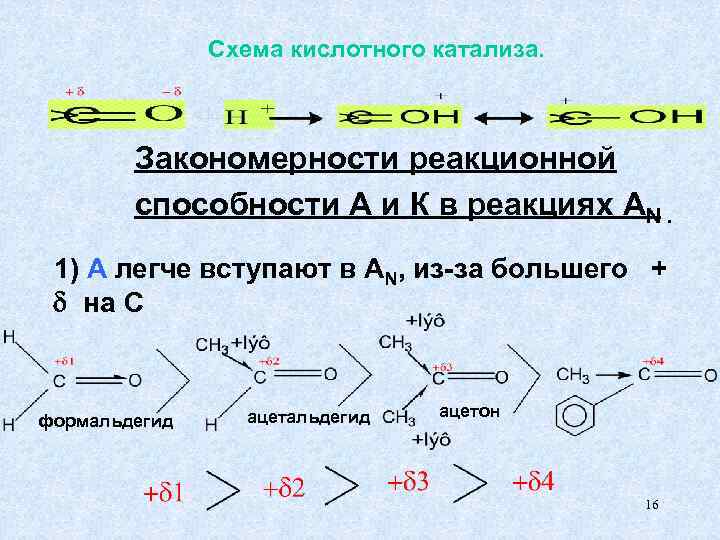
Cхема кислотного катализа. Закономерности реакционной способности А и К в реакциях AN. 1) A легче вступают в AN, из-за большего + на С ацетальдегид ацетон формальдегид 16
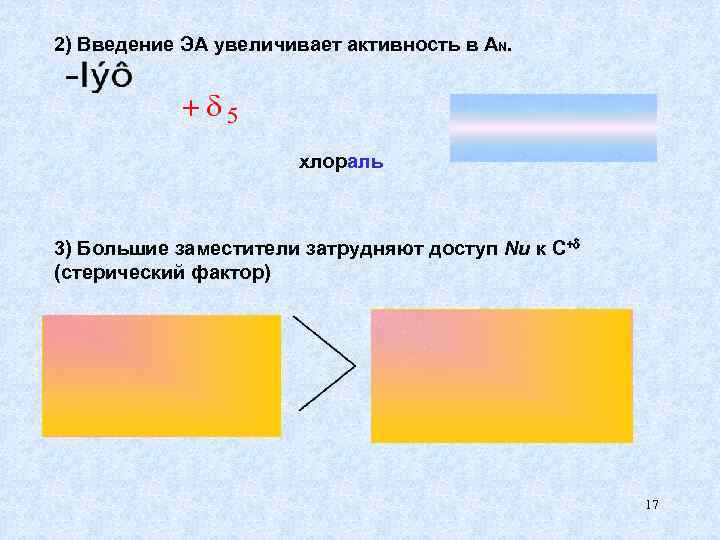
2) Введение ЭА увеличивает активность в AN. хлораль 3) Большие заместители затрудняют доступ Nu к С+ (стерический фактор) 17

Химические свойства карбонильных соединений. I. Реакции AN 1) Присоединение HCN– образование - гидроксинитрилов – А, К Реагент: - HCN (усл. КОН следы) или KCN (усл. Н+ ср. ) а) 2 - гидроксипропанонитрил 18
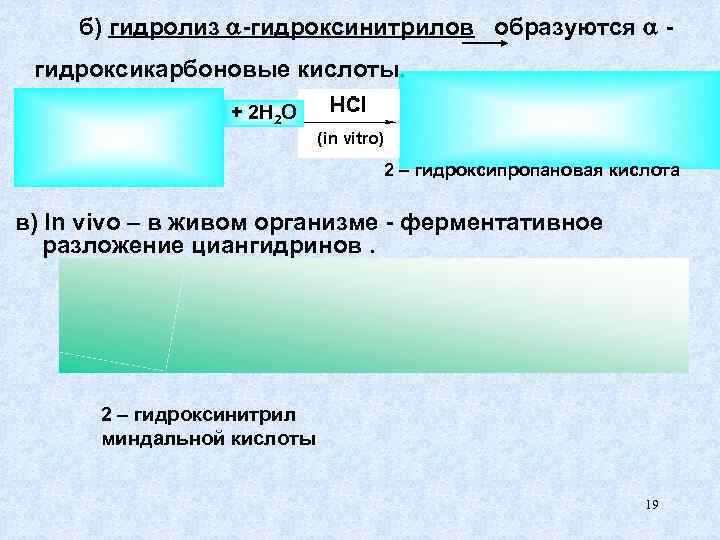
б) гидролиз -гидроксинитрилов образуются - гидроксикарбоновые кислоты. + 2 H 2 O 2 – гидроксипропановая кислота в) In vivo – в живом организме - ферментативное разложение циангидринов. 2 – гидроксинитрил миндальной кислоты 19

При гидролизе - гидроксинитрилов образуются - гидроксикарбоновые кислоты, которые имеют важное препаративное значение. - Молочная кислота участвует в реакциях кисломолочных продуктов, квашеной капусте, соленых огурцах. - Миндальная кислота содержится в косточках горького миндаля. 20
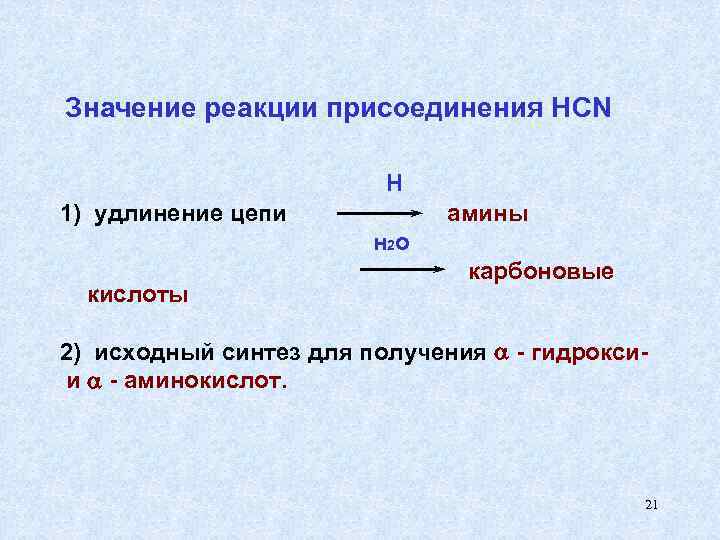
Значение реакции присоединения HCN Н 1) удлинение цепи амины н 2 о карбоновые кислоты 2) исходный синтез для получения - гидрокси- и - аминокислот. 21
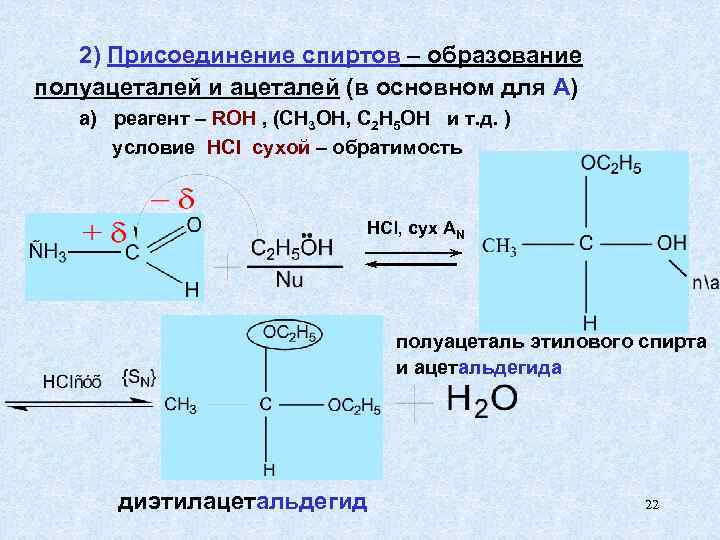
2) Присоединение спиртов – образование полуацеталей и ацеталей (в основном для А) а) реагент – ROH , (CH 3 OH, С 2 H 5 OH и т. д. ) условие HCl сухой – обратимость HCl, сух АN полуацеталь этилового спирта и ацетальдегида диэтилацетальдегид 22
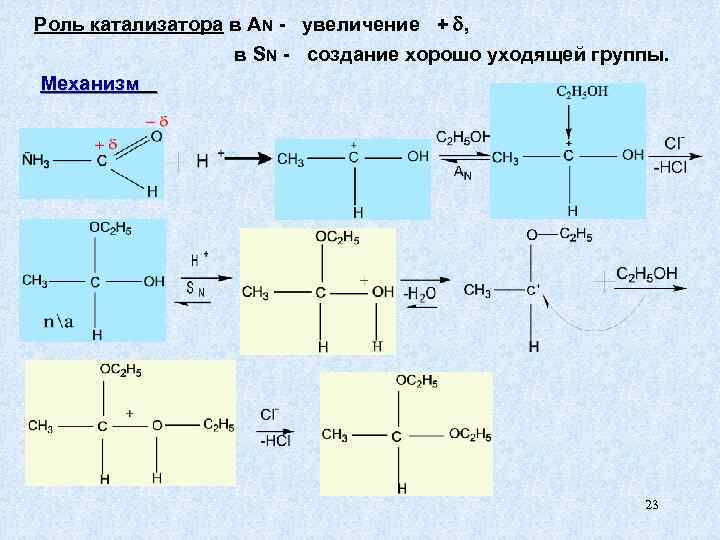
Роль катализатора в AN - увеличение + , в SN - создание хорошо уходящей группы. Механизм 23
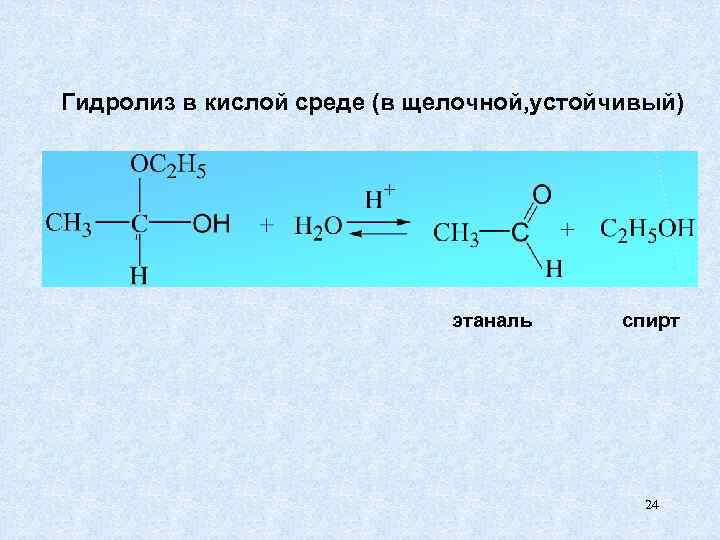
Гидролиз в кислой среде (в щелочной, устойчивый) этаналь спирт 24
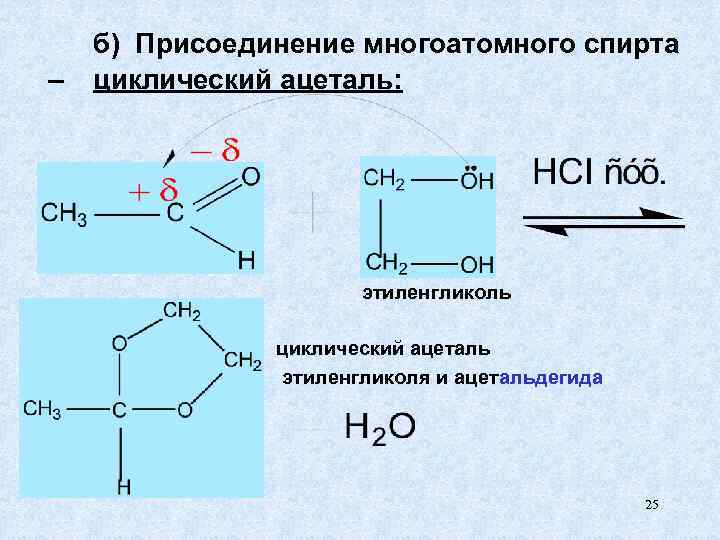
б) Присоединение многоатомного спирта – циклический ацеталь: этиленгликоль циклический ацеталь этиленгликоля и ацетальдегида 25
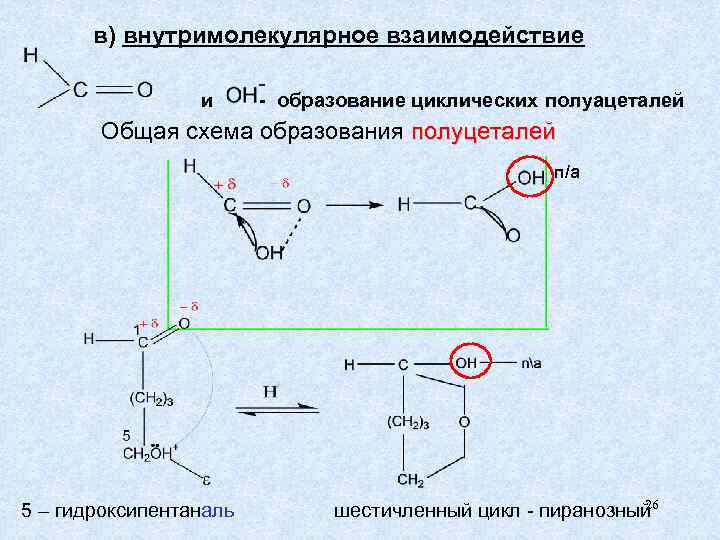
в) внутримолекулярное взаимодействие и - образование циклических полуацеталей Общая схема образования полуцеталей п/а 26 5 – гидроксипентаналь шестичленный цикл - пиранозный
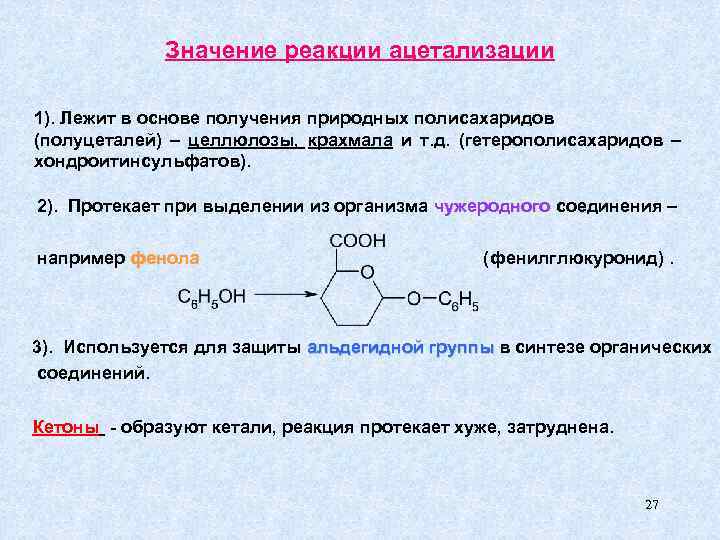
Значение реакции ацетализации 1). Лежит в основе получения природных полисахаридов (полуцеталей) – целлюлозы, крахмала и т. д. (гетерополисахаридов – хондроитинсульфатов). 2). Протекает при выделении из организма чужеродного соединения – например фенола (фенилглюкуронид). 3). Используется для защиты альдегидной группы в синтезе органических соединений. Кетоны - образуют кетали, реакция протекает хуже, затруднена. 27

Реакция ацетализации лежит в основе получения природных полисахаридов – целлюлозы, крахмала, и т. д. 28
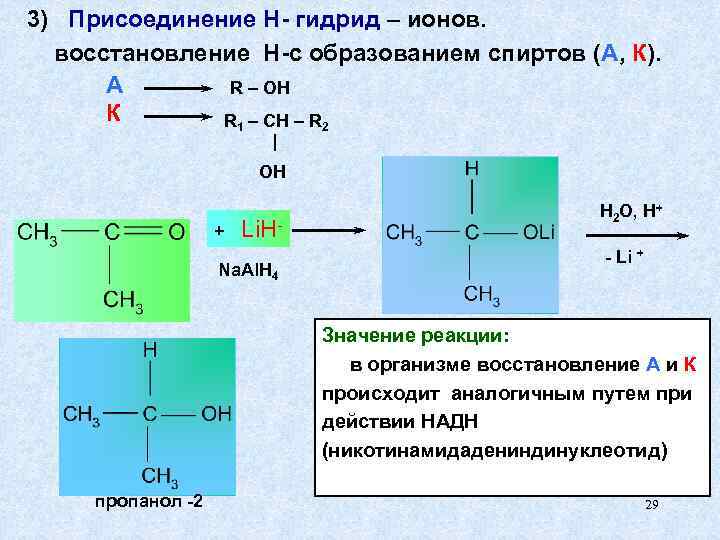
3) Присоединение H- гидрид – ионов. восстановление Н-с образованием спиртов (А, К). А R – OH К R 1 – CH – R 2 OH H 2 O, H+ + Li. H- - Li + Na. Al. H 4 Значение реакции: в организме восстановление А и К происходит аналогичным путем при действии НАДН (никотинамидадениндинуклеотид) пропанол -2 29
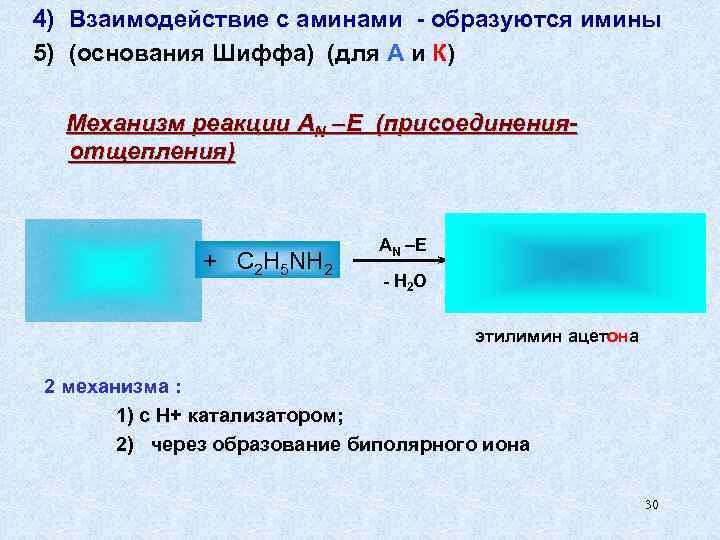
4) Взаимодействие с аминами - образуются имины 5) (основания Шиффа) (для А и К) Механизм реакции AN –E (присоединения- отщепления) AN –E + C 2 H 5 NH 2 - H 2 O этилимин ацетона 2 механизма : 1) с Н+ катализатором; 2) через образование биполярного иона 30
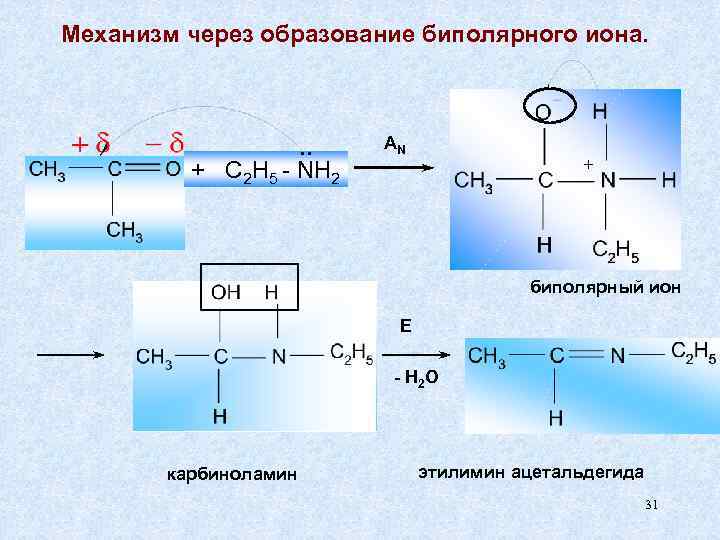
Механизм через образование биполярного иона. . . AN + C 2 H 5 - NH 2 + биполярный ион E - H 2 O карбиноламин этилимин ацетальдегида 31
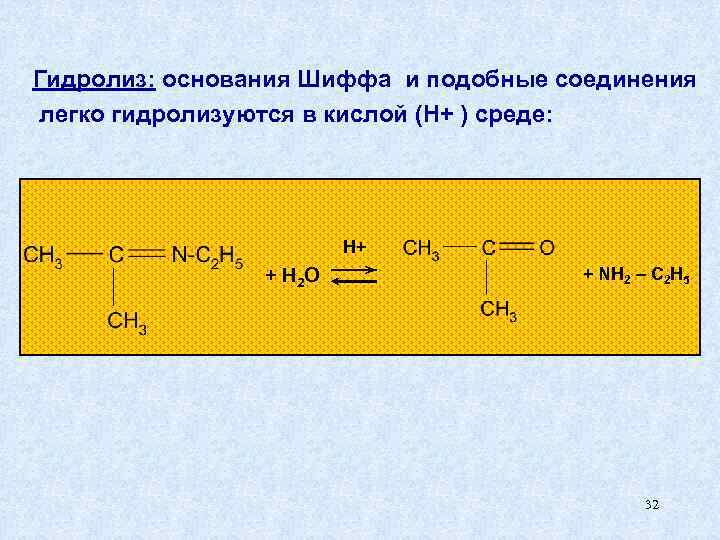
Гидролиз: основания Шиффа и подобные соединения легко гидролизуются в кислой (Н+ ) среде: H+ + H 2 O + NH 2 – C 2 H 5 32
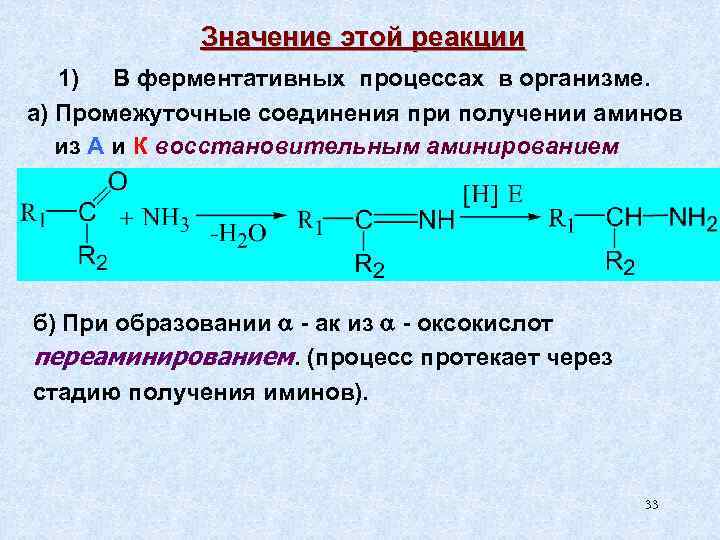
Значение этой реакции 1) В ферментативных процессах в организме. а) Промежуточные соединения при получении аминов из А и К восстановительным аминированием б) При образовании - ак из - оксокислот переаминированием. (процесс протекает через стадию получения иминов). 33

Процессы трансаминирования, переаминирования аминогруппы происходят с участием кофермента пиридоксальфосфата. Пиридоксальфосфат выполняет функцию переносчика аминогруппы, т. е. временно хранит NH 2 -группу, являясь «камерой хранения» ) 2 метил – 3 гидрокси, 5 гидрокси – пиридин – 4 карбальдегид 34

Химические превращения α-аминокислот в организме под воздействием пиридоксальфосфата пиридоксальфосфат α-аминокислота альдимин 35
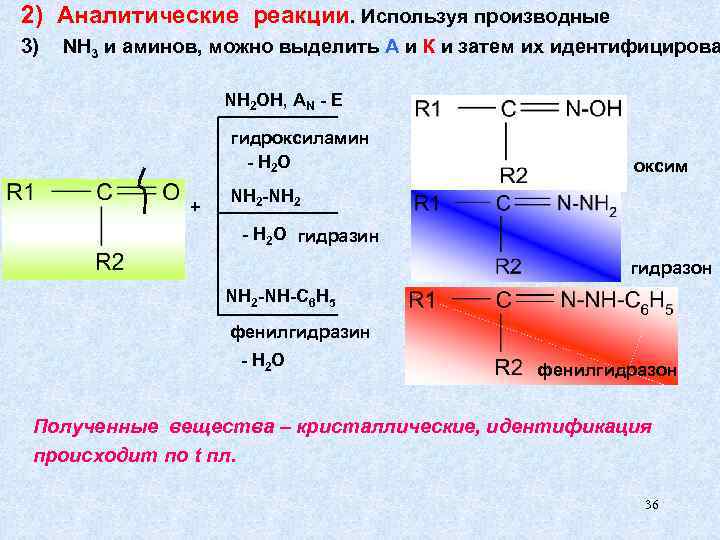
2) Аналитические реакции. Используя производные 3) NH 3 и аминов, можно выделить А и К и затем их идентифицирова NH 2 OH, AN - E гидроксиламин - H 2 O оксим NH 2 -NH 2 + - H 2 O гидразин гидразон NH 2 -NH-C 6 H 5 фенилгидразин - H 2 O фенилгидразон Полученные вещества – кристаллические, идентификация происходит по t пл. 36
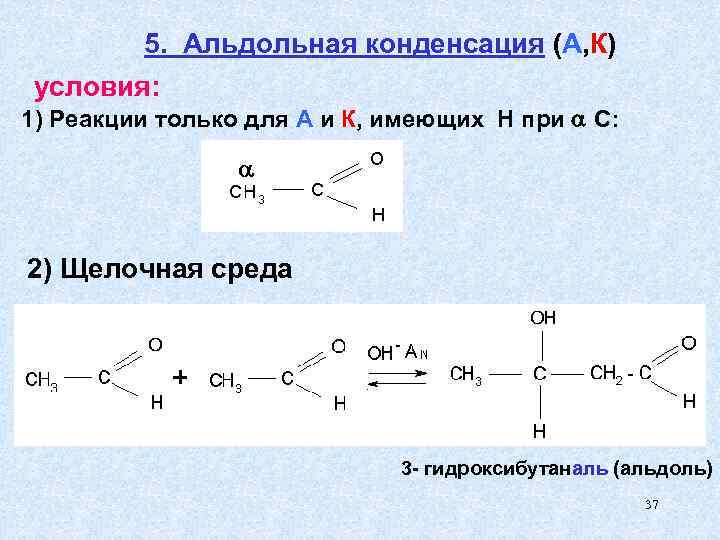
5. Альдольная конденсация (А, К) условия: 1) Реакции только для А и К, имеющих Н при С: 2) Щелочная среда 3 - гидроксибутаналь (альдоль) 37
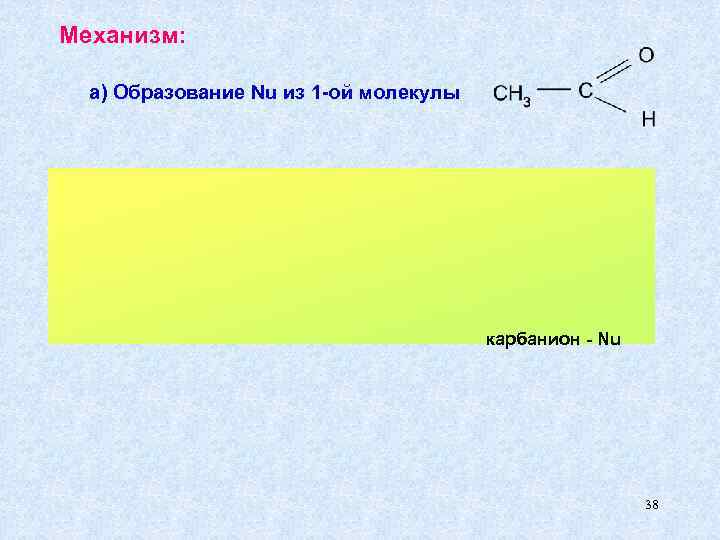
Механизм: а) Образование Nu из 1 -ой молекулы карбанион - Nu 38
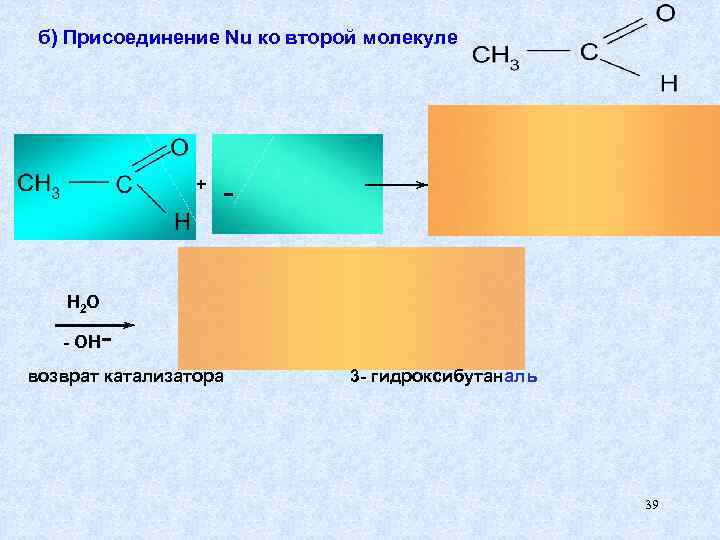
б) Присоединение Nu ко второй молекуле + - H 2 O - OH - возврат катализатора 3 - гидроксибутаналь 39
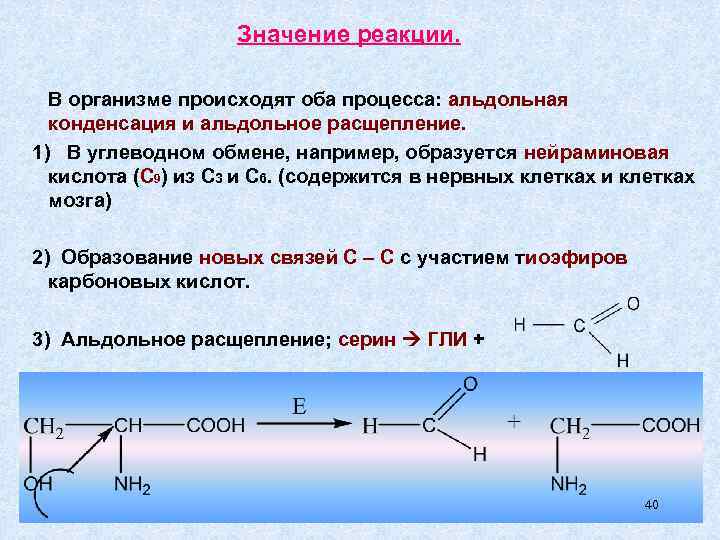
Значение реакции. В организме происходят оба процесса: альдольная конденсация и альдольное расщепление. 1) В углеводном обмене, например, образуется нейраминовая кислота (С 9) из С 3 и С 6. (содержится в нервных клетках и клетках мозга) 2) Образование новых связей С – С с участием тиоэфиров карбоновых кислот. 3) Альдольное расщепление; серин ГЛИ + 40
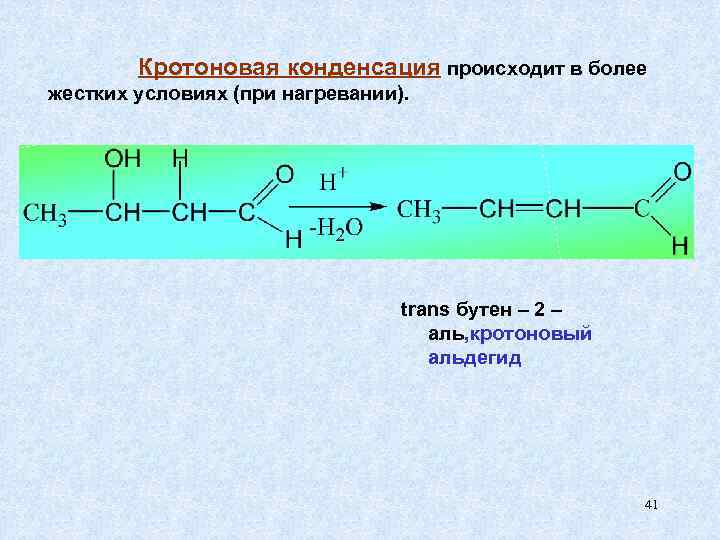
Кротоновая конденсация происходит в более жестких условиях (при нагревании). trans бутен – 2 – аль, кротоновый альдегид 41
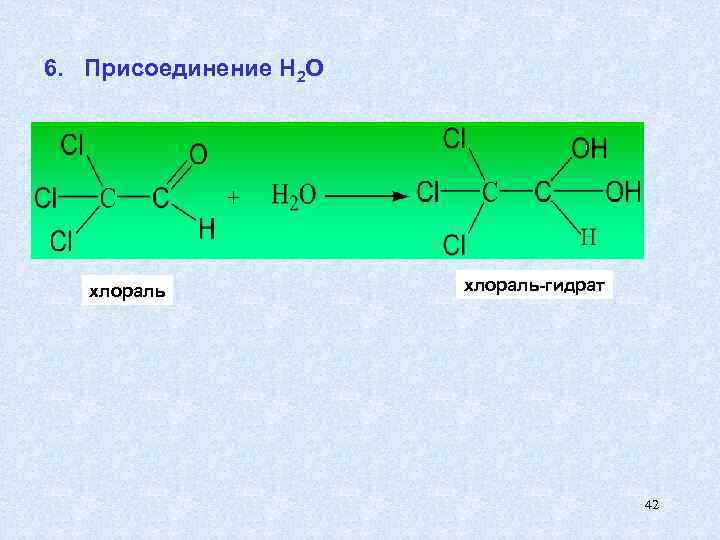
6. Присоединение Н 2 О хлораль-гидрат 42

Хлоральгидрат применяется в медицине как успокаивающее и снотворное средство. В основе его фармакологического эффекта лежит наркотическое действие на организм альдегидной группы. 43
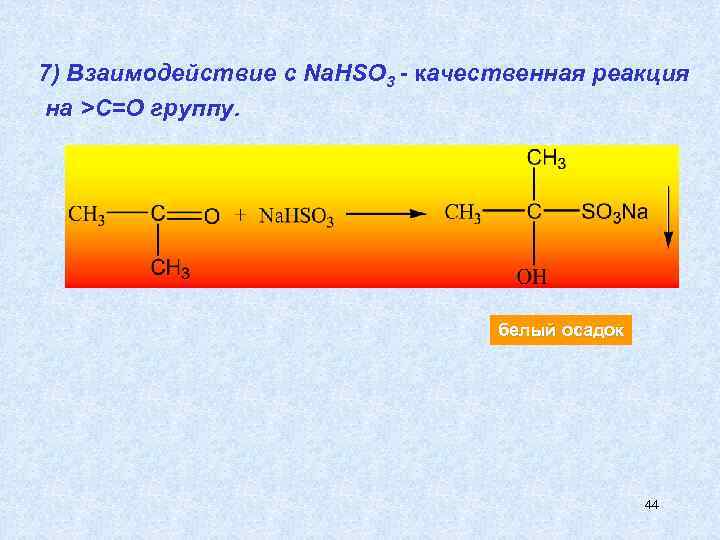
7) Взаимодействие с Na. HSO 3 - качественная реакция на >С=О группу. белый осадок 44
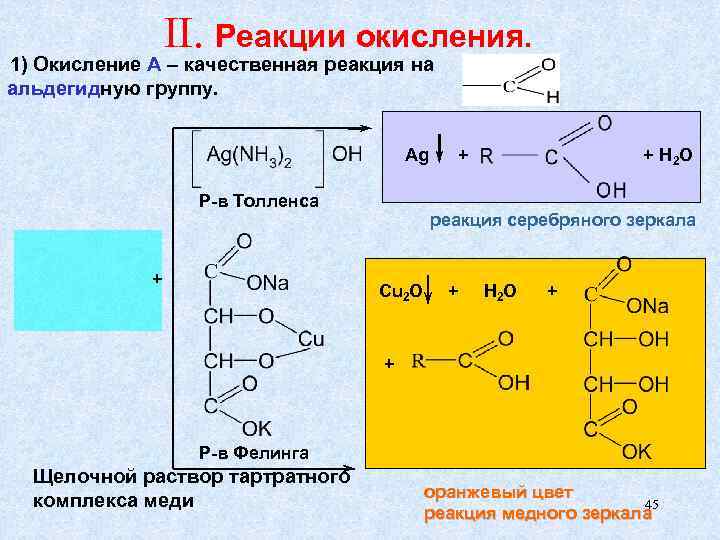
II. Реакции окисления. 1) Окисление А – качественная реакция на альдегидную группу. Ag + + H 2 O Р-в Толленса реакция серебряного зеркала + Cu 2 O + H 2 O + Р-в Фелинга Щелочной раствор тартратного оранжевый цвет комплекса меди 45 реакция медного зеркала
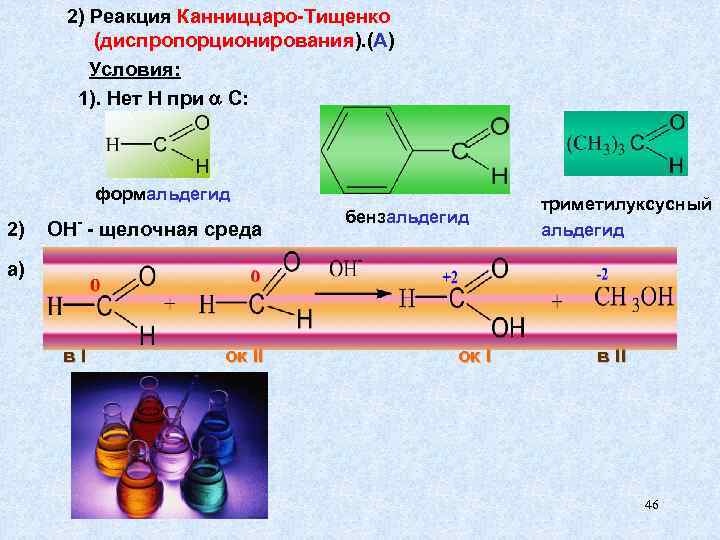
2) Реакция Канниццаро-Тищенко (диспропорционирования). (А) Условия: 1). Нет Н при С: формальдегид триметилуксусный бензальдегид 2) ОН- - щелочная среда альдегид а) в. I ок I в II 46
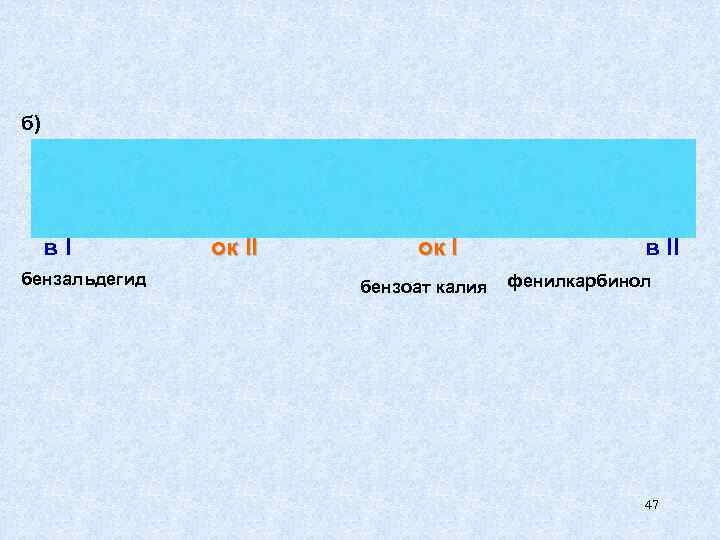
б) в. I ок I в II бензальдегид бензоат калия фенилкарбинол 47

III. Реакция в R. а) - SR , Cl 2, Br 2, h - (для предельных А. К). б) - AЕ, ( , )–против правила Марковникова (для предельных) в) - SЕ (Al. Cl 3) – в мета – положение (для ароматических). 48
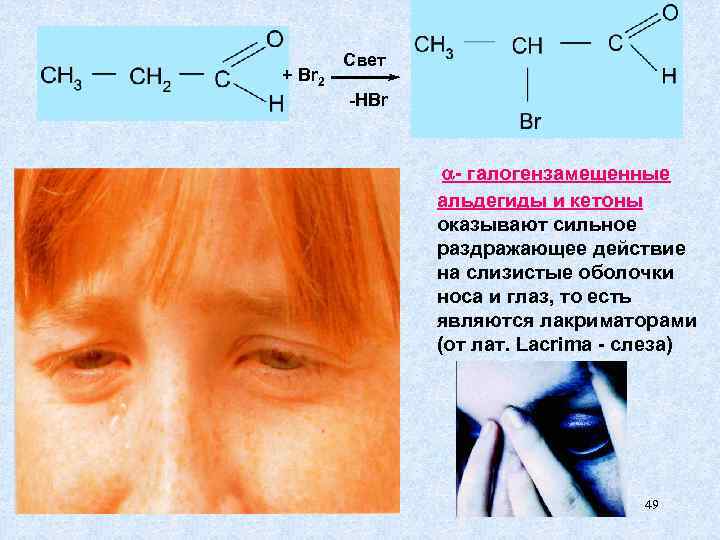
Свет + Br 2 -HBr - галогензамещенные альдегиды и кетоны оказывают сильное раздражающее действие на слизистые оболочки носа и глаз, то есть являются лакриматорами (от лат. Lacrima - слеза) 49

г) галоформная реакция – качественная реакция на - определение ацетона и ацетоновых тел в клиническом анализе при сахарном диабете. иодоформ 50
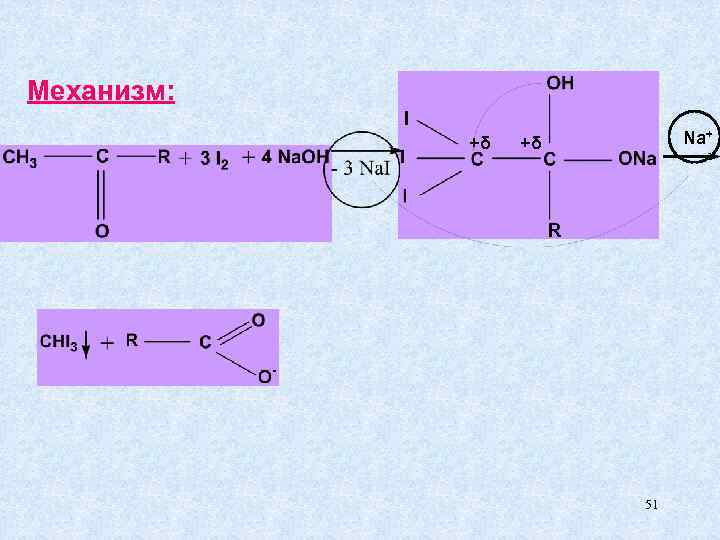
Механизм: +δ Na+ 51
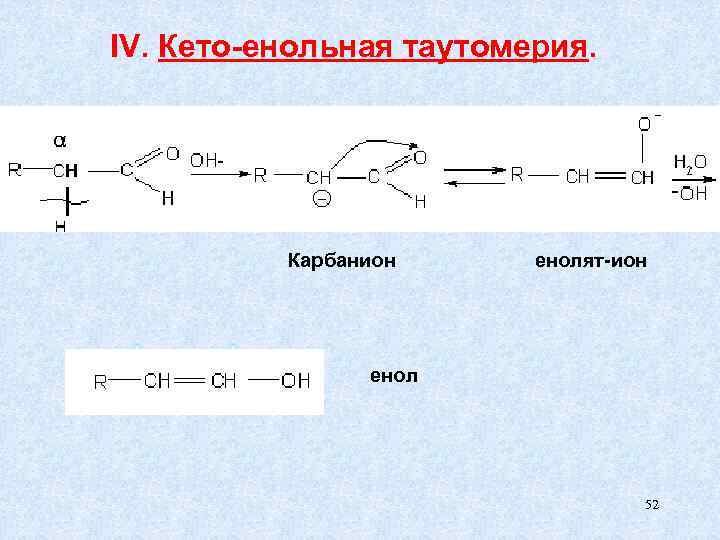
IV. Кето-енольная таутомерия. Карбанион енолят-ион енол 52

Биологическое значение. 53
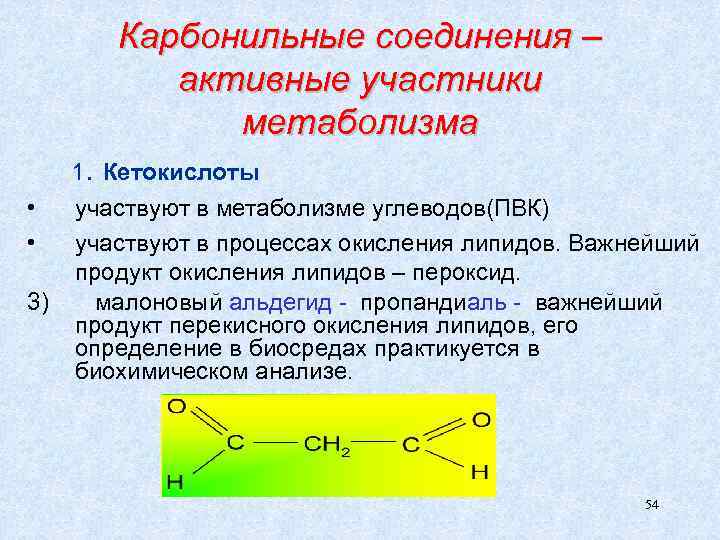
Карбонильные соединения – активные участники метаболизма 1. Кетокислоты • участвуют в метаболизме углеводов(ПВК) • участвуют в процессах окисления липидов. Важнейший продукт окисления липидов – пероксид. 3) малоновый альдегид - пропандиаль - важнейший продукт перекисного окисления липидов, его определение в биосредах практикуется в биохимическом анализе. 54
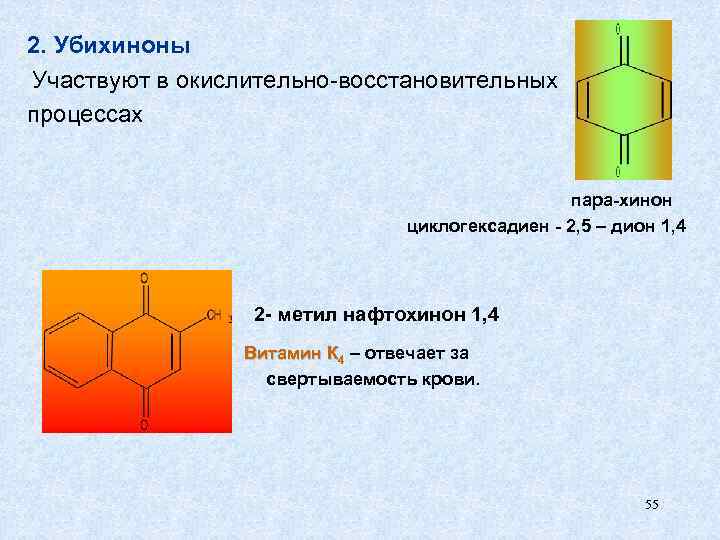
2. Убихиноны Участвуют в окислительно-восстановительных процессах пара-хинон циклогексадиен - 2, 5 – дион 1, 4 2 - метил нафтохинон 1, 4 Витамин К 4 – отвечает за свертываемость крови. 55
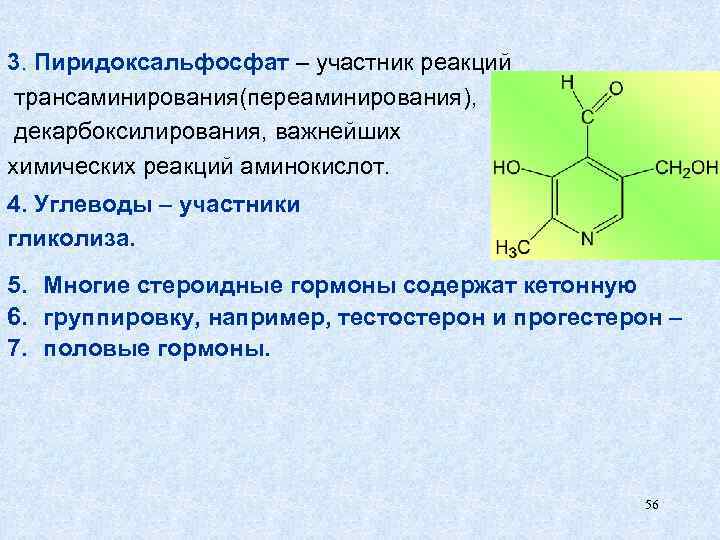
3. Пиридоксальфосфат – участник реакций трансаминирования(переаминирования), декарбоксилирования, важнейших химических реакций аминокислот. 4. Углеводы – участники гликолиза. 5. Многие стероидные гормоны содержат кетонную 6. группировку, например, тестостерон и прогестерон – 7. половые гормоны. 56

Карбонильные соединения как лекарственные средства 1) Производные бутиферона обладают успокаивающим действием (нейролептики). 57
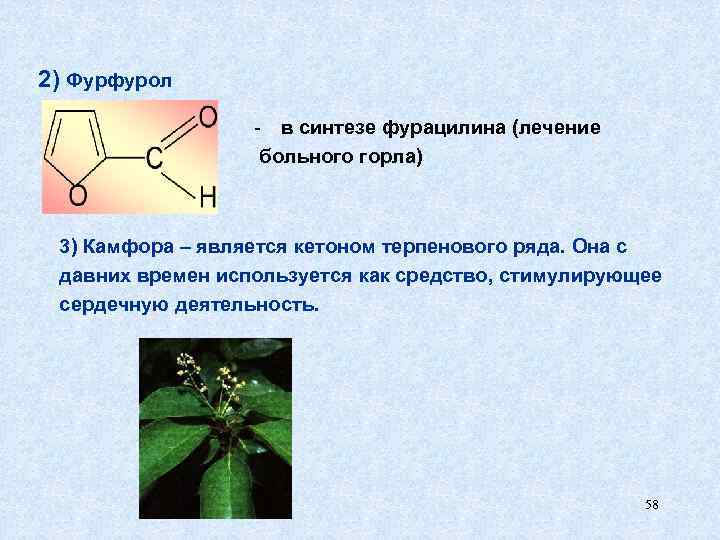
2) Фурфурол - в синтезе фурацилина (лечение больного горла) 3) Камфора – является кетоном терпенового ряда. Она с давних времен используется как средство, стимулирующее сердечную деятельность. 58

СПАСИБО ЗА ВНИМАНИЕ! 59
06 Лекция Карбонильные соединения.ppt
- Количество слайдов: 59

