7aa695b847d142265ebfa94f46691daf.ppt
- Количество слайдов: 77

Лекция 5 Зав. каф. клинической лабораторной диагностики ИГМАПО, проф. Скворцовой Р. Г.

n Стандартизация — это деятельность по установлению правил и характеристик в целях их добровольного многократного использования, направленная на достижение упорядоченности в сферах производства и обращения продукции и повышение конкурентоспособности продукции, работ или услуг.

Стандартизация Задача КДЛ- на основании результатов исследования оценить состояние здоровья пациента. Качество выполненных исследований непосредственно связано с правильной организацией работы на преаналитическом, аналитическом и постаналитическом этапах клинико-лабораторных исследований и взаимодействием с клиническим персоналом. Для оценки качества исследований необходимо сравнение всех вышеуказанных процессов с эталоном – стандартом.

Преавналитическимй этап Аналитический этап Постаналитический этап Внедрение рациональных принципов и способов стандартизации этих процессов — необходимый элемент современного этапа развития сферы лабораторной медицины. Наиболее гибкой формой регламентации являются национальные стандарты, поскольку они могут быть нацелены на упорядочение как конкретных, так и более общих взаимодействий и процессов, а применение их носит добровольный характер.

Целями стандартизации в лабораторной медицине являются: n n n Обеспечение получения достоверной и сопоставимой информации о состоянии внутренней среды/содержании клинически значимых компонентов биологических жидкостей, экскретов, тканей человека на основе: Обоснованного выбора и точного выполнения наиболее чувствительных, специфичных и устойчивых методик лабораторных исследований, обладающих оптимальной правильностью и прецизионностью; Соблюдения всеми участниками выполнения лабораторных тестов, включая клинический персонал, условий, обеспечивающих максимально возможное сохранение в образце биоматериала свойств и состава, присущих ему in vivo; Соблюдения изготовителями средств лабораторного анализа при их разработке, производстве, транспортировке наибольшего соответствия свойств изделий требованиям чувствительности, специфичности, правильности и прецизионности выполняемых с их применением методик исследований.

Стандартизация Нормы Государственной системы стандартизации России ГСС России допускает следующие варианты правил применения международных и региональных стандартов: Принятие аутентичного текста международного (регионального) стандарта в качестве государственного российского нормативного документа (ГОСТ Р) без каких-либо дополнений и изменений (метод обложки). Обозначается такой стандарт так, как это принято для отечественного стандарта; Принятие аутентичного текста международного (регионального) стандарта, но с дополнениями, отражающими особенности российских требований к объекту стандартизации.

ISO International Organization for Standardization — международная организация, занимающаяся выпуском стандартов. Цели международной стандартизации: сближение уровня качества продукции, изготавливаемой в различных странах; обеспечение взаимозаменяемости элементов сложной продукции; содействие международной торговле; содействие взаимному обмену научно-технической информацией и ускорение научно-технического прогресса.

Международный и Региональный стандарты n n Международный стандарт — стандарт, принятый международной организацией. Стандартом называется документ, в котором устанавливаются характеристики продукции, эксплуатации, хранения, перевозки, реализации и утилизации, выполн ения работ или оказания услуг. Основное назначение международных стандартов — это создание на международном уровне единой методической основы для разработки новых и совершенствование действующих систем качества и их сертификации. Региональная стандартизация — стандартизация, участие в которой открыто для соответствующих органов стран только одного географического или экономического региона мира.

Стандарт (standard – норма, образец, шаблон) Стандарт в Российской Федерации — документ, в котором в целях добровольного многократного использования устанавливаются характеристики продукции, правила осуществления и характеристики процессов, правила и методы исследований (испытаний) и измерений, правила отбора образцов, требования к терминологии, символике и т. д. Международная стандартизация. Органом по стандартизации является ИСО (ISO). Нормативным документом ИСО являются стандарты ИСО. Национальная стандартизация. Это — стандартизация в пределах одного государства. Нормативным документом по национальной стандартизации в России установлен государственный стандарт России — ГОСТ Р

Категории стандартов в КДЛ 1. Стандарты назначения лабораторного исследования на различных этапах оказания медицинской помощи в рамках отдельных нозологических форм, которые должны включать в себя перечень наиболее информативных анализов (Диск, 2. Стандарты мед. помощи). 2. Стандарты, относящиеся к деятельности самой лаборатории. Они устанавливают порядок выполнения каждого из этапов работы диагностической службы(Диск, 3. национальные стандарты КДЛ).

Стремление к совершенству n Сегодня некоторые частные медицинские компании имеют больше возможностей для оснащения своих клиник как в плане закупки современного оборудования, так и в части спектра предоставляемых услуг, поэтому могут осуществить лабораторные исследования, существенно превосходящие принятые государством стандарты по технологичности и сервисной составляющей, — рассказывает он. — Никто не ставит под сомнение, что частные лаборатории должны внедрять российские государственные стандарты и соответствовать им, но зачастую те, кто могут себе это позволить, придерживаются более сложных стандартов международного уровня.

www. gostedu. ru/47912. html Национальные стандарты Федеральное агенство по техническому регулированию и метрологии (РОССТАНДАРТ)

Цели стандартизации 1. Повышение уровня безопасности: - жизни и здоровья граждан; - имущества физических и юридических лиц; - государственного и муниципального имущества; - в области экологии; - жизни и здоровья животных и растений; - объектов с учетом риска возникновения чрезвычайных ситуаций природного и техногенного характера.

Цели стандартизации 2. Обеспечение: - конкурентоспособности продукции, работ, услуг; - научно-технического прогресса; - рационального использования ресурсов; - совместимости и взаимозаменяемости технических средств (машин и оборудования, их составных частей, комплектующих изделий и материалов); - информационной совместимости; - сопоставимости результатов исследований (испытаний) и измерений технических и экономико-статистических данных; - сравнительного анализа характеристик продукции; - государственных заказов, внедрения инноваций; - подтверждения соответствия продукции (работ, услуг); - решений арбитражных споров; - судебных решений;

Цели стандартизации n n n n n 3. Создание: - систем классификации и кодирования техникоэкономической и социальной информации; - систем каталогизации продукции; - систем обеспечения качества продукции; - систем поиска и передачи данных; - доказательной базы и условий выполнения требований технических регламентов. 4. Содействия проведению работ по унификации.

Принципы стандартизации Основные принципы стандартизации в Российской Федерации, обеспечивающие достижение целей и задач ее развития, заключаются в: - добровольности применения стандартов; - достижении при разработке и принятии стандартов консенсуса всех заинтересованных сторон; - использовании международных стандартов как основы разработки национальных стандартов; - комплексности стандартизации для взаимосвязанных объектов; - недопустимости установления в стандартах требований, противоречащих техническим регламентам;

Принципы стандартизации Изложение национальных стандартов должно быть четким и ясным, а для обеспечения однозначного понимания их требований: - содержание разрабатываемых стандартов не должно повторять и противоречить требованиям взаимосвязанных с ними действующих на федеральном уровне нормативных, правовых документов и технических регламентов; - в национальных стандартах должны быть приведены сведения о технических регламентах, выполнение которых обеспечивается при соблюдении требований данного национального стандарта; - принимаемые стандарты должны быть пригодны для подтверждения соответствия, в том числе для проведения работ по сертификации.

Добровольно-обязательные? n n Существует 2 мнения по поводу обязательности выполнения стандартов: Стандарты должны носить обязательный характер и быть едиными для всех, поскольку являются государственной гарантией определенного объема медицинских услуг, которые граждане страны могут получить в любом государственном медучреждении в случае наступления заболевания. Стандарты в области лабораторной диагностики должны соответствовать задачам медицинского учреждения, так как уровень лабораторной диагностики, доступный среднестатистическому гражданину нашей страны, пока ещё отстает от такового в высокоразвитых странах. Национальный стандарт применяют добровольно, после чего все его требования становятся обязательными для соблюдения.

Виды стандартов В зависимости от объекта и аспекта стандартизации, а также содержания устанавливаемых требований разрабатываются стандарты следующих видов: - стандарты на продукцию; - стандарты на процессы (работы) производства, эксплуатации, хранения, перевозки, реализации и утилизации продукции; - стандарты на услуги; - стандарты основополагающие (организационно-методические и общетехнические); - стандарты на термины и определения; - стандарты на методы контроля (испытаний, измерений, анализа). Стандарты организаций — отраслевые стандарты (ОСТ), стандарты предприятий (СТП), стандарты обществ и т. п. Это — низший уровень стандартизации.

Стандартизация в РФ. Основные положения (ГОСТ Р 1. 0 -2004) Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184 -ФЗ «О техническом регулировании»

n Следование стандартам — это не надуманное усложнение деятельности лабораторного диагноста, а необходимое условие для правильного выполнения исследования и оказания эффективной помощи больному.

Применение положений и требований Национальных стандартов РФ в клинико-диагностических лабораториях учреждений здравоохранения 1. Знакомы ли руководители и сотрудники лабораторий с действующими Национальными стандартами в области лабораторной медицины? 2. Какими способами получения текстов Национальных стандартов пользуется лаборатория (приобретение официальных изданий в Стандартинформе, Интернет, периодическачя литература)? 3. Применяются в организации и повседневной деятельности клиникодиагностических лабораторий положения следующих стандартов? Нужное подчеркнуть. не применять. ГОСТ Р ИСО 15189; ГОСТ Р 52905 (ИСО 15190) ГОСТ Р ИСО/ТО 22869 ГОСТ Р ИСО 22870 ГОСТ Р 53022, 2, 3, 4 ГОСТ Р 53079, 1, 2, 3, 4 ГОСТ Р 53133, 1, 2, 4 4. С какими трудностями сталкиваются руководители применении Национальных стандартов в области лабораторной медицины в своих учреждениях? Существует ли должное взаимодействие лаборатории с клиническим персоналом на преаналитическом этапе лабораторных Вопросы к отчетам за 2011 год

Применение положений и требований Национальных стандартов РФ в клинико-диагностических лабораториях учреждений здравоохранения 6. Применяются ли в лаборатории стандартные аналитические технологии лабораторных исследований, рекомендованные НПО стандартных лабораторных методов? 7. Проводится ли анализ причин несоответствия результатов одних и тех же аналитов, выполняемых с применением различных методик, тест-систем различных изготовителей? 8. Возникают ли проблемы качества исследований, связанные с калибраторами? 9. Имеются ли трудности с приобретением реагентов необходимого состава и качества через "систему закупок по тендерам"? 10. Имеются ли трудности в получении информации от фирм-поставщиков тестсистем о метрологических свойствах поставляемых ими средтв лабораторного анализа?

Основные стандарты для КДЛ n n n n ГОСТ Р ИСО 15189; ГОСТ Р 52905 (ИСО 15190) ГОСТ Р ИСО/ТО 22869 ГОСТ Р ИСО 22870 ГОСТ Р 53022, 2, 3, 4 ГОСТ Р 53079, 1, 2, 3, 4 ГОСТ Р 53133, 1, 2, 4 ( Диск, 2. Национальные стандарты КДЛ).
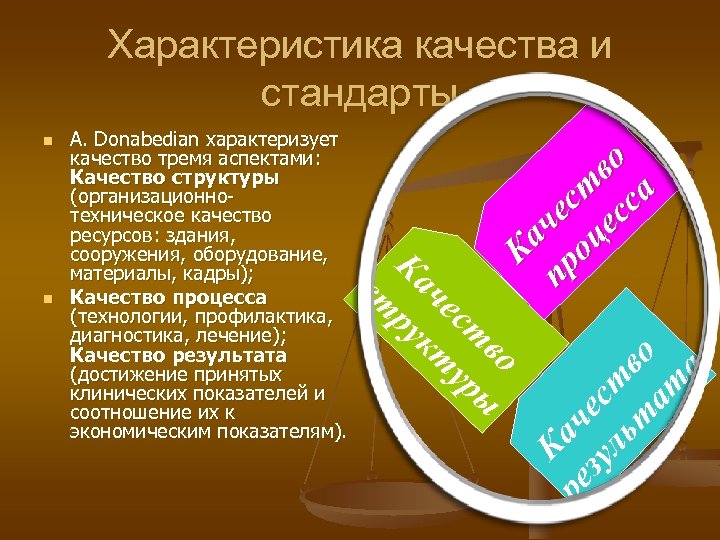
Характеристика качества и стандарты ст ч ру ест кт во ур ы че зу с ль тв т о ат а Ка во ст сса че це а о К р п ре n A. Donabedian характеризует качество тремя аспектами: Качество структуры (организационнотехническое качество ресурсов: здания, сооружения, оборудование, материалы, кадры); Качество процесса (технологии, профилактика, диагностика, лечение); Качество результата (достижение принятых клинических показателей и соотношение их к экономическим показателям). Ка n

ГОСТ Р 15189 -2009

ГОСТ Р ИСО 15189 -2009 Стандарты на методы контроля, испытаний, измерений и анализа устанавливают требования к используемому оборудованию, условиям и процедурам осуществления всех операций, обработке и представлению полученных результатов, квалификации персонала.

ГОСТ Р 52905 -2007 (ИСО 15190: 2003) НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ЛАБОРАТОРИИ МЕДИЦИНСКИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ MEDICAL LABORATORIES. REQUIEREMENTS FOR SAFETY Настоящий стандарт устанавливает требования по обеспечению безопасной работы в медицинской лаборатории. Утвержден Приказом Федерального агентства по техническому регулированию и метрологии от 27 декабря 2007 г. N 531 -ст Дата введения 1 июля 2009 года Аудиты и проверки программ безопасности предусмотрены данным стандартом и для этого составлен соответствующий опросники.

ГОСТ Р 53079. 1 -2008 n n Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 1. Правила описания методов исследования Действующий. Настоящий стандарт устанавливает правила описания в лабораторных руководствах, справочниках и инструктивных материалах к готовым наборам реагентов (тест-системам) методов клинических лабораторных исследований, предназначеных для применения в медицинских лабораториях всех форм собственности. Настоящий стандарт предназначен для применения всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи.

ГОСТ Р 53079. 2 -2008 n n n Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 2. Руководство по управлению качеством в клинико-диагностической лаборатории. Типовая модель Действующий. Настоящий стандарт устанавливает единые правила для разработки собственных систем управления качеством, включающих систему административного управления, технической деятельности, на основе составления и ведения документации, регламентирующей деятельность клинико -диагностических лабораторий медицинских организаций всех форм собственности. Настоящий стандарт создан с целью обеспечения качества клиникодиагностических исследований и может быть использован органами по аккредитации лабораторий признании или подтверждении компетентности лабораторий. Настоящий стандарт может использоваться всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи

ГОСТ Р 53079. 3 -2008 n n n Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 3. Правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций при выполнении клинических лабораторных исследований. Настоящий стандарт устанавливает единые правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций всех форм собственности проведении клинических лабораторных исследований и обеспечении их качества, соответствующего потребностям эффективной медицинской помощи пациентам. Настоящий стандарт предназначен для применения всеми организациями и учреждениями, деятельность которых связана с оказанием медицинской помощи.

ГОСТ Р 53079. 4 -2008 n n n Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа действующий Настоящий стандарт устанавливает требования к условиям и процедурам ведения преаналитического этапа клинических лабораторных исследований с целью исключения или ограничения влияния эндогенных, экзогенных, ятрогенных и иных факторов, мешающих правильному отражению состояния внутренней среды обследуемых пациентов в результатах клинических лабораторных исследований. Настоящий стандарт может использоваться всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи

ГОСТ Р 53022. 1 -2008 n n Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 1. Правила менеджмента качества клинических лабораторных исследований Действующий. Настоящий стандарт устанавливает общие положения, принципы и единые правила деятельности органов управления здравоохранением на всех уровнях по планированию, обеспечению, контролю и улучшению качества лабораторных исследований, выполняемых в клинико-диагностических лабораториях медицинских организаций всех форм собственности. Настоящий стандарт предназначен для применения всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи

ГОСТ Р 53022. 2 -2008 n n Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) Действующий. Настоящий стандарт устанавливает единые требования при оценке правильности, прецизионности, чувствительности, специфичности клинических лабораторных исследований, выполняемых в клинико-диагностических лабораториях медицинских организаций. Настоящий стандарт может использоваться всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи

ГОСТ Р 53022. 3 -2008 n n Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 3. Правила оценки клинической информативности лабораторных тестов Действующийю Настоящий стандарт устанавливает единые правила оценки клинической информативности лабораторных исследований, выполняемых в клинико-диагностических лабораториях медицинских организаций в целях оценки состояния здоровья, клинической диагностики и слежения за эффективностью лечения пациентов. Настоящий стандарт может использоваться всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи

ГОСТ Р 53022. 4 -2008 n n Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 4. Правила разработки требований к своевременности предоставления лабораторной информации Действующий. Настоящий стандарт устанавливает единые правила разработки требований к срокам выполнения клинических лабораторных исследований в клинико-диагностических лабораториях и порядок их применения их организации лабораторного обеспечения деятельности медицинских организаций. Настоящий стандарт предназначен для применения всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи

ГОСТ Р 53133. 1 -2008 n n Технологии лабораторные клинические. Контроль качества клинических лабораторных исследований. Часть 1. Пределы допускаемых погрешностей результатов измерения аналитов в клинико-диагностических лабораториях Действующий. Настоящий стандарт устанавливает пределы допускаемых значений внутрилабораторных погрешностей измерений аналитов состава сыворотки крови и мочи, выполняемых в медицинских организациях в диагностических целях. Указанные пределы применяются в целях оценки приемлемости точности используемых методик этих измерений в контрольных образцах сыворотки крови и мочи проведении внутрилабораторного контроля и вводятся как единые для всех видов клинико-диагностических лабораторий медицинских организаций страны вне зависимости от их типа, ведомственной подчиненности и формы собственности.

ГОСТ Р 53133. 2 -2008 n n n Технологии лабораторные клинические. Контроль качества клинических лабораторных исследований. Часть 2. Правила проведения внутрилабораторного контроля качества количественных методов клинических лабораторных исследований с использованием контрольных материалов Действующий. Настоящий стандарт устанавливает общие требования к проведению внутрилабораторного контроля качества количественных исследований, выполняемых в клинико-диагностических лабораториях, организациях здравоохранения, в составе которых действуют указанные лаборатории. Настоящий стандарт предназначен для применения всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи гражданам Российской Федерации.

ГОСТ Р 53133. 3 -2008 n n n Технологии лабораторные клинические. Контроль качества клинических лабораторных исследований. Часть 3. Описание материалов для контроля качества клинических лабораторных исследований Действующий. Настоящий стандарт устанавливает требования к материалам, предназначенным для контроля качества клинических лабораторных исследований, выполняемых в клинико-диагностических лабораториях медицинских организаций всех форм собственности.

ГОСТ Р 53133. 4 -2008 n n Технологии лабораторные клинические. Контроль качества клинических лабораторных исследований. Часть 4. Правила проведения клинического аудита эффективности лабораторного обеспечения деятельности медицинских организаций Действующий. Настоящий стандарт устанавливает единые принципы и правила при проведении в медицинских организациях всех форм собственности лабораторными специалистами и клиницистами совместной оценки качества обеспечения лабораторной информацией лечебно-диагностического процесса и ее использования для совершенствования медицинской помощи. Настоящий стандарт предназначен для применения всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи.

Стандартные операционные процедуры (СОП) n n Стандартные операционные процедуры (СОПы) документально оформленные инструкции по выполнению рабочих процедур или, иными словами, формализованные алгоритмы выполнения действий, исполнения требований стандартов медицинской помощи. СОПы разрабатываются на все производственные операции, включая: поступление, идентификацию, маркировку, обработку, отбор проб, использование и хранение исследуемых и стандартных веществ; обслуживание и калибровку измерительных приборов и оборудования. (Диск, 5 Пример СОП).

СОП n n Стандартные операции и процедуры (СОПы) документально оформленные инструкции по выполнению рабочих процедур. Стандартные операции и процедуры определяются в каждой медицинской организации индивидуально, поскольку зависят от ее типа, мощности, структуры, материально-технического обеспечения, укомплектованности кадрами и др. факторов, которые невозможно учесть на федеральном уровне.

Требования к СОПам n n Разработка СОПов медицинской организации должна проводиться с учетом принципа приоритетности. Разработка СОПов определяется в каждой медицинской организации индивидуально, поскольку зависит от ее типа, мощности, структуры, материально-технического обеспечения, укомплектованности кадрами и др. При этом создание первоочередных СОПов должно соотноситься с наиболее проблемными областями функционирования медицинской организации.

Требования к СОПам n n n Согласно разработанной «Технологии разработки клинических протоколов медицинской организации» СОПы по выполнению предусмотренных протоколом медицинских услуг должны включать как минимум: Перечень подразделений, где выполняются медицинские услуги; Перечень специалистов, их выполняющих; Время, очередность (последовательность) выполнения медицинских услуг контроль качества выполнения медицинской помощи конкретному пациенту с учетом удовлетворения его потребностей в медицинской помощи и т. д. Формирование и повсеместное использование ясных, четких, отвечающих современному развитию медицинской науки стандартных операционных процедур может стать одним из действенных элементов системы управления качеством медицинской помощи.

Пример СОПов ОЛД ИДЦ представлен на диске. В нем учтены все требования к СОПам. Положения, которые оговариваются Национальными стандартами и не изменяются в ЛПУ, прописываются ссылками на Национальные стандарты. Как инструкция к действиям прописываются индивидуальные для ЛПУ процедуры.

Общероссийкая общественная организация «Научно. Практическое Общество Специалистов лабораторной медицины» (НПО СЛМ) В целях облегчения доступности наиболее часто востребованных лабораторных тестов предлагаются Рекомендации Научно-практической конференции «Обеспечение доступности современных клинических лабораторных исследований: аналитические возможности, клинические потребности, организационно-экономические условия» (Москва, 4 -6 октября 2011 г. )на: n n n n Рекомендовать главным специалистам по клинической лабораторной диагностике и заведующим лабораториями использовать в практической работе принятые Правлением НПО СЛМ и одобренные настоящей конференцией следующие стандартизованные аналитические технологии: Технология клинического лабораторного анализа мочи. Анализ мочи общий Технология исследования клеточного состава крови с применением гематологических анализаторов Цитологическое исследование пунктата костного мозга Цитологическое исследование аспирата из полости матки Цитологическое исследование синовиальной жидкости Цитологическое исследование материала из лимфатических узлов Клиническое лабораторное исследование синовиальной жидкости Клиническое лабораторное исследование мочи. Подсчет форменных элементов (Полный текст документов представлен на диске, 4. Стандартные аналитиыеские технологии).

ПРИМЕР: «Cтандартизованная аналитическая технология клинического лабораторного анализа мочи: определение количества форменных элементов в моче» n n n n Цель исследования. 2. Требования к обеспечению выполнения технологии 2. 1. Требования к специалистам и вспомогательному персоналу 2. 1. 2. Требования к образованию специалистов 2. 2. Требования к обеспечению безопасности труда медицинского персонала 2. 3. Материальные ресурсы, необходимые для выполнения технологии: приборы, средства измерения, лабораторное оборудование 2. 4. Прочий расходуемый материал 3. Характеристика методики выполнения технологии исследования мочи 3. 1 Получение образцов мочи. 3. 2 Идентификация образца 3. 3 Приемлемость образца 3. 4. Определение форменных элементов в 1 мл мочи по методу Нечипоренко. 3. 5. Определение количества форменных элементов, выделенных за сутки, по методу Каковского-Аддиса. 3. 6. Определение количества форменных элементов, экскретируемых с мочой за 1 мин, по методу Амбурже

Cтандартизованная аналитическая технология клинического лабораторного анализа мочи: определение количества форменных элементов в моче n n n n n 4. Регистрация результатов подсчета форменных элементов в моче 5. Обеспечение качества выполнения технологии анализа 5. 1. Программы обеспечения качества 5. 2. Ведение регистрации контрольных мероприятий 5. 3. Инструкции к используемым методикам лабораторных исследований 5. 4. Контроль качества микроскопических исследований. 5. 5. Непрерывное образование специалистов как гарантия обеспечения качества исследования. 6. Требования к режиму труда и отдыха, диете и ограничениям при подготовке пациента 7. Трудозатраты на выполнение технологии клинического лабораторного анализа мочи «Определение количества форменных элементов в моче» .

Cтандартизованная аналитическая технология клинического лабораторного анализа мочи: определение количества форменных элементов в моче n n n n n ПРИЛОЖЕНИЕ А (справочное) Сбор образцов мочи, условия хранения и доставки (преаналитический этап) А. 2. Подготовка пациента. А 3. Виды образцов мочи: А 4. Сбор разных видов образцов мочи. А 4. 3. Сбор образца мочи за сутки (24 часа) или за другой промежуток времени. А 5. Хранение образца мочи А 6. Консерванты, используемые при сборе суточной мочи.



1. ГОСТ Р 53079. 3 -2008 - Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 3. Правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций при выполнении клинических лабораторных исследований Настоящий стандарт устанавливает единые правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций всех форм собственности проведении клинических лабораторных исследований и обеспечении их качества, соответствующего потребностям эффективной медицинской помощи пациентам. Настоящий стандарт предназначен для применения всеми организациями и учреждениями, деятельность которых связана с оказанием медицинской помощи Дата последнего изменения: 18. 05. 2011 2. ГОСТ Р 50382 -92 - Средства медико-биологического обеспечения жизнедеятельности человека и жизнеобеспечения биологических объектов на специальных объектах. Термины и определения Настоящий стандарт устанавливает термины и определения понятий в области средств медикобиологического обеспечения жизнедеятельности человека и биологических объектов (микроорганизмов, биологических тканей и сред, растений и животных) на специальных объектах. Термины, установленные настоящим стандартом, обязательны для применения во всех видах документации и литературы, входящих в сферу работ по стандартизации и (или) использующих результаты этих работ Дата последнего изменения: 18. 05. 2011

3. ГОСТ Р 51088 -97 - Наборы реагентов для клинической лабораторной диагностики. Общие технические условия Настоящий стандарт распространяется на наборы реагентов для клинической лабораторной диагностики природного или искусственного происхождения, предназначенные для применения в медицинской и научно-исследовательской практике и используемые в клинико-диагностических биохимических, иммунологических и генодиагностических лабораториях медицинских учреждений при проведении любых диагностических исследований in vitro, а также на составные части этих наборов, имеющие функциональное медицинское назначение и изготовляемые отдельно. Стандарт не распространяется на медицинские иммунобиологические препараты, предназначенные для специфической профилактики, диагностики и лечения инфекционных, паразитарных заболеваний и аллергических состояний: вакцины бактерийные и вирусные, анатоксины, иммуноглобулины нормальные и специфические, сыворотки диагностические и антитоксичные лечебные, бактериофаги диагностические и лечебно-профилактические и Поправки и изменения: Изменение № 1 к ГОСТ Р 51088 -97 (2000 -07 -01) - «Срок действия продлен»

4. ГОСТ Р 51352 -99 - Наборы реагентов для клинической лабораторной диагностики. Методы испытаний Настоящий стандарт распространяется на наборы реагентов для клинической лабораторной диагностики природного или искусственного происхождения, предназначенные для применения в медицинской и научно-исследовательской практике и используемые в клинико-диагностических, биохимических, иммунологических и генодиагностических лабораториях медицинских учреждений при проведении любых диагностических исследований in vitro, а также на составные части этих наборов, имеющие функциональное медицинское назначение и изготовляемые отдельно. Стандарт не распространяется на медицинские иммунобиологические препараты, предназначенные для специфической профилактики, диагностики и лечения инфекционных, паразитарных заболеваний и аллергических состояний. Дата последнего изменения: 18. 05. 2011

5. ГОСТ Р ЕН 12322 -2010 - Изделия медицинские для диагностики in vitro. Питательные среды для микробиологии. Критерии функциональных характеристик питательных сред Настоящий стандарт устанавливает требования к функциональным характеристикам питательных сред. Это относится к прослеживаемости, сравнимости, воспроизводимости и пригодности питательных сред, используемых в микробиологических лабораториях. Данные характеристики достигаются применении критериев качества, указанных в настоящем стандарте. Настоящий стандарт применим к: a) коммерческим организациям, распространяющим питательные среды в микробиологических лабораториях в готовой к употреблению форме как сухие среды или как готовые к применению среды (ЕН 1659: 1996); b) некоммерческим организациям, распространяющим среды в свои местные отделения; c) лабораториям, готовящим питательные среды для собственного использования. Среды для культивирования клеток не относятся к области применения настоящего стандарта Дата последнего изменения: 12. 10. 2011 6. ГОСТ Р 52905 -2007 - Лаборатории медицинские. Требования безопасности Настоящий стандарт устанавливает требования по обеспечению безопасной работы в медицинской лаборатории Дата последнего изменения: 18. 05. 2011

7. ГОСТ Р ЕН 13532 -2010 - Общие требования к медицинским изделиям для диагностики in vitro для самотестирования Настоящий стандарт устанавливает общие требования к медицинским изделиям для диагностики in vitro для обеспечения безопасности и пригодности данных изделий для применения в целях, специфицированных изготовителем. Настоящий стандарт не применим к медицинским аспектам медицинских изделий для диагностики in vitro для самотестирования Дата последнего изменения: 20. 09. 2011 8. ГОСТ Р ЕН 13612 -2010 - Оценка функциональных характеристик медицинских изделий для диагностики in vitro Настоящий стандарт применим для оценки функциональных характеристик медицинских изделий для диагностики in vitro, включая изделия для самотестирования. Настоящий стандарт устанавливает ответственность и общие требования в отношении планирования, проведения, оценки и документирования исследования для оценки функциональных характеристик изготовителем. Настоящий стандарт не применим в отношении планов специфической оценки определенных медицинских изделий для диагностики in vitro Дата последнего изменения: 12. 10. 2011

9. ГОСТ Р ЕН 13640 -2010 - Исследование стабильности реагентов для диагностики in vitro Настоящий стандарт применяется при проведении исследования стабильности реагентов для диагностики in vitro, включая собственно реагенты, калибраторы, контрольные материалы и наборы реагентов. Настоящий стандарт устанавливает общие требования к исследованию стабильности реагентов, а также специальные требования к исследованиям в реальном масштабе времени и ускоренным исследованиям при определении стабильности с целью: - установления срока годности реагентов для диагностики in vitro, включая стабильность при транспортировании; - установления стабильности реагентов для диагностики in vitro в процессе применения после первого открытия первичной упаковки; - мониторинга стабильности реагентов для диагностики in vitro, уже размещенных на рынке; - верификации стабильности реагентов для диагностики in vitro после их модификации, которая способна изменить стабильность. Требования настоящего стандарта не применяют к инструментам, приборам, оборудованию, системам или емкостям для сбора образцов биоматериалов Дата последнего изменения: 20. 09. 2011

10. ГОСТ Р ЕН 13641 -2010 - Устранение или снижение риска инфицирования, связанного с реагентами для диагностики in vitro Настоящий стандарт устанавливает требования к разработке и производству реагентов для диагностики in vitro с целью эффективно контролировать риски инфицирования, связанные с реагентами для диагностики in vitro, включая реагентные продукты, калибраторы, контрольные материалы и наборы. Настоящий стандарт применим к реагентам для диагностики in vitro, содержащим материалы человеческого происхождения. Настоящий стандарт применим также к реагентам, полученным с помощью биотехнологических процессов, или к материалам животного происхождения, в частности в связи с зоонозами, когда результаты анализа рисков выявляют возможность заражения человека. Настоящий стандарт не применим к следующим аспектам: - инструментам и емкостям для сбора образцов биоматериалов; - общим аспектам защиты пользователей; - транспортированию инфицированных материалов; - мерам удаления инфицированных материалов Дата последнего изменения: 20. 09. 2011

11. ГОСТ Р ЕН 14254 -2010 - Изделия медицинские для диагностики in vitro. Одноразовые емкости для сбора образцов у человека (кроме крови) Настоящий стандарт устанавливает требования и методы исследования для одноразовых вакуумных и невакуумных емкостей, предназначенных изготовителями для первичного размещения и сохранения образцов, кроме крови, взятых из тела человека в целях диагностического исследования in vitro. Настоящий стандарт не определяет требования к иглам для взятия образцов, держателям игл или другим приспособлениям, используемым вместе с емкостями для образцов Дата последнего изменения: 12. 10. 2011 12. ГОСТ Р ЕН 592 -2010 - Инструкция по применению инструментов для диагностики in vitro для самотестирования Настоящий стандарт устанавливает требования к содержанию инструкции по применению инструментов для диагностики in vitro, включая приборы и оборудование для самотестирования. Настоящий стандарт не применим к инструкциям для ремонта в полевых условиях Дата последнего изменения: 12. 10. 2011

13. ГОСТ Р ИСО 10993 -10 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия Настоящий стандарт описывает методы оценки возможного раздражающего и сенсибилизирующего действия медицинских изделий и материалов, входящих в их состав. Настоящий стандарт включает в себя: а) требования к описанию исследуемых образцов; b) детальное описание методов исследования; c) ключевые факторы, влияющие на интерпретацию полученных результатов. В приложении А приведены инструкции по подготовке образцов для проведения вышеуказанных исследований. Настоящий стандарт распространяется на категории изделий в соответствии с ИСО 10993 -1. Подготовку образцов к исследованиям проводят в соответствии с приложением А. В приложении B приведены дополнительные специфические методы исследования для изделий, используемых интрадермально, орально, вагинально, контактирующих с пенисом, в офтальмологии Дата последнего изменения: 18. 05. 2011

14. ГОСТ Р ИСО 10993 -15 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов Настоящий стандарт содержит основные требования к системе методов исследования для количественного анализа продуктов деградации медицинских изделий из металлов и сплавов или соответствующих образцов материалов, готовых для клинического применения. Настоящий стандарт распространяется только на исследования продуктов деградации, образующихся в результате химических изменений состава медицинских изделий, при использовании методов ускоренной деградации в условиях in vitro. Следует подчеркнуть, что результаты исследований ускоренных испытаний могут не отражать поведения изделия или материалов в организме человека. Для полного описания продуктов деградации необходимо привлекать существующие методики химического анализа. Настоящий стандарт не распространяется на продукты деградации, образующиеся в результате механических нагрузок. Из-за широкого спектра металлических материалов, применяемых для изготовления медицинских изделий, не существует специального аналитического оборудования для количественного анализа продуктов деградации. Идентификация следовых количеств элементов (менее 10 (в степени минус 6), содержащихся в конкретных металлах и сплавах, не является задачей настоящего стандарта. В стандарте не существует специальных требований к уровню продуктов деградации. Настоящий стандарт не предназначен для исследования биологической активности продуктов деградации, которые изложены в соответствующих разделах ИСО 10993 -1 и ИСО 10993 -17 Дата последнего изменения: 18. 05. 2011

15. ГОСТ Р ИСО 10993 -17 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ Настоящий стандарт устанавливает метод определения пороговых значений (допустимых уровней) для веществ, вымываемых из медицинских изделий. Он предназначен для использования при разработке стандартов и расчете соответствующих ограничений при отсутствии стандартов. Он устанавливает систематический процесс, путем которого выявленные риски при использовании токсикологически опасных субстанций в медицинских изделиях могут быть выражены количественно. Настоящий стандарт не применим к изделиям, не имеющим контакта с пациентом (например, изделия для in vitro диагностики). Воздействие конкретной химической субстанции может происходить из других источников, не имеющих отношения к медицинскому изделию, таких как пища, вода или воздух. Настоящий стандарт не описывает потенциал воздействия из таких источников Дата последнего изменения: 18. 05. 2011

16. ГОСТ Р ИСО 10993 -18 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов Настоящий стандарт описывает процедуру идентификации материала и идентификации и определения его химических составляющих. Полученные данные о химических свойствах материала могут быть использованы для ряда важных применений, например: - как часть оценки общей биологической безопасности медицинского изделия (ИСО 10993 -1 и 14971); - измерения уровня экстракции вещества из медицинского изделия для оценки соответствия допустимому пределу, выбранному для данного вещества с точки зрения оценки риска здоровью (ИСО 10993 -17); - оценки соответствия предлагаемого материала клинически проверенному материалу; - оценки соответствия конечного продукта прототипу и проверки применимости полученных данных для обоснования оценки конечного продукта; - отбора потенциально новых материалов для медицинских изделий, используемых в конкретном клиническом применении. Настоящий стандарт не рассматривает идентификацию или количественную оценку продуктов деградации, которые рассмотрены в ИСО 10993 -9, ИСО 10993 -13, ИСО 10993 -14 и ИСО 10993 -15. Настоящая серия стандартов ИСО 10993 применяется, если материал или изделие прямо или косвенно входит в контакт с телом пациента (см. 4. 2. 1 в ИСО 10993 -1: 2003). Настоящий стандарт предназначен для поставщиков материалов и изготовителей медицинских изделий при оценке биологической безопасности Дата последнего изменения: 18. 05. 2011

17. ГОСТ Р ИСО 10993 -4 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследование изделий, взаимодействующих с кровью Настоящий стандарт распространяется на методы оценки взаимодействия медицинских изделий с кровью. Настоящий стандарт устанавливает: a) классификацию медицинских и стоматологических изделий, предназначенных для использования в контакте с кровью, основанную на области применения и длительности контакта в соответствии с ИСО 10993 -1. b) фундаментальные принципы, лежащие в основе оценки взаимодействия изделий с кровью; c) пояснения к системному выбору методов исследования, а также принципы и научную основу этих методов. Детальные требования не могут быть определены из-за ограниченности знаний и точности методов исследований. Настоящий стандарт описывает биологическую оценку в общих чертах и может быть не полным для специфических медицинских изделий Дата последнего изменения: 18. 05. 2011 18. ГОСТ Р ИСО 10993 -5 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro Настоящий стандарт устанавливает методы исследования цитотоксичности медицинских изделий in vitro. Данные методы предусматривают проведение инкубации клеточной культуры непосредственно либо путем диффузии: a) с экстрактами из изделия, и (или); b) в контакте с изделием. Данные методы разработаны для определения in vitro биологической реакции клеток млекопитающих по определенным биологическим параметрам Дата последнего изменения: 18. 05. 2011

19. ГОСТ Р ИСО 10993 -6 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации Настоящий стандарт устанавливает методы исследования местного действия после имплантации материалов, предназначенных для использования в медицинских изделиях. Настоящий стандарт применим к следующим материалам: - твердые монолитные и биостабильные; - деградируемые и (или) резорбируемые (рассасывающиеся); - пористые материалы, жидкости, пасты и порошкообразные. Исследуемые образцы имплантируют в участки тела и ткани животного, которые пригодны для оценки биологической безопасности материала. Предлагаемые имплантационные методы не предназначены для оценки механических или функциональных свойств материалов. Настоящий стандарт применим к медицинским изделиям, используемым местно по клиническим показаниям, для оценки реакции окружающих тканей при возможном нарушении целостности изделия. Местное действие оценивают, сравнивая реакцию ткани, вызванную исследуемым материалом, с аналогичной реакцией для контрольных образов из материалов, используемых в медицинских изделиях, биологическая безопасность и возможность клинического применения которых ранее установлена. Задачами рассматриваемых методов исследования являются характеристика и динамика реакции тканей после имплантации медицинских изделий/биоматериалов, включая конечный результат процессов интеграции материала в окружающую ткань или его биодеградацию/резорбцию. В частности, для деградируемого/резорбируемого материала должно быть описано влияние процессов деградации на реакцию окружающих тканей. Настоящий стандарт не касается исследований системной токсичности, канцерогенности, тератогенности или мутагенности. Тем не менее, проведение имплантации образцов в течение длительного периода времени для оценки их местного биологического действия может помочь выявить некоторые из вышеперечисленных отрицательных проявлений общего биологического действия Дата последнего изменения: 18. 05. 2011

20. ГОСТ Р ИСО 10993 -7 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации Настоящий стандарт устанавливает допустимые предельные значения для остаточного количества этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) в медицинских изделиях, стерилизованных ЭО, методы определения ЭО и ЭХГ и требования, в соответствии с которыми осуществляется выпуск изделий. Требования настоящего стандарта являются рекомендуемыми. Стандарт не распространяется на изделия, стерилизованные ЭО, но не имеющие контакта с пациентом (например, диагностические устройства, использующиеся in vitro) Дата последнего изменения: 18. 05. 2011 21. ГОСТ Р ИСО 14155 -1 -2008 - Руководство по проведению клинических испытаний медицинских изделий. Часть 1. Общие требования Настоящий стандарт устанавливает процедуры организации и проведения клинических испытаний медицинских изделий, а также общие требования к: - защите субъектов клинических испытаний; - обеспечению научно обоснованного проведения клинических испытаний; - оказанию помощи организаторам, наблюдателям, исследователям, комитетам по этике, уполномоченным органам и органам, выполняющим оценку соответствия медицинских изделий. Настоящий стандарт: a) устанавливает требования к проведению клинических испытаний, а именно к определению клинической эффективности медицинского изделия в ходе клинических испытаний, имитирующих применение данного изделия в широкой медицинской практике, к выявлению нежелательных событий при обычных условиях применения и к оценке допустимости рисков, связанных с предназначенным применением медицинского изделия; b) устанавливает требования к организации, проведению, мониторингу, сбору данных и документированию клинических испытаний медицинского изделия; c) применяется ко всем клиническим испытаниям медицинских изделий, клиническую эффективность и безопасность которых оценивают с участием людей в качестве субъектов клинических испытаний. Настоящий стандарт не применяется к медицинским изделиям для диагностики in vitro Дата последнего изменения: 18. 05. 2011

22. ГОСТ Р ИСО 14155 -2 -2008 - Руководство по проведению клинических испытаний медицинских изделий. Часть 2. Планирование клинических испытаний Настоящий стандарт устанавливает требования к разработке плана клинических испытаний с целью клинических испытаний медицинских изделий. Разработка плана клинических испытаний в соответствии с требованиями настоящего стандарта и соблюдение данных требований помогают наилучшим образом обеспечить научную обоснованность и воспроизводимость результатов клинических испытаний. Настоящий стандарт не применим к медицинским изделиям для диагностики in vitro Переиздание: Дата последнего изменения: 18. 05. 2011 23. ГОСТ Р ИСО 15189 -2009 - Лаборатории медицинские. Частные требования к качеству и компетентности Настоящий стандарт устанавливает частные требования к качеству и компетентности медицинских лабораторий. Настоящий стандарт предназначен для применения медицинскими лабораториями при разработке их систем менеджмента качества и оценке собственной компетентности, а также для использования органами аккредитации при подтверждении или признании компетентности медицинских лабораторий Дата последнего изменения: 18. 05. 2011 24. ГОСТ Р ИСО 15193 -2007 - Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание референтных методик выполнения измерений Настоящий стандарт устанавливает требования к описанию референтной методики выполнения измерений. Стандарт применим для любого лица, органа или учреждения, работающего в одном из разделов лабораторной медицины, при разработке документа, который является референтной методикой выполнения измерений Дата последнего изменения: 18. 05. 2011

25. ГОСТ Р ИСО 15194 -2007 - Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание стандартных образцов Настоящий стандарт устанавливает требования к содержанию и построению описаний стандартных образцов. Они применимы к стандартным образцам наивысшего метрологического порядка, классифицируемым как первичные и вторичные эталоны, применяемым как калибраторы либо контрольные материалы референтных методик выполнения измерений. Настоящий стандарт не применяется к стандартным образцам, входящим в состав измерительных систем для диагностики in vitro. Настоящий стандарт содержит инструкции по сбору основных данных для определения и представления приписанного стандартному образцу значения величины. Настоящий стандарт также устанавливает содержание сертификата. Настоящий стандарт не применяют к процессам производства стандартных образцов Дата последнего изменения: 18. 05. 2011 26. ГОСТ Р ИСО 15195 -2006 - Лабораторная медицина. Требования к лабораториям референтных измерений Настоящий стандарт устанавливает специальные требования к лабораториям референтных измерений в лабораторной медицине. Исследования свойств, результаты которых представляют в номинальной или ординальной шкале, настоящий стандарт не рассматривает. Настоящий стандарт не распространяется на медицинские лаборатории рутинных измерений Дата последнего изменения: 18. 05. 2011

27. ГОСТ Р ИСО 15197 -2009 - Системы диагностические in vitro. Требования к системам мониторного наблюдения за концентрацией глюкозы в крови для самоконтроля при лечении сахарного диабета Настоящий стандарт устанавливает требования к системам мониторинга глюкозы in vitro, с помощью которых измеряют концентрацию глюкозы в пробах капиллярной крови, а также методы проверки и подтверждения эффективности этих систем пользователями. Такие системы предназначены для самоконтроля пользователей (непрофессионалов), страдающих сахарным диабетом. Настоящий стандарт применяется изготовителями таких систем и другими организациями (например, организациями по техническому регулированию и оценке соответствия), несущими ответственность за оценку эффективности работы таких систем. Настоящий стандарт - не обеспечивает всесторонней оценки всех возможных факторов, которые могут повлиять на рабочие характеристики таких систем, - не относится к измерению концентрации глюкозы для диагностирования сахарного диабета, - не касается медицинских аспектов лечения сахарного диабета и - не применяется к методам измерения, дающим результаты в порядковой шкале (например, визуальные, полуколичественные методы) Дата последнего изменения: 18. 05. 2011

28. ГОСТ Р ИСО 15198 -2009 - Клиническая лабораторная медицина. Изделия медицинские для диагностики in vitro. Подтверждение методик контроля качества, рекомендуемых изготовителями пользователям Настоящий стандарт описывает процесс подтверждения изготовителями медицинских изделий для диагностики in vitro методик контроля качества, рекомендуемых ими пользователям этих изделий. Эти методики контроля качества предназначены для того, чтобы предоставить пользователям гарантию, что работа устройства является совместимой с ее намеченным использованием и требованиями изготовителей. Действие настоящего стандарта распространяется на все медицинские изделия для диагностики in vitro Дата последнего изменения: 18. 05. 2011 29. ГОСТ Р ИСО 17511 -2006 - Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам Настоящий стандарт устанавливает правила обеспечения метрологической прослеживаемости значений, приписанных калибраторам и контрольным материалам, предназначенным для установления или подтверждения правильности измерений. Калибраторы и контрольные материалы предоставляются производителями как составная часть медицинских изделий для диагностики in vitro или для применения вместе с ними Дата последнего изменения: 18. 05. 2011

30. ГОСТ Р ИСО 17593 -2009 - Клинические лабораторные исследования и изделия медицинские in vitro. Требования к системам мониторинга in vitro для самотестирования при пероральной терапии антикоагулянтами Настоящий стандарт устанавливает требования к измерительным системам in vitro для самоконтроля лечения антагонистами витамина К, включая рабочие характеристики, обеспечение качества и обучение пользователей и методики верификации и валидации качества выполнения предполагаемыми пользователями при фактических и моделируемых условиях использования. Настоящий стандарт относится исключительно к системам измерения протромбинового времени, используемым людьми для контроля самостоятельного лечения антагонистами витамина K, и представляющим результаты как международное нормализованное отношение (МНО). Настоящий стандарт применим к изготовителям таких систем и к другим организациям (например, регулирующие органы и организации, оценивающие соответствие), ответственным за оценку работы данных систем. Действие настоящего стандарта не распространяется на: - измерительные системы in vitro для характеристик свертывания крови, оценивающих терапию антагонистами витамина K, используемых врачами или другими работниками здравоохранения; - всестороннюю оценку всех возможных факторов, которые могут повлиять на работу данных систем или - медицинские аспекты пероральной терапии антикоагулянтами Дата последнего изменения: 18. 05. 2011

31. ГОСТ Р ИСО 18153 -2006 - Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений каталитической концентрации ферментов, приписанных калибраторам и контрольным материалам Настоящий стандарт устанавливает правила обеспечения метрологической прослеживаемости значений, приписанных калибраторам и контрольным материалам, предназначенным для установления или подтверждении правильности измерения каталитической концентрации ферментов. Калибраторы и контрольные материалы предоставляются производителями как составная часть медицинских изделий для диагностики in vitro или для применения с ними Дата последнего изменения: 18. 05. 2011 32. ГОСТ Р ИСО 20776 -1 -2010 - Клинические лабораторные исследования и диагностические тест- системы in vitro. Исследование чувствительности инфекционных агентов и оценка функциональных характеристик изделий для исследования чувствительности к антимикробным средствам. Часть 1. Референтный метод лабораторного исследования активности антимикробных агентов против быстрорастущих аэробных бактерий, вызывающих инфекционные болезни Настоящий стандарт описывает референтный метод микроразведений в бульоне для определения МПК отражает активность препарата в описанных условиях проведения теста и может быть использована для целей менеджмента лечения, принимая в расчет другие факторы, такие как фармакология препарата или механизмы резистентности бактерий. Это позволяет осуществить классификацию бактерий как «чувствительную» (S), «промежуточную» (I) или «резистентную» (R) формы. Кроме того, распределения МПК могут использоваться для определения дикого или недикого типов бактериальной популяции Дата последнего изменения: 20. 09. 2011

ГОСТ Р ИСО 22870 -2009 Исследования по месту лечения. Требования к качеству и компетентности действующий Настоящий стандарт устанавливает специальные требования к проведению исследований по месту лечения и предназначен для применения в сочетании с ИСО 15189 -2003. Требования настоящего стандарта применяют при выполнении исследований по месту лечения в больнице или в организации здравоохранения, предоставляющей амбулаторную помощь. Настоящий стандарт может быть применен при выполнении чрезкожных измерений, анализе выдыхаемого воздуха и при мониторинге физиологических параметров in vivo. Выполнение исследований по месту лечения на дому исключено из сферы применения настоящего стандарта, хотя некоторые его элементы могут быть применены и в таких случаях. Примечание - Могут быть приняты во внимание местные и региональные правила

ГОСТ Р ЕН 13640 -2010 Исследование стабильности реагентов для диагностики in vitro принят Настоящий стандарт применяется при проведении исследования стабильности реагентов для диагностики in vitro, включая собственно реагенты, калибраторы, контрольные материалы и наборы реагентов. Настоящий стандарт устанавливает общие требования к исследованию стабильности реагентов, а также специальные требования к исследованиям в реальном масштабе времени и ускоренным исследованиям при определении стабильности с целью: - установления срока годности реагентов для диагностики in vitro, включая стабильность при транспортировании; - установления стабильности реагентов для диагностики in vitro в процессе применения после первого открытия первичной упаковки; - мониторинга стабильности реагентов для диагностики in vitro, уже размещенных на рынке; - верификации стабильности реагентов для диагностики in vitro после их модификации, которая способна изменить стабильность. Требования настоящего стандарта не применяют к инструментам, приборам, оборудованию, системам или емкостям для сбора образцов биоматериалов

ГОСТ Р ИСО/ТО 22869 -2009 Лаборатории медицинские. Руководство по внедрению ИСО 15189: 2003 действующий Настоящий стандарт представляет руководство для медицинских лабораторий. В нем содержится описание того, каким образом лаборатория может внедрить систему качества, чтобы соответствовать конкретным техническим и управленческим требованиям к качеству и компетентности, установленным в ИСО 15189: 2003. Органы, занимающиеся признанием компетентности медицинских лабораторий, могут также использовать настоящий стандарт как основу для содействия лабораториям в установлении системы качества с целью соответствия национальным требованиям и, в то же время, требованиям международных стандартов. Это руководство применимо как к вновь организованным, так и к уже действующим лабораториям и охватывает как управленческие, так и технические требования ИСО 15189: 2003

33. ГОСТ Р ИСО 22870 -2009 - Исследования по месту лечения. Требования к качеству и компетентности Настоящий стандарт устанавливает специальные требования к проведению исследований по месту лечения и предназначен для применения в сочетании с ИСО 15189 -2003. Требования настоящего стандарта применяют при выполнении исследований по месту лечения в больнице или в организации здравоохранения, предоставляющей амбулаторную помощь. Настоящий стандарт может быть применен при выполнении чрезкожных измерений, анализе выдыхаемого воздуха и при мониторинге физиологических параметров in vivo. Выполнение исследований по месту лечения на дому исключено из сферы применения настоящего стандарта, хотя некоторые его элементы могут быть применены и в таких случаях. Примечание - Могут быть приняты во внимание местные и региональные правила Дата последнего изменения: 18. 05. 2011 34. ГОСТ Р ИСО/ТС 10993 -19 -2009 - Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов Настоящий стандарт содержит сводку параметров и методов тестирования, которые могут быть использованы для идентификации и определения физико-химических, морфологических и топографических (ФМТ) свойств материалов, используемых в медицинских изделиях. Такая оценка ограничена только теми параметрами, которые имеют отношение к биологическим свойствам и конкретной области применения медицинского изделия (клиническое применение, длительность использования), даже если эти параметры не согласуются с клинической эффективностью Дата последнего изменения: 18. 05. 2011 Остальные стандарты МЗ и СЗ РФ планирует завершить до 2013 года.

7aa695b847d142265ebfa94f46691daf.ppt