Лекция 5 - Термодинамика биологических систем.ppt
- Количество слайдов: 29

Лекция 5 Термодинамика биологических систем Лектор: к. т. н. Якимов А. Н. Кафедра медицинской и биологической физики, медицинской информатики, биостатистики ГУ «Луганский государственный медицинский университет»

Введение Термодинамика ‒ это раздел физики, который изучает процессы, связанные с передачей тепла, энергии и вещества между телами. n Примеры термодинамических процессов: Ø фотосинтез; Ø использование энергии АТФ; Ø работа Na-K насоса в мембранах клеток; Ø регуляция температуры тела; Ø преобразование энергии, получаемой из 2 пищи n

Основные понятия термодинамики: Система – это совокупность материальных объектов, выделенных каким-либо образом из окружающей среды. Виды термодинамических систем § Изолированная ‒ отсутствует обмен энергией и веществом с окружающей средой; § Закрытая ‒ обмен веществом отсутствует, но возможен обмен энергией; § Открытая ‒ система обменивается с окружающей средой и энергией и веществом. 3
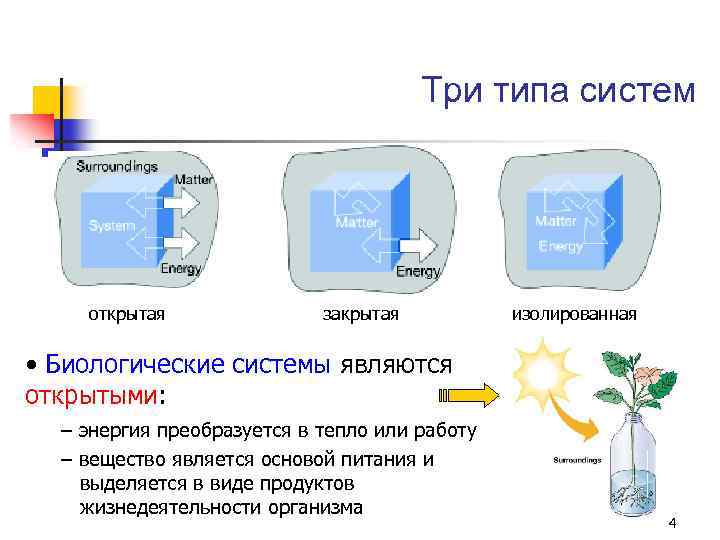
Три типа систем открытая закрытая изолированная • Биологические системы являются открытыми: – энергия преобразуется в тепло или работу – вещество является основой питания и выделяется в виде продуктов жизнедеятельности организма 4

Энергия, количество теплоты, работа Энергия – количественная мера способности тела или системы совершать работу. Единица измерения : Джоуль (Дж) к. Дж/моль, калория Работа ‒ форма энергии, которая может быть выведена из системы и преобразована в движение или изменение состояния других тел. 5

Энергия, количество теплоты, работа Количество теплоты - форма энергии, которая запасена в виде хаотического теплового движения молекул тела. Температура - величина, пропорциональная количеству теплоты, содержащемуся в одном моле вещества. 6

Первый закон термодинамики При любом физическом или химическом процессе полное количество энергии в системе остается постоянным, хотя форма энергии может изменяться. Внутренняя энергия системы может быть изменена только посредством обмена тепловой энергией или совершением работы: U – внутренняя энергия; Q – полученное или отданное количество теплоты; A ‒ работа, совершенная системой 7

Первый закон термодинамики для живых (открытых) систем В открытых системах, таких как, например, клетка, первый закон термодинамики гласит, что при протекании любой реакции общее количество энергии, покидающей систему, должно быть в точности равно энергии, которую получает система за вычетом энергии, что остается (сохраняется) в системе. 8

Формы энергии в биологических системах Внутренняя энергия U системы включает в себя все основные формы энергии: Ø Механическая энергия – характеризует движение макротел и способность совершать механическую работу. Ø Тепловая энергия – представлена суммой кинетической энергии хаотического теплового движения всех атомов и молекул вещества. Ø Химическая энергия – определяется энергией взаимодействия атомов в молекулах. Ø Электрическая энергия ‒ обусловлена энергией взаимодействия заряженных частиц. 9

Основные виды работы, совершаемой в человеческом теле n n Механическая работа ‒ работа по перемещению частей тела и органов против механических сил. В основном производится с помощью мускулов и мышечной системы. Химическая работа ‒ совершается при синтезе высокомолекулярных соединений из низкомолекулярных компонентов. Такой синтез требует затрат энергии. Осмотическая работа ‒ работа по переносу различных веществ через мембраны клеток из области с меньшей концентрации в область с большей концентрацией. Электрическая работа – работа, затрачиваемая для переноса заряженных частиц (ионов) в электрическом поле, идущая на создание мембранного потенциала. 10

Первичное и вторичное количество теплоты n Первичное (основное) количество теплоты n Оставшаяся энергия трансформируется во связано с неизбежными тепловыми потерями, приводящими к рассеянию энергии при необратимых биохимических и биофизических процессах, имеющими место при метаболизме (коэффициент полезного действия < 100 % !!!). вторичное (активное) количество теплоты, часть которой может быть запасена (например, в АТФ) и использована организмом позже. 11
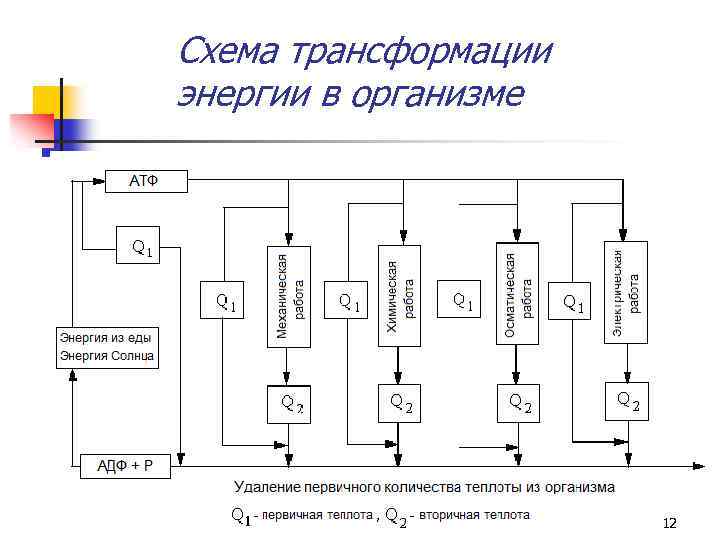
Схема трансформации энергии в организме 12

Закон Гесса n Закон Гесса является следствием из первого закона термодинамики для случая химических превращений: Тепловой эффект многоступенчатой химической реакции не зависит от пути, по которому она протекает, а зависит лишь от начального и конечного состояния химической системы. 13

Значение Закона Гесса n n n Закон Гесса позволяет рассчитать калориметрический эффект химических реакций, которые не протекают при имеющихся условиях или тепловой эффект которых сложно измерить. Закон Гесса дает возможность рассчитать тепловой эффект сложной химической реакции зная лишь энтальпию начальных и конечных продуктов реакции: Закон Гесса позволяет рассчитать количество калорий в питательном веществе. 14

Примеры использования закона Гесса для расчета теплового эффекта химических реакциий 15

ПЕРЕРЫВ НА 5 МИНУТ 16

Направление протекания процессов. Энтропия. Термодинамический процесс называется обратимым, если он может быть проведен в обратном направлении, причем система будет проходить в обратном порядке через те же состояния, что и прямом процессе. В противном случае процесс называется необратимым. Энтропией называется отношение количества теплоты, произведенного в обратимом изотермическом процессе, к абсолютной температуре T, при которой этот процесс проходит: 17

Энтропия. Формула Больцмана. При обратимом процессе энтропия остается постоянной: n В ходе необратимого процесса энтропия увеличивается: n n Формула Больцмана: Энтропия, S, является количественной характеристикой, равной где W - статистическая вероятность (число микросостояний, реализующих данное макросостояние системы), а k - постоянная Больцмана (k =1. 38 x 10 -23 Дж/К) 18

Пример использования формулы Больцмана ab c d c a b d 19

Энтропия. Порядок и хаос в системе. Второй закон термодинамики. Энтропия является мерой порядка в системе: • более упорядоченному состоянию системы соответствует меньшее значение энтропии; • в беспорядочном состоянии система обладает большей энтропией; • если конечное состояние системы более упорядоченное, чем начальное, то ∆S < 0 (упорядочивание требует энергии). Второй закон термодинамики: при любом самопроизвольно протекающем процессе энтропия системы (S) увеличивается: 20

Альтернативные формулировки второго закона термодинамики Q 1 Нагреватель T 1 Q 2 ТМ Холодильник T 2 Невозможен самопроизвольный переход тепла от тел с более низкой температуры к телам с более высокой (формулировка Клаузиуса) Невозможно создание вечного двигателя второго рода, то есть такого циклического процесса, в результате которого все поглощенное системой тепло расходовалось бы на совершение этой системой работы (формулировка Томсона) 21

Термодинамические потенциалы Энтальпия обозначается символом H и определяется суммой внутренней энергии (U) и произведением давления в системе (P) на занимаемый ею объем (V): H = U + PV Биологические реакции обычно происходят лишь с небольшим изменением давления и объема. Начальные условия протекания реакций также сходные: – постоянная температура (25 °C или 37 °C) – постоянное давление (1 атм = 101, 3 к. Па) Таким образом, и V и P обычно практически равны 0. Поэтому H U 22

Термодинамические потенциалы Свободная энергия Гельмгольца обозначается символом F и определяется разностью внутренней энергии (U) и произведением температуры системы (T) на ее энтропию (S): F = U - TS Свободная энергия Гельмгольца является мерой работы, которую может совершить термодинамическая система над внешними телами: Максимальная работа равна убыли свободной энергии Гельмгольца. Произведение TS иногда называют связанной энергией. 23

Термодинамические потенциалы Свободная энергия Гиббса (G) (потенциал Гиббса) связана с количеством энергии, необходимой для протекания химической реакции при постоянной температуре и давлении: G = H – TS = U + p. V – TS Энергию Гиббса можно понимать как полную химическую энергию системы. Если изменение потенциала Гиббса, G < 0, то химическая реакция может протекать самопроизвольно (и энергия Гиббса в конечном состоянии меньше, чем в исходном): В состоянии равновесия G Gmin и G = 0. 24

Системы вдали от равновесия Николс и Пригожин предположили, что изменение энтропии системы ( S) за определенный интервал времени (t) может быть представлено суммой S = Se + Si , где Se ‒ изменение энтропии, происходящее благодаря внешнему притоку энергии (взаимодействие с внешней средой), а Si ‒ изменение энтропия внутри системы в ходе необратимых процессов, таких как диффузия, теплопроводность, протекание химических реакций. 25

Системы вдали от равновесия В отличие от Si, Se в живых системах может быть, в принципе, и отрицательным. Поэтому возможен случай когда полное изменение энтропии S < 0 (отрицательно). Эта ситуация реализуется при условии, что Se 0 и | Se | > Si (происходить увеличение упорядоченности системы). S > 0 ( Se > 0) ‒ патологическое состояние организма (разложение тканей, онкологические заболевания, резкое старение). S < 0 ( Se < 0, и | Se | > Si ) ‒ рост, формирование 26

Теорема Пригожина Вблизи состояния термодинамического равновесия при постоянных внешних условиях производство энтропии (скорость ее изменения за единицу времени), происходящее в результате идущих в системе необратимых внутренних процессов, остается постоянной минимальной положительной величиной: 27

ИТОГИ: В ходе лекции рассмотрены следующие основные моменты: • типы термодинамических систем; • базовые понятия термодинамики (энергия, работа, количество теплоты, температура и т. д. ) • первое начало термодинамики; • второе начало термодинамики (3 формулировки); • Закон Гесса • энтропия системы (формула Больцмана) • основные термодинамические потенциалы U, H, F, G) • условия равновесия и теорема Пригожина 28

СПАСИБО ЗА ВНИМАНИЕ! 29
Лекция 5 - Термодинамика биологических систем.ppt