 Лекция 5. Тема № 5 Химия s, p -элементов
Лекция 5. Тема № 5 Химия s, p -элементов
 Учебные вопросы n 1. Водород n 2. Щелочные и щелочноземельные металлы n 3. р - элементы 7 группы Периодической системы элементов. Галогены
Учебные вопросы n 1. Водород n 2. Щелочные и щелочноземельные металлы n 3. р - элементы 7 группы Периодической системы элементов. Галогены
 Литература n Ахметов Н. С. Общая и неорганическая химия, 2009, с. 289 -338
Литература n Ахметов Н. С. Общая и неорганическая химия, 2009, с. 289 -338
 Водород 1766 г - Г. Кавендиш установил природу Н 2 ; 1783 г. Лавуазье причислил к элементам и назвал. Кларк Н - 1% В природе встречается в виде 2 изотопов: 1 Н - протия (99, 8%) 2 Н ( 2 D ) - дейтерия (0, 02%)
Водород 1766 г - Г. Кавендиш установил природу Н 2 ; 1783 г. Лавуазье причислил к элементам и назвал. Кларк Н - 1% В природе встречается в виде 2 изотопов: 1 Н - протия (99, 8%) 2 Н ( 2 D ) - дейтерия (0, 02%)
 Третий изотоп - 3 Н ( Т ) - тритий постоянно образуется в верхних слоях атмосферы под действием нейтронов космических лучей на атомы N и других газов. Бета-радиоактивен, период полураспада Т 1/2 = 12, 26 года. 3 Т= 3 He + бета-частицы 1 2
Третий изотоп - 3 Н ( Т ) - тритий постоянно образуется в верхних слоях атмосферы под действием нейтронов космических лучей на атомы N и других газов. Бета-радиоактивен, период полураспада Т 1/2 = 12, 26 года. 3 Т= 3 He + бета-частицы 1 2
 Физико-химические свойства Н 2 - бесцветный газ, без вкуса и запаха т. пл. - 259 о. С т. кип. - 252, 8 о. С. Ведет себя как идеальный газ 1. Взаимодействует с кислородом 2 Н 2 + О 2 = 2 Н 2 О
Физико-химические свойства Н 2 - бесцветный газ, без вкуса и запаха т. пл. - 259 о. С т. кип. - 252, 8 о. С. Ведет себя как идеальный газ 1. Взаимодействует с кислородом 2 Н 2 + О 2 = 2 Н 2 О
 2. С галогенами Н 2 + F 2 = 2 HF (со взрывом) H 2 + Cl 2 = 2 HCl 3. С серой и селеном - только при нагревании с образованием Н 2 S и H 2 Se 4. С С, N 2, Si - только в присутствии катализаторов.
2. С галогенами Н 2 + F 2 = 2 HF (со взрывом) H 2 + Cl 2 = 2 HCl 3. С серой и селеном - только при нагревании с образованием Н 2 S и H 2 Se 4. С С, N 2, Si - только в присутствии катализаторов.
 n 4. С металлами образует гидриды (со щелочными, щелочноземельными, лантаноидами и некоторыми dэлементами) 2 К +Н 2 = 2 КН Н 2 - активный восстановитель.
n 4. С металлами образует гидриды (со щелочными, щелочноземельными, лантаноидами и некоторыми dэлементами) 2 К +Н 2 = 2 КН Н 2 - активный восстановитель.
 В обычных условиях восстанавливает только металлы с Е > +0, 7 B (Hg, Ag, Pd, Au): 2 Ag. NO 3(p) + H 2(г) = 2 Ag(к) + 2 HNO 3(p) Pd. O(к) + Н 2(г) = Pd(к) + H 2 O(ж)
В обычных условиях восстанавливает только металлы с Е > +0, 7 B (Hg, Ag, Pd, Au): 2 Ag. NO 3(p) + H 2(г) = 2 Ag(к) + 2 HNO 3(p) Pd. O(к) + Н 2(г) = Pd(к) + H 2 O(ж)
 В промышленности при высоких температурах Н 2 применяется для восстановления более активных металлов: Ge. O 2 + 2 H 2 = Ge + 2 H 2 O WO 3 + 3 H 2 = W + 3 H 2 O
В промышленности при высоких температурах Н 2 применяется для восстановления более активных металлов: Ge. O 2 + 2 H 2 = Ge + 2 H 2 O WO 3 + 3 H 2 = W + 3 H 2 O
 Получение Н 2 Основной промышленный метод переработка природного газа СН 4(г)+2 Н 2 О = 4 Н 2↑+ СО 2↑ Наиболее чистый водород получают электрохимическим разложением воды (в присутствии ОН-): катод(-): 2 Н 2 О + 2 е- = Н 2↑ + 2 ОНанод(+): 2 ОН- - 2 е- = 0, 5 О 2 + Н 2 О
Получение Н 2 Основной промышленный метод переработка природного газа СН 4(г)+2 Н 2 О = 4 Н 2↑+ СО 2↑ Наиболее чистый водород получают электрохимическим разложением воды (в присутствии ОН-): катод(-): 2 Н 2 О + 2 е- = Н 2↑ + 2 ОНанод(+): 2 ОН- - 2 е- = 0, 5 О 2 + Н 2 О
 В лабораторных условиях Н 2 получают из кислот: Zn +2 HCl = H 2↑ + Zn. Cl 2 или из гидрида Ti: Ti. H 2 = Н 2↑ + Ti
В лабораторных условиях Н 2 получают из кислот: Zn +2 HCl = H 2↑ + Zn. Cl 2 или из гидрида Ti: Ti. H 2 = Н 2↑ + Ti
 Галогены F, Cl, Br, I, At Электронная конфигурация внешнего слоя - ns 2 np 5 Характерная степень окисления -1 Для хлора, брома и иода известны степени окисления: +1, +3, +5 и +7 В обычных условиях существуют в виде простых веществ Hal 2
Галогены F, Cl, Br, I, At Электронная конфигурация внешнего слоя - ns 2 np 5 Характерная степень окисления -1 Для хлора, брома и иода известны степени окисления: +1, +3, +5 и +7 В обычных условиях существуют в виде простых веществ Hal 2
 F 2 - газ, бледно-желтого цвета Cl 2 - газ, желто-зеленого цвета Br 2 - густая жидкость, краснокоричневого цвета I 2 - кристаллы, серо-черного цвета, блестят
F 2 - газ, бледно-желтого цвета Cl 2 - газ, желто-зеленого цвета Br 2 - густая жидкость, краснокоричневого цвета I 2 - кристаллы, серо-черного цвета, блестят
 Лабораторные способы получения Cl 2 - получают действием различных окислителей на НCl: Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O -Br 2, I 2 - получают окислением HBr, HI или их солей: 6 KBr + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Br 2 + + Cr 2(SO 4)3 + 4 K 2 SO 4 + 7 H 2 O
Лабораторные способы получения Cl 2 - получают действием различных окислителей на НCl: Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O -Br 2, I 2 - получают окислением HBr, HI или их солей: 6 KBr + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Br 2 + + Cr 2(SO 4)3 + 4 K 2 SO 4 + 7 H 2 O
 Соединения галогенов Галогеноводороды - HF, НCl, HBr, HI при обычных условиях газы, хорошо растворимые в воде. Получение KF(кр) + H 2 SO 4(конц) = HF↑ +KHSO 4 KCl + H 2 SO 4(конц) = HCl↑ + KHSO 4 3 Br 2 + 2 P + 6 H 2 O = 6 HBr↑ + 2 H 3 PO 3
Соединения галогенов Галогеноводороды - HF, НCl, HBr, HI при обычных условиях газы, хорошо растворимые в воде. Получение KF(кр) + H 2 SO 4(конц) = HF↑ +KHSO 4 KCl + H 2 SO 4(конц) = HCl↑ + KHSO 4 3 Br 2 + 2 P + 6 H 2 O = 6 HBr↑ + 2 H 3 PO 3
 При растворении НCl, HBr, HI диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. 4 HF + Si. O 2 = Si. F 4↑ + 2 H 2 O В отличии от других кислот, HF взаимодействует с Si. O 2, и вследствие этого разъедает стекло.
При растворении НCl, HBr, HI диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. 4 HF + Si. O 2 = Si. F 4↑ + 2 H 2 O В отличии от других кислот, HF взаимодействует с Si. O 2, и вследствие этого разъедает стекло.
 Кислородсодержащие соединения галогенов Все галогены, кроме фтора, образуют соединения которых они обладают положительной степенью окисления. Наиболее важные - НHal. On (n=1÷ 4)
Кислородсодержащие соединения галогенов Все галогены, кроме фтора, образуют соединения которых они обладают положительной степенью окисления. Наиболее важные - НHal. On (n=1÷ 4)
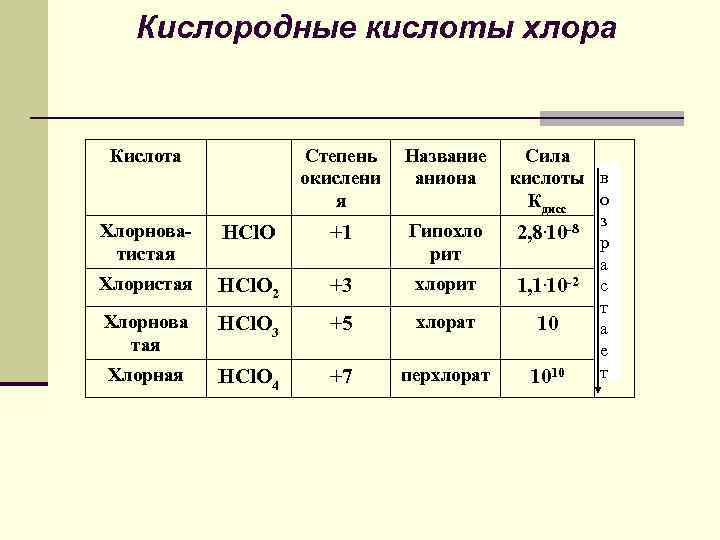 Кислородные кислоты хлора Кислота Степень окислени я Название аниона Сила кислоты в о Кдисс +1 Гипохло рит 2, 8. 10 -8 р з Хлорноватистая HCl. O Хлористая HCl. O 2 +3 хлорит 1, 1. 10 -2 Хлорнова тая HCl. O 3 +5 хлорат 10 Хлорная HCl. O 4 +7 перхлорат 1010 а с т а е т
Кислородные кислоты хлора Кислота Степень окислени я Название аниона Сила кислоты в о Кдисс +1 Гипохло рит 2, 8. 10 -8 р з Хлорноватистая HCl. O Хлористая HCl. O 2 +3 хлорит 1, 1. 10 -2 Хлорнова тая HCl. O 3 +5 хлорат 10 Хлорная HCl. O 4 +7 перхлорат 1010 а с т а е т
 Кислоты ННаl при взаимодействии с металлами их окисляют только за счет ионов Н+: 2 HCl + Zn = Zn. Cl 2 + H 2↑ Галогениды металлов, за исключением солей Аg и Pb, хорошо растворимы в воде.
Кислоты ННаl при взаимодействии с металлами их окисляют только за счет ионов Н+: 2 HCl + Zn = Zn. Cl 2 + H 2↑ Галогениды металлов, за исключением солей Аg и Pb, хорошо растворимы в воде.
 Реакци Ag+ + Hal- = Ag. Hal↓ является качественной на галогенионы: Ag. Cl - осадок белого цвета; Ag. Br - желто-белого цвета; Ag. I - ярко-желтого цвета;
Реакци Ag+ + Hal- = Ag. Hal↓ является качественной на галогенионы: Ag. Cl - осадок белого цвета; Ag. Br - желто-белого цвета; Ag. I - ярко-желтого цвета;
 Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом и металлами: F 2+ 2 Cl- = 2 F- +Cl 2 + 2 Br- = 2 Cl- + Br 2 + 2 I- = 2 Br- + I 2
Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом и металлами: F 2+ 2 Cl- = 2 F- +Cl 2 + 2 Br- = 2 Cl- + Br 2 + 2 I- = 2 Br- + I 2
 ПОЛУЧЕНИЕ ГАЛОГЕНОВ Промышленные методы: а) электролиз F 2 получают из расплавов фторидов: Сa. F 2 → Ca+F 2 Cl 2 получают из расплавов или из растворов хлоридов: 2 Na. Cl → 2 Na +Cl 2 2 Na. Cl + 2 H 2 O → H 2↑ + Cl 2↑ + 2 Na. OH б) окисление солей брома и иода хлором.
ПОЛУЧЕНИЕ ГАЛОГЕНОВ Промышленные методы: а) электролиз F 2 получают из расплавов фторидов: Сa. F 2 → Ca+F 2 Cl 2 получают из расплавов или из растворов хлоридов: 2 Na. Cl → 2 Na +Cl 2 2 Na. Cl + 2 H 2 O → H 2↑ + Cl 2↑ + 2 Na. OH б) окисление солей брома и иода хлором.
 ХИМИЧЕСКИЕ СВОЙСТВА F - самый активный из галогенов. а) взаимодействует с металлами: 2 Al + 3 F 2 = 2 Al. F 3 + Q б) с неметаллами: H 2 + F 2 = 2 HF + Q Si+ 2 F 2 =Si. F 4 Hal 2 + F 2 = 2 Hal. F (где Hal=Cl, Br, I) межгалогенные соединения (сильные окислители)
ХИМИЧЕСКИЕ СВОЙСТВА F - самый активный из галогенов. а) взаимодействует с металлами: 2 Al + 3 F 2 = 2 Al. F 3 + Q б) с неметаллами: H 2 + F 2 = 2 HF + Q Si+ 2 F 2 =Si. F 4 Hal 2 + F 2 = 2 Hal. F (где Hal=Cl, Br, I) межгалогенные соединения (сильные окислители)
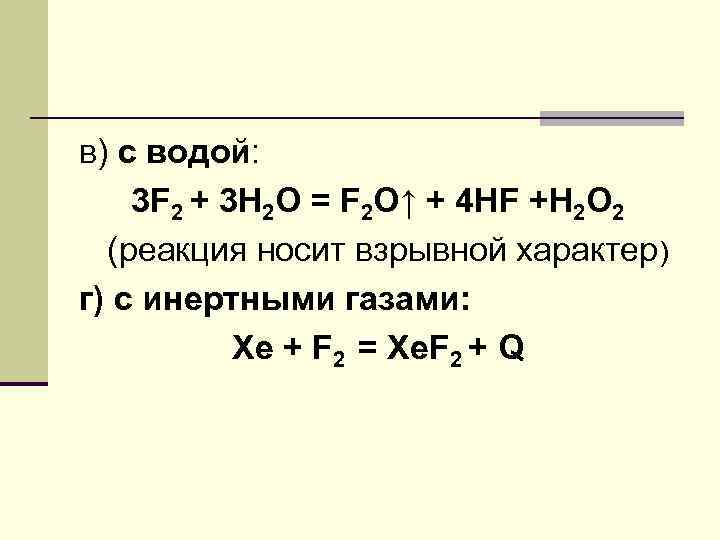 в) с водой: 3 F 2 + 3 H 2 O = F 2 O↑ + 4 HF +H 2 O 2 (реакция носит взрывной характер) г) с инертными газами: Xe + F 2 = Xe. F 2 + Q
в) с водой: 3 F 2 + 3 H 2 O = F 2 O↑ + 4 HF +H 2 O 2 (реакция носит взрывной характер) г) с инертными газами: Xe + F 2 = Xe. F 2 + Q
 Сl 2 - очень реакционноактивен а) реагирует со всеми простыми веществами, кроме О 2, N 2, инертных газов: 2 Al + 3 Cl 2 = 2 Al. Cl 3 + Q Si+ 2 Cl 2 = Si. Cl 4 + Q H 2 + Cl 2 = 2 HCl + Q (реакция протекает по цепному механизму)
Сl 2 - очень реакционноактивен а) реагирует со всеми простыми веществами, кроме О 2, N 2, инертных газов: 2 Al + 3 Cl 2 = 2 Al. Cl 3 + Q Si+ 2 Cl 2 = Si. Cl 4 + Q H 2 + Cl 2 = 2 HCl + Q (реакция протекает по цепному механизму)
 б) взаимодействует со сложными веществами: Н 3 С-СН 3 + Сl 2 → CH 3 -CH 2 Cl + HCl -вытесняет Br 2 и I 2 из их соединений: Cl 2 + 2 HBr = 2 HCl + Br 2 Cl 2 + 2 HI = 2 HCl + I 2
б) взаимодействует со сложными веществами: Н 3 С-СН 3 + Сl 2 → CH 3 -CH 2 Cl + HCl -вытесняет Br 2 и I 2 из их соединений: Cl 2 + 2 HBr = 2 HCl + Br 2 Cl 2 + 2 HI = 2 HCl + I 2
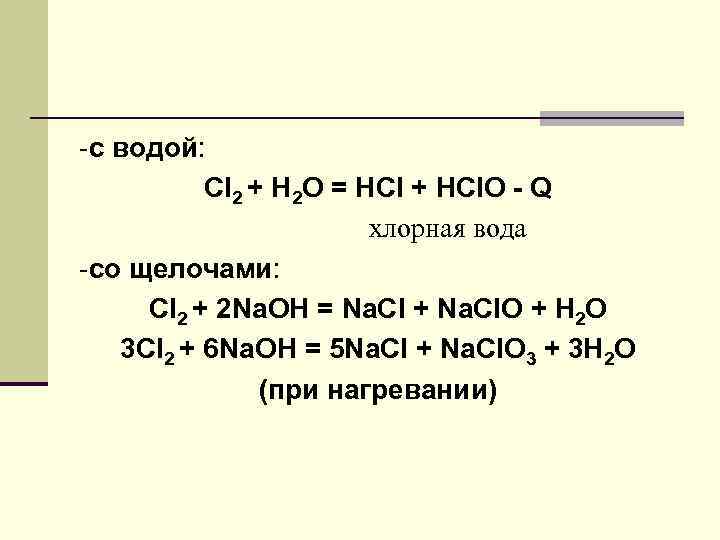 -с водой: Cl 2 + H 2 O = HCl + HCl. O - Q хлорная вода -со щелочами: Сl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O 3 Сl 2 + 6 Na. OH = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (при нагревании)
-с водой: Cl 2 + H 2 O = HCl + HCl. O - Q хлорная вода -со щелочами: Сl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O 3 Сl 2 + 6 Na. OH = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (при нагревании)
 Br 2 - менее активен, чем F 2 и Cl 2 -с простыми веществами: Si + 2 Br 2 = Si. Br 4 + Q H 2 + Br 2 = 2 HBr + Q Как «мягкий» реагент, широко используется в органическом синтезе.
Br 2 - менее активен, чем F 2 и Cl 2 -с простыми веществами: Si + 2 Br 2 = Si. Br 4 + Q H 2 + Br 2 = 2 HBr + Q Как «мягкий» реагент, широко используется в органическом синтезе.
 I 2 - существенно отличается по химической активности от F 2, Cl 2, Br 2. -не взаимодействует с неметаллами; -с металлами медленно реагирует при to.
I 2 - существенно отличается по химической активности от F 2, Cl 2, Br 2. -не взаимодействует с неметаллами; -с металлами медленно реагирует при to.


