2010 ЛЕКЦИЯ 5. РАСТВОРЫ.ppt
- Количество слайдов: 22
 ЛЕКЦИЯ 5. РАСТВОРЫ.
ЛЕКЦИЯ 5. РАСТВОРЫ.
 РАСТВОР – это однородная (гомогенная) система переменного состава, состоящая из двух и более компонентов и продуктов их взаимодействия. По агрегатному состоянию растворы бывают: а) газообразные (воздух); б) жидкие (H 2 SO 4 в воде); в) твердые (металлические сплавы).
РАСТВОР – это однородная (гомогенная) система переменного состава, состоящая из двух и более компонентов и продуктов их взаимодействия. По агрегатному состоянию растворы бывают: а) газообразные (воздух); б) жидкие (H 2 SO 4 в воде); в) твердые (металлические сплавы).
 Растворитель и растворенное вещество. Движущая сила образования растворов - уменьшение свободной энергии. Cu. SO 4, безв. + x. H 2 O = Cu. SО 4, водн. + 73, 2 Cu. SO 4 5 H 2 O+ (x-5)H 2 O = Cu. SО 4, водн. - 7, 15 ______________________ Cu. SO 4, безв. + x. H 2 O - Cu. SO 4 5 H 2 Oкр. - x. H 2 O + 5 H 2 O = + 73, 2 + 7, 15 Cu. SO 4, безв. + 5 H 2 O = Cu. SO 4 5 H 2 O + 80, 35 H = - 80, 35
Растворитель и растворенное вещество. Движущая сила образования растворов - уменьшение свободной энергии. Cu. SO 4, безв. + x. H 2 O = Cu. SО 4, водн. + 73, 2 Cu. SO 4 5 H 2 O+ (x-5)H 2 O = Cu. SО 4, водн. - 7, 15 ______________________ Cu. SO 4, безв. + x. H 2 O - Cu. SO 4 5 H 2 Oкр. - x. H 2 O + 5 H 2 O = + 73, 2 + 7, 15 Cu. SO 4, безв. + 5 H 2 O = Cu. SO 4 5 H 2 O + 80, 35 H = - 80, 35
 Тепловой эффект определяется соотношением энергий связей в веществе и между веществом и растворителем. Cтандартные энтальпии растворения некоторых солей в воде. Соль KNO 3 Na. Cl Pr 2(SO 4)3 Na 2 SO 4∙ 10 H 2 O ∆р-рения. Н 0298, к. Дж/моль + 36, 3 + 4, 0 <0 - 2, 3 + 79, 8
Тепловой эффект определяется соотношением энергий связей в веществе и между веществом и растворителем. Cтандартные энтальпии растворения некоторых солей в воде. Соль KNO 3 Na. Cl Pr 2(SO 4)3 Na 2 SO 4∙ 10 H 2 O ∆р-рения. Н 0298, к. Дж/моль + 36, 3 + 4, 0 <0 - 2, 3 + 79, 8
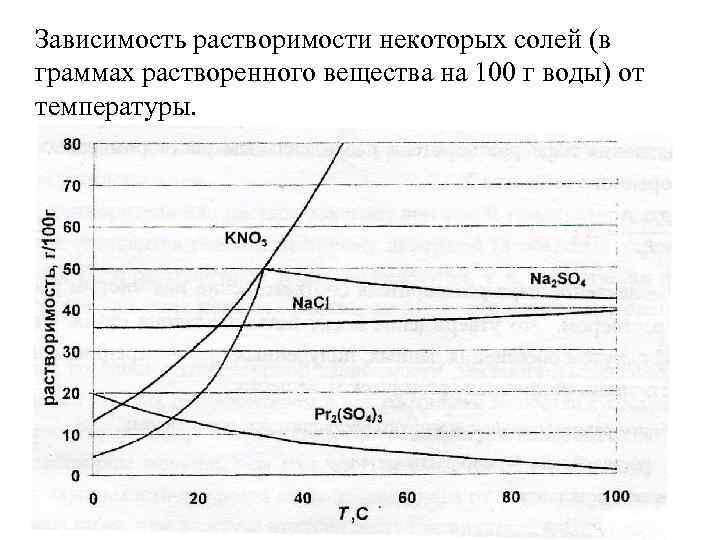 Зависимость растворимости некоторых солей (в граммах растворенного вещества на 100 г воды) от температуры.
Зависимость растворимости некоторых солей (в граммах растворенного вещества на 100 г воды) от температуры.
 CH 3 COONa 3 H 2 O – переохлажденный кристаллогидрат На растворимость влияют все факторы, смещающие равновесие в соответствии с принципом Ле-Шателье. Na. Cl + H 2 O Na+водн. + Cl-водн. (CH 3 COO)2 Pb + 2 KI Pb. I 2 + 2 CH 3 COOK (Растворимость Pb. I 2: 200 C - 0, 07 г в 100 г воды, а при 1000 С - 0, 44 г) Химическая теория Д. М. Менделеева. I 2 H 2 O желтоватая C 2 H 5 OH коричневая CCl 4 краснофиолетовая C 6 H 6 малиновая
CH 3 COONa 3 H 2 O – переохлажденный кристаллогидрат На растворимость влияют все факторы, смещающие равновесие в соответствии с принципом Ле-Шателье. Na. Cl + H 2 O Na+водн. + Cl-водн. (CH 3 COO)2 Pb + 2 KI Pb. I 2 + 2 CH 3 COOK (Растворимость Pb. I 2: 200 C - 0, 07 г в 100 г воды, а при 1000 С - 0, 44 г) Химическая теория Д. М. Менделеева. I 2 H 2 O желтоватая C 2 H 5 OH коричневая CCl 4 краснофиолетовая C 6 H 6 малиновая
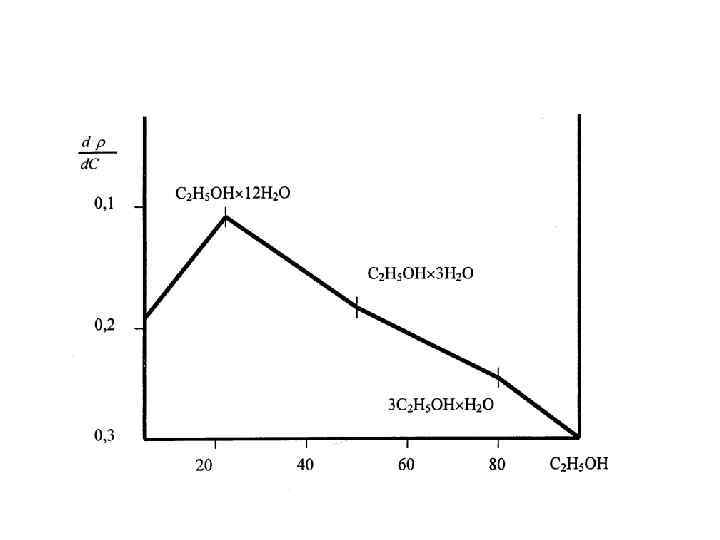
 Идеальный раствор обладает следующими свойствами: 1. Между молекулами одного компонента раствора и молекулами разных компонентов действуют одинаковые силы межмолекулярного притяжения. Молекулы одного компонента не облегчают и не затрудняют переход в паровую фазу молекул другого компонента. 2. Смешивание двух компонентов раствора сопровождается изменением энтальпии. не 3. Объем смеси двух компонентов раствора в точности равен сумме их объемов до смешивания.
Идеальный раствор обладает следующими свойствами: 1. Между молекулами одного компонента раствора и молекулами разных компонентов действуют одинаковые силы межмолекулярного притяжения. Молекулы одного компонента не облегчают и не затрудняют переход в паровую фазу молекул другого компонента. 2. Смешивание двух компонентов раствора сопровождается изменением энтальпии. не 3. Объем смеси двух компонентов раствора в точности равен сумме их объемов до смешивания.
 Относительное понижение давления насыщенного пара над идеальным раствором равно мольной доле растворенного вещества. (1 й ЗАКОН РАУЛЯ)
Относительное понижение давления насыщенного пара над идеальным раствором равно мольной доле растворенного вещества. (1 й ЗАКОН РАУЛЯ)
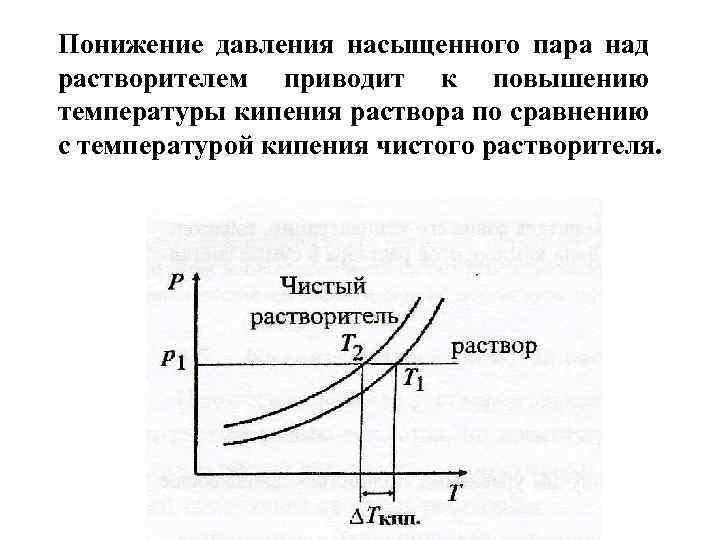 Понижение давления насыщенного пара над растворителем приводит к повышению температуры кипения раствора по сравнению с температурой кипения чистого растворителя.
Понижение давления насыщенного пара над растворителем приводит к повышению температуры кипения раствора по сравнению с температурой кипения чистого растворителя.
 2 -й закон Рауля или следствие закона Рауля. Понижение температуры замерзания и повышение температуры кипения раствора пропорционально числу частиц растворенного вещества. если G – грамм растворителя К = Кк - криоскопическая константа, Е = Кэ - эбулиоскопическая константа. C 6 H 6 CH 3 COOH H 2 O E 2, 53 3, 03 0, 52 K 5, 12 3, 90 1, 86
2 -й закон Рауля или следствие закона Рауля. Понижение температуры замерзания и повышение температуры кипения раствора пропорционально числу частиц растворенного вещества. если G – грамм растворителя К = Кк - криоскопическая константа, Е = Кэ - эбулиоскопическая константа. C 6 H 6 CH 3 COOH H 2 O E 2, 53 3, 03 0, 52 K 5, 12 3, 90 1, 86
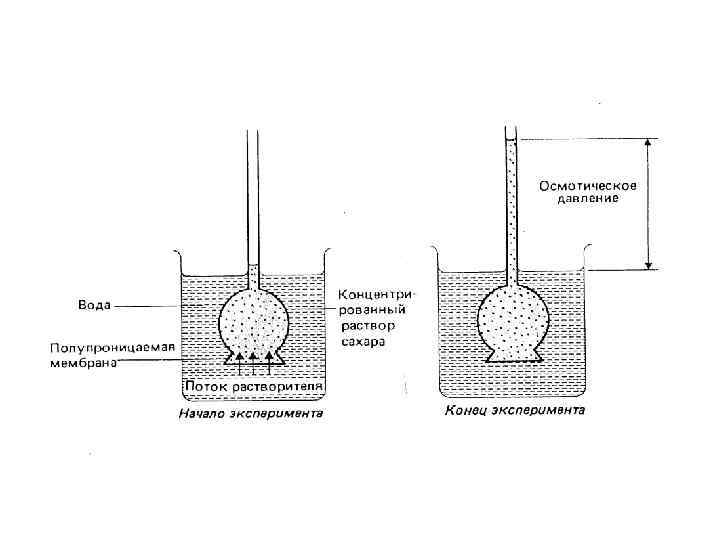
 ОСМОС - это самопроизвольный переход растворителя через полупроницаемую мембрану из разбавленного раствора или чистого растворителя в концентрированный раствор. Силикаты двух- и трехвалентных металлов пропускают воду, но задерживают ионы солей. Na 2 Si. O 3 + Mn. Cl 2; Mn. Si. O 3 белый +Fe. Cl 2; Fe. Si. O 3 темнозеленый +Ni. Cl 2; +Co. Cl 2 Ni. Si. O 3 Co. Si. O 3 изумрудносиний с зеленый розовым оттенком Вант-Гофф показал, что давление, которое необходимо приложить, чтобы остановить осмос (осмотическое давление) зависит от молярной концентрации следующим образом:
ОСМОС - это самопроизвольный переход растворителя через полупроницаемую мембрану из разбавленного раствора или чистого растворителя в концентрированный раствор. Силикаты двух- и трехвалентных металлов пропускают воду, но задерживают ионы солей. Na 2 Si. O 3 + Mn. Cl 2; Mn. Si. O 3 белый +Fe. Cl 2; Fe. Si. O 3 темнозеленый +Ni. Cl 2; +Co. Cl 2 Ni. Si. O 3 Co. Si. O 3 изумрудносиний с зеленый розовым оттенком Вант-Гофф показал, что давление, которое необходимо приложить, чтобы остановить осмос (осмотическое давление) зависит от молярной концентрации следующим образом:
 ЗАКОН ВАНТ-ГОФФА Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало тот же объем, который занимает раствор.
ЗАКОН ВАНТ-ГОФФА Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало тот же объем, который занимает раствор.
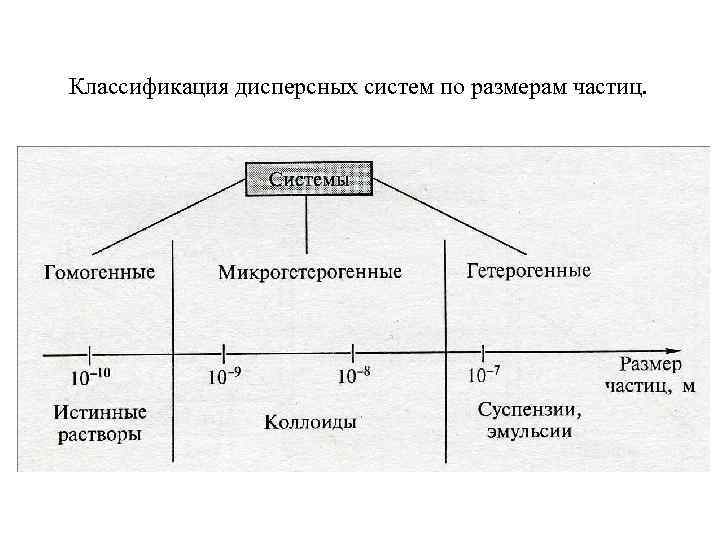 Классификация дисперсных систем по размерам частиц.
Классификация дисперсных систем по размерам частиц.
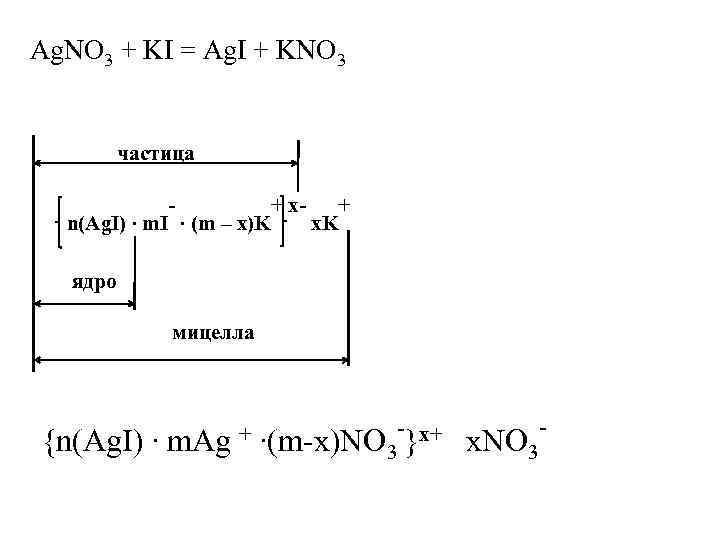 Ag. NO 3 + KI = Ag. I + KNO 3 частица - n(Ag. I) ∙ m. I ∙ (m – x)K + x- x. K + ядро мицелла {n(Ag. I) ∙ m. Ag + - x+ ∙(m-x)NO 3 } x. NO 3
Ag. NO 3 + KI = Ag. I + KNO 3 частица - n(Ag. I) ∙ m. I ∙ (m – x)K + x- x. K + ядро мицелла {n(Ag. I) ∙ m. Ag + - x+ ∙(m-x)NO 3 } x. NO 3
 Коллигативные свойства растворов. Зависят от числа частиц в растворе. Пример 1. Раствор 0, 217 г серы в 19, 18 г сероуглерода кипит на 0, 1140 выше, чем чистый сероуглерод. Есероуглерода = 2, 37; М = ? 257, 8/32 = 8; S 8
Коллигативные свойства растворов. Зависят от числа частиц в растворе. Пример 1. Раствор 0, 217 г серы в 19, 18 г сероуглерода кипит на 0, 1140 выше, чем чистый сероуглерод. Есероуглерода = 2, 37; М = ? 257, 8/32 = 8; S 8
 Пример 2. 11, 9 г KBr растворили в 1000 г H 2 O, t = 0, 3380 ; Kводы = 1, 86
Пример 2. 11, 9 г KBr растворили в 1000 г H 2 O, t = 0, 3380 ; Kводы = 1, 86
 N – исходное число молекул α– степень диссоциации n – число ионов, образующихся при диссоциации одной молекулы N – Nα - число нераспавшихся молекул N(1 - α) Nαn – число образовавшихся ионов
N – исходное число молекул α– степень диссоциации n – число ионов, образующихся при диссоциации одной молекулы N – Nα - число нераспавшихся молекул N(1 - α) Nαn – число образовавшихся ионов
 i – изотонический коэффициент Вант-Гоффа
i – изотонический коэффициент Вант-Гоффа
 Растворенное Т 3 опыт. вещество С 12 Н 22 О 11 Na. Cl Na 2 SO 4 Al 2(SO 4)3 Na. Cl 1, 86*2 1, 86*3 1, 86*5 Т 3 теор. 1, 86 Na+(водн. ) + Cl-(водн. ) Na 2 SO 4 Al 2(SO 4)3 2 Na+(водн. ) +SO 42 - (водн. ) 2 Al 3+(водн. ) +3 SO 42 -(водн. ) i=Т 3 опыт. /Т 3 теор. 1 2 3 5
Растворенное Т 3 опыт. вещество С 12 Н 22 О 11 Na. Cl Na 2 SO 4 Al 2(SO 4)3 Na. Cl 1, 86*2 1, 86*3 1, 86*5 Т 3 теор. 1, 86 Na+(водн. ) + Cl-(водн. ) Na 2 SO 4 Al 2(SO 4)3 2 Na+(водн. ) +SO 42 - (водн. ) 2 Al 3+(водн. ) +3 SO 42 -(водн. ) i=Т 3 опыт. /Т 3 теор. 1 2 3 5
 a- степень диссоциации. Отношение числа молей, продиссоциировавших на ионы, к исходному общему числу молей. Сильные электролиты ( 30%): HCl, HBr, HNO 3(разб. ), H 2 SO 4(разб. ), HCl. O 4, Na. OH, Ba(OH)2, Ca(OH)2, почти все соли. Слабые электролиты ( 5%): органические кислоты, HCN, H 3 BO 3, H 2 CO 3, H 2 S, NH 4 OH, Fe(OH)2, Fe(OH)3, HF, H 2 O, Hg. Cl 2, Cd. Cl 2. Электролиты средней силы ( 5 - 30 %): H 3 PO 4, H 2 Cr. O 4, H 2 SO 3.
a- степень диссоциации. Отношение числа молей, продиссоциировавших на ионы, к исходному общему числу молей. Сильные электролиты ( 30%): HCl, HBr, HNO 3(разб. ), H 2 SO 4(разб. ), HCl. O 4, Na. OH, Ba(OH)2, Ca(OH)2, почти все соли. Слабые электролиты ( 5%): органические кислоты, HCN, H 3 BO 3, H 2 CO 3, H 2 S, NH 4 OH, Fe(OH)2, Fe(OH)3, HF, H 2 O, Hg. Cl 2, Cd. Cl 2. Электролиты средней силы ( 5 - 30 %): H 3 PO 4, H 2 Cr. O 4, H 2 SO 3.


