функ свойства и превращ белков.ppt
- Количество слайдов: 36

Лекция 5. Функциональные свойства и превращения белков в технологическом потоке 1. Функции белков и их классификация. Краткая характеристика функциональных свойств белков и их суспензий 2. Превращения белков в технологическом потоке. 3. Методы регулирования функциональных свойств белков 4 Методы определения качества и количества белков в продуктах (КСР).

1. ПИЩЕВАЯ ХИМИЯ Литература основная: Пищевая химия * Нечаев А. П. и др. Изд. 3 -е, испр. – СПб. : ГИОРД, 2004. – 640 с Дополнительная: Скурихин И. М. , Нечаев А. П. Все о пище с точки зрения химика: Справ. Изд. М. : Высш. Шк. 1991. 288 с.
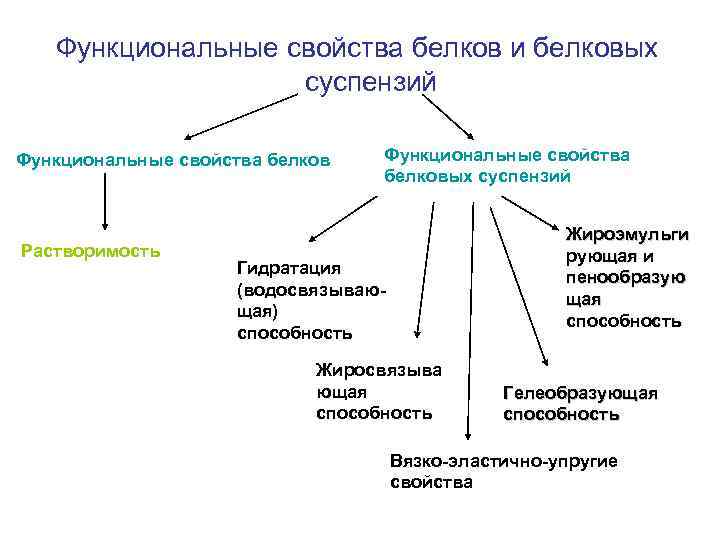
Функциональные свойства белков и белковых суспензий Функциональные свойства белков Растворимость Функциональные свойства белковых суспензий Жироэмульги рующая и пенообразую щая способность Гидратация (водосвязывающая) способность Жиросвязыва ющая способность Гелеобразующая способность Вязко-эластично-упругие свойства

Растворимость – способность определенных веществ или их функциональных групп переходить в раствор. Характеризуется коэффициентами КРА и КДБ. Факторы, влияющие на растворимость белков: 1. Гидрофобные связи Средняя гидрофобность - энергия стабилизации, приходящаяся на одну неполярную боковую группу при связывании ее внутри глобулы белковой молекулы. Относительная гидрофобность - степень гидрофобного взаимодействия неполярных остатков аминокислот, расположенных на поверхности глобул. 2. р. Н среды 3. Концентрации солей 4. Наличие водородных и электростатических связей

Значение растворимости белков: • Различия в растворимости белков пищевого сырья лежат в основе технологических процессов выделения изолятов и концентратов. • Роль в формировании реологических свойств пищевых продуктов, в производстве которых предусмотрен их гидролиз (автолиз) и денатурация (начальные технологические стадии, сушка и хранение). • Влияет на степень переваримости белков в ЖКТ. • Роль в производстве напитков, хлебных, кондитерских изделий.

Свойства белковых суспензий: ВОДОСВЯЗЫВАЮЩАЯ способность характеризуется адсорбцией воды при участии гидрофильных остатков аминокислот Определяется как количество (в граммах) воды, связанных с 1 граммом белка, когда сухой порошок белка находится в равновесии с водяным паром при 90 -95% относительной влажности.

ЖИРОСВЯЗЫВАЮЩАЯ способность характеризуется адсорбцией жира за счет гидрофобных остатков Определяется как количество (в граммах) липидов, связанных с 1 граммом белка.

Факторы, влияющие на водо- и жиросвязывающую способность: • Особенности аминокислотного состава и структуры белков • Фракционный состав белков • Способ обработки (степень денатурации) • р. Н среды • Температура • Присутствия углеводов, липидов и других белков, солей.

РОЛЬ ВОДОСВЯЗЫВАЮЩЕЙ И ЖИРОСВЯЗЫВАЮЩЕЙ СПОСОБНОСТИ: • повышают выход изделий, • удлиняют сроки хранения, • улучшают текстуру.

Жироэмульгирующая и пенообразующая способность Присутствие в одной белковой цепи гидрофобных и гидрофильных группировок обеспечивает распределение молекул определенным образом на границе раздела фаз вода—масло и вода—газ. Эмульсии (прямые и обратные) – дисперстные системы из разных жидких фаз. Жироэмульгирующая способность определяется в мл масла, которое может быть эмульсифицировано 1 граммом белка до изменения фаз эмульсии (перехода из прямой в обратную). Изменение фаз констатируется изменением вязкости и цвета.

Жироэмульгирующие свойства характеризуются: • Эмульгирующей способностью – минимальное количество белка при котором возможно образование эмульсий. • Эмульгирующей емкостью - измеряется объемом эмульсии, отнесенным к массе белка. • Стабильностью эмульсии - измеряется периодом ее полураспада (временем, необходимым для разрушения половины объема пены).

• Пены - дисперсные системы с газообразной фазой с одной стороны и жидкой или твердой средой с другой. Пенообразующие свойства белков характеризуются: • пенообразующей способностью измеряется объемом пены, отнесенным к массе белка • стабильностью пены - измеряется периодом ее полураспада, то есть временем, необходимым для разрушения половины объема пены.

Факторы, влияющие на жироэмульгирующие и пенообразующие свойства: • р. Н среды, концентрации белка, солей, температуры, присутствия липидов, сахарозы, пищевых волокон, фракционного состава и строения белков.

РОЛЬ ПЕНООБРАЗУЮЩЕЙ СПОСОБНОСТИ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ: 1. Роль жироэмульгирующих свойств в формировании структуры хлебобулочных, мучных кондитерских изделий, низкокалорийных маргаринов, майонезов, паст, мясных продуктов. 2. Пенообразующие свойства являются основой производства сбивных кондитерских изделий (бисквитов, десертов, кремов и т. д. ). 3. Способность белковых суспензий к сцеплению с поверхностями металла, пластмасс, картона, бумаги (адгезия) важна в процессах транспортировки, обработки, формования и упаковки тестовых, творожных, сырных, конфетных масс, мясных и рыбных фаршей и т. д.

Гелеобразующие свойства белков характеризуются способностью их коллоидного раствора из свободно диспергированного состояния переходить в связнодисперсное (с образованием систем, обладающих свойствами твердых тел). Факторы, определяющие свойства: минимальная концентрация белка, при котором наступает гелеобразование, р. Н среды, присутствие других белков, солей, полисахаридов. • Виды гелей: наполненные, смешанные, комплексные, анизотропные гели и ксерогели. • Факторы, влияющие на свойства: • Размер, форма молекул, водосвязывающая способность, пенообразующие и эмульгирующие свойства.

Вязко-эластично-упругие свойства • Вязкость – свойства текучих тел (суспензий) оказывать сопротивление перемещению одной части их относительно другой. • Эластичность – определяется как упругость, растяжимость, вместе с тем способность сокращаться, нежность, гибкость, мягкость. • Упругость – свойство материала под действием напряжений обратимо деформироваться.

Вопрос 4. МЕТОДЫ РЕГУЛИРОВАНИЯ ФУНКЦИОНАЛЬНЫХ СВОЙСТВ 1. Физико-химические - перевод белков перед сушкой в раствор кислот, щелочей, оснований с целью изменения заряда или ионного состава, тепловая денатурация и т. д. 2. Ферментативные. Ферментативное изменение функциональных свойств белков осуществляется с использованием ферментов.

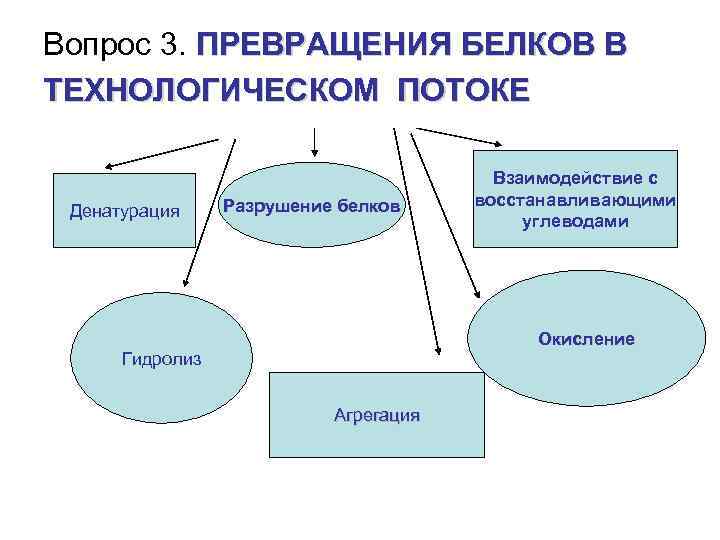
Вопрос 3. ПРЕВРАЩЕНИЯ БЕЛКОВ В ТЕХНОЛОГИЧЕСКОМ ПОТОКЕ Денатурация Разрушение белков Взаимодействие с восстанавливающими углеводами Окисление Гидролиз Агрегация

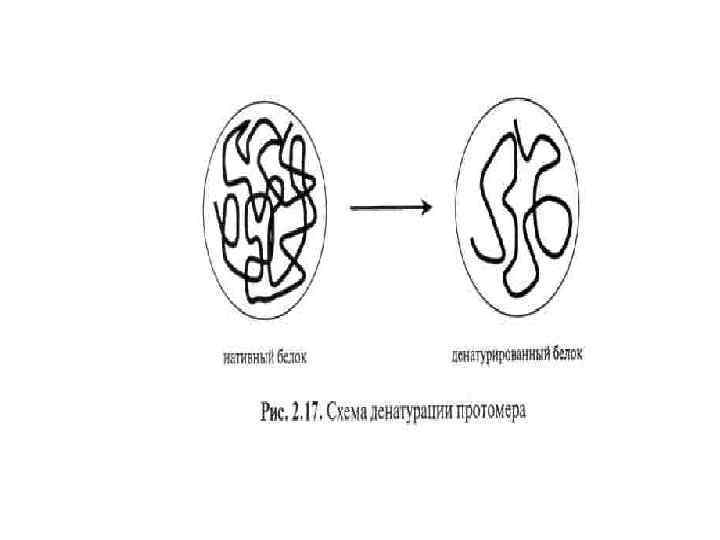
Денатурация - разупорядочение конформации полипептидной цепи без изменения первичной структуры, сопровождающееся потерей биологической активности. • Степень денатурации зависит от влажности, солевого состава, присутствия небелковых соединений. Большая часть денатурирует при 60 -80 С, однако встречаются и термостабильные, например, лактоглобулин молока и -амилаза некоторых бактерий. Факторы, приводящие к денатурации белка: сильные минеральные кислоты или щелочи; нагревание; охлаждение; обработка ПАВ (додецилсульфатом) и мочевиной; тяжелыми металлами (Ag, Pb, Hg); органическими растворителями (этанолом, метанолом, ацетоном). Например, температура денатурации белков сои и подсолнечника понижается в присутствии кислот жирного ряда, в кислой и влажной среде и повышается в присутствии углеводов - сахарозы и крахмала. 1.

Денатурированные белки менее растворимы в воде, т. к. их полипептидные цепи сильно переплетены между собой, что затрудняет доступ молекул растворителя к радикалам остатков аминокислот. Повышенная устойчивость белков к нагреванию обуславливается наличием в их составе большого количества дисульфидных связей. РОЛЬ: • Основной физико-химический процесс при выпечке, стерилизации, пастеризации. • Денатурация ускоряет процесс переваривания белков в ЖКТ (облегчает доступ к ним протеолитических ферментов). • Обуславливливает потребительские свойства пищевых продуктов (текстуру, внешний вид, органолептические свойства).

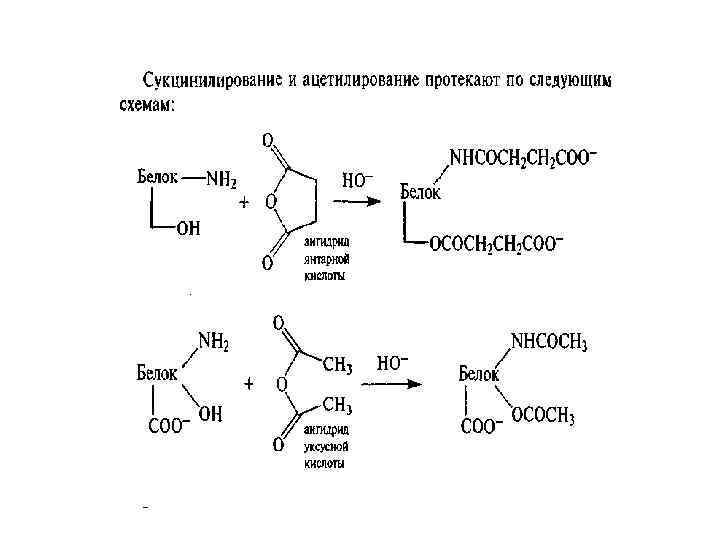
2. Разрушение белков при температуре 100 -1200 С, сопровождающееся отрывом функциональных групп, расщеплением пептидных связей и образованием сероводорода, аммиака, углекислого газа, сложных соединений небелковой природы. Например: • А) в сильнощелочных средах и особенно при высоких температурах аргинин превращается в орнитин, цистеин в дегидроаланин с выделением сероводорода. Цитрулин в мочевину и аммиак; • Б) дезаминирование аспарагиновой и глутаминовой кислоты;

Дегидроаланин

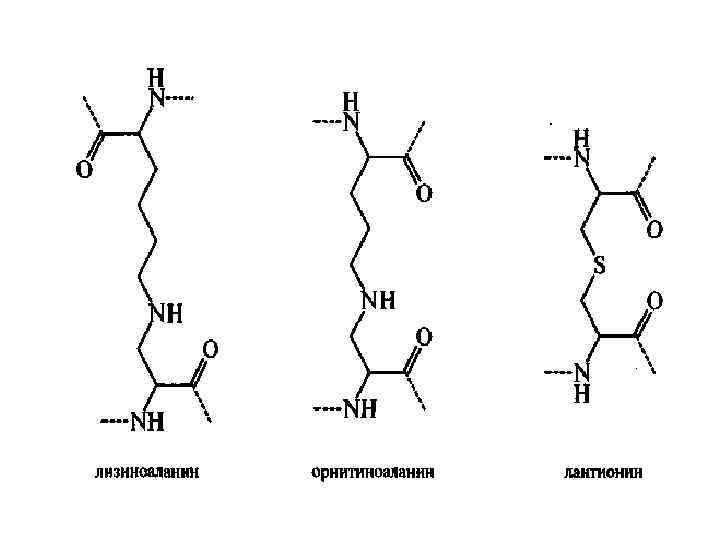
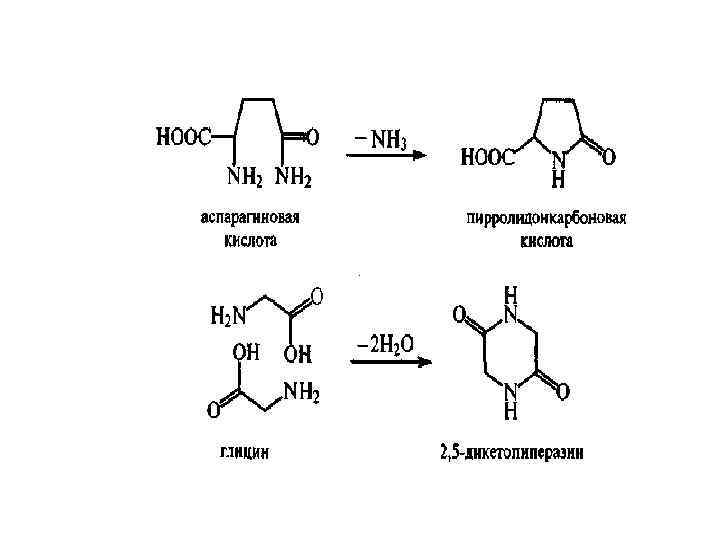
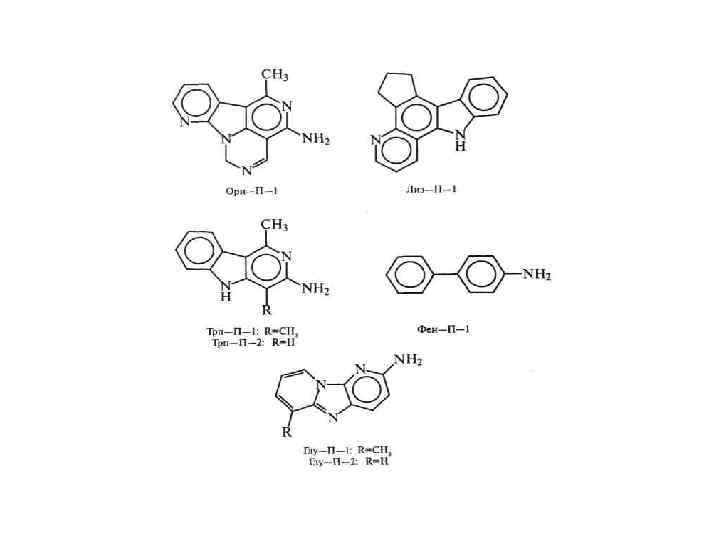
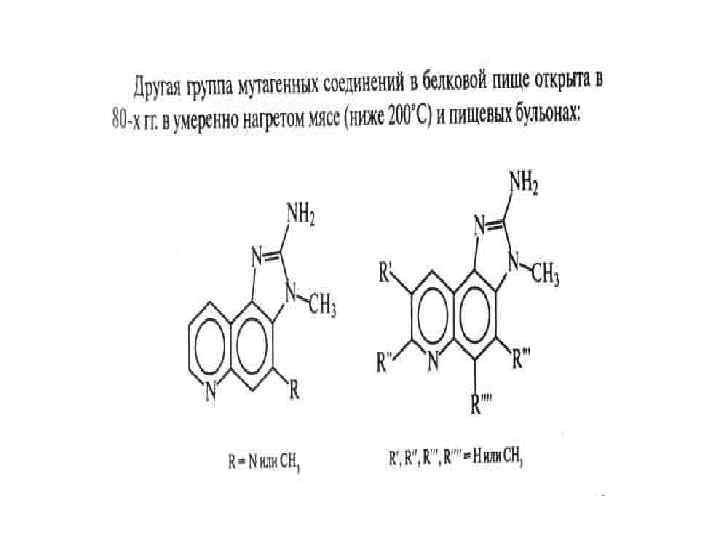
• В) дегидратация глицина с образованием 2, 5 дикетопиперазин; • Г) образование мутагенов; • Д) изомеризация аминокислот из L формы в D-форму. Разрушение белков приводит к снижению питательной ценности, снижению содержания лизина на 40%, треонина на 26%, валина на 24%. • D-форма аминокислот понижает усвояемость белков. • Некоторые аминокислоты могут вступать в реакцию конденсации. При этом питательная ценность белков с новыми поперечными связями ниже, чем у белков с нативной структурой. • Образование, например, лизиналанина стимулирует диарею, облысение и нефрокальциноз.

3. Взаимодействие с восстанавливающими углеводами с образованием темноокрашенных соединений меланоидинов Сущность реакции меланоидинообразования заключается в том, что при температуре от 4060 С до 100 С происходит взаимодействие аминогрупп белков с гликозидными гидроксилами восстанавливающих сахаров, сопровождающееся образованием карбонильных соединений и темноокрашенных продуктов меланоидинов.

4. Окисление. Связано с неблагоприятными условиями, усиливающими структурные перестройки: разрушение белковолипидных взаимодействий.

5. Механические, физические воздействия на белки. Агрегация – деструкция белковых молекул с разрывом дисульфидных и даже пептидных связей при механической и термической обработке сырья

ФАКТОРЫ, ВЛИЯЮЩИЕ НА АГРЕГАЦИЮ: • 1. Возрастает по мере увеличения подвижности полипептидов и уменьшения их молекулярной массы. • 2. Особенности аминокислотного состава. • 3. Количество водородных, гидрофобных, ионно-электростатических, дисульфидных связей. • 4. р. Н среды. • 5. Присутствие ПАВ. • 6. Дисульфидно-суфгидрильный обмен.

6. Гидролиз • Гидролиз белков наблюдается под воздействием протеолитических ферментов на стадии солодоращения, при брожении теста, при производстве кисломолочных продуктов. • Зависит скорость гидролиза от р. Н среды, температуры, активности ферментов, состава белков.

ВОПРОС 3. Определение белков. • МЕТОДЫ ОБНАРУЖЕНИЯ. • Присутствие белков можно определить по цветным реакциям • МЕТОДЫ ВЫДЕЛЕНИЯ БЕЛКОВ: • 1. Измельчение материала (гомогенизация), • 2. экстрагирование (выделение и очистка). • Методы очистки • А) от небелковых соединений и др белков • Б) Адсорбционная хроматография на различиях полярности белков. • В) Распределительная хроматография. • Г) ионообменная хроматогарфия. • Е) Гель-фильтрация. • Ж). Электрофоретические. • З) Изоэлектрическое фокусирование. • И) Иммуноэлектрофорез. • К) Ультрацентрифугирование. • Методы количественного определения: • По цветным реакциям (растворимые белки) и метод Кьельдаля.
функ свойства и превращ белков.ppt