Лекция 5 — 6 Перспективные



















Лекция-5-6-перспективные металлы.ppt
- Количество слайдов: 38
 Лекция 5 - 6 Перспективные металлы С помощью новых технологических методов можно создать металлы с такой кристаллической структурой, которая придаст им исключительно высокие прочность, жаростойкость и антикоррозионные Образец никель-алюминиевого суперсплава увеличен примерно в 140 тыс. раз
Лекция 5 - 6 Перспективные металлы С помощью новых технологических методов можно создать металлы с такой кристаллической структурой, которая придаст им исключительно высокие прочность, жаростойкость и антикоррозионные Образец никель-алюминиевого суперсплава увеличен примерно в 140 тыс. раз
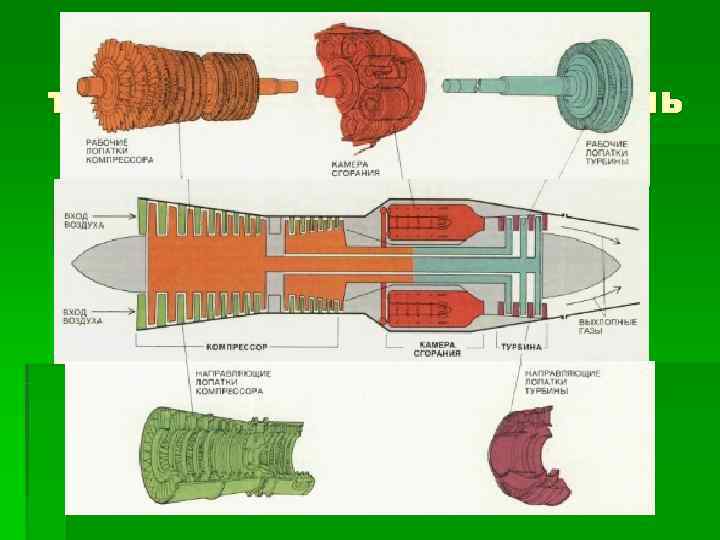
 Авиационный турбореактивный двигатель
Авиационный турбореактивный двигатель
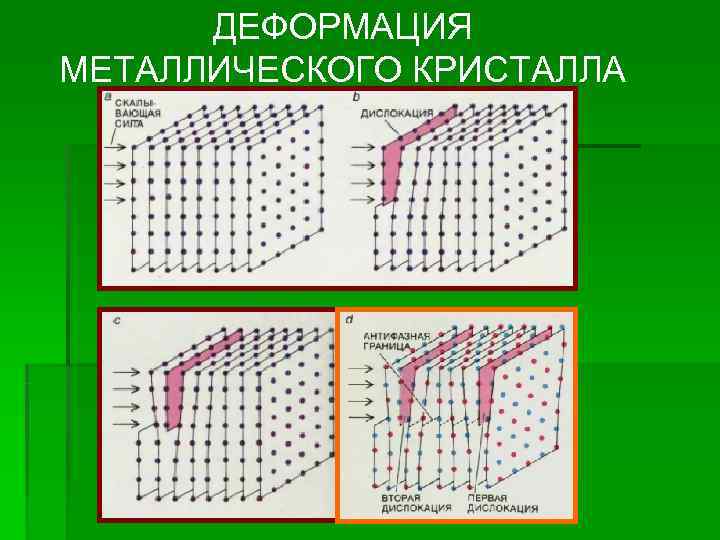
 ДЕФОРМАЦИЯ МЕТАЛЛИЧЕСКОГО КРИСТАЛЛА
ДЕФОРМАЦИЯ МЕТАЛЛИЧЕСКОГО КРИСТАЛЛА
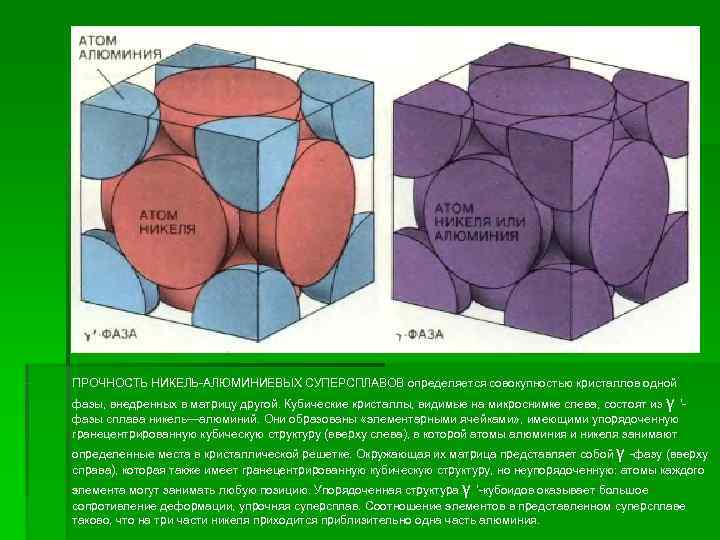
 ПРОЧНОСТЬ НИКЕЛЬ-АЛЮМИНИЕВЫХ СУПЕРСПЛАВОВ определяется совокупностью кристаллов одной фазы, внедренных в матрицу другой. Кубические кристаллы, видимые на микроснимке слева, состоят из γ '- фазы сплава никель—алюминий. Они образованы «элементарными ячейками» , имеющими упорядоченную гранецентрированную кубическую структуру (вверху слева), в которой атомы алюминия и никеля занимают определенные места в кристаллической решетке. Окружающая их матрица представляет собой γ -фазу (вверху справа), которая также имеет гранецентрированную кубическую структуру, но неупорядоченную: атомы каждого элемента могут занимать любую позицию. Упорядоченная структура γ '-кубоидов оказывает большое сопротивление деформации, упрочняя суперсплав. Соотношение элементов в представленном суперсплаве таково, что на три части никеля приходится приблизительно одна часть алюминия.
ПРОЧНОСТЬ НИКЕЛЬ-АЛЮМИНИЕВЫХ СУПЕРСПЛАВОВ определяется совокупностью кристаллов одной фазы, внедренных в матрицу другой. Кубические кристаллы, видимые на микроснимке слева, состоят из γ '- фазы сплава никель—алюминий. Они образованы «элементарными ячейками» , имеющими упорядоченную гранецентрированную кубическую структуру (вверху слева), в которой атомы алюминия и никеля занимают определенные места в кристаллической решетке. Окружающая их матрица представляет собой γ -фазу (вверху справа), которая также имеет гранецентрированную кубическую структуру, но неупорядоченную: атомы каждого элемента могут занимать любую позицию. Упорядоченная структура γ '-кубоидов оказывает большое сопротивление деформации, упрочняя суперсплав. Соотношение элементов в представленном суперсплаве таково, что на три части никеля приходится приблизительно одна часть алюминия.
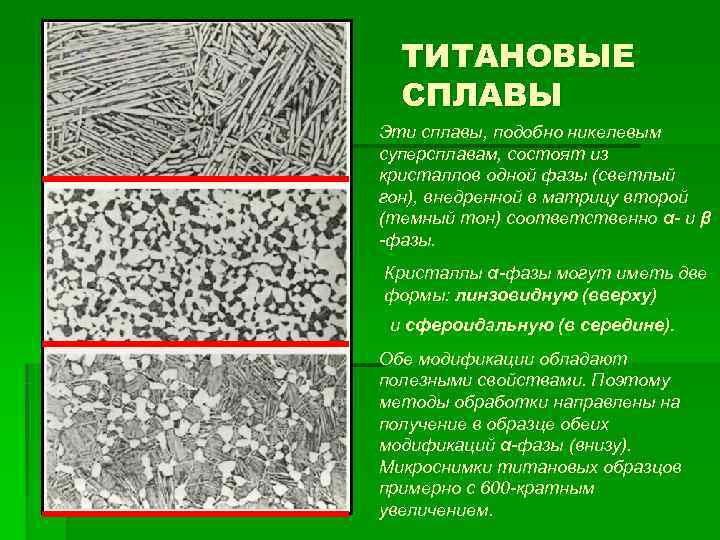
 ТИТАНОВЫЕ СПЛАВЫ Эти сплавы, подобно никелевым суперсплавам, состоят из кристаллов одной фазы (светлый гон), внедренной в матрицу второй (темный тон) соответственно α- и β -фазы. Кристаллы α-фазы могут иметь две формы: линзовидную (вверху) и сфероидальную (в середине). Обе модификации обладают полезными свойствами. Поэтому методы обработки направлены на получение в образце обеих модификаций α-фазы (внизу). Микроснимки титановых образцов примерно с 600 -кратным увеличением.
ТИТАНОВЫЕ СПЛАВЫ Эти сплавы, подобно никелевым суперсплавам, состоят из кристаллов одной фазы (светлый гон), внедренной в матрицу второй (темный тон) соответственно α- и β -фазы. Кристаллы α-фазы могут иметь две формы: линзовидную (вверху) и сфероидальную (в середине). Обе модификации обладают полезными свойствами. Поэтому методы обработки направлены на получение в образце обеих модификаций α-фазы (внизу). Микроснимки титановых образцов примерно с 600 -кратным увеличением.
 Способы кристаллизации
Способы кристаллизации
 Турбинные лопатки а b c
Турбинные лопатки а b c
 РАСПРЕДЕЛЕНИЕ НАПРЯЖЕНИЙ в гибком композите, состоящем из волнистых волокон, заключенных в эпоксидную матрицу, зафиксировано с помощью цветовых эффектов. Напряжение изменяет оптические свойства полимерной матрицы, приводя к возникновению цветных интерференционных картин в поляризованном свете. Как характерно для всех композитов, матрица, армированная волокнами, приобретает новые механические свойства. Легко деформируемый при низких напряжениях, композит становится намного жестче при высоких напряжениях, когда волокна полностью выпрямляются (деформируя края матрицы, на которых появляются зубцы).
РАСПРЕДЕЛЕНИЕ НАПРЯЖЕНИЙ в гибком композите, состоящем из волнистых волокон, заключенных в эпоксидную матрицу, зафиксировано с помощью цветовых эффектов. Напряжение изменяет оптические свойства полимерной матрицы, приводя к возникновению цветных интерференционных картин в поляризованном свете. Как характерно для всех композитов, матрица, армированная волокнами, приобретает новые механические свойства. Легко деформируемый при низких напряжениях, композит становится намного жестче при высоких напряжениях, когда волокна полностью выпрямляются (деформируя края матрицы, на которых появляются зубцы).
 БУДУЩЕЕ АВИАЦИОННЫХ МЕТАЛЛОВ ГЕОМЕТРИЮ АРМИРОВАНИЯ композитов можно классифицировать по форме упрочняющих включений: частицы, непрерывные волокна, короткие волокна (верхний ряд). Часто композит представляет собой слоистую структуру, в которой каждый слой армирован большим числом параллельных непрерывных волокон. Однако каждый слой можно армировать также непрерывными волокнами, сотканными в ткань определенного рисунка (средний ряд), которая представляет собой исходную форму, по ширине и длине соответствующую конечному материалу. Недавно разработанные геометрии армирования позволили отказаться от послойной сборки материала: волокна сплетают в трехмерные структуры (нижний ряд). В некоторых случаях уже на этой стадии можно задать форму изделию из композита.
БУДУЩЕЕ АВИАЦИОННЫХ МЕТАЛЛОВ ГЕОМЕТРИЮ АРМИРОВАНИЯ композитов можно классифицировать по форме упрочняющих включений: частицы, непрерывные волокна, короткие волокна (верхний ряд). Часто композит представляет собой слоистую структуру, в которой каждый слой армирован большим числом параллельных непрерывных волокон. Однако каждый слой можно армировать также непрерывными волокнами, сотканными в ткань определенного рисунка (средний ряд), которая представляет собой исходную форму, по ширине и длине соответствующую конечному материалу. Недавно разработанные геометрии армирования позволили отказаться от послойной сборки материала: волокна сплетают в трехмерные структуры (нижний ряд). В некоторых случаях уже на этой стадии можно задать форму изделию из композита.
 Если удается исключить примеси, обеспечить минимальное количество влаги (жаркий климат), равномерно распределить деформирующие усилия в изделии или снять отжигом неравномерность деформационных напряжений, то может получиться то, что получилось в Индии примерно более 1000 лет назад: во дворе минарета Кутуб – Минар (построен в 1200 г. ) стоит Делийская железная колонна и не подвергается коррозии.
Если удается исключить примеси, обеспечить минимальное количество влаги (жаркий климат), равномерно распределить деформирующие усилия в изделии или снять отжигом неравномерность деформационных напряжений, то может получиться то, что получилось в Индии примерно более 1000 лет назад: во дворе минарета Кутуб – Минар (построен в 1200 г. ) стоит Делийская железная колонна и не подвергается коррозии.
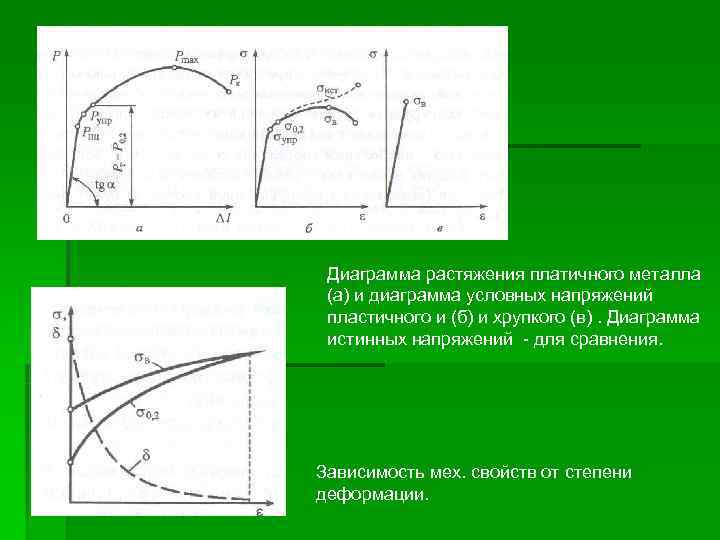
 Диаграмма растяжения платичного металла (а) и диаграмма условных напряжений пластичного и (б) и хрупкого (в). Диаграмма истинных напряжений - для сравнения. Зависимость мех. свойств от степени деформации.
Диаграмма растяжения платичного металла (а) и диаграмма условных напряжений пластичного и (б) и хрупкого (в). Диаграмма истинных напряжений - для сравнения. Зависимость мех. свойств от степени деформации.
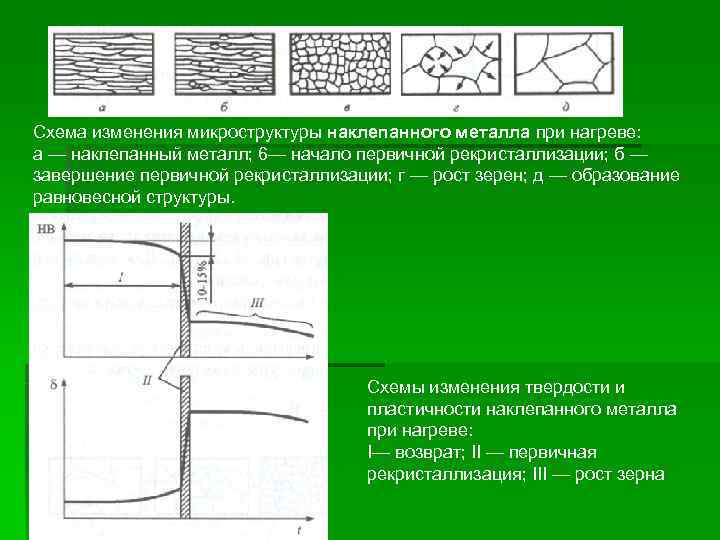
 Схема изменения микроструктуры наклепанного металла при нагреве: а — наклепанный металл; 6— начало первичной рекристаллизации; б — завершение первичной рекристаллизации; г — рост зерен; д — образование равновесной структуры. Схемы изменения твердости и пластичности наклепанного металла при нагреве: I— возврат; II — первичная рекристаллизация; III — рост зерна
Схема изменения микроструктуры наклепанного металла при нагреве: а — наклепанный металл; 6— начало первичной рекристаллизации; б — завершение первичной рекристаллизации; г — рост зерен; д — образование равновесной структуры. Схемы изменения твердости и пластичности наклепанного металла при нагреве: I— возврат; II — первичная рекристаллизация; III — рост зерна
 Элементы термодинамики § I начало термодинамики может быть сформулировано так: § ТЕПЛОТА (Q), ПОДВОДИМАЯ К СИСТЕМЕ, РАСХОДУЕТСЯ НА ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ (Δ) И СОВЕРШЕНИЕ РАБОТЫ (А): Q = ΔU + А. Внутренняя энергия (U) - СОВОКУПНОСТЬ ЭНЕРГИЙ КОЛЕБАТЕЛЬНЫХ ПРОЦЕССОВ ВСЕХ ЧАCТИЦ, ОБРАЗУЮЩИХ ВЕЩЕСТВО.
Элементы термодинамики § I начало термодинамики может быть сформулировано так: § ТЕПЛОТА (Q), ПОДВОДИМАЯ К СИСТЕМЕ, РАСХОДУЕТСЯ НА ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ (Δ) И СОВЕРШЕНИЕ РАБОТЫ (А): Q = ΔU + А. Внутренняя энергия (U) - СОВОКУПНОСТЬ ЭНЕРГИЙ КОЛЕБАТЕЛЬНЫХ ПРОЦЕССОВ ВСЕХ ЧАCТИЦ, ОБРАЗУЮЩИХ ВЕЩЕСТВО.
 Расчёты, производимые в термодинамике, предполагают из трёх наиболее важных характеристик системы ( давление, объём, температура ) постоянство одного: при постоянном объёме - изохорные , при постоянном давлении - изобарные и при постоянной температуре - изотермические. Известно, что работа оценивается как А= РΔ V. Если V = const (!), то А = 0 , т. е. изменение внутренней энергии системы связано с получением или отдачей тепла, и, наоборот, при подведении энергии в систему с V = const работа системой не совершается (QV = ΔU + А (= 0)). Для Р = const (изобарный процесс): из физики известно, что работа – это А = РΔV, А = Р(V 2 ––V 1), тогда ΔU = QP - А или U 2 -U 1 = QР - Р(V 2 - VI) , решая относительно QP = (U 2 + + РV 2) - ( U 1 + РV 1). Сумма ( U + Р V ) в термодинамике при постоянном ( Р= con давлении называется ЭНТАЛЬПИЯ , обозначается через Н и определяет теплосодержание системы , тогда Q р = Н 2 – H 1 или ΔН , где ΔН = Δ U + РΔ V. Энтальпия - одна из функций состояния вещества (системы). Она зависит только от начального и конечного состояний системы (вещества).
Расчёты, производимые в термодинамике, предполагают из трёх наиболее важных характеристик системы ( давление, объём, температура ) постоянство одного: при постоянном объёме - изохорные , при постоянном давлении - изобарные и при постоянной температуре - изотермические. Известно, что работа оценивается как А= РΔ V. Если V = const (!), то А = 0 , т. е. изменение внутренней энергии системы связано с получением или отдачей тепла, и, наоборот, при подведении энергии в систему с V = const работа системой не совершается (QV = ΔU + А (= 0)). Для Р = const (изобарный процесс): из физики известно, что работа – это А = РΔV, А = Р(V 2 ––V 1), тогда ΔU = QP - А или U 2 -U 1 = QР - Р(V 2 - VI) , решая относительно QP = (U 2 + + РV 2) - ( U 1 + РV 1). Сумма ( U + Р V ) в термодинамике при постоянном ( Р= con давлении называется ЭНТАЛЬПИЯ , обозначается через Н и определяет теплосодержание системы , тогда Q р = Н 2 – H 1 или ΔН , где ΔН = Δ U + РΔ V. Энтальпия - одна из функций состояния вещества (системы). Она зависит только от начального и конечного состояний системы (вещества).
 W = 10 S ; lg. W = lg 10 S ; S = lg. W Л. Больцман Д. У. Гиббс (1844 – 1906) (1839 – 1903) Гиббс ввел понятие "свободная энергия". Эта величина по решению Международного союза чистой и прикладной химии (IUPAC) называется "энергия Гиббса". Определяется по формуле G = Н - ТS. Необходимость введения этого понятия была обусловлена тем, что измерить изменение величины свободной энергии легче, чем измерить изменение энтропии: ΔG = ΔН - ТΔS (Гиббс предложил эту формулу в 1876 г. ).
W = 10 S ; lg. W = lg 10 S ; S = lg. W Л. Больцман Д. У. Гиббс (1844 – 1906) (1839 – 1903) Гиббс ввел понятие "свободная энергия". Эта величина по решению Международного союза чистой и прикладной химии (IUPAC) называется "энергия Гиббса". Определяется по формуле G = Н - ТS. Необходимость введения этого понятия была обусловлена тем, что измерить изменение величины свободной энергии легче, чем измерить изменение энтропии: ΔG = ΔН - ТΔS (Гиббс предложил эту формулу в 1876 г. ).
 Элементы термодинамики § II ЗАКОН ИЛИ ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ (S) § II закон утверждает, что природные и технологические процессы самопроизвольно могут протекать только в одном направлении, стремясь к состоянию равновесия. При этом тепло идёт от горячего тела к холодному. Газы самопроизвольно при нагревании расширяются. Кусок сахара равномерно распространяется молекулами сахарозы по всему объёму воды (чая). Единой, унифицированной формулировки II закона нет. Их несколько: § теплота не может сама переходить от холодного к горячему телу, не оставляя изменений в окружающей среде; § теплота стремится рассеяться, т. е. теплоту нельзя полностью превратить в работу.
Элементы термодинамики § II ЗАКОН ИЛИ ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ (S) § II закон утверждает, что природные и технологические процессы самопроизвольно могут протекать только в одном направлении, стремясь к состоянию равновесия. При этом тепло идёт от горячего тела к холодному. Газы самопроизвольно при нагревании расширяются. Кусок сахара равномерно распространяется молекулами сахарозы по всему объёму воды (чая). Единой, унифицированной формулировки II закона нет. Их несколько: § теплота не может сама переходить от холодного к горячему телу, не оставляя изменений в окружающей среде; § теплота стремится рассеяться, т. е. теплоту нельзя полностью превратить в работу.
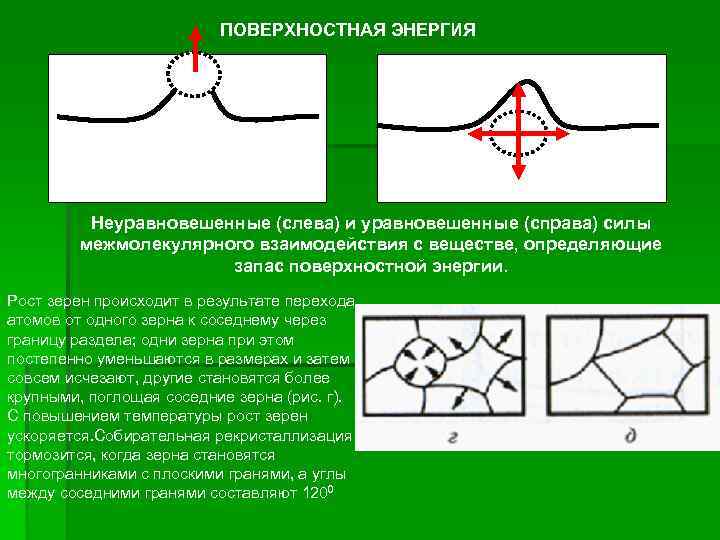
 ПОВЕРХНОСТНАЯ ЭНЕРГИЯ Неуравновешенные (слева) и уравновешенные (справа) силы межмолекулярного взаимодействия с веществе, определяющие запас поверхностной энергии. Рост зерен происходит в результате перехода атомов от одного зерна к соседнему через границу раздела; одни зерна при этом постепенно уменьшаются в размерах и затем совсем исчезают, другие становятся более крупными, поглощая соседние зерна (рис. г). С повышением температуры рост зерен ускоряется. Собирательная рекристаллизация тормозится, когда зерна становятся многогранниками с плоскими гранями, а углы между соседними гранями составляют 1200
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ Неуравновешенные (слева) и уравновешенные (справа) силы межмолекулярного взаимодействия с веществе, определяющие запас поверхностной энергии. Рост зерен происходит в результате перехода атомов от одного зерна к соседнему через границу раздела; одни зерна при этом постепенно уменьшаются в размерах и затем совсем исчезают, другие становятся более крупными, поглощая соседние зерна (рис. г). С повышением температуры рост зерен ускоряется. Собирательная рекристаллизация тормозится, когда зерна становятся многогранниками с плоскими гранями, а углы между соседними гранями составляют 1200
 До следующей лекции
До следующей лекции
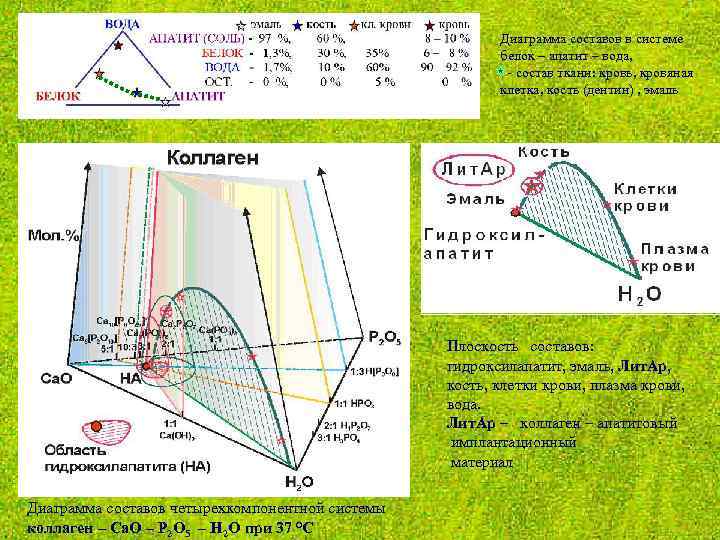
 Диаграмма составов в системе белок – апатит – вода, - состав ткани: кровь, кровяная клетка, кость (дентин) , эмаль Плоскость составов: гидроксилапатит, эмаль, Лит. Ар, кость, клетки крови, плазма крови, вода. Лит. Ар – коллаген – апатитовый имплантационный материал Диаграмма составов четырехкомпонентной системы коллаген – Са. О – P 2 O 5 – H 2 O при 37 °С
Диаграмма составов в системе белок – апатит – вода, - состав ткани: кровь, кровяная клетка, кость (дентин) , эмаль Плоскость составов: гидроксилапатит, эмаль, Лит. Ар, кость, клетки крови, плазма крови, вода. Лит. Ар – коллаген – апатитовый имплантационный материал Диаграмма составов четырехкомпонентной системы коллаген – Са. О – P 2 O 5 – H 2 O при 37 °С
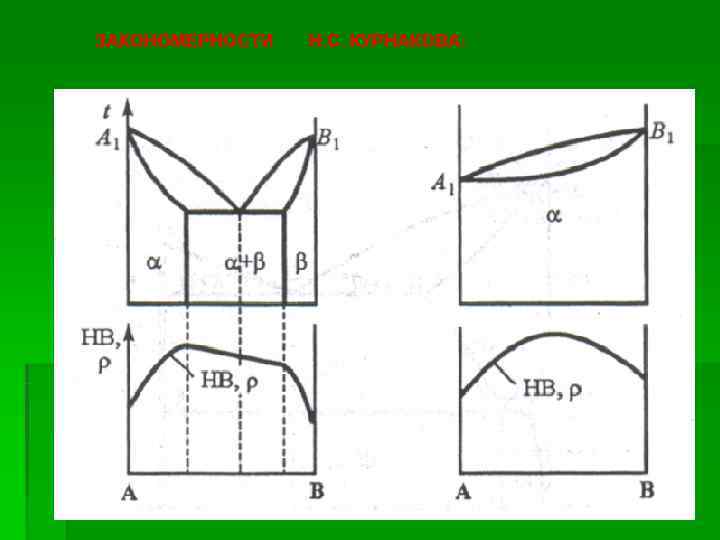
 Приведенные диаграммы состояния системы «СОСТАВ – СВОЙСТВО» представляют собой элементы большого раздела общей химии «Физико – химического анализа» , основоположником которого является выдающийся российский учёный Николой Семёнович Курнаков (1860 – 1941)
Приведенные диаграммы состояния системы «СОСТАВ – СВОЙСТВО» представляют собой элементы большого раздела общей химии «Физико – химического анализа» , основоположником которого является выдающийся российский учёный Николой Семёнович Курнаков (1860 – 1941)
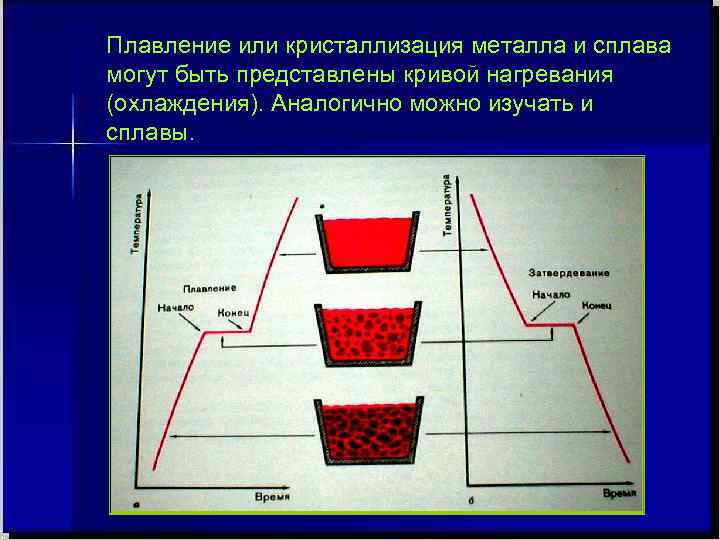
 Плавление или кристаллизация металла и сплава могут быть представлены кривой нагревания (охлаждения). Аналогично можно изучать и сплавы.
Плавление или кристаллизация металла и сплава могут быть представлены кривой нагревания (охлаждения). Аналогично можно изучать и сплавы.
 ЗАКОНОМЕРНОСТИ Н. С. КУРНАКОВА:
ЗАКОНОМЕРНОСТИ Н. С. КУРНАКОВА:
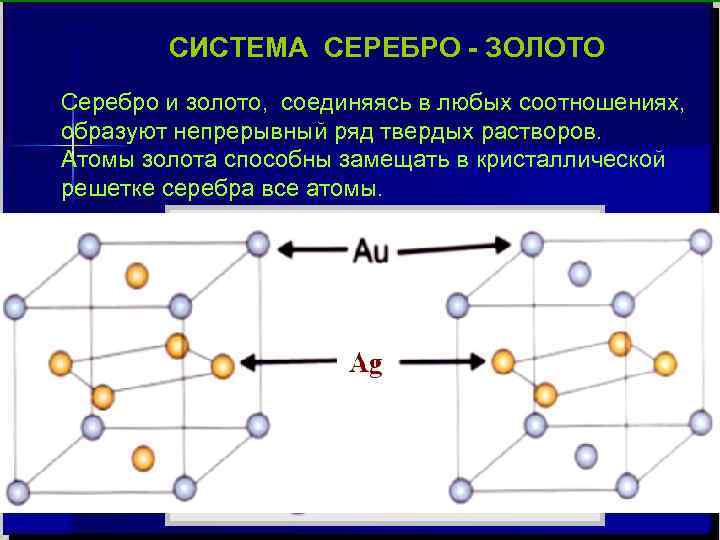
 СИСТЕМА СЕРЕБРО - ЗОЛОТО Серебро и золото, соединяясь в любых соотношениях, образуют непрерывный ряд твердых растворов. Атомы золота способны замещать в кристаллической решетке серебра все атомы.
СИСТЕМА СЕРЕБРО - ЗОЛОТО Серебро и золото, соединяясь в любых соотношениях, образуют непрерывный ряд твердых растворов. Атомы золота способны замещать в кристаллической решетке серебра все атомы.
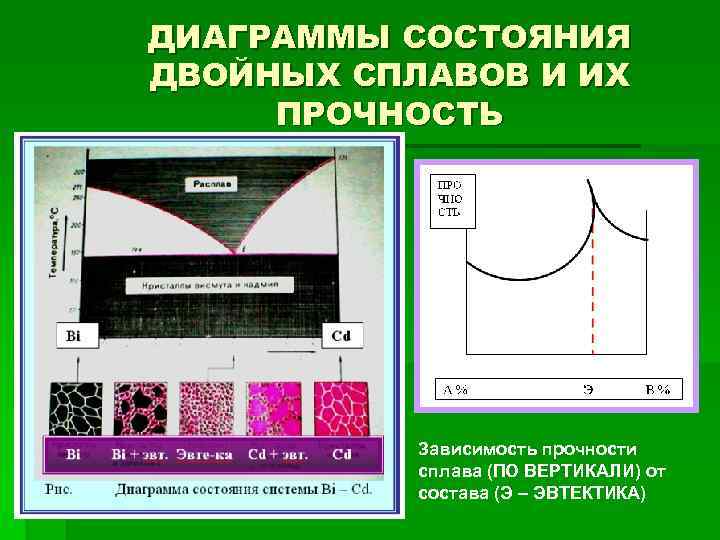
 СИСТЕМА ВИСМУТ - КАДМИЙ В случае, когда при кристаллизации каждый компонент формируется отдельно (т. е. в твердом состоянии кристаллы металлов располагаются рядом, появляется граница раздела фаз), область существования расплава ограничена ломаной линией, соединяющей точки плавления компонентов через некоторую точку «Е» (или «Э» ). В системе Bi – Cd она соответствует 60 % (мас. ) висмута и 40 % (мас. ) кадмия. Это единственный сплав, имеющий точки плавления ликвидуса и солидуса одинаковые + 146 0 С (температура плавления висмута +276 0 С, а кадмия +324 0 С). Этот сплавится как чистый металл, т. е. при определенной температуре. Он называется эвтектическим (от гр. ευτεκτοσ – легкоплавкий) и плавится при самой низкой температуре относительно других составов.
СИСТЕМА ВИСМУТ - КАДМИЙ В случае, когда при кристаллизации каждый компонент формируется отдельно (т. е. в твердом состоянии кристаллы металлов располагаются рядом, появляется граница раздела фаз), область существования расплава ограничена ломаной линией, соединяющей точки плавления компонентов через некоторую точку «Е» (или «Э» ). В системе Bi – Cd она соответствует 60 % (мас. ) висмута и 40 % (мас. ) кадмия. Это единственный сплав, имеющий точки плавления ликвидуса и солидуса одинаковые + 146 0 С (температура плавления висмута +276 0 С, а кадмия +324 0 С). Этот сплавится как чистый металл, т. е. при определенной температуре. Он называется эвтектическим (от гр. ευτεκτοσ – легкоплавкий) и плавится при самой низкой температуре относительно других составов.
 СИСТЕМА ВИСМУТ - КАДМИЙ Это происходит потому, что в эвтектических сплавах самые мелкие кристаллы, образуют достаточно однородную фазу, имитирующую поведение чистого металла, только при более низкой температуре*.
СИСТЕМА ВИСМУТ - КАДМИЙ Это происходит потому, что в эвтектических сплавах самые мелкие кристаллы, образуют достаточно однородную фазу, имитирующую поведение чистого металла, только при более низкой температуре*.
 СИСТЕМА ВИСМУТ - КАДМИЙ Равномерность распределения мелких частиц предполагает минимальные затраты энергии, поэтому понижается температура. Тогда как, в других случаях присутствие крупных частиц высокоплавкого компонента (в данном случае кадмия предполагает большие затраты энергии (что поднимает температуру плавления): они тем больше. Чем больше высокоплавкого компонента в смеси. Максимальная температура достигается, когда остается один высокоплавкий компонент. Его структура становится совершенной, искажения в ней за счёт присутствия второго компонента – нет, поэтому прочность химической связи между атомами кадмия максимальная. Это является причиной температуры плавления (в данной случае наиболее высокой), соответствующей плавлению чистого компонента (кадмия).
СИСТЕМА ВИСМУТ - КАДМИЙ Равномерность распределения мелких частиц предполагает минимальные затраты энергии, поэтому понижается температура. Тогда как, в других случаях присутствие крупных частиц высокоплавкого компонента (в данном случае кадмия предполагает большие затраты энергии (что поднимает температуру плавления): они тем больше. Чем больше высокоплавкого компонента в смеси. Максимальная температура достигается, когда остается один высокоплавкий компонент. Его структура становится совершенной, искажения в ней за счёт присутствия второго компонента – нет, поэтому прочность химической связи между атомами кадмия максимальная. Это является причиной температуры плавления (в данной случае наиболее высокой), соответствующей плавлению чистого компонента (кадмия).
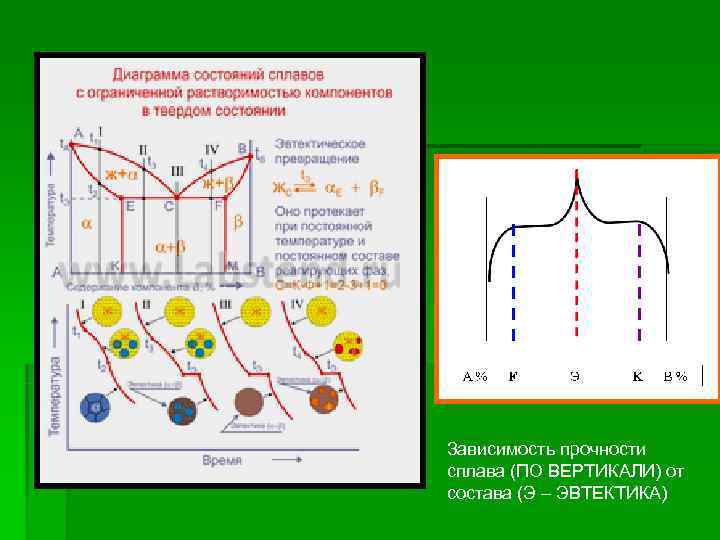
 ДИАГРАММЫ СОСТОЯНИЯ ДВОЙНЫХ СПЛАВОВ И ИХ ПРОЧНОСТЬ Зависимость прочности сплава (ПО ВЕРТИКАЛИ) от состава (Э – ЭВТЕКТИКА)
ДИАГРАММЫ СОСТОЯНИЯ ДВОЙНЫХ СПЛАВОВ И ИХ ПРОЧНОСТЬ Зависимость прочности сплава (ПО ВЕРТИКАЛИ) от состава (Э – ЭВТЕКТИКА)
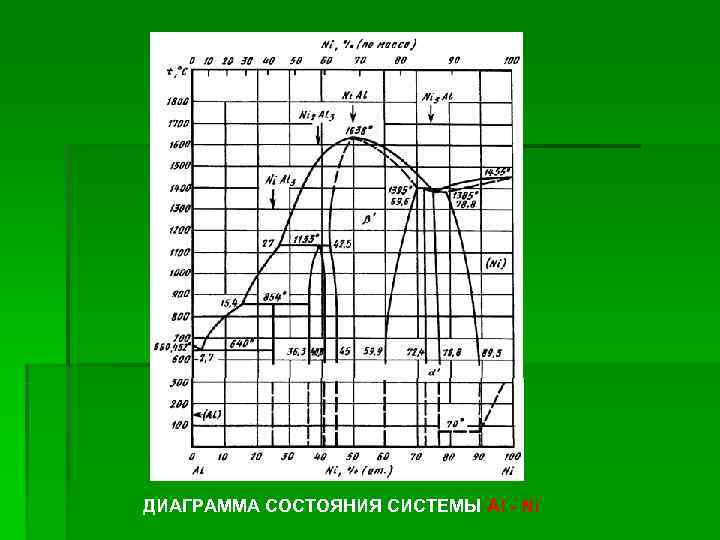
 ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ Al - Ni
ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ Al - Ni
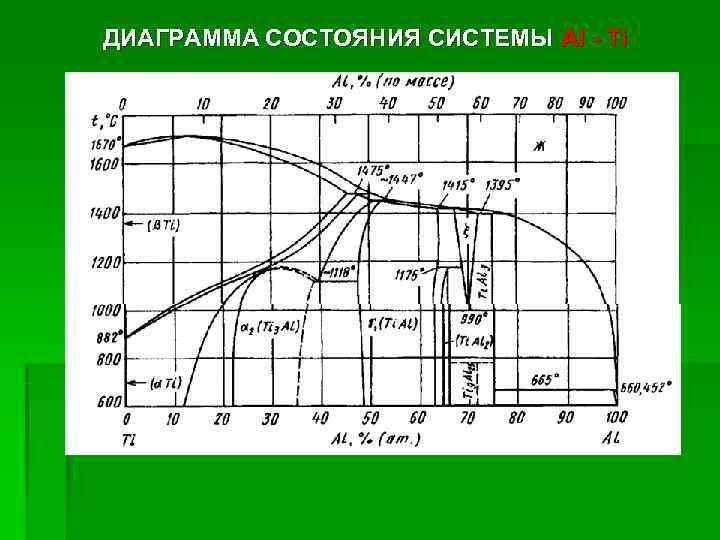
 ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ Al - Тi
ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ Al - Тi
 Зависимость прочности сплава (ПО ВЕРТИКАЛИ) от состава (Э – ЭВТЕКТИКА)
Зависимость прочности сплава (ПО ВЕРТИКАЛИ) от состава (Э – ЭВТЕКТИКА)
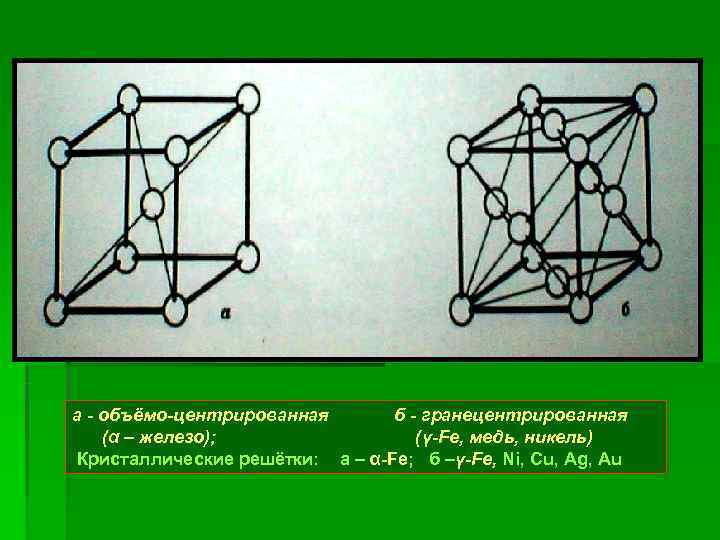
 a - объёмо-центрированная б - гранецентрированная (α – железо); (γ-Fe, медь, никель) Кристаллические решётки: а – α-Fe; б –γ-Fe, Ni, Cu, Ag, Au
a - объёмо-центрированная б - гранецентрированная (α – железо); (γ-Fe, медь, никель) Кристаллические решётки: а – α-Fe; б –γ-Fe, Ni, Cu, Ag, Au
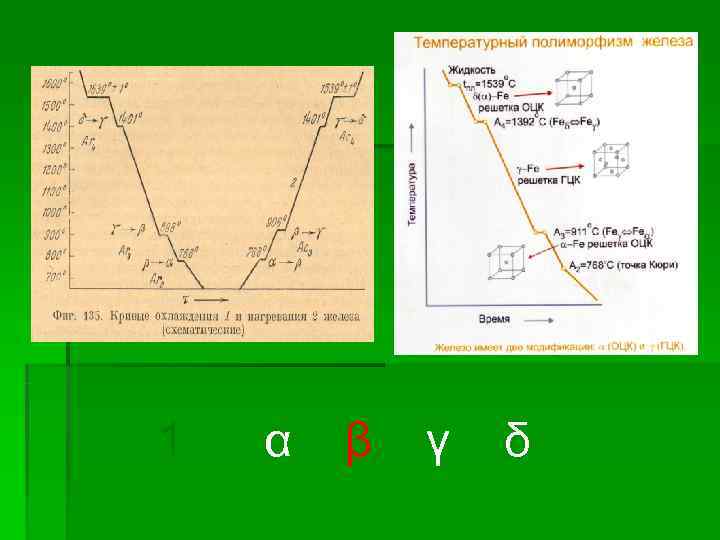
 1 α β γ δ
1 α β γ δ
 В. Роберт-Аустен в 1896 г: σ-Fe + C γ -Fe + C АУСТЕНИТ- ТВ. РАСТВОР ВНЕДРЕНИЯ УГЛЕРОДА В ГАММА-ЖЕЛЕЗЕ
В. Роберт-Аустен в 1896 г: σ-Fe + C γ -Fe + C АУСТЕНИТ- ТВ. РАСТВОР ВНЕДРЕНИЯ УГЛЕРОДА В ГАММА-ЖЕЛЕЗЕ
 ОСНОВНЫЕ ФАЗЫ СИСТЕМЫ Fe-C : § Жидкость (раствор углерода в железе) § Аустенит (тв. р-р углерода в γ-железе) § Феррит (тв. р-р углерода в α-железе) § Цементит (соединение Fe 3 C ) § Ледебурит (эвтектика аустенит + цементит) § Перлит (эвтектоид феррит + цементит) § Мартенсит (быстро закалённая сталь) § Сорбит (смесь фаз: феррит + цементит) – продукт повторного нагревания мартенсита до 200 – 300 0 С, имеет более грубые кристаллы, чем у перлита
ОСНОВНЫЕ ФАЗЫ СИСТЕМЫ Fe-C : § Жидкость (раствор углерода в железе) § Аустенит (тв. р-р углерода в γ-железе) § Феррит (тв. р-р углерода в α-железе) § Цементит (соединение Fe 3 C ) § Ледебурит (эвтектика аустенит + цементит) § Перлит (эвтектоид феррит + цементит) § Мартенсит (быстро закалённая сталь) § Сорбит (смесь фаз: феррит + цементит) – продукт повторного нагревания мартенсита до 200 – 300 0 С, имеет более грубые кристаллы, чем у перлита
 Эвтектическая смесь аустенита и цементита называется ледебуритом (4, 3% С). Эвтектоидная смесь феррита и цементита — перлитом (0, 81% С). Ледебур А. (1837 – 1906) – предложил первые теории закалки стали, металлург, учёный (Фрейбург, Германия)
Эвтектическая смесь аустенита и цементита называется ледебуритом (4, 3% С). Эвтектоидная смесь феррита и цементита — перлитом (0, 81% С). Ледебур А. (1837 – 1906) – предложил первые теории закалки стали, металлург, учёный (Фрейбург, Германия)
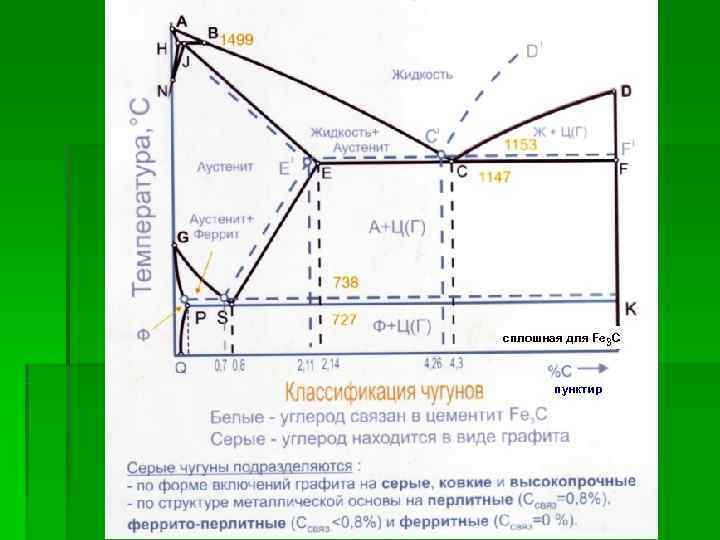
 сплошная для Fe 3 C пунктир
сплошная для Fe 3 C пунктир
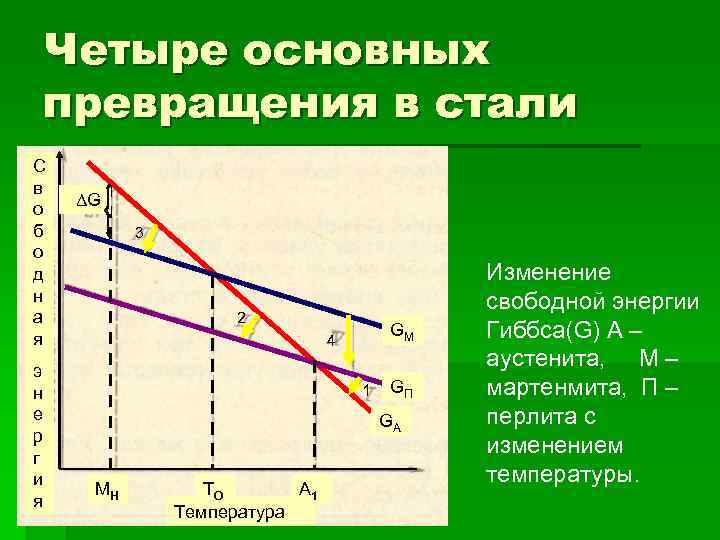
 Четыре основных превращения в стали С в ΔG о б 3 о д Изменение н свободной энергии а 2 я 4 GМ Гиббса(G) А – э аустенита, М – н 1 GП мартенмита, П – е GА перлита с р г изменением и температуры. МН ТО А 1 я Температура
Четыре основных превращения в стали С в ΔG о б 3 о д Изменение н свободной энергии а 2 я 4 GМ Гиббса(G) А – э аустенита, М – н 1 GП мартенмита, П – е GА перлита с р г изменением и температуры. МН ТО А 1 я Температура
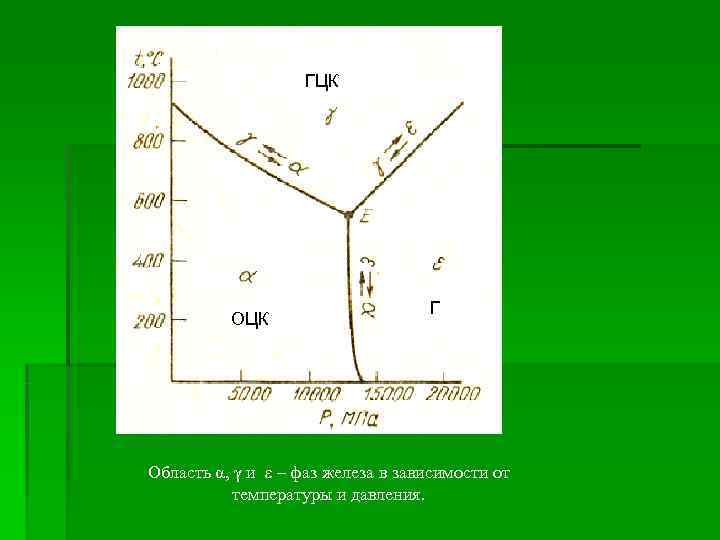
 ГЦК Г ОЦК Область α, γ и ε – фаз железа в зависимости от температуры и давления.
ГЦК Г ОЦК Область α, γ и ε – фаз железа в зависимости от температуры и давления.

