 Лекция 4. Тема № 5 Химия s, p -элементов
Лекция 4. Тема № 5 Химия s, p -элементов
 Учебные вопросы 1. Водород l 2. Щелочные и щелочноземельные металлы l 3. р - элементы 7 группы Периодической системы элементов. Галогены l
Учебные вопросы 1. Водород l 2. Щелочные и щелочноземельные металлы l 3. р - элементы 7 группы Периодической системы элементов. Галогены l

 Водород 1766 г - Г. Кавендиш установил природу Н 2 ; 1783 г. Лавуазье причислил к элементам и назвал. Кларк Н - 1% В природе встречается в виде 2 изотопов: l 1 Н - протия (99, 8%) l 2 Н ( 2 D ) - дейтерия (0, 02%)
Водород 1766 г - Г. Кавендиш установил природу Н 2 ; 1783 г. Лавуазье причислил к элементам и назвал. Кларк Н - 1% В природе встречается в виде 2 изотопов: l 1 Н - протия (99, 8%) l 2 Н ( 2 D ) - дейтерия (0, 02%)
 l Третий изотоп - 3 Н ( Т ) - тритий постоянно образуется в верхних слоях атмосферы под действием нейтронов космических лучей на атомы N и других газов. Бетарадиоактивен, период полураспада Т 1/2 = 12, 26 года. 3 Т= 3 He + бета-частицы 1 2
l Третий изотоп - 3 Н ( Т ) - тритий постоянно образуется в верхних слоях атмосферы под действием нейтронов космических лучей на атомы N и других газов. Бетарадиоактивен, период полураспада Т 1/2 = 12, 26 года. 3 Т= 3 He + бета-частицы 1 2
 Физико-химические свойства Н 2 - бесцветный газ, без вкуса и запаха т. пл. - 259 о. С т. кип. - 252, 8 о. С Ведет себя как идеальный газ l 1. Взаимодействует с кислородом 2 Н 2 + О 2 = 2 Н 2 О l
Физико-химические свойства Н 2 - бесцветный газ, без вкуса и запаха т. пл. - 259 о. С т. кип. - 252, 8 о. С Ведет себя как идеальный газ l 1. Взаимодействует с кислородом 2 Н 2 + О 2 = 2 Н 2 О l
 2. с галогенами Н 2 + F 2 = 2 HF (со взрывом) H 2 + Cl 2 = 2 HCl l 3. С серой и селеном - только при нагревании с образованием Н 2 S и H 2 Se l С С, N 2, Si - только в присутствии катализаторов. l
2. с галогенами Н 2 + F 2 = 2 HF (со взрывом) H 2 + Cl 2 = 2 HCl l 3. С серой и селеном - только при нагревании с образованием Н 2 S и H 2 Se l С С, N 2, Si - только в присутствии катализаторов. l
 l 4. С металлами образует гидриды (со щелочными, щелочноземельными, лантаноидами и некоторыми dэлементами) 2 К +Н 2 = 2 КН Н 2 - активный восстановитель.
l 4. С металлами образует гидриды (со щелочными, щелочноземельными, лантаноидами и некоторыми dэлементами) 2 К +Н 2 = 2 КН Н 2 - активный восстановитель.
 В обычных условиях восстанавливает только металлы с Е > +0, 7 B (Hg, Ag, Pd, Au): 2 Ag. NO 3(p) + H 2(г) = 2 Ag(к) + 2 HNO 3(p) Pd. O(к) + Н 2(г) = Pd(к) + H 2 O(ж) l
В обычных условиях восстанавливает только металлы с Е > +0, 7 B (Hg, Ag, Pd, Au): 2 Ag. NO 3(p) + H 2(г) = 2 Ag(к) + 2 HNO 3(p) Pd. O(к) + Н 2(г) = Pd(к) + H 2 O(ж) l
 l. В промышленности при высоких температурах Н 2 применяется для восстановления более активных металлов: Ge. O 2 + 2 H 2 = Ge + 2 H 2 O WO 3 + 3 H 2 = W + 3 H 2 O
l. В промышленности при высоких температурах Н 2 применяется для восстановления более активных металлов: Ge. O 2 + 2 H 2 = Ge + 2 H 2 O WO 3 + 3 H 2 = W + 3 H 2 O
 Получение Н 2 Основной промышленный метод переработка природного газа СН 4(г)+2 Н 2 О = 4 Н 2↑+ СО 2↑ Наиболее чистый водород получают электрохимическим разложением воды (в присутствии ОН-): l катод(-): 2 Н 2 О + 2 е- = Н 2↑ + 2 ОНl анод(+): 2 ОН- - 2 е- = 0, 5 О 2 + Н 2 О l
Получение Н 2 Основной промышленный метод переработка природного газа СН 4(г)+2 Н 2 О = 4 Н 2↑+ СО 2↑ Наиболее чистый водород получают электрохимическим разложением воды (в присутствии ОН-): l катод(-): 2 Н 2 О + 2 е- = Н 2↑ + 2 ОНl анод(+): 2 ОН- - 2 е- = 0, 5 О 2 + Н 2 О l
 l. В лабораторных условиях Н 2 получают из кислот: Zn +2 HCl = H 2↑ + Zn. Cl 2 или из гидрида Ti: Ti. H 2 = Н 2↑ + Ti
l. В лабораторных условиях Н 2 получают из кислот: Zn +2 HCl = H 2↑ + Zn. Cl 2 или из гидрида Ti: Ti. H 2 = Н 2↑ + Ti
 2 уч. в. Щелочные металлы l Li Na K Rb Cs Fr От Li к Fr – 1) усиление металлических свойств; 2) усиление восстановительных свойств; 3) уменьшение энергии ионизации I. 4) усиление основных свойств гидроксидов
2 уч. в. Щелочные металлы l Li Na K Rb Cs Fr От Li к Fr – 1) усиление металлических свойств; 2) усиление восстановительных свойств; 3) уменьшение энергии ионизации I. 4) усиление основных свойств гидроксидов
 Химические свойства: l а) взаимодействие с водородом: 2 Li + H 2 → 2 Li. H гидрид лития сильный восстановитель 2 Li. H + 2 H 2 O → 2 Li. OH + Н 2↑ Используется для наполнения воздушных шаров, дирижаблей, надувных лодок с условиях ЧС (из 0, 5 кг Li. H получают 650 л Н 2↑)
Химические свойства: l а) взаимодействие с водородом: 2 Li + H 2 → 2 Li. H гидрид лития сильный восстановитель 2 Li. H + 2 H 2 O → 2 Li. OH + Н 2↑ Используется для наполнения воздушных шаров, дирижаблей, надувных лодок с условиях ЧС (из 0, 5 кг Li. H получают 650 л Н 2↑)
 l б) взаимодействие с кислородом: 4 Li + O 2 → 2 Li 2 O – оксид лития 2 Na + O 2 → Na 2 O 2 – пероксид натрия К + О 2 → КО 2 – супероксид калия Na 2 O 2 и КО 2 – сильные окислители Na 2 O 2 + СO 2 → 2 Na 2 СO 3 + O 2 ↑ (изолирующие противогазы, акваланги, подлодки)
l б) взаимодействие с кислородом: 4 Li + O 2 → 2 Li 2 O – оксид лития 2 Na + O 2 → Na 2 O 2 – пероксид натрия К + О 2 → КО 2 – супероксид калия Na 2 O 2 и КО 2 – сильные окислители Na 2 O 2 + СO 2 → 2 Na 2 СO 3 + O 2 ↑ (изолирующие противогазы, акваланги, подлодки)
 в) взаимодействие с Н 2 О – образование гидроксидов –щелочей: 2 Ме + 2 H 2 O → 2 Ме. OH + H 2↑ Li 2 O +H 2 O → 2 Li. OH Na 2 O 2 + 2 H 2 O → 2 Na. OH + H 2 O 2 → (Н 2 О + О 2 ↑) г) взаимодействие с растворами кислот : 2 Ме. O + 2 Н+ → Н 2 O↑+ 2 Ме+ Е=-2, 9 B l
в) взаимодействие с Н 2 О – образование гидроксидов –щелочей: 2 Ме + 2 H 2 O → 2 Ме. OH + H 2↑ Li 2 O +H 2 O → 2 Li. OH Na 2 O 2 + 2 H 2 O → 2 Na. OH + H 2 O 2 → (Н 2 О + О 2 ↑) г) взаимодействие с растворами кислот : 2 Ме. O + 2 Н+ → Н 2 O↑+ 2 Ме+ Е=-2, 9 B l
 Соли щелочных металлов хорошо растворимы в воде (исключение: фторид лития, карбид лития, перхлораты К, Rb, Cs) - окрашивают пламя: Na → Na* + hν - желтого цвета Li → Li* + hν - красного цвета K → K* + hν - фиолетового цвета
Соли щелочных металлов хорошо растворимы в воде (исключение: фторид лития, карбид лития, перхлораты К, Rb, Cs) - окрашивают пламя: Na → Na* + hν - желтого цвета Li → Li* + hν - красного цвета K → K* + hν - фиолетового цвета
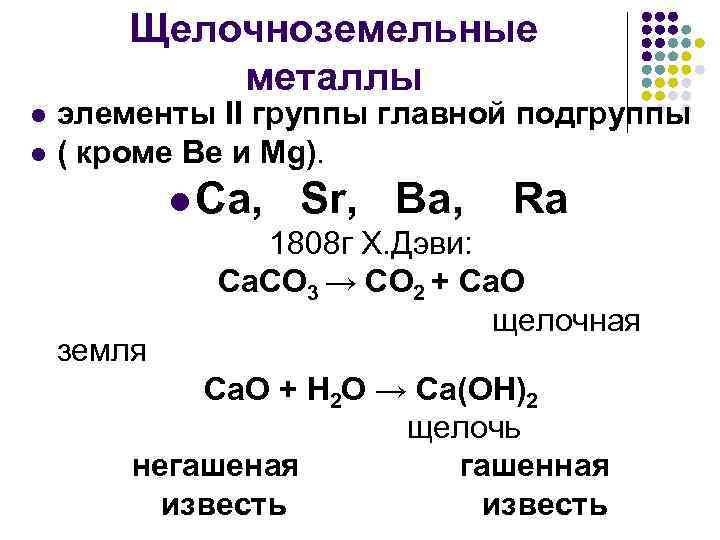 Щелочноземельные металлы l l элементы II группы главной подгруппы ( кроме Be и Mg). l Са, земля Sr, Ba, Ra 1808 г Х. Дэви: Са. СО 3 → СО 2 + Са. О щелочная Са. О + Н 2 О → Са(ОН)2 щелочь негашеная гашенная известь
Щелочноземельные металлы l l элементы II группы главной подгруппы ( кроме Be и Mg). l Са, земля Sr, Ba, Ra 1808 г Х. Дэви: Са. СО 3 → СО 2 + Са. О щелочная Са. О + Н 2 О → Са(ОН)2 щелочь негашеная гашенная известь
 Получение l а) электролиз хлоридов металлов: Са. Cl 2 → Ca + Cl 2↑ l б) восстановление из оксидов нелетучими восстановителями: 2 Mg. O + Si → 2 Mg + Si. O 2 3 Ca. O + 2 Al → Al 2 O 3 + 3 Ca
Получение l а) электролиз хлоридов металлов: Са. Cl 2 → Ca + Cl 2↑ l б) восстановление из оксидов нелетучими восстановителями: 2 Mg. O + Si → 2 Mg + Si. O 2 3 Ca. O + 2 Al → Al 2 O 3 + 3 Ca
 Химические свойства l l а) взаимодействие с кислородом: 2 Mg + O 2 → 2 Mg. O 2 Ca + O 2 → 2 Ca. O 2 Ba + O 2 → 2 Ba. O б) взаимодействие с водородом: Са + Н 2 → Са. Н 2 гидрид кальция- сильный восстановитель Са. Н 2 + О 2 → Са. О + Н 2 О Са. Н 2 + Н 2 О → Са(ОН)2 + Н 2↑
Химические свойства l l а) взаимодействие с кислородом: 2 Mg + O 2 → 2 Mg. O 2 Ca + O 2 → 2 Ca. O 2 Ba + O 2 → 2 Ba. O б) взаимодействие с водородом: Са + Н 2 → Са. Н 2 гидрид кальция- сильный восстановитель Са. Н 2 + О 2 → Са. О + Н 2 О Са. Н 2 + Н 2 О → Са(ОН)2 + Н 2↑
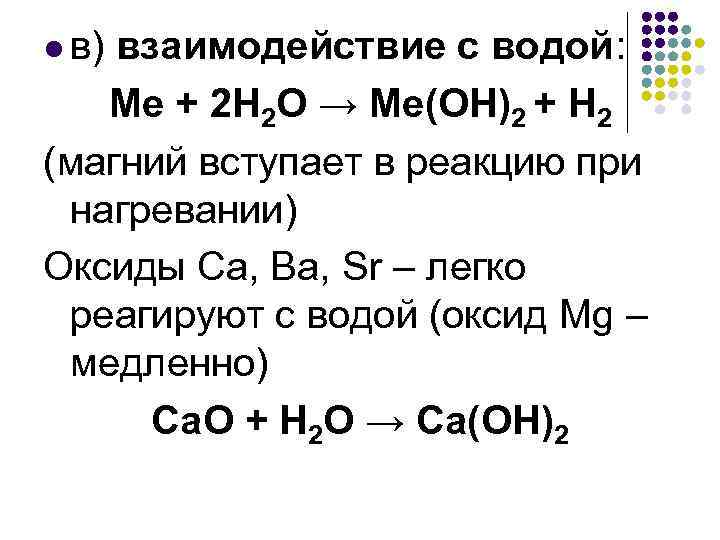 l в) взаимодействие с водой: Ме + 2 Н 2 О → Ме(ОН)2 + Н 2 (магний вступает в реакцию при нагревании) Оксиды Са, Ва, Sr – легко реагируют с водой (оксид Mg – медленно) Са. О + Н 2 О → Са(ОН)2
l в) взаимодействие с водой: Ме + 2 Н 2 О → Ме(ОН)2 + Н 2 (магний вступает в реакцию при нагревании) Оксиды Са, Ва, Sr – легко реагируют с водой (оксид Mg – медленно) Са. О + Н 2 О → Са(ОН)2
 l Соли щелочноземельных металлов l - хлориды, сульфаты, бикарбонаты – хорошо растворимы в воде l - фториды, хроматы, оксалаты – плохо растворимы в воде.
l Соли щелочноземельных металлов l - хлориды, сульфаты, бикарбонаты – хорошо растворимы в воде l - фториды, хроматы, оксалаты – плохо растворимы в воде.
 Жесткость воды обусловлена содержанием в воде ионов Са 2+ и Мg 2+. Различают 3 вида жесткости воды: l Общая жесткость воды определяется суммой растворимых солей Са и Мg (хлоридов, сульфатов, гидрокарбонатов)
Жесткость воды обусловлена содержанием в воде ионов Са 2+ и Мg 2+. Различают 3 вида жесткости воды: l Общая жесткость воды определяется суммой растворимых солей Са и Мg (хлоридов, сульфатов, гидрокарбонатов)
 l l Временная жесткость - это часть общей жесткости, устраняемая кипячением: Сa(HCO 3)2 = Ca. CO 3↓+H 2 O + CO 2↑ Постоянная жесткость воды часть общей жесткости, остающаяся после кипячения воды (хлориды, сульфаты).
l l Временная жесткость - это часть общей жесткости, устраняемая кипячением: Сa(HCO 3)2 = Ca. CO 3↓+H 2 O + CO 2↑ Постоянная жесткость воды часть общей жесткости, остающаяся после кипячения воды (хлориды, сульфаты).
 Умягчение воды Содовый способ: l Mg. SO 4 + Na 2 CO 3 = Mg. CO 3↓ + Na 2 SO 4 l Ca. Cl 2 + Na 2 CO 3 = Ca. CO 3↓ + 2 Na. Cl l В настоящее время: использование ионнообменных смол, поглощающих ионы Са 2+ и Мg 2+. l
Умягчение воды Содовый способ: l Mg. SO 4 + Na 2 CO 3 = Mg. CO 3↓ + Na 2 SO 4 l Ca. Cl 2 + Na 2 CO 3 = Ca. CO 3↓ + 2 Na. Cl l В настоящее время: использование ионнообменных смол, поглощающих ионы Са 2+ и Мg 2+. l
 Галогены F, Cl, Br, I, At Электронная конфигурация внешнего слоя - ns 2 np 5 Характерная степень окисления l -1 Для хлора, брома и иода известны степени окисления: +1, +3, +5 и +7 В обычных условиях существуют в виде простых веществ Hal 2 l
Галогены F, Cl, Br, I, At Электронная конфигурация внешнего слоя - ns 2 np 5 Характерная степень окисления l -1 Для хлора, брома и иода известны степени окисления: +1, +3, +5 и +7 В обычных условиях существуют в виде простых веществ Hal 2 l
 l F 2 - газ, бледно-желтого цвета l Cl 2 - газ, желто-зеленого цвета l Br 2 - густая жидкость, красно -коричневого цвета l I 2 - кристаллы, серо-черного цвета, блестят
l F 2 - газ, бледно-желтого цвета l Cl 2 - газ, желто-зеленого цвета l Br 2 - густая жидкость, красно -коричневого цвета l I 2 - кристаллы, серо-черного цвета, блестят
 Лабораторные способы получения l Cl 2 - получают действием различных окислителей на НCl: Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O l -Br 2, I 2 - получают окислением HBr, HI или их солей: l 6 KBr + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Br 2 + l + Cr 2(SO 4)3 + 4 K 2 SO 4 + 7 H 2 O
Лабораторные способы получения l Cl 2 - получают действием различных окислителей на НCl: Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O l -Br 2, I 2 - получают окислением HBr, HI или их солей: l 6 KBr + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Br 2 + l + Cr 2(SO 4)3 + 4 K 2 SO 4 + 7 H 2 O
 Соединения галогенов l Галогеноводороды - HF, НCl, HBr, HI при обычных условиях газы, хорошо растворимые в воде. l Получение: KF(кр) + H 2 SO 4(конц) = HF↑ +KHSO 4 KCl + H 2 SO 4(конц) = HCl↑ + KHSO 4 3 Br 2 + 2 P + 6 H 2 O = 6 HBr↑ + 2 H 3 PO 3
Соединения галогенов l Галогеноводороды - HF, НCl, HBr, HI при обычных условиях газы, хорошо растворимые в воде. l Получение: KF(кр) + H 2 SO 4(конц) = HF↑ +KHSO 4 KCl + H 2 SO 4(конц) = HCl↑ + KHSO 4 3 Br 2 + 2 P + 6 H 2 O = 6 HBr↑ + 2 H 3 PO 3
 При растворении НCl, HBr, HI диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. 4 HF + Si. O 2 = Si. F 4↑ + 2 H 2 O В отличии от других кислот, HF взаимодействует с Si. O 2, и вследствие этого разъедает стекло.
При растворении НCl, HBr, HI диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. 4 HF + Si. O 2 = Si. F 4↑ + 2 H 2 O В отличии от других кислот, HF взаимодействует с Si. O 2, и вследствие этого разъедает стекло.
 Кислородсодержащие соединения галогенов l Все галогены, , в кроме фтора, образуют соединения которых они обладают положительной степенью окисления. l Наиболее важные - НHal. On (n=1÷ 4)
Кислородсодержащие соединения галогенов l Все галогены, , в кроме фтора, образуют соединения которых они обладают положительной степенью окисления. l Наиболее важные - НHal. On (n=1÷ 4)
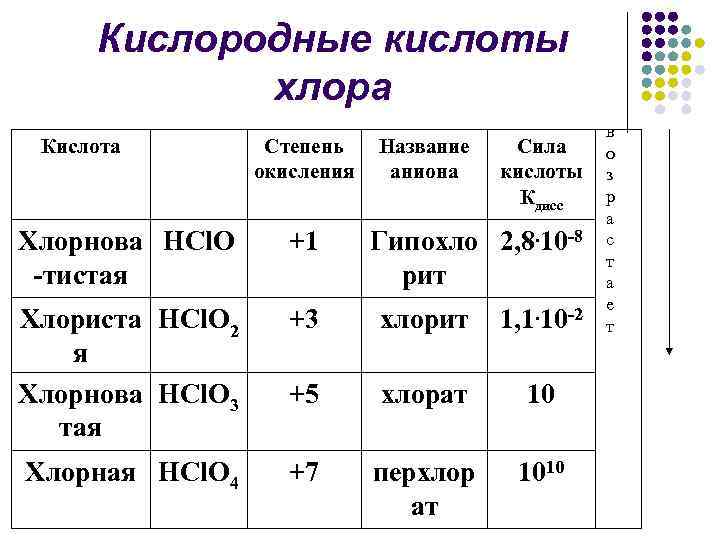 Кислородные кислоты хлора Кислота Степень окисления Название аниона Сила кислоты Кдисс Хлорнова HCl. O -тистая +1 Гипохло 2, 8. 10 -8 рит Хлориста HCl. O 2 я Хлорнова HCl. O 3 тая +3 хлорит 1, 1. 10 -2 +5 хлорат 10 Хлорная HCl. O 4 +7 перхлор ат 1010 в о з р а с т а е т
Кислородные кислоты хлора Кислота Степень окисления Название аниона Сила кислоты Кдисс Хлорнова HCl. O -тистая +1 Гипохло 2, 8. 10 -8 рит Хлориста HCl. O 2 я Хлорнова HCl. O 3 тая +3 хлорит 1, 1. 10 -2 +5 хлорат 10 Хлорная HCl. O 4 +7 перхлор ат 1010 в о з р а с т а е т
 l Кислоты ННаl при взаимодействии с металлами их окисляют только за счет ионов Н+ : 2 HCl + Zn = Zn. Cl 2 + H 2↑ l Галогениды металлов, за исключением солей Аg и Pb, хорошо растворимы в воде.
l Кислоты ННаl при взаимодействии с металлами их окисляют только за счет ионов Н+ : 2 HCl + Zn = Zn. Cl 2 + H 2↑ l Галогениды металлов, за исключением солей Аg и Pb, хорошо растворимы в воде.
 l Реакция: Ag+ + Hal- = Ag. Hal↓ является качественной на галоген-ионы. Ag. Cl - осадок белого цвета Ag. Br - желто-белого цвета Ag. I - ярко-желтого цвета
l Реакция: Ag+ + Hal- = Ag. Hal↓ является качественной на галоген-ионы. Ag. Cl - осадок белого цвета Ag. Br - желто-белого цвета Ag. I - ярко-желтого цвета
 l Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом и металлами: F 2+ 2 Cl- = 2 F- +Cl 2 + 2 Br- = 2 Cl- + Br 2 + 2 I- = 2 Br- + I 2
l Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом и металлами: F 2+ 2 Cl- = 2 F- +Cl 2 + 2 Br- = 2 Cl- + Br 2 + 2 I- = 2 Br- + I 2
 ПОЛУЧЕНИЕ ГАЛОГЕНОВ Промышленные методы: l а) электролиз F 2 получают из расплавов фторидов: Сa. F 2 → Ca+F 2 Cl 2 получают из расплавов или из растворов хлоридов: 2 Na. Cl → 2 Na +Cl 2 2 Na. Cl + 2 H 2 O → H 2↑ + Cl 2↑ + 2 Na. OH l б) окисление солей брома и иода хлором. l
ПОЛУЧЕНИЕ ГАЛОГЕНОВ Промышленные методы: l а) электролиз F 2 получают из расплавов фторидов: Сa. F 2 → Ca+F 2 Cl 2 получают из расплавов или из растворов хлоридов: 2 Na. Cl → 2 Na +Cl 2 2 Na. Cl + 2 H 2 O → H 2↑ + Cl 2↑ + 2 Na. OH l б) окисление солей брома и иода хлором. l
 ХИМИЧЕСКИЕ СВОЙСТВА F - самый активный из галогенов. а) взаимодействует с металлами: l 2 Al + 3 F 2 = 2 Al. F 3 + Q б) с неметаллами: H 2 + F 2 = 2 HF + Q Si+ 2 F 2 =Si. F 4 Hal 2 + F 2 = 2 Hal. F (где Hal=Cl, Br, I) межгалогенные соединения (сильные окислители)
ХИМИЧЕСКИЕ СВОЙСТВА F - самый активный из галогенов. а) взаимодействует с металлами: l 2 Al + 3 F 2 = 2 Al. F 3 + Q б) с неметаллами: H 2 + F 2 = 2 HF + Q Si+ 2 F 2 =Si. F 4 Hal 2 + F 2 = 2 Hal. F (где Hal=Cl, Br, I) межгалогенные соединения (сильные окислители)
 l в) с водой: 3 F 2 + 3 H 2 O = F 2 O↑ + 4 HF +H 2 O 2 (реакция носит взрывной характер) г) с инертными газами Xe + F 2 = Xe. F 2 + Q
l в) с водой: 3 F 2 + 3 H 2 O = F 2 O↑ + 4 HF +H 2 O 2 (реакция носит взрывной характер) г) с инертными газами Xe + F 2 = Xe. F 2 + Q
 Сl 2 - очень реакционноактивен l а) реагирует со всеми простыми веществами, кроме О 2, N 2, инертных газов: 2 Al + 3 Cl 2 = 2 Al. Cl 3 + Q Si+ 2 Cl 2 = Si. Cl 4 + Q H 2 + Cl 2 = 2 HCl + Q (реакция протекает по цепному механизму)
Сl 2 - очень реакционноактивен l а) реагирует со всеми простыми веществами, кроме О 2, N 2, инертных газов: 2 Al + 3 Cl 2 = 2 Al. Cl 3 + Q Si+ 2 Cl 2 = Si. Cl 4 + Q H 2 + Cl 2 = 2 HCl + Q (реакция протекает по цепному механизму)
 l б) взаимодействует со сложными веществами: Н 3 С-СН 3 + Сl 2 → CH 3 -CH 2 Cl + HCl -вытесняет Br 2 и I 2 из их соединений: Cl 2 + 2 HBr = 2 HCl + Br 2 Cl 2 + 2 HI = 2 HCl + I 2
l б) взаимодействует со сложными веществами: Н 3 С-СН 3 + Сl 2 → CH 3 -CH 2 Cl + HCl -вытесняет Br 2 и I 2 из их соединений: Cl 2 + 2 HBr = 2 HCl + Br 2 Cl 2 + 2 HI = 2 HCl + I 2
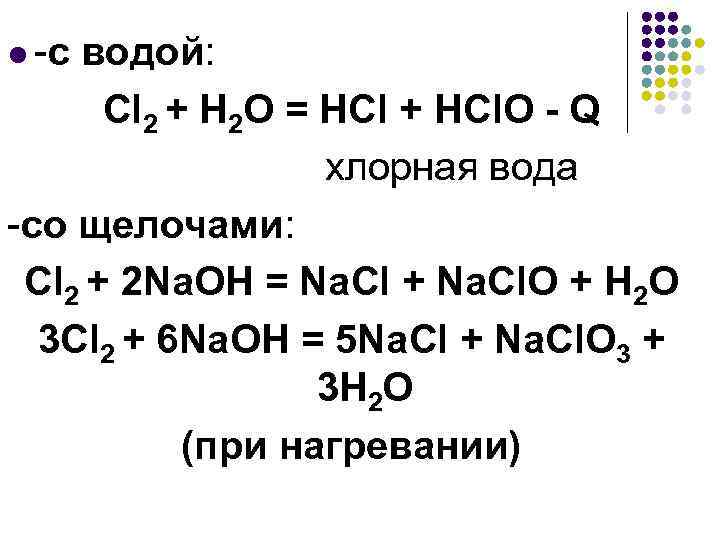 l -с водой: Cl 2 + H 2 O = HCl + HCl. O - Q хлорная вода -со щелочами: Сl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O 3 Сl 2 + 6 Na. OH = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (при нагревании)
l -с водой: Cl 2 + H 2 O = HCl + HCl. O - Q хлорная вода -со щелочами: Сl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O 3 Сl 2 + 6 Na. OH = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (при нагревании)
 l Br 2 - менее активен, чем F 2 и Cl 2 l -с простыми веществами: l Si + 2 Br 2 = Si. Br 4 + Q l H 2 + Br 2 = 2 HBr + Q l Как «мягкий» реагент, широко используется в органическом синтезе.
l Br 2 - менее активен, чем F 2 и Cl 2 l -с простыми веществами: l Si + 2 Br 2 = Si. Br 4 + Q l H 2 + Br 2 = 2 HBr + Q l Как «мягкий» реагент, широко используется в органическом синтезе.
 I 2 - существенно отличается по химической активности от F 2, Cl 2, Br 2. -не взаимодействует с неметаллами; -с металлами медленно реагирует при to.
I 2 - существенно отличается по химической активности от F 2, Cl 2, Br 2. -не взаимодействует с неметаллами; -с металлами медленно реагирует при to.
 ТЕМА № 6 Свойства элементов 5, 6 групп Периодической системы элементов Д. И. Менделеева
ТЕМА № 6 Свойства элементов 5, 6 групп Периодической системы элементов Д. И. Менделеева
 Учебные вопросы: 1. Азот. Соединения со степенью окисления азота (+1), (+2), (+3), (+4), (+5). 2. Фосфор. Соединения со степенью окисления фосфора (+3), (+5). 3. Кислород. Соединения со степенью окисления (-2), (-1). 4. Сера. Соединения со степенью окисления серы (+2), (+4), (+6). Подгруппа селена.
Учебные вопросы: 1. Азот. Соединения со степенью окисления азота (+1), (+2), (+3), (+4), (+5). 2. Фосфор. Соединения со степенью окисления фосфора (+3), (+5). 3. Кислород. Соединения со степенью окисления (-2), (-1). 4. Сера. Соединения со степенью окисления серы (+2), (+4), (+6). Подгруппа селена.
 Литература 1. Ахметов Н. С. Общая и неорганическая химия. М. , «Высшая школа» , 2009, с. 338 -470.
Литература 1. Ахметов Н. С. Общая и неорганическая химия. М. , «Высшая школа» , 2009, с. 338 -470.
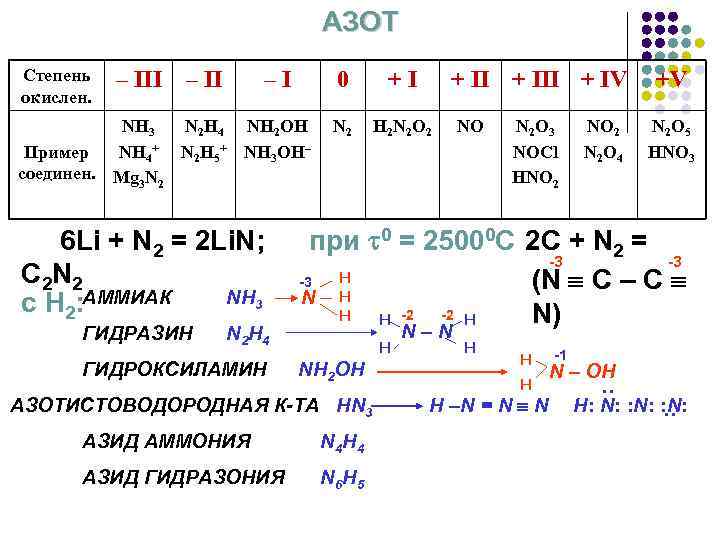 АЗОТ –I 0 NH 3 N 2 H 4 NH 2 OH Пример NH 4+ N 2 H 5+ NH 3 OH– соединен. Mg 3 N 2 6 Li + N 2 = 2 Li. N; C 2 N 2 NH 3 c H 2: АММИАК ГИДРАЗИН N 2 H 4 ГИДРОКСИЛАМИН +I + III + IV N 2 H 2 N 2 O 2 NO N 2 O 3 NOCl HNO 2 N 2 O 4 +V N 2 O 5 HNO 3 при 0 = 25000 C 2 C + N 2 = -3 -3 H -3 (N C – C H N -2 H H N) H -2 H NH 2 OH АЗОТИСТОВОДОРОДНАЯ К-ТА HN 3 АЗИД АММОНИЯ N 4 H 4 АЗИД ГИДРАЗОНИЯ N 6 H 5 N–N H H –N = N N -1 N – OH H: N: : – III – II : Степень окислен.
АЗОТ –I 0 NH 3 N 2 H 4 NH 2 OH Пример NH 4+ N 2 H 5+ NH 3 OH– соединен. Mg 3 N 2 6 Li + N 2 = 2 Li. N; C 2 N 2 NH 3 c H 2: АММИАК ГИДРАЗИН N 2 H 4 ГИДРОКСИЛАМИН +I + III + IV N 2 H 2 N 2 O 2 NO N 2 O 3 NOCl HNO 2 N 2 O 4 +V N 2 O 5 HNO 3 при 0 = 25000 C 2 C + N 2 = -3 -3 H -3 (N C – C H N -2 H H N) H -2 H NH 2 OH АЗОТИСТОВОДОРОДНАЯ К-ТА HN 3 АЗИД АММОНИЯ N 4 H 4 АЗИД ГИДРАЗОНИЯ N 6 H 5 N–N H H –N = N N -1 N – OH H: N: : – III – II : Степень окислен.
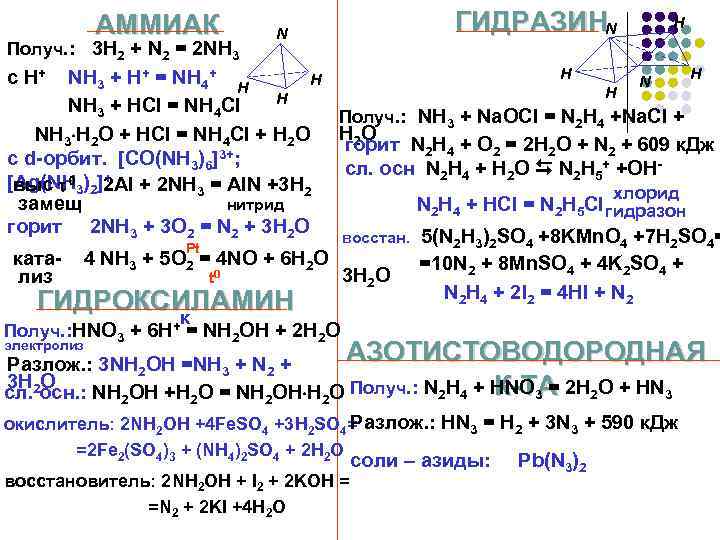 АММИАК Получ. : 3 H 2 + N 2 = 2 NH 3 N ГИДРАЗИНN H H H NH 3 + H+ = NH 4+ H H NH 3 + HCl = NH 4 Cl Получ. : NH 3 + Na. OCl = N 2 H 4 +Na. Cl + NH 3 H 2 O + HCl = NH 4 Cl + H 2 O горит N 2 H 4 + O 2 = 2 H 2 O + N 2 + 609 к. Дж 3+; с d-орбит. [CO(NH 3)6] сл. осн N 2 H 4 + H 2 O N 2 H 5+ +OH+ [Ag(NH 3)2]2 Al + 2 NH 3 = Al. N +3 H 2 выс 0 хлорид замещ нитрид N 2 H 4 + HCl = N 2 H 5 Cl гидразон горит 2 NH 3 + 3 O 2 = N 2 + 3 H 2 O восстан. 5(N 2 H 3)2 SO 4 +8 KMn. O 4 +7 H 2 SO 4= Pt ката- 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O =10 N 2 + 8 Mn. SO 4 + 4 K 2 SO 4 + 3 H 2 O лиз t 0 N 2 H 4 + 2 I 2 = 4 HI + N 2 ГИДРОКСИЛАМИН к Получ. : HNO 3 + 6 H+ = NH 2 OH + 2 H 2 O c H+ АЗОТИСТОВОДОРОДНАЯ Разлож. : 3 NH 2 OH =NH 3 + N 2 + 3 H O К-ТА сл. 2 осн. : NH 2 OH +H 2 O = NH 2 OH H 2 O Получ. : N 2 H 4 + HNO 3 = 2 H 2 O + HN 3 Разлож. : HN 3 = H 2 + 3 N 3 + 590 к. Дж окислитель: 2 NH 2 OH +4 Fe. SO 4 +3 H 2 SO 4= электролиз =2 Fe 2(SO 4)3 + (NH 4)2 SO 4 + 2 H 2 O восстановитель: 2 NH 2 OH + I 2 + 2 KOH = =N 2 + 2 KI +4 H 2 O соли – азиды: Pb(N 3)2
АММИАК Получ. : 3 H 2 + N 2 = 2 NH 3 N ГИДРАЗИНN H H H NH 3 + H+ = NH 4+ H H NH 3 + HCl = NH 4 Cl Получ. : NH 3 + Na. OCl = N 2 H 4 +Na. Cl + NH 3 H 2 O + HCl = NH 4 Cl + H 2 O горит N 2 H 4 + O 2 = 2 H 2 O + N 2 + 609 к. Дж 3+; с d-орбит. [CO(NH 3)6] сл. осн N 2 H 4 + H 2 O N 2 H 5+ +OH+ [Ag(NH 3)2]2 Al + 2 NH 3 = Al. N +3 H 2 выс 0 хлорид замещ нитрид N 2 H 4 + HCl = N 2 H 5 Cl гидразон горит 2 NH 3 + 3 O 2 = N 2 + 3 H 2 O восстан. 5(N 2 H 3)2 SO 4 +8 KMn. O 4 +7 H 2 SO 4= Pt ката- 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O =10 N 2 + 8 Mn. SO 4 + 4 K 2 SO 4 + 3 H 2 O лиз t 0 N 2 H 4 + 2 I 2 = 4 HI + N 2 ГИДРОКСИЛАМИН к Получ. : HNO 3 + 6 H+ = NH 2 OH + 2 H 2 O c H+ АЗОТИСТОВОДОРОДНАЯ Разлож. : 3 NH 2 OH =NH 3 + N 2 + 3 H O К-ТА сл. 2 осн. : NH 2 OH +H 2 O = NH 2 OH H 2 O Получ. : N 2 H 4 + HNO 3 = 2 H 2 O + HN 3 Разлож. : HN 3 = H 2 + 3 N 3 + 590 к. Дж окислитель: 2 NH 2 OH +4 Fe. SO 4 +3 H 2 SO 4= электролиз =2 Fe 2(SO 4)3 + (NH 4)2 SO 4 + 2 H 2 O восстановитель: 2 NH 2 OH + I 2 + 2 KOH = =N 2 + 2 KI +4 H 2 O соли – азиды: Pb(N 3)2
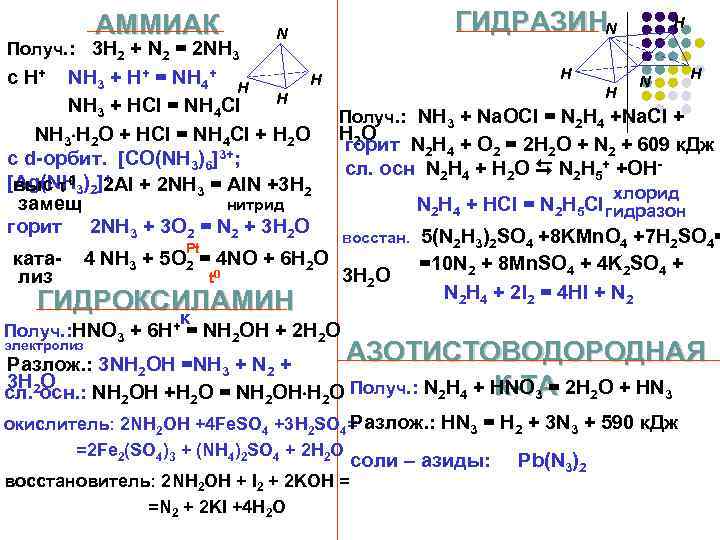 АММИАК Получ. : 3 H 2 + N 2 = 2 NH 3 N ГИДРАЗИНN H H H NH 3 + H+ = NH 4+ H H NH 3 + HCl = NH 4 Cl Получ. : NH 3 + Na. OCl = N 2 H 4 +Na. Cl + NH 3 H 2 O + HCl = NH 4 Cl + H 2 O горит N 2 H 4 + O 2 = 2 H 2 O + N 2 + 609 к. Дж 3+; с d-орбит. [CO(NH 3)6] сл. осн N 2 H 4 + H 2 O N 2 H 5+ +OH+ [Ag(NH 3)2]2 Al + 2 NH 3 = Al. N +3 H 2 выс 0 хлорид замещ нитрид N 2 H 4 + HCl = N 2 H 5 Cl гидразон горит 2 NH 3 + 3 O 2 = N 2 + 3 H 2 O восстан. 5(N 2 H 3)2 SO 4 +8 KMn. O 4 +7 H 2 SO 4= Pt ката- 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O =10 N 2 + 8 Mn. SO 4 + 4 K 2 SO 4 + 3 H 2 O лиз t 0 N 2 H 4 + 2 I 2 = 4 HI + N 2 ГИДРОКСИЛАМИН к Получ. : HNO 3 + 6 H+ = NH 2 OH + 2 H 2 O c H+ АЗОТИСТОВОДОРОДНАЯ Разлож. : 3 NH 2 OH =NH 3 + N 2 + 3 H O К-ТА сл. 2 осн. : NH 2 OH +H 2 O = NH 2 OH H 2 O Получ. : N 2 H 4 + HNO 3 = 2 H 2 O + HN 3 Разлож. : HN 3 = H 2 + 3 N 3 + 590 к. Дж окислитель: 2 NH 2 OH +4 Fe. SO 4 +3 H 2 SO 4= электролиз =2 Fe 2(SO 4)3 + (NH 4)2 SO 4 + 2 H 2 O восстановитель: 2 NH 2 OH + I 2 + 2 KOH = =N 2 + 2 KI +4 H 2 O соли – азиды: Pb(N 3)2
АММИАК Получ. : 3 H 2 + N 2 = 2 NH 3 N ГИДРАЗИНN H H H NH 3 + H+ = NH 4+ H H NH 3 + HCl = NH 4 Cl Получ. : NH 3 + Na. OCl = N 2 H 4 +Na. Cl + NH 3 H 2 O + HCl = NH 4 Cl + H 2 O горит N 2 H 4 + O 2 = 2 H 2 O + N 2 + 609 к. Дж 3+; с d-орбит. [CO(NH 3)6] сл. осн N 2 H 4 + H 2 O N 2 H 5+ +OH+ [Ag(NH 3)2]2 Al + 2 NH 3 = Al. N +3 H 2 выс 0 хлорид замещ нитрид N 2 H 4 + HCl = N 2 H 5 Cl гидразон горит 2 NH 3 + 3 O 2 = N 2 + 3 H 2 O восстан. 5(N 2 H 3)2 SO 4 +8 KMn. O 4 +7 H 2 SO 4= Pt ката- 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O =10 N 2 + 8 Mn. SO 4 + 4 K 2 SO 4 + 3 H 2 O лиз t 0 N 2 H 4 + 2 I 2 = 4 HI + N 2 ГИДРОКСИЛАМИН к Получ. : HNO 3 + 6 H+ = NH 2 OH + 2 H 2 O c H+ АЗОТИСТОВОДОРОДНАЯ Разлож. : 3 NH 2 OH =NH 3 + N 2 + 3 H O К-ТА сл. 2 осн. : NH 2 OH +H 2 O = NH 2 OH H 2 O Получ. : N 2 H 4 + HNO 3 = 2 H 2 O + HN 3 Разлож. : HN 3 = H 2 + 3 N 3 + 590 к. Дж окислитель: 2 NH 2 OH +4 Fe. SO 4 +3 H 2 SO 4= электролиз =2 Fe 2(SO 4)3 + (NH 4)2 SO 4 + 2 H 2 O восстановитель: 2 NH 2 OH + I 2 + 2 KOH = =N 2 + 2 KI +4 H 2 O соли – азиды: Pb(N 3)2
 КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ОКСИДЫ 0 +2 ЗАКИСЬ N 2 O N = O N N = O +2 ОКСИД(II) NO N = O +3 +3 ОКСИД(III) N 2 O 3 азотистый ангидрид O = N – O – N = O N+4 O O O = O ОКСИД(IV) NO 2 (N 2 O 4) диоксид +5 +5 ОКСИД(V) N 2 O 5 азотный ангидрид N–O–N = O ЗАКИСЬ = = +3 = = -1 O ОКСИД - NO t 0 Получ. : NH 4 NO 3 = N 2 O + H 2 O Получ. : N 2 + O 2 = 2 NO – 180 к. Дж к t 0 Разлож. : 2 N 2 O = 2 N 2 + OЛабор. : 3 Cu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO + H 2 O (разб) Присоед. : 2 NO + Cl 2 = 2 NOCl (нитрозил хлорид) 2 NO + O 2 = 2 NO 2 ДИОКСИД Получ. : 2 NO + O 2 = 2 NO 2 раств. в Н 2 О Лабор. : 4 HNO 3 + Cu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O на холоду 2 NO 2 + H 2 O HNO 3 + HNO 2 Равновесие: 2 NO 2 N 2 O 4 горяч. H O 3 NO + H O 2 HNO + NO тепло +100 холод -11 2 2 2 3
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ОКСИДЫ 0 +2 ЗАКИСЬ N 2 O N = O N N = O +2 ОКСИД(II) NO N = O +3 +3 ОКСИД(III) N 2 O 3 азотистый ангидрид O = N – O – N = O N+4 O O O = O ОКСИД(IV) NO 2 (N 2 O 4) диоксид +5 +5 ОКСИД(V) N 2 O 5 азотный ангидрид N–O–N = O ЗАКИСЬ = = +3 = = -1 O ОКСИД - NO t 0 Получ. : NH 4 NO 3 = N 2 O + H 2 O Получ. : N 2 + O 2 = 2 NO – 180 к. Дж к t 0 Разлож. : 2 N 2 O = 2 N 2 + OЛабор. : 3 Cu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO + H 2 O (разб) Присоед. : 2 NO + Cl 2 = 2 NOCl (нитрозил хлорид) 2 NO + O 2 = 2 NO 2 ДИОКСИД Получ. : 2 NO + O 2 = 2 NO 2 раств. в Н 2 О Лабор. : 4 HNO 3 + Cu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O на холоду 2 NO 2 + H 2 O HNO 3 + HNO 2 Равновесие: 2 NO 2 N 2 O 4 горяч. H O 3 NO + H O 2 HNO + NO тепло +100 холод -11 2 2 2 3
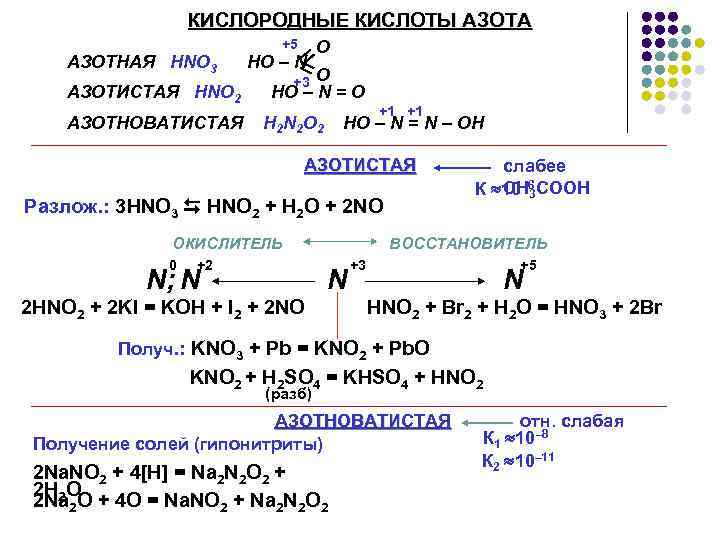 КИСЛОРОДНЫЕ КИСЛОТЫ АЗОТА +5 O HO – N = +3 O АЗОТИСТАЯ HNO 2 HO – N = O АЗОТНОВАТИСТАЯ = АЗОТНАЯ HNO 3 H 2 N 2 O 2 +1 +1 HO – N = N – OH АЗОТИСТАЯ Разлож. : 3 HNO 3 HNO 2 + H 2 O + 2 NO ОКИСЛИТЕЛЬ 0 +2 N; N слабее СН 3 К 10– 6 СООН ВОССТАНОВИТЕЛЬ N 2 HNO 2 + 2 KI = KOH + I 2 + 2 NO +3 +5 N HNO 2 + Br 2 + H 2 O = HNO 3 + 2 Br Получ. : KNO 3 + Pb = KNO 2 + Pb. O KNO 2 + H 2 SO 4 = KHSO 4 + HNO 2 (разб) АЗОТНОВАТИСТАЯ Получение солей (гипонитриты) 2 Na. NO 2 + 4[H] = Na 2 N 2 O 2 + 2 H 2 O 2 Na 2 O + 4 O = Na. NO 2 + Na 2 N 2 O 2 отн. слабая К 1 10– 8 К 2 10– 11
КИСЛОРОДНЫЕ КИСЛОТЫ АЗОТА +5 O HO – N = +3 O АЗОТИСТАЯ HNO 2 HO – N = O АЗОТНОВАТИСТАЯ = АЗОТНАЯ HNO 3 H 2 N 2 O 2 +1 +1 HO – N = N – OH АЗОТИСТАЯ Разлож. : 3 HNO 3 HNO 2 + H 2 O + 2 NO ОКИСЛИТЕЛЬ 0 +2 N; N слабее СН 3 К 10– 6 СООН ВОССТАНОВИТЕЛЬ N 2 HNO 2 + 2 KI = KOH + I 2 + 2 NO +3 +5 N HNO 2 + Br 2 + H 2 O = HNO 3 + 2 Br Получ. : KNO 3 + Pb = KNO 2 + Pb. O KNO 2 + H 2 SO 4 = KHSO 4 + HNO 2 (разб) АЗОТНОВАТИСТАЯ Получение солей (гипонитриты) 2 Na. NO 2 + 4[H] = Na 2 N 2 O 2 + 2 H 2 O 2 Na 2 O + 4 O = Na. NO 2 + Na 2 N 2 O 2 отн. слабая К 1 10– 8 К 2 10– 11
 АЗОТНАЯ Получ. : 2/3 NO 2 + H 2 O = 2 HNO 3 + NO NO + O 2 = NO 2 4 NO 2 + 2 H 2 O + O 2 = 4 HNO 3 сильн. NO 2; N 2 O 3; NO; окислитель: N 2 O; N 2; NH 3 . им а Au; Pt; Rh; Nb; W; Ta вз не пассив. HNO 3 (конц. ) Al; Fe; Cr; B эти М восст. HNO 3 до ре аг NO ир все М правее Н в ряду напряжений 2. O о. N HNO 3 (разб. ) д Cu; Ag; Hg; Bi; KI; H 2 S 2 KNO 3 + 3 H 2 S = 2 NO + 3 S +4 H 2 O до N 2 O (разб. ) д Fe; Mn (N о N H 2 O ; N 4 NO 2; N 3 H Zn; Al; Ca 3) Царская водка HNO 3(1 об. ) + HCl(3 об. ) Au + HNO 3 + 3 HCl = Au. Cl 3 + NO +2 H 2 O Au. Cl 3 + HCl = H[Au. Cl 4] HNO 3 + 3 HCl = NOCl + Cl 2 + 2 H 2 O нитрозил хлорид Порох t 0 K S + N + 2 KNO 3 + S + 3 C = 2 2 Разложение солей 3 CO 2 1) Катион левее Mg (в ряду напряжений) t 0 Na. NO 3 = Na. NO 2 + O 2 2) Mg – Cu t 0 Pb(NO 3)2 = Pb. O + NO 2 + NO + O 2 3) Правее Cu t 0 2 Ag. NO 3 = 2 Ag + 2 NO 2 + O 2
АЗОТНАЯ Получ. : 2/3 NO 2 + H 2 O = 2 HNO 3 + NO NO + O 2 = NO 2 4 NO 2 + 2 H 2 O + O 2 = 4 HNO 3 сильн. NO 2; N 2 O 3; NO; окислитель: N 2 O; N 2; NH 3 . им а Au; Pt; Rh; Nb; W; Ta вз не пассив. HNO 3 (конц. ) Al; Fe; Cr; B эти М восст. HNO 3 до ре аг NO ир все М правее Н в ряду напряжений 2. O о. N HNO 3 (разб. ) д Cu; Ag; Hg; Bi; KI; H 2 S 2 KNO 3 + 3 H 2 S = 2 NO + 3 S +4 H 2 O до N 2 O (разб. ) д Fe; Mn (N о N H 2 O ; N 4 NO 2; N 3 H Zn; Al; Ca 3) Царская водка HNO 3(1 об. ) + HCl(3 об. ) Au + HNO 3 + 3 HCl = Au. Cl 3 + NO +2 H 2 O Au. Cl 3 + HCl = H[Au. Cl 4] HNO 3 + 3 HCl = NOCl + Cl 2 + 2 H 2 O нитрозил хлорид Порох t 0 K S + N + 2 KNO 3 + S + 3 C = 2 2 Разложение солей 3 CO 2 1) Катион левее Mg (в ряду напряжений) t 0 Na. NO 3 = Na. NO 2 + O 2 2) Mg – Cu t 0 Pb(NO 3)2 = Pb. O + NO 2 + NO + O 2 3) Правее Cu t 0 2 Ag. NO 3 = 2 Ag + 2 NO 2 + O 2
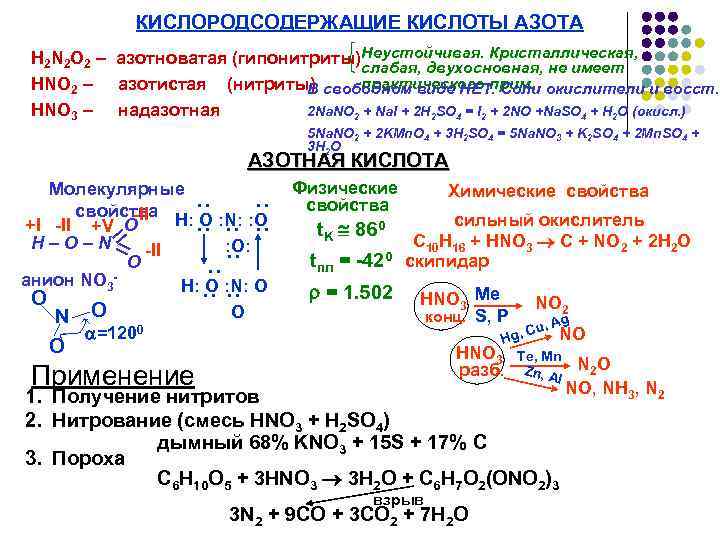 КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ АЗОТА H 2 N 2 O 2 – азотноватая (гипонитриты)Неустойчивая. Кристаллическая, слабая, двухосновная, не имеет практического прим. HNO 2 – азотистая (нитриты) свободном виде НЕТ. Соли окислители и восст. В HNO 3 – надазотная 2 Na. NO 2 + Na. I + 2 H 2 SO 4 = I 2 + 2 NO +Na. SO 4 + H 2 O (окисл. ) 5 Na. NO 2 + 2 KMn. O 4 + 3 H 2 SO 4 = 5 Na. NO 3 + K 2 SO 4 + 2 Mn. SO 4 + 3 H 2 O АЗОТНАЯ КИСЛОТА : : : : : Молекулярные свойства -II Н: O : N: : O +I -II +V O Н – О – N = -II : O: O анион NO 3 Н: O : N: O O O N O =1200 Физические свойства t. K 860 tпл = -420 = 1. 502 Химические свойства сильный окислитель C 10 H 16 + HNO 3 C + NO 2 + 2 H 2 O скипидар HNO 3 Me конц. S, P NO 2 , Ag , Cu NO Hg = O HNO 3 разб. Применение Te, Mn Zn, A l 1. Получение нитритов 2. Нитрование (смесь HNO 3 + H 2 SO 4) дымный 68% KNO 3 + 15 S + 17% C 3. Пороха C 6 H 10 O 5 + 3 HNO 3 3 H 2 O + C 6 H 7 O 2(ONO 2)3 взрыв 3 N 2 + 9 CO + 3 CO 2 + 7 H 2 O N 2 O NO, NH 3, N 2
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ АЗОТА H 2 N 2 O 2 – азотноватая (гипонитриты)Неустойчивая. Кристаллическая, слабая, двухосновная, не имеет практического прим. HNO 2 – азотистая (нитриты) свободном виде НЕТ. Соли окислители и восст. В HNO 3 – надазотная 2 Na. NO 2 + Na. I + 2 H 2 SO 4 = I 2 + 2 NO +Na. SO 4 + H 2 O (окисл. ) 5 Na. NO 2 + 2 KMn. O 4 + 3 H 2 SO 4 = 5 Na. NO 3 + K 2 SO 4 + 2 Mn. SO 4 + 3 H 2 O АЗОТНАЯ КИСЛОТА : : : : : Молекулярные свойства -II Н: O : N: : O +I -II +V O Н – О – N = -II : O: O анион NO 3 Н: O : N: O O O N O =1200 Физические свойства t. K 860 tпл = -420 = 1. 502 Химические свойства сильный окислитель C 10 H 16 + HNO 3 C + NO 2 + 2 H 2 O скипидар HNO 3 Me конц. S, P NO 2 , Ag , Cu NO Hg = O HNO 3 разб. Применение Te, Mn Zn, A l 1. Получение нитритов 2. Нитрование (смесь HNO 3 + H 2 SO 4) дымный 68% KNO 3 + 15 S + 17% C 3. Пороха C 6 H 10 O 5 + 3 HNO 3 3 H 2 O + C 6 H 7 O 2(ONO 2)3 взрыв 3 N 2 + 9 CO + 3 CO 2 + 7 H 2 O N 2 O NO, NH 3, N 2
 ФОСФОР Валентность при 15000 С 2 Ca 3(PO 4)2 + 6 Si. O 2 + 10 C = 6 Ca. Si. O 3 + P 4 + 10 CO P III (PF 3; PCl 3) IV (PH 4 Cl; PH 4 I) V (PF 5; PCl 5) VI (PCl 6–) Степень окисления – 3 – 2 – 1 0 +1 +2 +3 +4 +5 P P P Пример соединения PH 3 H H P 2 H 4 P–P H P 4 H 3 PO 2 P 2 Cl 4 H 3 PO 3; P 4 O 6 H 4 P 2 O 6 PCl 5; P 4 H 10; H 3 PO 4 H
ФОСФОР Валентность при 15000 С 2 Ca 3(PO 4)2 + 6 Si. O 2 + 10 C = 6 Ca. Si. O 3 + P 4 + 10 CO P III (PF 3; PCl 3) IV (PH 4 Cl; PH 4 I) V (PF 5; PCl 5) VI (PCl 6–) Степень окисления – 3 – 2 – 1 0 +1 +2 +3 +4 +5 P P P Пример соединения PH 3 H H P 2 H 4 P–P H P 4 H 3 PO 2 P 2 Cl 4 H 3 PO 3; P 4 O 6 H 4 P 2 O 6 PCl 5; P 4 H 10; H 3 PO 4 H
 с Н 2 c O 2 горение дым c Hal P 4 +6 H 2 = 4 PH 3 P 4 + 3 O 2 = P 4 O 6 ХИМИЧЕСКИЕ P 4 +5 O 2 = P 4 O 10 СВОЙСТВА P 4 O 10 +6 H 2 O = 4 H 3 PO 4 P 4 + 10 F 2 = 4 PF 5 – взрыв P 4 + 6 Cl 2 = 4 PCl 3; PCl 3 + Cl 2 = PCl 5 c. S P 4 + S P 4 S 3; P 4 S 5; P 4 S 7; P 4 S 10 с щел. 4 P + KOH + 3 H 2 O = PH 3 + 3 KHPO 2 (гипофосфиты) 8 P + 3 Ca(OH)2 + 6 H 2 O = 3 PH 3 + 3 Ca(H 2 PO 2)2 4 P 3 P+1 + P+3 из-за близости электроотр. Н и Р может восст. 4 P + 4 KOH + 4 H 2 O = 4 KH 2 PO 2 + 2 H 2 с кислотами неокислителями НЕ взаимодействует с кисл. окисл. P +5 HNO 3 = H 3 PO 4 + 5 NO 2 + H 2 O 2 KMn. O 4 + 2 P +3 H 2 SO 4 = K 2 SO 4 +2 Mn. SO 4 + 2 H 3 PO 4 c N 2 P 4 + 2 N 2 = 4 PN (нитрид) (при электрич. разряд) с Ме P 4 + 12 Na = 4 Na 3 P (фосфид) с окислителем (твердым) 10 KCl. O 3 + 12 P = 10 KCl + 3 P 4 O 10
с Н 2 c O 2 горение дым c Hal P 4 +6 H 2 = 4 PH 3 P 4 + 3 O 2 = P 4 O 6 ХИМИЧЕСКИЕ P 4 +5 O 2 = P 4 O 10 СВОЙСТВА P 4 O 10 +6 H 2 O = 4 H 3 PO 4 P 4 + 10 F 2 = 4 PF 5 – взрыв P 4 + 6 Cl 2 = 4 PCl 3; PCl 3 + Cl 2 = PCl 5 c. S P 4 + S P 4 S 3; P 4 S 5; P 4 S 7; P 4 S 10 с щел. 4 P + KOH + 3 H 2 O = PH 3 + 3 KHPO 2 (гипофосфиты) 8 P + 3 Ca(OH)2 + 6 H 2 O = 3 PH 3 + 3 Ca(H 2 PO 2)2 4 P 3 P+1 + P+3 из-за близости электроотр. Н и Р может восст. 4 P + 4 KOH + 4 H 2 O = 4 KH 2 PO 2 + 2 H 2 с кислотами неокислителями НЕ взаимодействует с кисл. окисл. P +5 HNO 3 = H 3 PO 4 + 5 NO 2 + H 2 O 2 KMn. O 4 + 2 P +3 H 2 SO 4 = K 2 SO 4 +2 Mn. SO 4 + 2 H 3 PO 4 c N 2 P 4 + 2 N 2 = 4 PN (нитрид) (при электрич. разряд) с Ме P 4 + 12 Na = 4 Na 3 P (фосфид) с окислителем (твердым) 10 KCl. O 3 + 12 P = 10 KCl + 3 P 4 O 10
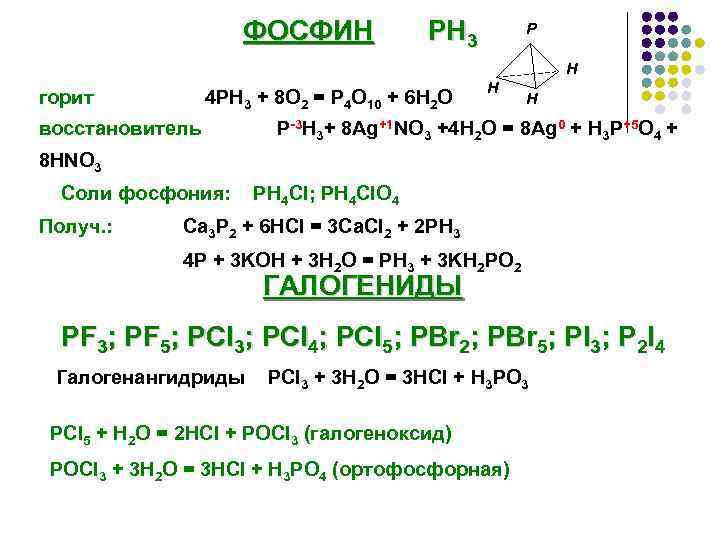 ФОСФИН РН 3 P Н горит 4 PH 3 + 8 O 2 = P 4 O 10 + 6 H 2 O восстановитель Н Н P-3 H 3+ 8 Ag+1 NO 3 +4 H 2 O = 8 Ag 0 + H 3 P+5 O 4 + 8 HNO 3 Соли фосфония: Получ. : PH 4 Cl; PH 4 Cl. O 4 Ca 3 P 2 + 6 HCl = 3 Ca. Cl 2 + 2 PH 3 4 P + 3 KOH + 3 H 2 O = PH 3 + 3 KH 2 PO 2 ГАЛОГЕНИДЫ PF 3; PF 5; PCl 3; PCl 4; PCl 5; PBr 2; PBr 5; PI 3; P 2 I 4 Галогенангидриды PCl 3 + 3 H 2 O = 3 HCl + H 3 PO 3 PCl 5 + H 2 O = 2 HCl + POCl 3 (галогеноксид) POCl 3 + 3 H 2 O = 3 HCl + H 3 PO 4 (ортофосфорная)
ФОСФИН РН 3 P Н горит 4 PH 3 + 8 O 2 = P 4 O 10 + 6 H 2 O восстановитель Н Н P-3 H 3+ 8 Ag+1 NO 3 +4 H 2 O = 8 Ag 0 + H 3 P+5 O 4 + 8 HNO 3 Соли фосфония: Получ. : PH 4 Cl; PH 4 Cl. O 4 Ca 3 P 2 + 6 HCl = 3 Ca. Cl 2 + 2 PH 3 4 P + 3 KOH + 3 H 2 O = PH 3 + 3 KH 2 PO 2 ГАЛОГЕНИДЫ PF 3; PF 5; PCl 3; PCl 4; PCl 5; PBr 2; PBr 5; PI 3; P 2 I 4 Галогенангидриды PCl 3 + 3 H 2 O = 3 HCl + H 3 PO 3 PCl 5 + H 2 O = 2 HCl + POCl 3 (галогеноксид) POCl 3 + 3 H 2 O = 3 HCl + H 3 PO 4 (ортофосфорная)
 КИСЛОРОДНЫЕ СОЕДИНЕНИЯ Р 1. НЕДООКИСЬ P 4 O 2. ФОСФОРИСТЫЙ P 4+3 O 6 P 4 O 6 + 3 H 2 O = 4 H 3 PO 3 АНГИДРИД 3. ФОСФОРНОВАТЫЙ P 2+4 O 4 P 2 O 4 + 3 H 2 O = H 3 PO 3 + H 3 PO 4 АНГИДРИД 4. ФОСФОРНЫЙ P 4+5 O 10 P 4 O 10 + 2 H 2 O = 4 HPO 3 АНГИДРИД 5. ПЕРЕОКИСЬ P 2+5 O 6 P 4 O 10 + O 2 = 2 P 2 O 6 H 4 P 2 O 8 КИСЛОТЫ 1. ФОСФОРНОВАТИСТАЯ H 3 PO 2 – слабая одноосновная 2. ФОСФОРИСТАЯ H 3 PO 3 – слабая трехосновная 3. ПИРОФОСФОРИСТАЯ H 4 P 2 O 5 – средней силы 4. ФОСФОРНОВАТАЯ H 4 P 2 O 6 5. МЕТАФОСФОРНАЯ HPO 3 – средней силы 6. ОРТОФОСФОРНАЯ H 3 PO 4 – средней силы трехосновная 7. ПОЛИФОСФОРНЫЕ (их 3) n=2, 3, 4 (HPO 3)n H 2 O H 4 P 2 O 7 8. ПОЛИМЕТАФОСФОРНЫЕ (их 2) n=3, 4 (HPO 3)n 9. МОНОНАДФОСФОРНАЯ H 3 PO 5 10. ДИНАДФОСФОРНАЯ H 4 P 2 O 8
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ Р 1. НЕДООКИСЬ P 4 O 2. ФОСФОРИСТЫЙ P 4+3 O 6 P 4 O 6 + 3 H 2 O = 4 H 3 PO 3 АНГИДРИД 3. ФОСФОРНОВАТЫЙ P 2+4 O 4 P 2 O 4 + 3 H 2 O = H 3 PO 3 + H 3 PO 4 АНГИДРИД 4. ФОСФОРНЫЙ P 4+5 O 10 P 4 O 10 + 2 H 2 O = 4 HPO 3 АНГИДРИД 5. ПЕРЕОКИСЬ P 2+5 O 6 P 4 O 10 + O 2 = 2 P 2 O 6 H 4 P 2 O 8 КИСЛОТЫ 1. ФОСФОРНОВАТИСТАЯ H 3 PO 2 – слабая одноосновная 2. ФОСФОРИСТАЯ H 3 PO 3 – слабая трехосновная 3. ПИРОФОСФОРИСТАЯ H 4 P 2 O 5 – средней силы 4. ФОСФОРНОВАТАЯ H 4 P 2 O 6 5. МЕТАФОСФОРНАЯ HPO 3 – средней силы 6. ОРТОФОСФОРНАЯ H 3 PO 4 – средней силы трехосновная 7. ПОЛИФОСФОРНЫЕ (их 3) n=2, 3, 4 (HPO 3)n H 2 O H 4 P 2 O 7 8. ПОЛИМЕТАФОСФОРНЫЕ (их 2) n=3, 4 (HPO 3)n 9. МОНОНАДФОСФОРНАЯ H 3 PO 5 10. ДИНАДФОСФОРНАЯ H 4 P 2 O 8
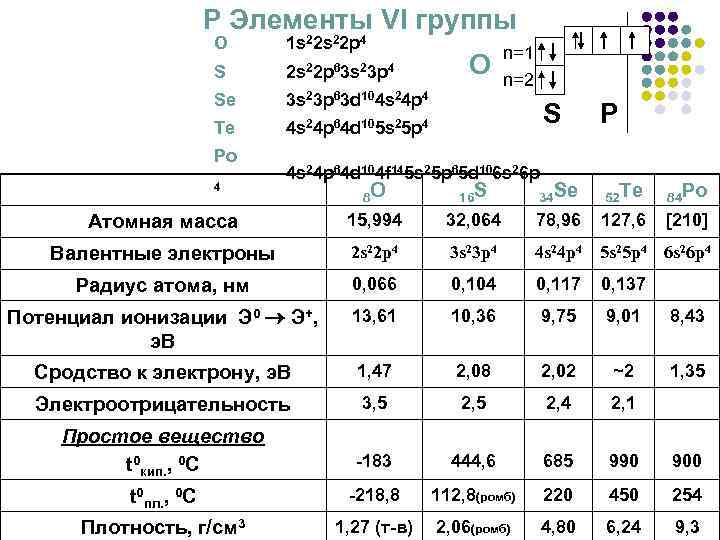 Р Элементы VI группы O 1 s 22 p 4 S 2 s 22 p 63 s 23 p 4 Se 3 s 23 p 63 d 104 s 24 p 4 Te 4 s 24 p 64 d 105 s 25 p 4 Po О n=1 n=2 S 4 s 24 p 64 d 104 f 145 s 25 p 65 d 106 s 26 p P 8 O 16 S 34 Se 52 Te 84 Po Атомная масса 15, 994 32, 064 78, 96 127, 6 [210] Валентные электроны 2 s 22 p 4 3 s 23 p 4 4 s 24 p 4 5 s 25 p 4 6 s 26 p 4 Радиус атома, нм 0, 066 0, 104 0, 117 0, 137 Потенциал ионизации Э 0 Э+, э. В 13, 61 10, 36 9, 75 9, 01 8, 43 Сродство к электрону, э. В 1, 47 2, 08 2, 02 ~2 1, 35 Электроотрицательность 3, 5 2, 4 2, 1 Простое вещество t 0 кип. , 0 C -183 444, 6 685 990 900 t 0 пл. , 0 C -218, 8 112, 8(ромб) 220 450 254 Плотность, г/см 3 1, 27 (т-в) 2, 06(ромб) 4, 80 6, 24 9, 3 4
Р Элементы VI группы O 1 s 22 p 4 S 2 s 22 p 63 s 23 p 4 Se 3 s 23 p 63 d 104 s 24 p 4 Te 4 s 24 p 64 d 105 s 25 p 4 Po О n=1 n=2 S 4 s 24 p 64 d 104 f 145 s 25 p 65 d 106 s 26 p P 8 O 16 S 34 Se 52 Te 84 Po Атомная масса 15, 994 32, 064 78, 96 127, 6 [210] Валентные электроны 2 s 22 p 4 3 s 23 p 4 4 s 24 p 4 5 s 25 p 4 6 s 26 p 4 Радиус атома, нм 0, 066 0, 104 0, 117 0, 137 Потенциал ионизации Э 0 Э+, э. В 13, 61 10, 36 9, 75 9, 01 8, 43 Сродство к электрону, э. В 1, 47 2, 08 2, 02 ~2 1, 35 Электроотрицательность 3, 5 2, 4 2, 1 Простое вещество t 0 кип. , 0 C -183 444, 6 685 990 900 t 0 пл. , 0 C -218, 8 112, 8(ромб) 220 450 254 Плотность, г/см 3 1, 27 (т-в) 2, 06(ромб) 4, 80 6, 24 9, 3 4
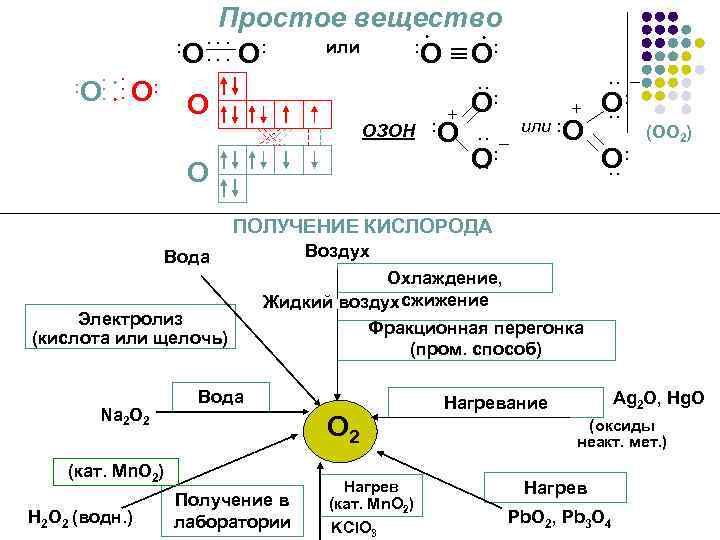 Простое вещество или : : : О О О О: + ОЗОН : О : + – или : О О: (ОО 2) : : О О: О: – О: : : О: : О ПОЛУЧЕНИЕ КИСЛОРОДА Воздух Вода Электролиз (кислота или щелочь) Na 2 O 2 Охлаждение, Жидкий воздух сжижение Фракционная перегонка (пром. способ) Вода О 2 (кат. Mn. O 2) Н 2 О 2 (водн. ) Получение в лаборатории Нагрев (кат. Mn. O 2) KCl. O 3 Ag 2 O, Hg. O Нагревание (оксиды неакт. мет. ) Нагрев Pb. O 2, Pb 3 O 4
Простое вещество или : : : О О О О: + ОЗОН : О : + – или : О О: (ОО 2) : : О О: О: – О: : : О: : О ПОЛУЧЕНИЕ КИСЛОРОДА Воздух Вода Электролиз (кислота или щелочь) Na 2 O 2 Охлаждение, Жидкий воздух сжижение Фракционная перегонка (пром. способ) Вода О 2 (кат. Mn. O 2) Н 2 О 2 (водн. ) Получение в лаборатории Нагрев (кат. Mn. O 2) KCl. O 3 Ag 2 O, Hg. O Нагревание (оксиды неакт. мет. ) Нагрев Pb. O 2, Pb 3 O 4
 СТЕПЕНИ ОКИСЛЕНИЯ КИСЛОРОДА Соединение H 2 O (оксиды) Cu. O H пероксид H 2 O 4 +2 +4 NO 3 F O 2 F 2 O 3(OO 2} O O O : O O : + е- [ : O O : ] 2 O : + 2 е- [ : : O O O : ] H O O H H O O O F N O O F F O O : Ba. O 2 Al : : надпероксид H 2 O 3 0 +1 Al KO 2 H 2 O 2 H Cu = O Al 2 O 3 – 1 O 109, 50 F O O O 1040 116, 50 : – 2 Структура соединения : : Степень окисления
СТЕПЕНИ ОКИСЛЕНИЯ КИСЛОРОДА Соединение H 2 O (оксиды) Cu. O H пероксид H 2 O 4 +2 +4 NO 3 F O 2 F 2 O 3(OO 2} O O O : O O : + е- [ : O O : ] 2 O : + 2 е- [ : : O O O : ] H O O H H O O O F N O O F F O O : Ba. O 2 Al : : надпероксид H 2 O 3 0 +1 Al KO 2 H 2 O 2 H Cu = O Al 2 O 3 – 1 O 109, 50 F O O O 1040 116, 50 : – 2 Структура соединения : : Степень окисления
 Химические свойства. Кислород в реакциях со всеми элементами (кроме фтора) является окислителем. 1. Реакции с неметаллами происходят в основном при нагревании. 4 P + 5 O 2 = 2 P 2 O 5 S + O 2 = SO 2 C + O 2 = CO 2 Взаимодействие кислорода с азотом начинается лишь при 12000 С или в электрическом разряде: N 2 + O 2 2 NO – Q. 1. Реакции с активными металлами происходят при комнатной температуре, например: 4 Li + O 2 = 2 Li 2 O. При нагревании натрия в сухом кислороде образуется пероксид натрия: 2 Na + O 2 = Na 2 O 2 При нагревании калия – надпероксид: K + O 2 = KO 2.
Химические свойства. Кислород в реакциях со всеми элементами (кроме фтора) является окислителем. 1. Реакции с неметаллами происходят в основном при нагревании. 4 P + 5 O 2 = 2 P 2 O 5 S + O 2 = SO 2 C + O 2 = CO 2 Взаимодействие кислорода с азотом начинается лишь при 12000 С или в электрическом разряде: N 2 + O 2 2 NO – Q. 1. Реакции с активными металлами происходят при комнатной температуре, например: 4 Li + O 2 = 2 Li 2 O. При нагревании натрия в сухом кислороде образуется пероксид натрия: 2 Na + O 2 = Na 2 O 2 При нагревании калия – надпероксид: K + O 2 = KO 2.
 СВОЙСТВА ОКСИДОВ Эффективный заряд Na 2 O Mg. O Al 2 O 3 Si. O 2 0, 81 – 0, 42 – 0, 31 – Свойства основные сильно слабо Na 2 O + H 2 O = 2 Na. OH; основный амфот ерные 0, 23 – P 2 O 5 SO 3 0, 13 – 0, 03 – Cl 2 O 7 0, 01 – кислотные слабо средне сильно 3 H 2 O + P 2 O 5 = 2 H 3 PO 4 кислотный 3 Ca. O + P 2 O 5 = Ca 3(PO 4)2 основный кислотный Амфотерные оксиды Al 2 O 3 + 6 HCl + 9 H 2 O = 2[Al(OH 2)6]Cl 3 Al 2 O 3 + 9 Na. OH + 3 H 2 O = 2 Na 3[Al(OH)6]Cl
СВОЙСТВА ОКСИДОВ Эффективный заряд Na 2 O Mg. O Al 2 O 3 Si. O 2 0, 81 – 0, 42 – 0, 31 – Свойства основные сильно слабо Na 2 O + H 2 O = 2 Na. OH; основный амфот ерные 0, 23 – P 2 O 5 SO 3 0, 13 – 0, 03 – Cl 2 O 7 0, 01 – кислотные слабо средне сильно 3 H 2 O + P 2 O 5 = 2 H 3 PO 4 кислотный 3 Ca. O + P 2 O 5 = Ca 3(PO 4)2 основный кислотный Амфотерные оксиды Al 2 O 3 + 6 HCl + 9 H 2 O = 2[Al(OH 2)6]Cl 3 Al 2 O 3 + 9 Na. OH + 3 H 2 O = 2 Na 3[Al(OH)6]Cl
 СЕРА S Открытие - давно Встречается в природе в свободном виде и в виде соединений в природе встречается в виде сульфидов: Fe. S 2 ; Cu. Fe. S 2 ; Hg. S ; As 2 S 3 ; Co. S ; …. в виде сульфатов: Na 2 SO 4· 10 H 2 O мирабелит Cu. SO 4· 2 H 2 O гипс Ba. SO 4 барит и т. д. Атомные свойства S 2 -х вал. SCl 2 4 -х вал. SCl 4 6 -ти вал. SF 6
СЕРА S Открытие - давно Встречается в природе в свободном виде и в виде соединений в природе встречается в виде сульфидов: Fe. S 2 ; Cu. Fe. S 2 ; Hg. S ; As 2 S 3 ; Co. S ; …. в виде сульфатов: Na 2 SO 4· 10 H 2 O мирабелит Cu. SO 4· 2 H 2 O гипс Ba. SO 4 барит и т. д. Атомные свойства S 2 -х вал. SCl 2 4 -х вал. SCl 4 6 -ти вал. SF 6
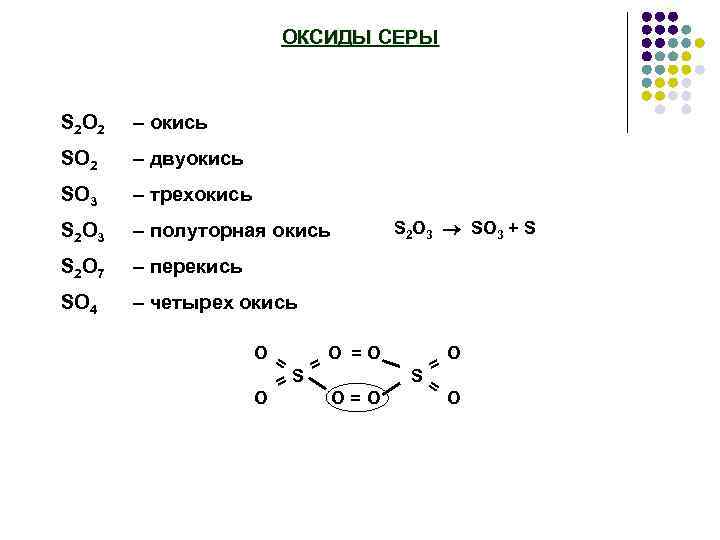 ОКСИДЫ СЕРЫ S 2 O 2 – окись SO 2 – двуокись SO 3 – трехокись S 2 O 3 – полуторная окись S 2 O 7 – перекись SO 4 – четырех окись O= O =S = S 2 O 3 SO 3 + S O =O O= O = S= O O
ОКСИДЫ СЕРЫ S 2 O 2 – окись SO 2 – двуокись SO 3 – трехокись S 2 O 3 – полуторная окись S 2 O 7 – перекись SO 4 – четырех окись O= O =S = S 2 O 3 SO 3 + S O =O O= O = S= O O
 Степени окисления: – 2; +4; +6 Аллотропные модификации Ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, молекулы которой состоят из восьми атомов. Физические свойства Сера – твёрдое кристаллическое вещество жёлтого цвета. Получение 1. Неполное окисление сероводорода: H 2 S + O 2 = 2 S + 2 H 2 O (недостаток O 2) 2. Реакция Вакенродера: 2 H 2 S + SO 2 = 3 S + 2 H 2 O
Степени окисления: – 2; +4; +6 Аллотропные модификации Ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, молекулы которой состоят из восьми атомов. Физические свойства Сера – твёрдое кристаллическое вещество жёлтого цвета. Получение 1. Неполное окисление сероводорода: H 2 S + O 2 = 2 S + 2 H 2 O (недостаток O 2) 2. Реакция Вакенродера: 2 H 2 S + SO 2 = 3 S + 2 H 2 O
 Химические свойства 1. Окислительные свойства сера проявляет при взаимодействии с металлами: Fe + S = Fe. S, Hg + S = Hg. S (реакция протекает при комнатной температуре). 2. Восстановительные свойства сера проявляет в реакциях с сильными окислителями: S + О 2 = SО 2
Химические свойства 1. Окислительные свойства сера проявляет при взаимодействии с металлами: Fe + S = Fe. S, Hg + S = Hg. S (реакция протекает при комнатной температуре). 2. Восстановительные свойства сера проявляет в реакциях с сильными окислителями: S + О 2 = SО 2
 Обычно H 2 S получают действием разбавленных кислот на сульфиды: Fe. S + 2 HСl = Fe. Cl 2 + H 2 S Сероводород H 2 S – бесцветный газ с запахом тухлых яиц, ядовит, плохо растворим в воде. Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая двухосновна: H 2 S Н+ + HS-, HS- Н+ + S 2 -. Сероводородная кислота образует два типа солей: сульфиды (в воде растворимы только сульфиды щелочных металлов, аммония, кальция и бария) и гидросульфиды (устойчивы только в растворах). Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу.
Обычно H 2 S получают действием разбавленных кислот на сульфиды: Fe. S + 2 HСl = Fe. Cl 2 + H 2 S Сероводород H 2 S – бесцветный газ с запахом тухлых яиц, ядовит, плохо растворим в воде. Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая двухосновна: H 2 S Н+ + HS-, HS- Н+ + S 2 -. Сероводородная кислота образует два типа солей: сульфиды (в воде растворимы только сульфиды щелочных металлов, аммония, кальция и бария) и гидросульфиды (устойчивы только в растворах). Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу.
 Сульфиды металлов, стоящие в ряду напряжений левее железа, растворимы в сильных кислотах: Zn. S + H 2 SO 4 = Zn. SO 4 + H 2 S Cu. S + H 2 SO 4 Качественная реакция на H 2 S и растворимые сульфиды: H 2 S + Pb(NO 3)2 = Pb. S + 2 HNO 3 Pb. S – осадок чёрного цвета Сероводородная кислота – очень сильный восстановитель. Состав продуктов окисления сероводородной кислоты зависит от силы и количества окислителя: H 2 S + 4 Сl 2 + 4 H 2 O = H 2 SO 4 + 8 HCl 3 H 2 S + 8 HNO 3(конц) = 3 H 2 SO 4 + 8 NO + 4 H 2 O H 2 S + 3 H 2 SO 4(конц) = 4 SO 2 + 4 H 2 O H 2 S + Br 2 = S + 2 HBr 2 Fe. Cl 3 + H 2 S = 2 Fe. Cl 2 + S + 2 HCl
Сульфиды металлов, стоящие в ряду напряжений левее железа, растворимы в сильных кислотах: Zn. S + H 2 SO 4 = Zn. SO 4 + H 2 S Cu. S + H 2 SO 4 Качественная реакция на H 2 S и растворимые сульфиды: H 2 S + Pb(NO 3)2 = Pb. S + 2 HNO 3 Pb. S – осадок чёрного цвета Сероводородная кислота – очень сильный восстановитель. Состав продуктов окисления сероводородной кислоты зависит от силы и количества окислителя: H 2 S + 4 Сl 2 + 4 H 2 O = H 2 SO 4 + 8 HCl 3 H 2 S + 8 HNO 3(конц) = 3 H 2 SO 4 + 8 NO + 4 H 2 O H 2 S + 3 H 2 SO 4(конц) = 4 SO 2 + 4 H 2 O H 2 S + Br 2 = S + 2 HBr 2 Fe. Cl 3 + H 2 S = 2 Fe. Cl 2 + S + 2 HCl
 Оксид серы (VI) получают окислением SO 2 кислородом в присутствии катализатора (V 2 O 5): 2 SO 2 + O 2 2 SO 3 Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту: SO 3 + Н 2 O = Н 2 SO 4 Концентрированная серная кислота окисляет медь, серебро, углерод, фосфор: Сu + 2 H 2 SO 4 = Cu. SO 4 + SO 2 + 2 H 2 O 2 Ag + 2 H 2 SO 4 = Ag 2 SO 4 + SO 2 + 2 H 2 O С + 2 H 2 SO 4 = CO 2 + 2 SO 2 + 2 H 2 O 5 P + 5 H 2 SO 4 = 2 H 3 PO 4 + 5 SO 2 + 2 H 2 O Разбавленная серная кислота окисляет только металлы, стоящие в ряду активности левее водорода, за счёт ионов Н+, например: Zn + H 2 SO 4(разб) = Zn. SO 4 + H 2
Оксид серы (VI) получают окислением SO 2 кислородом в присутствии катализатора (V 2 O 5): 2 SO 2 + O 2 2 SO 3 Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту: SO 3 + Н 2 O = Н 2 SO 4 Концентрированная серная кислота окисляет медь, серебро, углерод, фосфор: Сu + 2 H 2 SO 4 = Cu. SO 4 + SO 2 + 2 H 2 O 2 Ag + 2 H 2 SO 4 = Ag 2 SO 4 + SO 2 + 2 H 2 O С + 2 H 2 SO 4 = CO 2 + 2 SO 2 + 2 H 2 O 5 P + 5 H 2 SO 4 = 2 H 3 PO 4 + 5 SO 2 + 2 H 2 O Разбавленная серная кислота окисляет только металлы, стоящие в ряду активности левее водорода, за счёт ионов Н+, например: Zn + H 2 SO 4(разб) = Zn. SO 4 + H 2


