04 Лекция Арены.ppt
- Количество слайдов: 61
 Лекция 4 Сопряженные системы. Реакции электрофильного замещения SЕ. 1
Лекция 4 Сопряженные системы. Реакции электрофильного замещения SЕ. 1
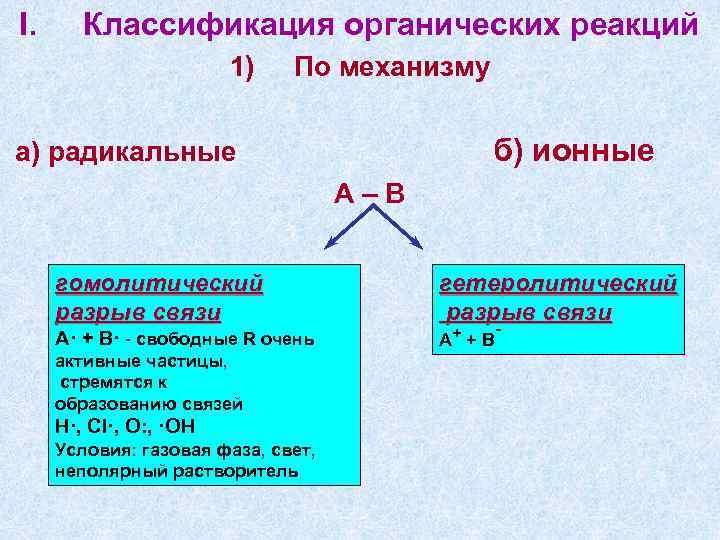 I. Классификация органических реакций 1) По механизму б) ионные а) радикальные А–В гомолитический разрыв связи А· + В· - свободные R очень гетеролитический разрыв связи А+ + В - активные частицы, стремятся к образованию связей Н·, Cl·, O: , ·OH Условия: газовая фаза, свет, неполярный растворитель 2
I. Классификация органических реакций 1) По механизму б) ионные а) радикальные А–В гомолитический разрыв связи А· + В· - свободные R очень гетеролитический разрыв связи А+ + В - активные частицы, стремятся к образованию связей Н·, Cl·, O: , ·OH Условия: газовая фаза, свет, неполярный растворитель 2
 образуются положительные частицы электрофилы - -(Е) (Н+, NO 2+, Br+, SO 3 и т. д. ) и отрицательные частицы – нуклеофилы – Nu (H–, OH–, NH 2, H 2 O и т. д. ) Условия: полярные растворители в) синхронные 3
образуются положительные частицы электрофилы - -(Е) (Н+, NO 2+, Br+, SO 3 и т. д. ) и отрицательные частицы – нуклеофилы – Nu (H–, OH–, NH 2, H 2 O и т. д. ) Условия: полярные растворители в) синхронные 3
 2) По конечному результату S: SR, SE, SN A: AR, AE, AN E O–B (реакции замещения) (реакции присоединения) (реакции отщепления) (окислительно-восстановительные) 3) По числу частиц, принимающих участие в элементарной стадии - мономолекулярные (SN 1) - бимолекулярные (SN 2) 4
2) По конечному результату S: SR, SE, SN A: AR, AE, AN E O–B (реакции замещения) (реакции присоединения) (реакции отщепления) (окислительно-восстановительные) 3) По числу частиц, принимающих участие в элементарной стадии - мономолекулярные (SN 1) - бимолекулярные (SN 2) 4
 II. Электронные эффекты заместителей. Одна из самых трудных и важных задач биоорганической химии – прогнозирование реакционной способности соединения. Обычно участок молекулы, где ē - плотность максимальная или минимальная является самым активным. На реакционную способность влияют: а) электронные эффекты заместителей б) наличие сопряжения в) пространственные факторы 5
II. Электронные эффекты заместителей. Одна из самых трудных и важных задач биоорганической химии – прогнозирование реакционной способности соединения. Обычно участок молекулы, где ē - плотность максимальная или минимальная является самым активным. На реакционную способность влияют: а) электронные эффекты заместителей б) наличие сопряжения в) пространственные факторы 5
 Электронные эффекты заместителей. Любой атом или группа атомов, замещающая H в исходном соединении, называется заместителем. Влияние заместителей определяется электронными эффектами: индуктивным (I) и мезомерным (M). 6
Электронные эффекты заместителей. Любой атом или группа атомов, замещающая H в исходном соединении, называется заместителем. Влияние заместителей определяется электронными эффектами: индуктивным (I) и мезомерным (M). 6
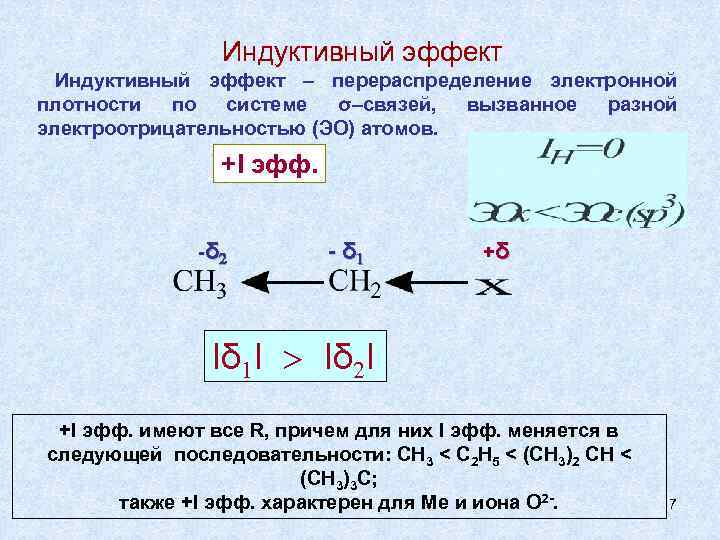 Индуктивный эффект – перераспределение электронной плотности по системе σ–связей, вызванное разной электроотрицательностью (ЭО) атомов. +I эфф. -δ 2 - δ 1 +δ Іδ 1І > Іδ 2І +I эфф. имеют все R, причем для них I эфф. меняется в следующей последовательности: CH 3 < C 2 H 5 < (CH 3)2 CH < (CH 3)3 C; также +I эфф. характерен для Мe и иона О 2 -. 7
Индуктивный эффект – перераспределение электронной плотности по системе σ–связей, вызванное разной электроотрицательностью (ЭО) атомов. +I эфф. -δ 2 - δ 1 +δ Іδ 1І > Іδ 2І +I эфф. имеют все R, причем для них I эфф. меняется в следующей последовательности: CH 3 < C 2 H 5 < (CH 3)2 CH < (CH 3)3 C; также +I эфф. характерен для Мe и иона О 2 -. 7
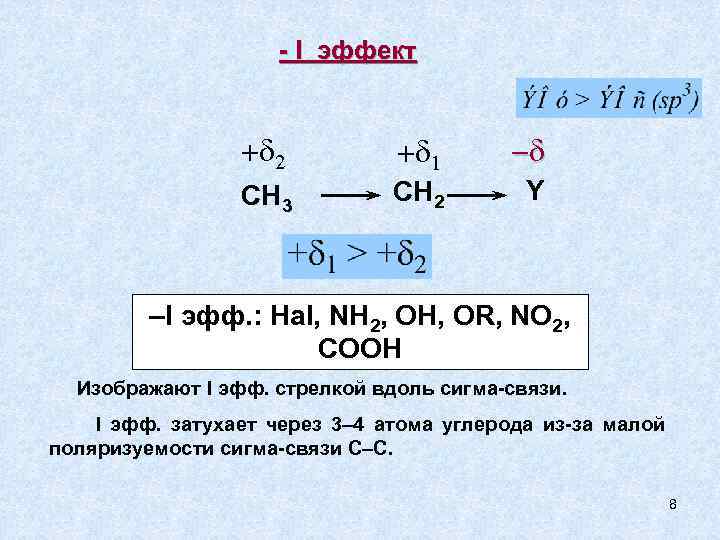 - I эффект + 2 + 1 - CH 3 CH 2 Y –I эфф. : Hal, NH 2, OH, OR, NO 2, COOH Изображают I эфф. стрелкой вдоль сигма-связи. I эфф. затухает через 3– 4 атома углерода из-за малой поляризуемости сигма-связи С–С. 8
- I эффект + 2 + 1 - CH 3 CH 2 Y –I эфф. : Hal, NH 2, OH, OR, NO 2, COOH Изображают I эфф. стрелкой вдоль сигма-связи. I эфф. затухает через 3– 4 атома углерода из-за малой поляризуемости сигма-связи С–С. 8
 МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ) Мезомерный эффект (М) – перераспределение электронной плотности по системе p–связей. М эфф. , в отличие от I эфф. , возникает лишь там, где появляется сопряжение. Сопряжение – это выравнивание связей и зарядов в реальной молекуле по сравнению с идеальной. Сопряжение возникает в результате образования единого –делокализованного облака, принадлежащего более чем двум атомам. 9
МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ) Мезомерный эффект (М) – перераспределение электронной плотности по системе p–связей. М эфф. , в отличие от I эфф. , возникает лишь там, где появляется сопряжение. Сопряжение – это выравнивание связей и зарядов в реальной молекуле по сравнению с идеальной. Сопряжение возникает в результате образования единого –делокализованного облака, принадлежащего более чем двум атомам. 9
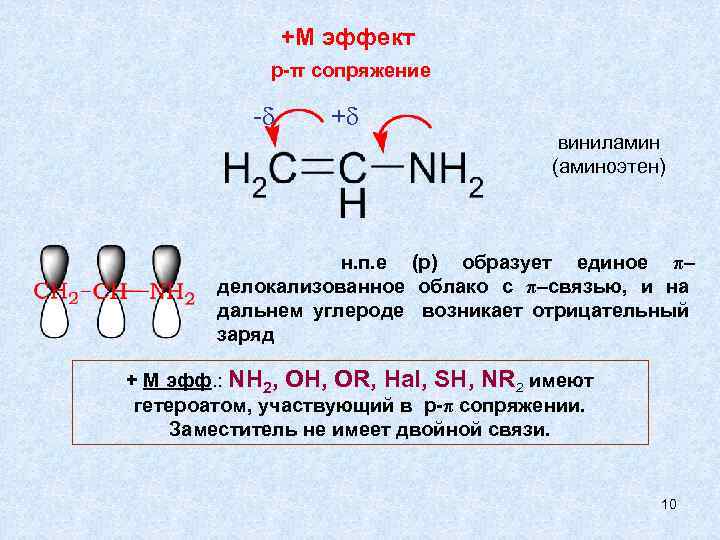 +М эффект p-π сопряжение - + виниламин (аминоэтен) н. п. е (р) образует единое π– делокализованное облако с π–связью, и на дальнем углероде возникает отрицательный заряд + М эфф. : NH 2, OH, OR, Hal, SH, NR 2 имеют гетероатом, участвующий в p-π сопряжении. Заместитель не имеет двойной связи. 10
+М эффект p-π сопряжение - + виниламин (аминоэтен) н. п. е (р) образует единое π– делокализованное облако с π–связью, и на дальнем углероде возникает отрицательный заряд + М эфф. : NH 2, OH, OR, Hal, SH, NR 2 имеют гетероатом, участвующий в p-π сопряжении. Заместитель не имеет двойной связи. 10
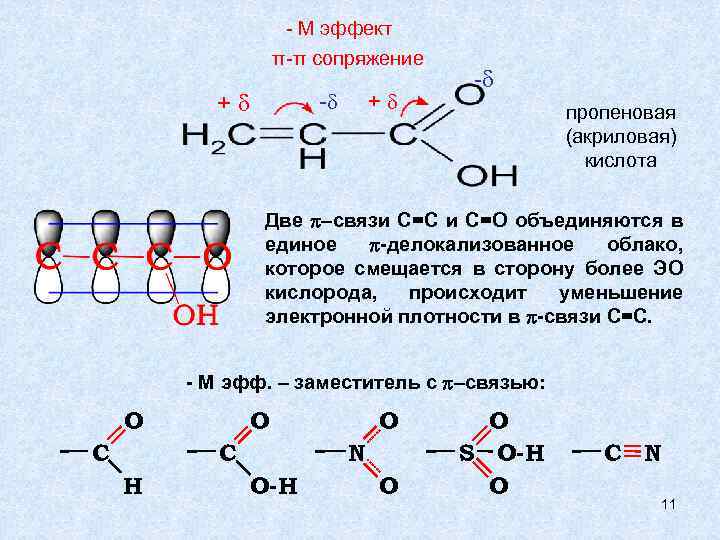 - М эффект π-π сопряжение + + - - пропеновая (акриловая) кислота Две p–связи С=С и С=О объединяются в единое p-делокализованное облако, которое смещается в сторону более ЭО кислорода, происходит уменьшение электронной плотности в p-связи С=С. - М эфф. – заместитель с p–связью: O C H O N O-H O O S O-H O C N 11
- М эффект π-π сопряжение + + - - пропеновая (акриловая) кислота Две p–связи С=С и С=О объединяются в единое p-делокализованное облако, которое смещается в сторону более ЭО кислорода, происходит уменьшение электронной плотности в p-связи С=С. - М эфф. – заместитель с p–связью: O C H O N O-H O O S O-H O C N 11
 Суммарный эффект заместителей складывается из I и М эффектов. В результате заместители делятся на: 1) электронодонорные (ЭД); 2) электроноакцепторные (ЭА). ЭД (+ М > - I) (+ I ) ЭА (- I, - M) (- I > + M) OH, OR, NH 2, NHR, NR 2, SH R COOH, CHO, NO 2, CN, SO 3 Н Hal (F, Cl, Br, I) 12
Суммарный эффект заместителей складывается из I и М эффектов. В результате заместители делятся на: 1) электронодонорные (ЭД); 2) электроноакцепторные (ЭА). ЭД (+ М > - I) (+ I ) ЭА (- I, - M) (- I > + M) OH, OR, NH 2, NHR, NR 2, SH R COOH, CHO, NO 2, CN, SO 3 Н Hal (F, Cl, Br, I) 12
 Системы с открытой цепью сопряжения В результате сопряжения молекула становится более термодинамически устойчивой. Объединение –связей понижает энергию по сравнению с молекулами с изолированными связями. Это понижение энергии называют ЭНЕРГИЕЙ СОПРЯЖЕНИЯ. Чем больше энергия сопряжения, тем устойчивее молекула! 13
Системы с открытой цепью сопряжения В результате сопряжения молекула становится более термодинамически устойчивой. Объединение –связей понижает энергию по сравнению с молекулами с изолированными связями. Это понижение энергии называют ЭНЕРГИЕЙ СОПРЯЖЕНИЯ. Чем больше энергия сопряжения, тем устойчивее молекула! 13
 В сопряженных системах существует чередование двойной и одинарной связей: Если имеется начало и конец сопряжения – это открытая цепь сопряжения. бутадиен-1, 3: Е сопр. = 15 к. Дж/Моль 14
В сопряженных системах существует чередование двойной и одинарной связей: Если имеется начало и конец сопряжения – это открытая цепь сопряжения. бутадиен-1, 3: Е сопр. = 15 к. Дж/Моль 14
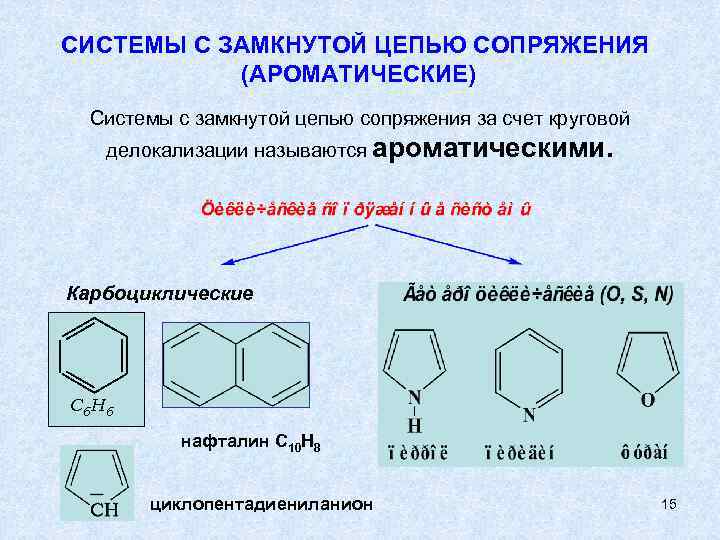 СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ СОПРЯЖЕНИЯ (АРОМАТИЧЕСКИЕ) Системы с замкнутой цепью сопряжения за счет круговой делокализации называются ароматическими. Карбоциклические C 6 H 6 нафталин C 10 H 8 циклопентадиениланион 15
СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ СОПРЯЖЕНИЯ (АРОМАТИЧЕСКИЕ) Системы с замкнутой цепью сопряжения за счет круговой делокализации называются ароматическими. Карбоциклические C 6 H 6 нафталин C 10 H 8 циклопентадиениланион 15
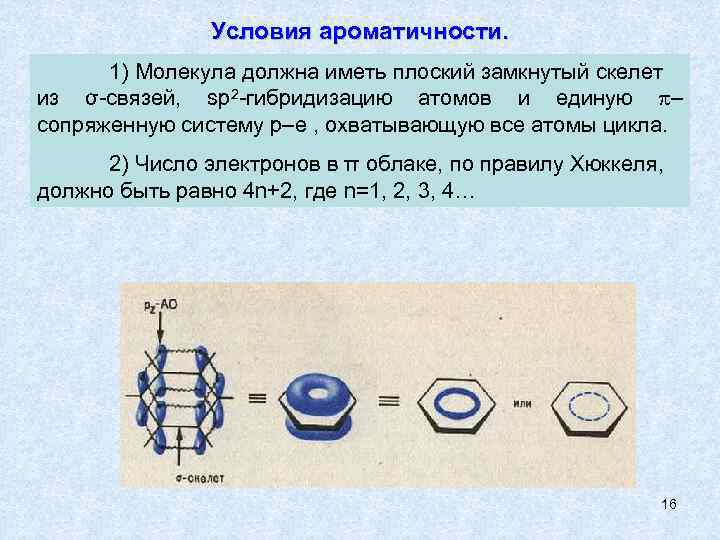 Условия ароматичности. 1) Молекула должна иметь плоский замкнутый скелет из σ-связей, sp 2 -гибридизацию атомов и единую – сопряженную систему р–е , охватывающую все атомы цикла. 2) Число электронов в π облаке, по правилу Хюккеля, должно быть равно 4 n+2, где n=1, 2, 3, 4… 16
Условия ароматичности. 1) Молекула должна иметь плоский замкнутый скелет из σ-связей, sp 2 -гибридизацию атомов и единую – сопряженную систему р–е , охватывающую все атомы цикла. 2) Число электронов в π облаке, по правилу Хюккеля, должно быть равно 4 n+2, где n=1, 2, 3, 4… 16
 ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА 17
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА 17
 Для бензола, как и для других аренов, характерны: ь Устойчивость к окислению (энергия сопряжения =150 к. Дж/моль) ; ь Способность к реакциям SЕ (сохраняющим ароматичность) ь Относительная устойчивость к реакциям присоединения А (жесткие условия). 18
Для бензола, как и для других аренов, характерны: ь Устойчивость к окислению (энергия сопряжения =150 к. Дж/моль) ; ь Способность к реакциям SЕ (сохраняющим ароматичность) ь Относительная устойчивость к реакциям присоединения А (жесткие условия). 18
 Общая схема SE а) Образование электрофильной частицы под действием катализатора: б) Образование π-комплекса π–комплекс: нехимическое соединение, π–облако содержит 6 электронов, ароматический характер не нарушен 19
Общая схема SE а) Образование электрофильной частицы под действием катализатора: б) Образование π-комплекса π–комплекс: нехимическое соединение, π–облако содержит 6 электронов, ароматический характер не нарушен 19
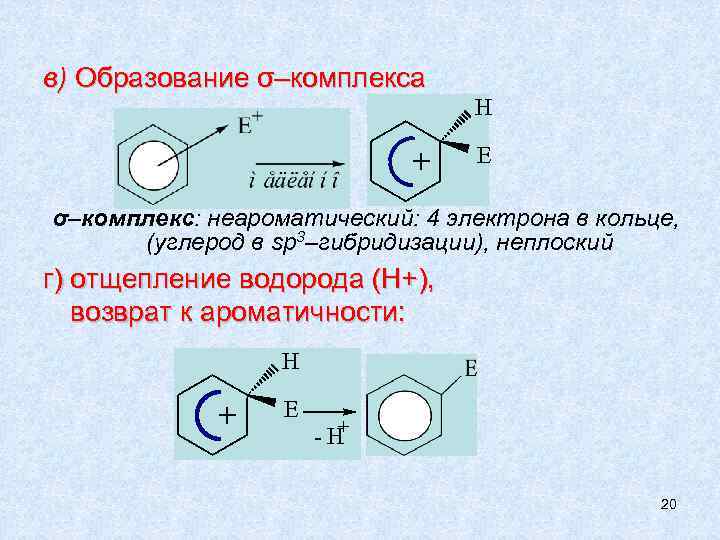 в) Образование σ–комплекса + H E σ–комплекс: неароматический: 4 электрона в кольце, (углерод в sp 3–гибридизации), неплоский г) отщепление водорода (Н+), возврат к ароматичности: H + E + -H 20
в) Образование σ–комплекса + H E σ–комплекс: неароматический: 4 электрона в кольце, (углерод в sp 3–гибридизации), неплоский г) отщепление водорода (Н+), возврат к ароматичности: H + E + -H 20
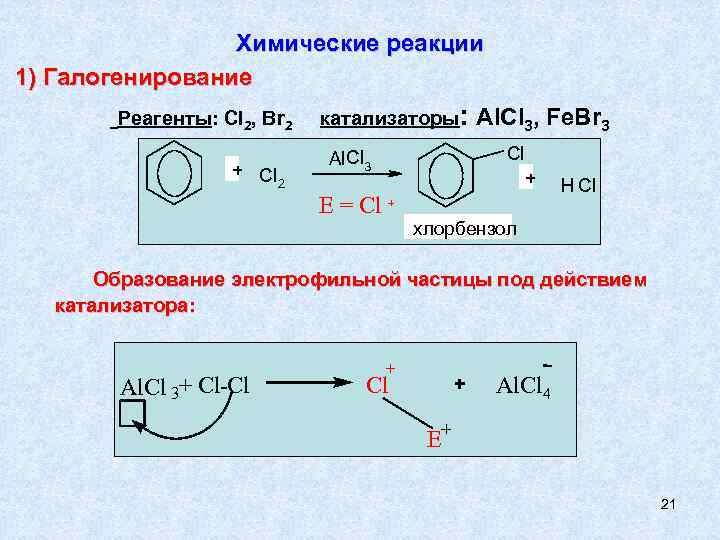 Химические реакции 1) Галогенирование Реагенты: Cl 2, Br 2 + Cl 2 катализаторы: Cl Al. Cl 3 E = Cl Al. Cl 3, Fe. Br 3 + H Cl + хлорбензол Образование электрофильной частицы под действием катализатора: Al. Cl 3+ Cl-Cl + Al. Cl 4 E+ 21
Химические реакции 1) Галогенирование Реагенты: Cl 2, Br 2 + Cl 2 катализаторы: Cl Al. Cl 3 E = Cl Al. Cl 3, Fe. Br 3 + H Cl + хлорбензол Образование электрофильной частицы под действием катализатора: Al. Cl 3+ Cl-Cl + Al. Cl 4 E+ 21
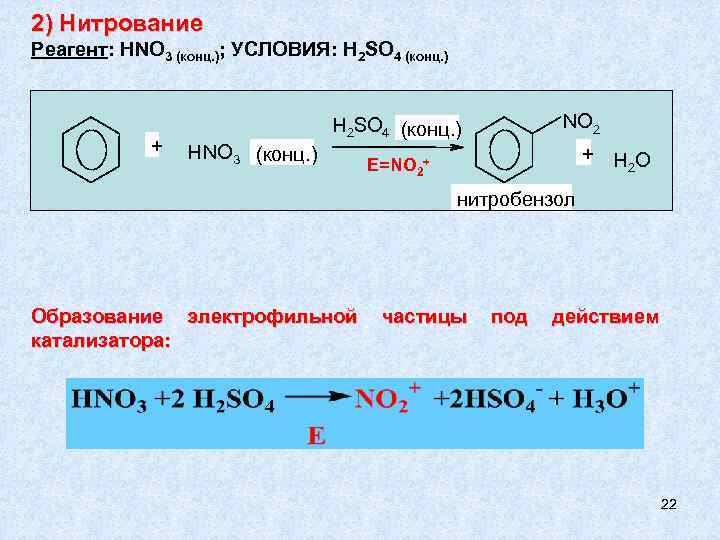 2) Нитрование Реагент: HNO 3 (конц. ); УСЛОВИЯ: H 2 SO 4 (конц. ) + NО 2 H 2 SO 4 (конц. ) H NО 3 (конц. ) + HО 2 E=NO 2+ нитробензол Образование электрофильной катализатора: частицы под действием 22
2) Нитрование Реагент: HNO 3 (конц. ); УСЛОВИЯ: H 2 SO 4 (конц. ) + NО 2 H 2 SO 4 (конц. ) H NО 3 (конц. ) + HО 2 E=NO 2+ нитробензол Образование электрофильной катализатора: частицы под действием 22
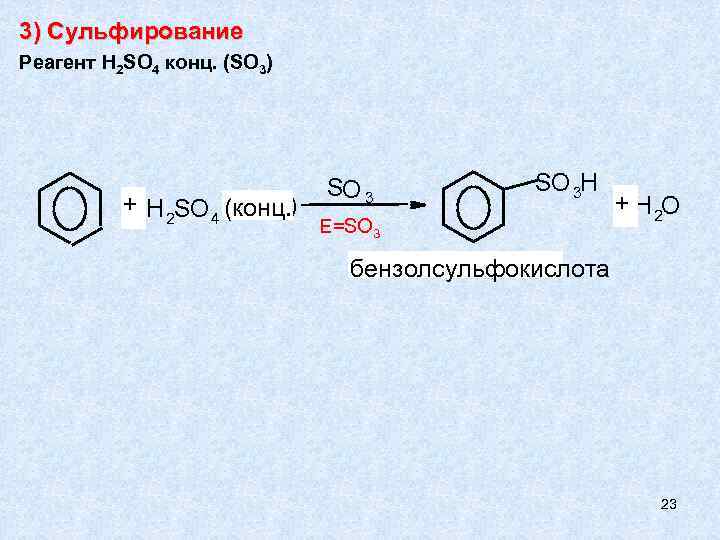 3) Сульфирование Реагент H 2 SO 4 конц. (SO 3) + H 2 SO 4 (конц. ) SО 3 SO 3 H E=SO 3 + H 2 О бензолсульфокислота 23
3) Сульфирование Реагент H 2 SO 4 конц. (SO 3) + H 2 SO 4 (конц. ) SО 3 SO 3 H E=SO 3 + H 2 О бензолсульфокислота 23
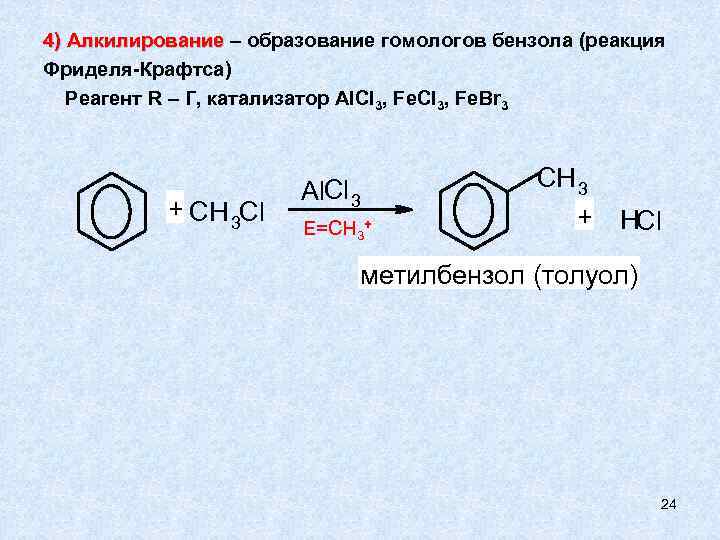 4) Алкилирование – образование гомологов бензола (реакция Фриделя-Крафтса) Реагент R – Г, катализатор Al. Cl 3, Fe. Br 3 + CH 3 Cl Al. Cl 3 E=CH 3+ CH 3 + HCl метилбензол (толуол) 24
4) Алкилирование – образование гомологов бензола (реакция Фриделя-Крафтса) Реагент R – Г, катализатор Al. Cl 3, Fe. Br 3 + CH 3 Cl Al. Cl 3 E=CH 3+ CH 3 + HCl метилбензол (толуол) 24
 ПРАВИЛА ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ 1. Первый заместитель встает в любое положение и влияет на распределение электронной плотности в кольце. 2. По влиянию на распределение электронной плотности заместители делятся на два рода. Заместители первого рода - усиливают электронную плотность в кольце, активируют реакции SЕ, орто- , пара – ориентанты: R, CH 2=CH- , OH, NHR, NR 2, NH 2, OR , (Cl, Br, I) 25
ПРАВИЛА ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ 1. Первый заместитель встает в любое положение и влияет на распределение электронной плотности в кольце. 2. По влиянию на распределение электронной плотности заместители делятся на два рода. Заместители первого рода - усиливают электронную плотность в кольце, активируют реакции SЕ, орто- , пара – ориентанты: R, CH 2=CH- , OH, NHR, NR 2, NH 2, OR , (Cl, Br, I) 25
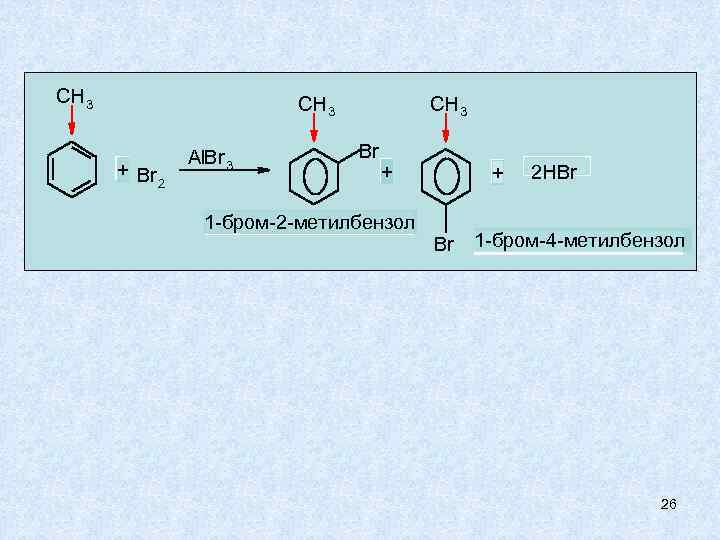 CH 3 + Br 2 Al. Br 3 CH 3 Br + 1 -бром-2 -метилбензол + Br 2 HBr 1 -бром-4 -метилбензол 26
CH 3 + Br 2 Al. Br 3 CH 3 Br + 1 -бром-2 -метилбензол + Br 2 HBr 1 -бром-4 -метилбензол 26
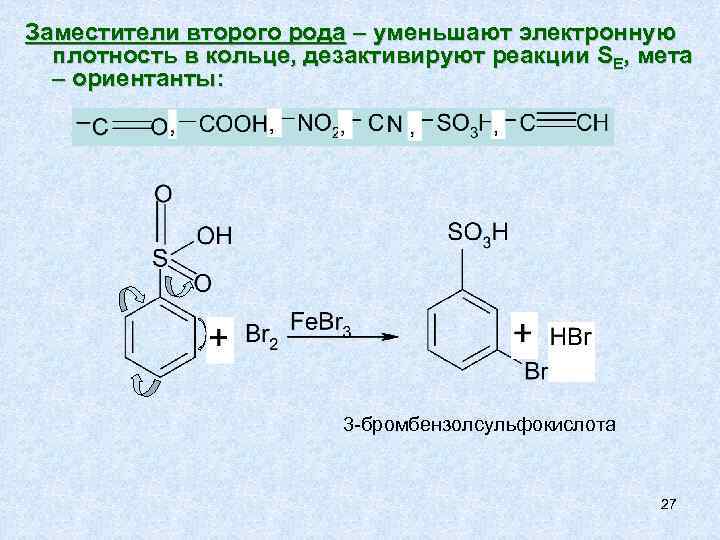 Заместители второго рода – уменьшают электронную плотность в кольце, дезактивируют реакции SE, мета – ориентанты: 3 -бромбензолсульфокислота 27
Заместители второго рода – уменьшают электронную плотность в кольце, дезактивируют реакции SE, мета – ориентанты: 3 -бромбензолсульфокислота 27
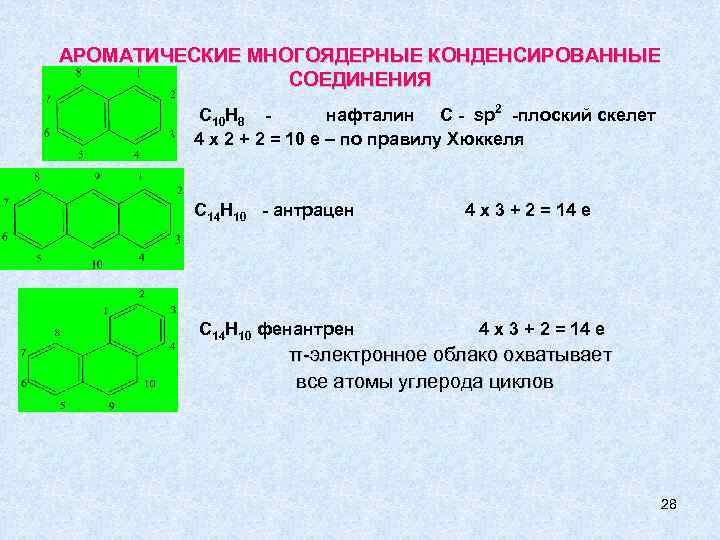 АРОМАТИЧЕСКИЕ МНОГОЯДЕРНЫЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ С 10 Н 8 нафталин С - sp 2 -плоский скелет 4 х 2 + 2 = 10 е – по правилу Хюккеля С 14 Н 10 - антрацен С 14 Н 10 фенантрен 4 х 3 + 2 = 14 е π-электронное облако охватывает все атомы углерода циклов 28
АРОМАТИЧЕСКИЕ МНОГОЯДЕРНЫЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ С 10 Н 8 нафталин С - sp 2 -плоский скелет 4 х 2 + 2 = 10 е – по правилу Хюккеля С 14 Н 10 - антрацен С 14 Н 10 фенантрен 4 х 3 + 2 = 14 е π-электронное облако охватывает все атомы углерода циклов 28
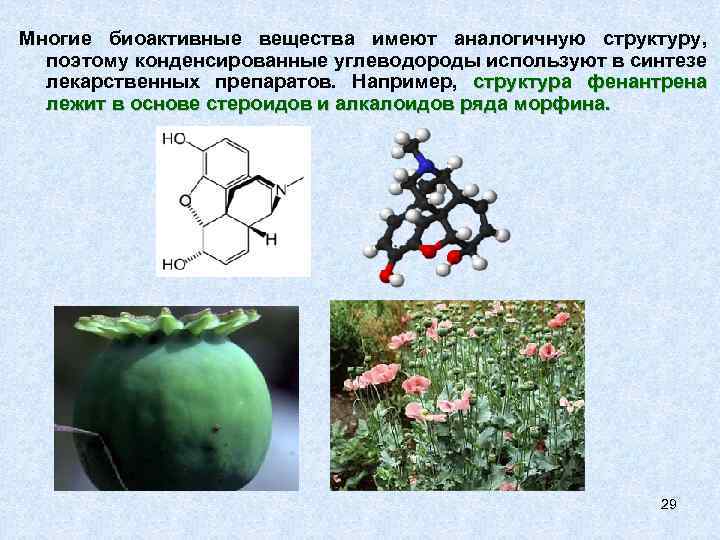 Многие биоактивные вещества имеют аналогичную структуру, поэтому конденсированные углеводороды используют в синтезе лекарственных препаратов. Например, структура фенантрена лежит в основе стероидов и алкалоидов ряда морфина. 29
Многие биоактивные вещества имеют аналогичную структуру, поэтому конденсированные углеводороды используют в синтезе лекарственных препаратов. Например, структура фенантрена лежит в основе стероидов и алкалоидов ряда морфина. 29
 • Структура тетрацена – в тетрациклиновых антибиотиках. • Эти антибиотики представляют собой производные частично гидрированного нафтацена – соединения, состоящего из четырех линейно конденсированных шестичленных карбоциклов. Тетрациклины обладают широким спектром антимикробного действия и могут быть использованы даже при вирусных заболеваниях. 30
• Структура тетрацена – в тетрациклиновых антибиотиках. • Эти антибиотики представляют собой производные частично гидрированного нафтацена – соединения, состоящего из четырех линейно конденсированных шестичленных карбоциклов. Тетрациклины обладают широким спектром антимикробного действия и могут быть использованы даже при вирусных заболеваниях. 30
 Некоторые многоядерные конденсированные углеводороды обладают канцерогенными свойствами. Они изучаются в связи с проблемами раковых заболеваний. Например: Из холестерина в организме может образовываться метилхолантрен. З, 4 – бензпирен содержится в табачнoм дыме, легко окисляется по дыме связям (1, 2 и 3, 4). Вступает во взаимодействие с NH 2 - группами гуанина (в ДНК), что приводит к необратимым изменением в ДНК и возникновению раковых заболеваний клеток. 31
Некоторые многоядерные конденсированные углеводороды обладают канцерогенными свойствами. Они изучаются в связи с проблемами раковых заболеваний. Например: Из холестерина в организме может образовываться метилхолантрен. З, 4 – бензпирен содержится в табачнoм дыме, легко окисляется по дыме связям (1, 2 и 3, 4). Вступает во взаимодействие с NH 2 - группами гуанина (в ДНК), что приводит к необратимым изменением в ДНК и возникновению раковых заболеваний клеток. 31
 Химические свойства конденсированных систем Химические свойства подобны свойствам бензола но, в связи с неполной выравненностью электронной плотности, имеют особенности: плотности а) SЕ протекают легче, чем в бензоле б) достаточно активны в реакциях присоединения и окисления 32
Химические свойства конденсированных систем Химические свойства подобны свойствам бензола но, в связи с неполной выравненностью электронной плотности, имеют особенности: плотности а) SЕ протекают легче, чем в бензоле б) достаточно активны в реакциях присоединения и окисления 32
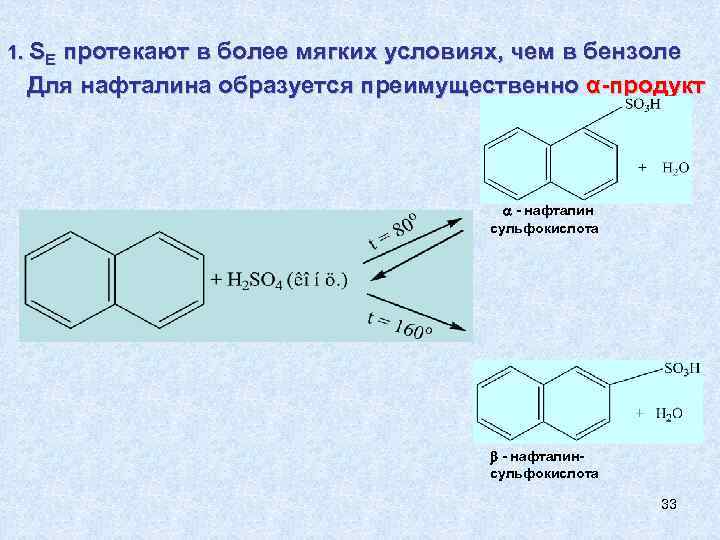 1. SЕ протекают в более мягких условиях, чем в бензоле Для нафталина образуется преимущественно α-продукт - нафталин сульфокислота - нафталинсульфокислота 33
1. SЕ протекают в более мягких условиях, чем в бензоле Для нафталина образуется преимущественно α-продукт - нафталин сульфокислота - нафталинсульфокислота 33
 Замена сульфогруппы на гидроксильную в β– нафталинсульфокислоте приводит к образованию β – нафтола, нафтола который используется в медицине как дезинфицирующее средство. 34
Замена сульфогруппы на гидроксильную в β– нафталинсульфокислоте приводит к образованию β – нафтола, нафтола который используется в медицине как дезинфицирующее средство. 34
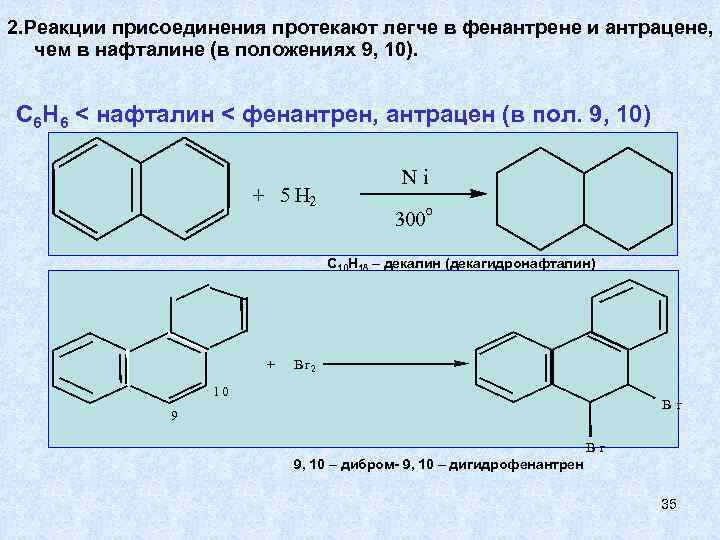 2. Реакции присоединения протекают легче в фенантрене и антрацене, чем в нафталине (в положениях 9, 10). C 6 H 6 < нафталин < фенантрен, антрацен (в пол. 9, 10) + 5 H 2 Ni o 300 C 10 H 18 – декалин (декагидронафталин) + B r 2 10 Br 9, 10 – дибром- 9, 10 – дигидрофенантрен 35
2. Реакции присоединения протекают легче в фенантрене и антрацене, чем в нафталине (в положениях 9, 10). C 6 H 6 < нафталин < фенантрен, антрацен (в пол. 9, 10) + 5 H 2 Ni o 300 C 10 H 18 – декалин (декагидронафталин) + B r 2 10 Br 9, 10 – дибром- 9, 10 – дигидрофенантрен 35
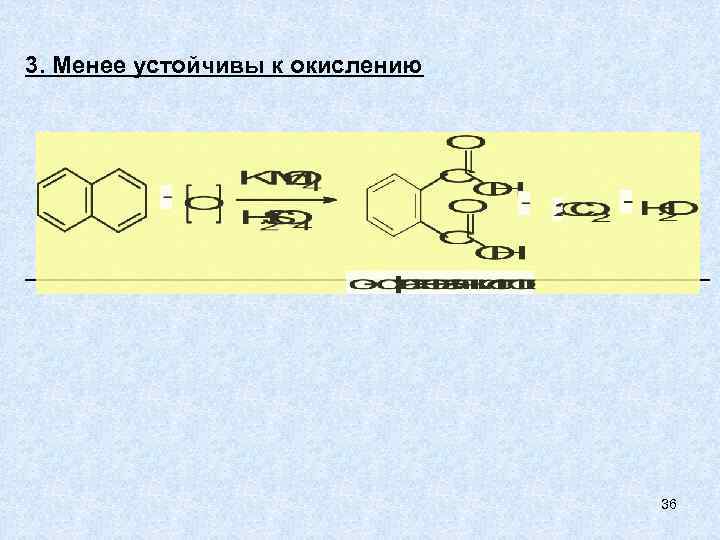 3. Менее устойчивы к окислению 36
3. Менее устойчивы к окислению 36
 БИОЛОГИЧЕСКИ ВАЖНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ Гетероциклическими называются циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов).
БИОЛОГИЧЕСКИ ВАЖНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ Гетероциклическими называются циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов).
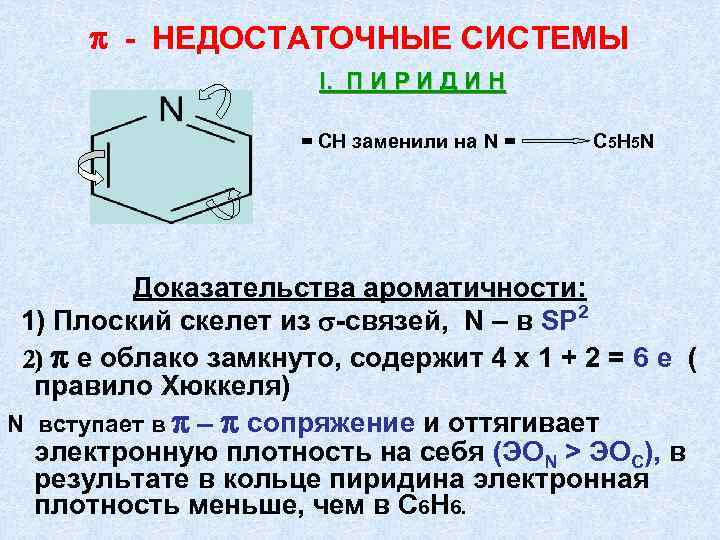 π - НЕДОСТАТОЧНЫЕ СИСТЕМЫ I. П И Р И Д И Н = СН заменили на N = C 5 H 5 N Доказательства ароматичности: 1) Плоский скелет из -связей, N – в SP 2 2) π е облако замкнуто, содержит 4 х 1 + 2 = 6 е ( правило Хюккеля) N вступает в π – π сопряжение и оттягивает электронную плотность на себя (ЭОN > ЭОC), в результате в кольце пиридина электронная плотность меньше, чем в С 6 Н 6.
π - НЕДОСТАТОЧНЫЕ СИСТЕМЫ I. П И Р И Д И Н = СН заменили на N = C 5 H 5 N Доказательства ароматичности: 1) Плоский скелет из -связей, N – в SP 2 2) π е облако замкнуто, содержит 4 х 1 + 2 = 6 е ( правило Хюккеля) N вступает в π – π сопряжение и оттягивает электронную плотность на себя (ЭОN > ЭОC), в результате в кольце пиридина электронная плотность меньше, чем в С 6 Н 6.
 Атом N называют пиридиновым – на внешней sp 2 -гибридизованной атомной орбитали располагается неподеленная электронная пара, которая придаёт основные свойства С 5 Н 5 N. • •
Атом N называют пиридиновым – на внешней sp 2 -гибридизованной атомной орбитали располагается неподеленная электронная пара, которая придаёт основные свойства С 5 Н 5 N. • •
 ХИМИЧЕСКИЕ СВОЙСТВА π-недостаточных систем 1) Реакции SЕ. Меньшая реакционная способность, чем у С 6 Н 6. Реакции SE затруднены 2) Основные свойства 3) Реакции SN в -положение
ХИМИЧЕСКИЕ СВОЙСТВА π-недостаточных систем 1) Реакции SЕ. Меньшая реакционная способность, чем у С 6 Н 6. Реакции SE затруднены 2) Основные свойства 3) Реакции SN в -положение
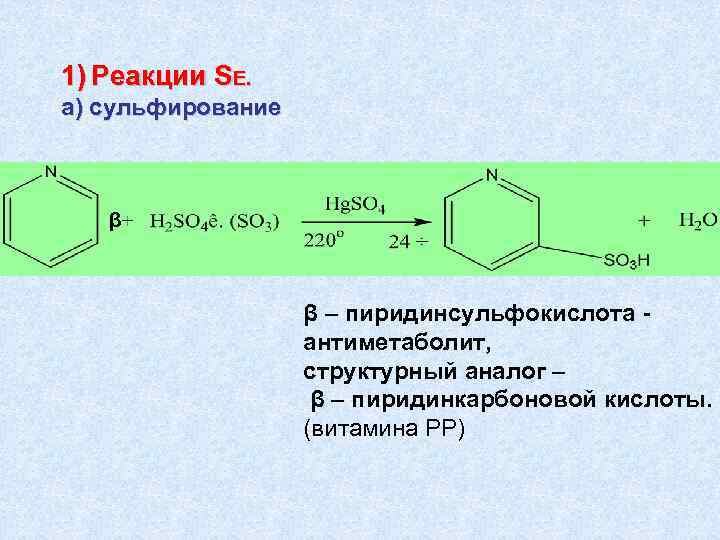 1) Реакции SЕ. а) сульфирование β β – пиридинсульфокислота антиметаболит, структурный аналог – β – пиридинкарбоновой кислоты. (витамина РР)
1) Реакции SЕ. а) сульфирование β β – пиридинсульфокислота антиметаболит, структурный аналог – β – пиридинкарбоновой кислоты. (витамина РР)
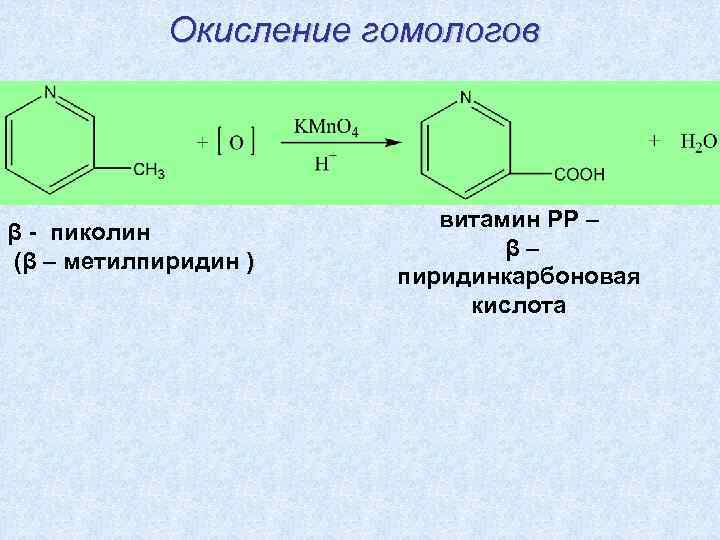 Окисление гомологов β - пиколин (β – метилпиридин ) витамин РР – β– пиридинкарбоновая кислота
Окисление гомологов β - пиколин (β – метилпиридин ) витамин РР – β– пиридинкарбоновая кислота
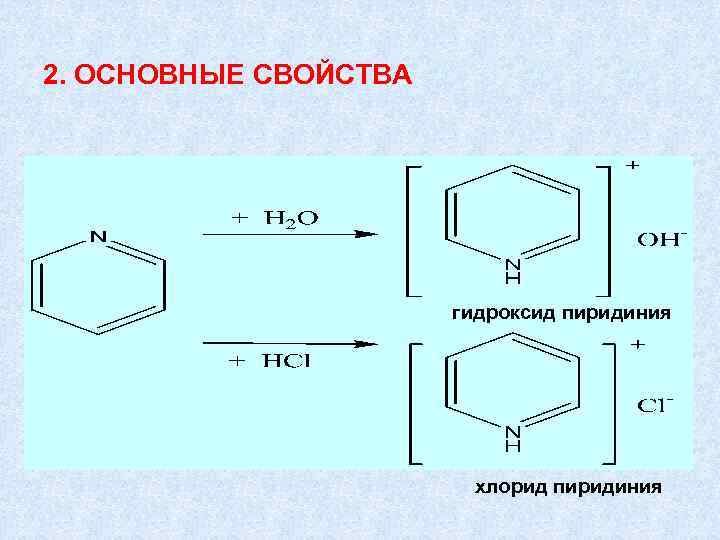 2. ОСНОВНЫЕ СВОЙСТВА гидроксид пиридиния хлорид пиридиния
2. ОСНОВНЫЕ СВОЙСТВА гидроксид пиридиния хлорид пиридиния
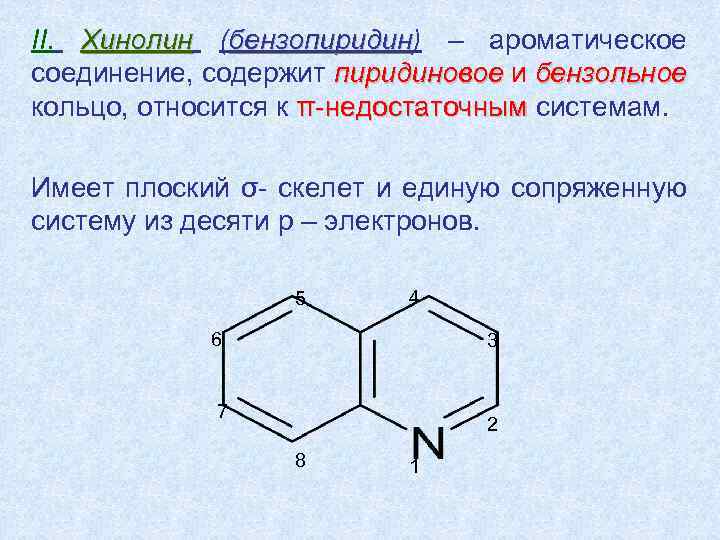 II. Хинолин (бензопиридин) – ароматическое пиридин соединение, содержит пиридиновое и бензольное кольцо, относится к π-недостаточным системам. Имеет плоский σ- скелет и единую сопряженную систему из десяти p – электронов. 5 4 6 3 7 2 8 1
II. Хинолин (бензопиридин) – ароматическое пиридин соединение, содержит пиридиновое и бензольное кольцо, относится к π-недостаточным системам. Имеет плоский σ- скелет и единую сопряженную систему из десяти p – электронов. 5 4 6 3 7 2 8 1
 ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ХИНОЛИНА 1) В реакциях SE атаке подвергается бензольное кольцо (кольцо пиридина является π – недостаточным). Замещение протекает в положении 5 или 8. 2) В реакции SN может вступать только π – недостаточное пиридиновое кольцо (положения 2 и 4).
ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ХИНОЛИНА 1) В реакциях SE атаке подвергается бензольное кольцо (кольцо пиридина является π – недостаточным). Замещение протекает в положении 5 или 8. 2) В реакции SN может вступать только π – недостаточное пиридиновое кольцо (положения 2 и 4).
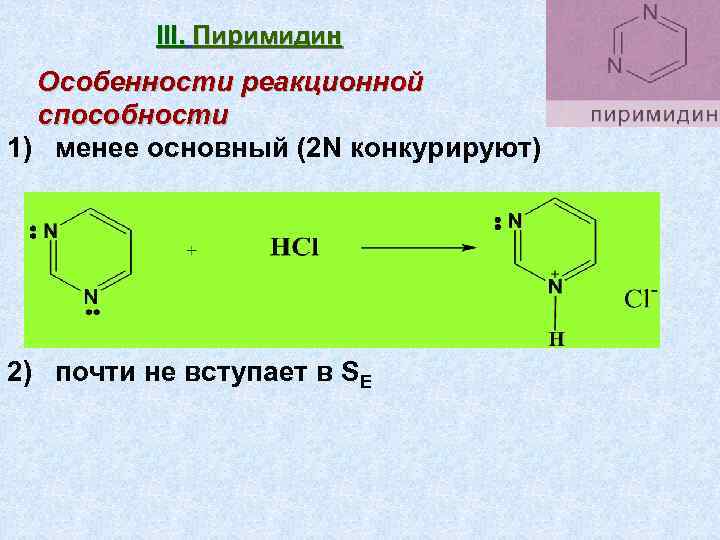 III. Пиримидин Особенности реакционной способности 1) менее основный (2 N конкурируют) 2) почти не вступает в SЕ
III. Пиримидин Особенности реакционной способности 1) менее основный (2 N конкурируют) 2) почти не вступает в SЕ
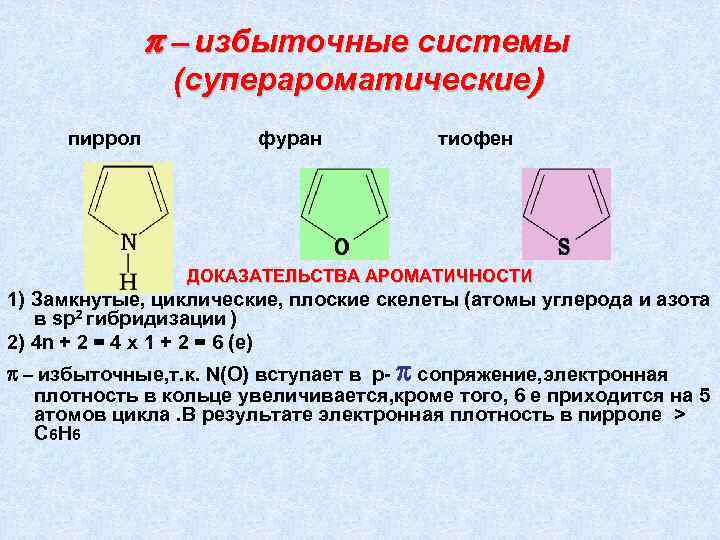 π – избыточные системы (суперароматические) пиррол фуран тиофен ДОКАЗАТЕЛЬСТВА АРОМАТИЧНОСТИ 1) Замкнутые, циклические, плоские скелеты (атомы углерода и азота в sp 2 гибридизации ) 2) 4 n + 2 = 4 х 1 + 2 = 6 (е) π – избыточные, т. к. N(O) вступает в р- π сопряжение, электронная плотность в кольце увеличивается, кроме того, 6 е приходится на 5 атомов цикла. В результате электронная плотность в пирроле > C 6 H 6
π – избыточные системы (суперароматические) пиррол фуран тиофен ДОКАЗАТЕЛЬСТВА АРОМАТИЧНОСТИ 1) Замкнутые, циклические, плоские скелеты (атомы углерода и азота в sp 2 гибридизации ) 2) 4 n + 2 = 4 х 1 + 2 = 6 (е) π – избыточные, т. к. N(O) вступает в р- π сопряжение, электронная плотность в кольце увеличивается, кроме того, 6 е приходится на 5 атомов цикла. В результате электронная плотность в пирроле > C 6 H 6
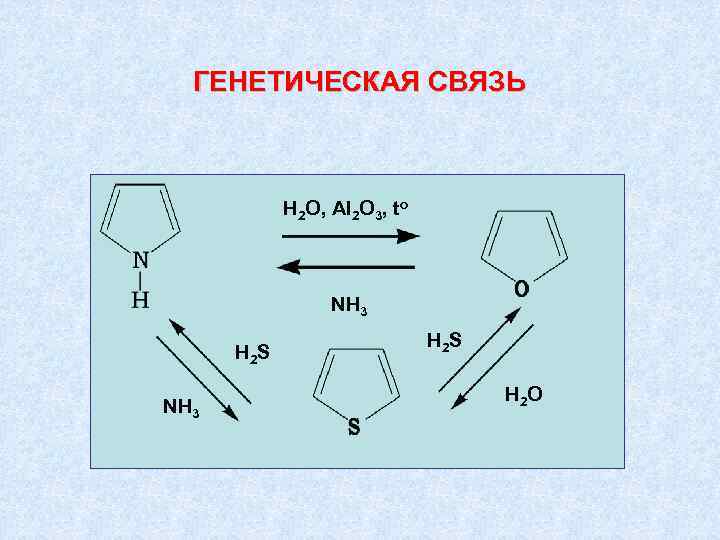 ГЕНЕТИЧЕСКАЯ СВЯЗЬ H 2 O, Al 2 O 3, to NH 3 H 2 S H 2 O
ГЕНЕТИЧЕСКАЯ СВЯЗЬ H 2 O, Al 2 O 3, to NH 3 H 2 S H 2 O
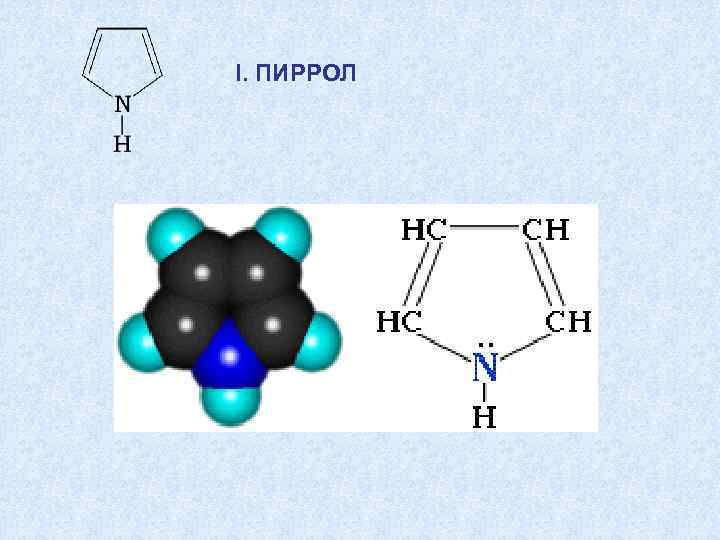 I. ПИРРОЛ
I. ПИРРОЛ
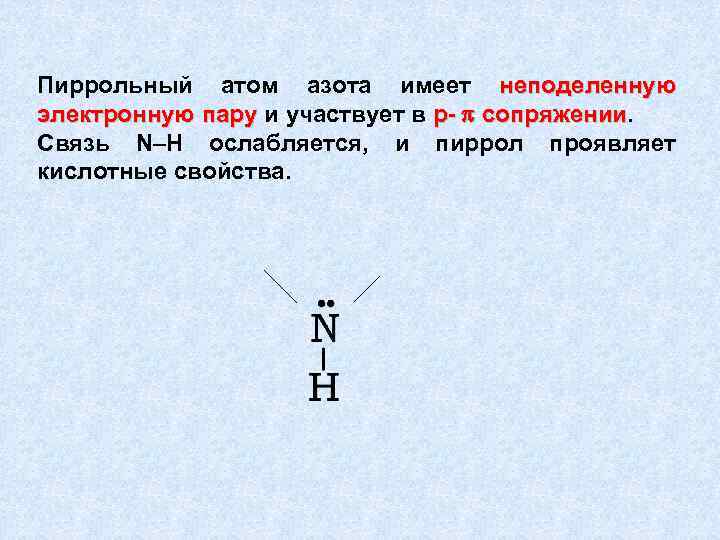 Пиррольный атом азота имеет неподеленную электронную пару и участвует в р- p сопряжении Связь N–Н ослабляется, и пиррол проявляет кислотные свойства.
Пиррольный атом азота имеет неподеленную электронную пару и участвует в р- p сопряжении Связь N–Н ослабляется, и пиррол проявляет кислотные свойства.
 ХИМИЧЕСКИЕ СВОЙСТВА π-избыточных систем 1) Реакции SЕ. Большая реакционная способность, чем у С 6 Н 6 2) а) алкилирование б) галогенирование в) ацилирование г) сульфирование д) нитрование 2) Слабокислые свойства
ХИМИЧЕСКИЕ СВОЙСТВА π-избыточных систем 1) Реакции SЕ. Большая реакционная способность, чем у С 6 Н 6 2) а) алкилирование б) галогенирование в) ацилирование г) сульфирование д) нитрование 2) Слабокислые свойства
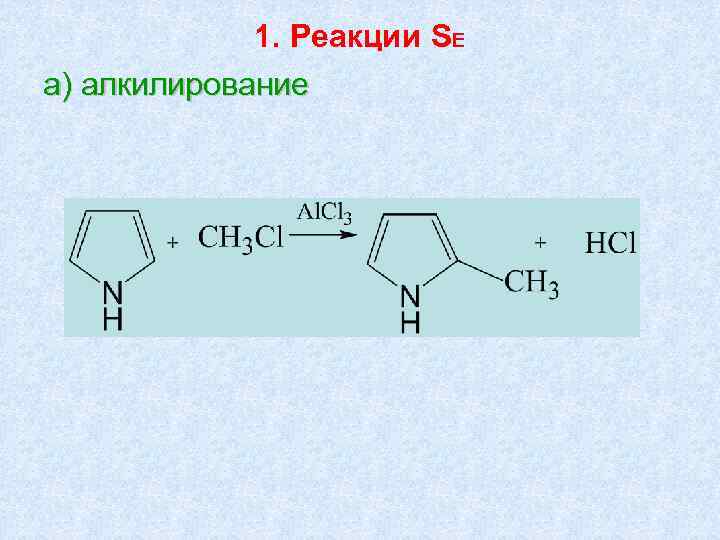 1. Реакции SE а) алкилирование
1. Реакции SE а) алкилирование
 Пиррол и фуран обладают свойствами ацидофобности (т. е. разрушаются в кислой среде Реагент не должен содержать Н+ ) Тиофен – более ароматичен, не боится кислоты.
Пиррол и фуран обладают свойствами ацидофобности (т. е. разрушаются в кислой среде Реагент не должен содержать Н+ ) Тиофен – более ароматичен, не боится кислоты.
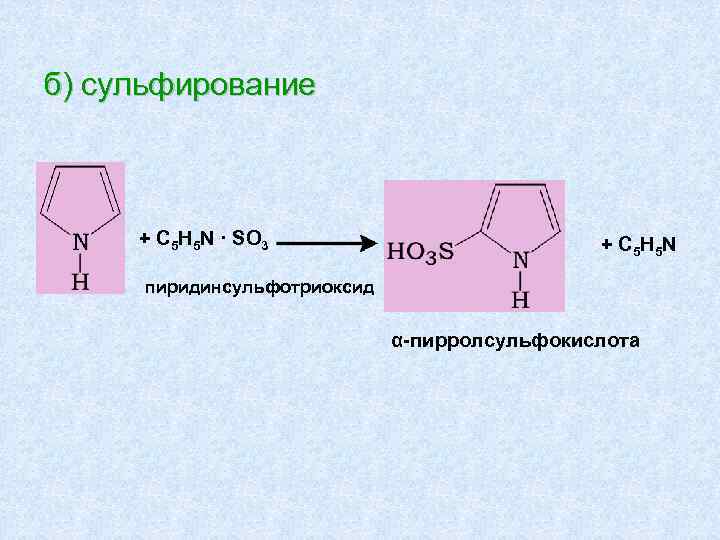 б) сульфирование + С 5 Н 5 N · SO 3 + С 5 H 5 N пиридинсульфотриоксид α-пирролсульфокислота
б) сульфирование + С 5 Н 5 N · SO 3 + С 5 H 5 N пиридинсульфотриоксид α-пирролсульфокислота
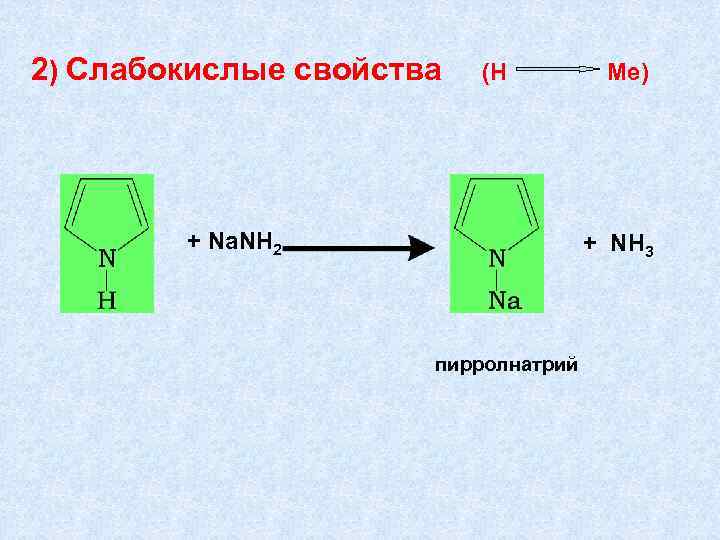 2) Слабокислые свойства (Н + Na. NH 2 Ме) + NH 3 пирролнатрий
2) Слабокислые свойства (Н + Na. NH 2 Ме) + NH 3 пирролнатрий
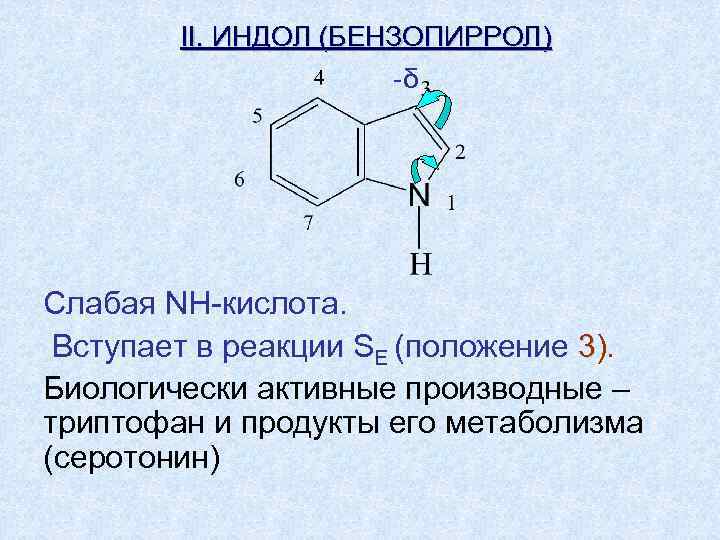 II. ИНДОЛ (БЕНЗОПИРРОЛ) -δ Слабая NH-кислота. Вступает в реакции SE (положение 3). Биологически активные производные – триптофан и продукты его метаболизма (серотонин)
II. ИНДОЛ (БЕНЗОПИРРОЛ) -δ Слабая NH-кислота. Вступает в реакции SE (положение 3). Биологически активные производные – триптофан и продукты его метаболизма (серотонин)
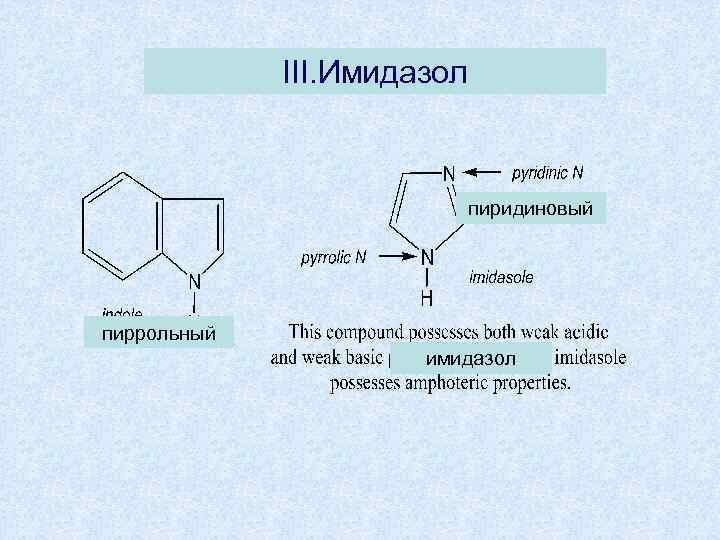 III. Имидазол пиридиновый пиррольный имидазол
III. Имидазол пиридиновый пиррольный имидазол
 • Имидазол-амфотерное соединение, 1. проявляет слабокислотные свойства за счет пиррольного N • 2. слабоосновные – за счет пиридинового N • образует соли с сильными кислотами и щелочными металлами • NH кислотная группа и –N= основная образуют межмолекулярные водородные связи
• Имидазол-амфотерное соединение, 1. проявляет слабокислотные свойства за счет пиррольного N • 2. слабоосновные – за счет пиридинового N • образует соли с сильными кислотами и щелочными металлами • NH кислотная группа и –N= основная образуют межмолекулярные водородные связи
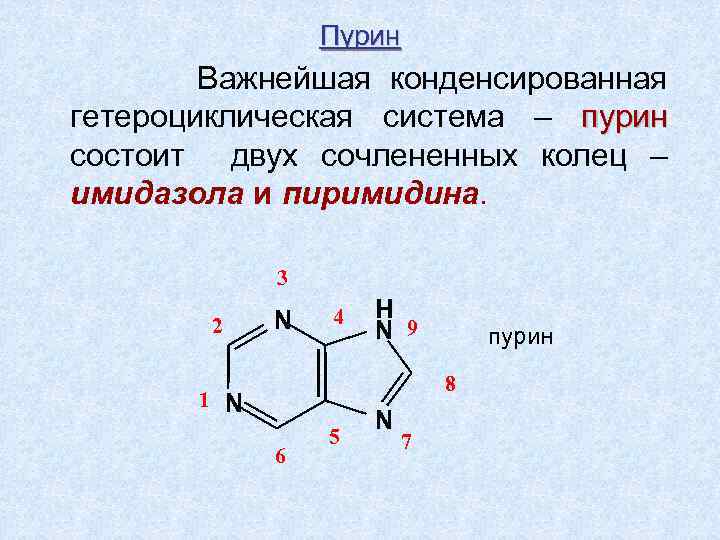 Пурин Важнейшая конденсированная гетероциклическая система – пурин состоит двух сочлененных колец – имидaзола и пиримидина. 3 2 N 4 H N 9 пурин 8 1 N 6 5 N 7
Пурин Важнейшая конденсированная гетероциклическая система – пурин состоит двух сочлененных колец – имидaзола и пиримидина. 3 2 N 4 H N 9 пурин 8 1 N 6 5 N 7
 Свойства пурина 1) устойчив к действию окислителей 2) 3) хорошо растворяется в воде амфотерен, образует соли не только с сильными кислотами, но (благодаря наличию NH – группы) и со щелочными Ме. Наиболее важны гидрокси – и аминопурины, принимающие активное участие процессах жизнедеятельности. в
Свойства пурина 1) устойчив к действию окислителей 2) 3) хорошо растворяется в воде амфотерен, образует соли не только с сильными кислотами, но (благодаря наличию NH – группы) и со щелочными Ме. Наиболее важны гидрокси – и аминопурины, принимающие активное участие процессах жизнедеятельности. в
 СПАСИБО ЗА ВНИМАНИЕ! 61
СПАСИБО ЗА ВНИМАНИЕ! 61


