 Лекция № 4 РАСТВОРЫ
Лекция № 4 РАСТВОРЫ
 План лекции 1. Общие положения; 2. Способы выражения концентраций раствора; 3. Электролитическая диссоциация, р. Н раствора; 4. Гидролиз солей.
План лекции 1. Общие положения; 2. Способы выражения концентраций раствора; 3. Электролитическая диссоциация, р. Н раствора; 4. Гидролиз солей.

 Растворимость Хорошо растворимые (более 10 г в-ва в 1 л воды) Малорастворимые (от 0, 01 до 10 г в-ва в 1 л воды) Нерастворимые (менее 0, 01 г в-ва в 1 л воды) Таблица растворимости
Растворимость Хорошо растворимые (более 10 г в-ва в 1 л воды) Малорастворимые (от 0, 01 до 10 г в-ва в 1 л воды) Нерастворимые (менее 0, 01 г в-ва в 1 л воды) Таблица растворимости
 СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ Массовая концентрация (Массовая доля), – число грамм растворенного вещества, содержащегося в 100 г раствора. 5 % водный раствор HCl 100 г раствора содержит 5 г HCl и 95 г растворителя (воды): 5 г HCl + 95 г H 2 O = 100 г р-ра
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ Массовая концентрация (Массовая доля), – число грамм растворенного вещества, содержащегося в 100 г раствора. 5 % водный раствор HCl 100 г раствора содержит 5 г HCl и 95 г растворителя (воды): 5 г HCl + 95 г H 2 O = 100 г р-ра

![Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n, содержащегося в 1 Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n, содержащегося в 1](https://present5.com/presentation/43238305_452147941/image-7.jpg) Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n, содержащегося в 1 л раствора V. 3 М р-р Na. OH M(Na. OH) = 40 г/моль 3 40 = 120 г В 1 л р-ра – 120 г Na. OH
Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n, содержащегося в 1 л раствора V. 3 М р-р Na. OH M(Na. OH) = 40 г/моль 3 40 = 120 г В 1 л р-ра – 120 г Na. OH
![, [моль/л] , [моль/л]](https://present5.com/presentation/43238305_452147941/image-8.jpg) , [моль/л]
, [моль/л]
 Определите массу нитрата натрия, которая требуется для приготовления 2 л децимолярного раствора (0, 1 м). В 1 л раствора содержится: СМ МNa. NO 3 = 0, 1 моль/л 85 г/моль = = 8, 5 г Na. NO 3 Составим пропорцию: в 1 л р-ра – 8, 5 г Na. NO 3 в 2 л р-ра – х г Na. NO 3 Отсюда: х = 17 г
Определите массу нитрата натрия, которая требуется для приготовления 2 л децимолярного раствора (0, 1 м). В 1 л раствора содержится: СМ МNa. NO 3 = 0, 1 моль/л 85 г/моль = = 8, 5 г Na. NO 3 Составим пропорцию: в 1 л р-ра – 8, 5 г Na. NO 3 в 2 л р-ра – х г Na. NO 3 Отсюда: х = 17 г
![Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] число эквивалентов растворенного вещества nэ, содержащихся в 1 Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] число эквивалентов растворенного вещества nэ, содержащихся в 1](https://present5.com/presentation/43238305_452147941/image-10.jpg) Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] число эквивалентов растворенного вещества nэ, содержащихся в 1 л раствора V. 0, 1 н р-р H 2 SO 4 MЭ(H 2 SO 4) = M/осн-ть = 98/2 = = 49 г/моль 0, 1 49 = 4, 9 г В 1 л р-ра – 4, 9 г H 2 SO 4
Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] число эквивалентов растворенного вещества nэ, содержащихся в 1 л раствора V. 0, 1 н р-р H 2 SO 4 MЭ(H 2 SO 4) = M/осн-ть = 98/2 = = 49 г/моль 0, 1 49 = 4, 9 г В 1 л р-ра – 4, 9 г H 2 SO 4
![, [моль/л] , [моль/л]](https://present5.com/presentation/43238305_452147941/image-11.jpg) , [моль/л]
, [моль/л]
 0, 75 н р-р H 2 SO 4 или CН = 0, 75 моль/л р-ра H 2 SO 4 в 1 л р-ра – 0, 75 моль H 2 SO 4 или в 1 л р-ра – 0, 75 49 = 36, 75 г H 2 SO 4 где 49 – эквивалентная масса H 2 SO 4. В общем виде: в 1 л раствора содержится СН МЭ в заданном V раствора содержится х г
0, 75 н р-р H 2 SO 4 или CН = 0, 75 моль/л р-ра H 2 SO 4 в 1 л р-ра – 0, 75 моль H 2 SO 4 или в 1 л р-ра – 0, 75 49 = 36, 75 г H 2 SO 4 где 49 – эквивалентная масса H 2 SO 4. В общем виде: в 1 л раствора содержится СН МЭ в заданном V раствора содержится х г
![Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n, приходящихся на 1 Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n, приходящихся на 1](https://present5.com/presentation/43238305_452147941/image-13.jpg) Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n, приходящихся на 1 кг растворителя mр-ля. 0, 5 m р-р Na. OH M(Na. OH) = 40 г/моль 0, 5 40 = 20 г В 1000 г р-ля – 20 г Na. OH 1000 г H 2 O + 20 г Na. OH = 1020 г р-ра
Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n, приходящихся на 1 кг растворителя mр-ля. 0, 5 m р-р Na. OH M(Na. OH) = 40 г/моль 0, 5 40 = 20 г В 1000 г р-ля – 20 г Na. OH 1000 г H 2 O + 20 г Na. OH = 1020 г р-ра
![, [моль/кг] , [моль/кг]](https://present5.com/presentation/43238305_452147941/image-14.jpg) , [моль/кг]
, [моль/кг]
 2 m раствор H 2 SO 4 2 моля приходятся на 1000 г растворителя Cm М приходятся на 1000 г растворителя
2 m раствор H 2 SO 4 2 моля приходятся на 1000 г растворителя Cm М приходятся на 1000 г растворителя
![Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося в 1 мл раствора Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося в 1 мл раствора](https://present5.com/presentation/43238305_452147941/image-16.jpg) Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося в 1 мл раствора V: , [г/мл]
Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося в 1 мл раствора V: , [г/мл]
 Способы выражения концентраций растворов Наименование концентрации Уравнение расчета Единицы измерения Массовая концентрация (доля) %, доли Молярная концентрация (молярность) моль/л (0, 5 м р-р) Нормальная концентрация (нормальность) моль/л (0, 5 н р-р) Моляльная концентрация (моляльность) моль/кг (0, 5 m р-р) Титр г/мл
Способы выражения концентраций растворов Наименование концентрации Уравнение расчета Единицы измерения Массовая концентрация (доля) %, доли Молярная концентрация (молярность) моль/л (0, 5 м р-р) Нормальная концентрация (нормальность) моль/л (0, 5 н р-р) Моляльная концентрация (моляльность) моль/кг (0, 5 m р-р) Титр г/мл
 Закон эквивалентов для растворов Объемы реагирующих веществ обратно пропорциональны их нормальностям:
Закон эквивалентов для растворов Объемы реагирующих веществ обратно пропорциональны их нормальностям:
 Закон эквивалентов для растворов
Закон эквивалентов для растворов
 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ диссоциация KA ⇄ K+ + A¯ Катион Анион Na. Cl ⇄ Na+ + Cl– Степень диссоциации:
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ диссоциация KA ⇄ K+ + A¯ Катион Анион Na. Cl ⇄ Na+ + Cl– Степень диссоциации:
 a 30 % a 3% Сильные электролиты Слабые электролиты 1. HCl, HBr, HI, НNО 3, 1. HF, H 2 S, HCN, Н 3 ВО 3, H 2 SO 4, НСl. О 3, Н 2 СО 3, H 2 Si. O 3, HNO 2, Н 2 Сr. О 4, Н 2 Сr 2 О 7, H 3 PO 4, Н 2 НРО 3, , НМn. О 4 HCl. O 2, HCl. O 2. Все щелочи 2. Нерастворимые 3. Почти все основания, NH 4 OH растворимые соли 3. Некоторые соли Zn. Cl 2, Hg. Cl 2
a 30 % a 3% Сильные электролиты Слабые электролиты 1. HCl, HBr, HI, НNО 3, 1. HF, H 2 S, HCN, Н 3 ВО 3, H 2 SO 4, НСl. О 3, Н 2 СО 3, H 2 Si. O 3, HNO 2, Н 2 Сr. О 4, Н 2 Сr 2 О 7, H 3 PO 4, Н 2 НРО 3, , НМn. О 4 HCl. O 2, HCl. O 2. Все щелочи 2. Нерастворимые 3. Почти все основания, NH 4 OH растворимые соли 3. Некоторые соли Zn. Cl 2, Hg. Cl 2
 Константа диссоциации СН 3 СООН ⇄ –+ СН 3 СОО Кдис(СН 3 СООН) = 1, 8 10– 5 Кдис (НСN) = 8 10– 10 + Н
Константа диссоциации СН 3 СООН ⇄ –+ СН 3 СОО Кдис(СН 3 СООН) = 1, 8 10– 5 Кдис (НСN) = 8 10– 10 + Н
![Электролитическая диссоциация воды Н 2 О ⇄ Н+ + ОН– где [H+], [OH–] и Электролитическая диссоциация воды Н 2 О ⇄ Н+ + ОН– где [H+], [OH–] и](https://present5.com/presentation/43238305_452147941/image-23.jpg) Электролитическая диссоциация воды Н 2 О ⇄ Н+ + ОН– где [H+], [OH–] и [H 2 O] – молярные концентрации частиц в воде. Молярная концентрация воды (CM): 1 моль Н 2 О – 18 г х моль Н 2 О – 1000 г в 1 л воды x = 1000/18 = 55, 5 моль/л [H 2 O] = 55, 5 моль/л
Электролитическая диссоциация воды Н 2 О ⇄ Н+ + ОН– где [H+], [OH–] и [H 2 O] – молярные концентрации частиц в воде. Молярная концентрация воды (CM): 1 моль Н 2 О – 18 г х моль Н 2 О – 1000 г в 1 л воды x = 1000/18 = 55, 5 моль/л [H 2 O] = 55, 5 моль/л
![KH 2 O – константа воды Ионное произведение воды: KH 2 O = [H+][OH–] KH 2 O – константа воды Ионное произведение воды: KH 2 O = [H+][OH–]](https://present5.com/presentation/43238305_452147941/image-24.jpg) KH 2 O – константа воды Ионное произведение воды: KH 2 O = [H+][OH–] = 10– 14 моль/л в чистой воде [H+] = [OH–] = 10– 7 моль/л Нейтральная среда [H+] = [OH–] = 10– 7 Кислая среда [H+] > 10– 7 > [OH–] Щелочная среда [H+] < 10– 7 < [OH–]
KH 2 O – константа воды Ионное произведение воды: KH 2 O = [H+][OH–] = 10– 14 моль/л в чистой воде [H+] = [OH–] = 10– 7 моль/л Нейтральная среда [H+] = [OH–] = 10– 7 Кислая среда [H+] > 10– 7 > [OH–] Щелочная среда [H+] < 10– 7 < [OH–]
![Водородный показатель p. H = –lg[H+] = 10– 7 p. H = –lg 10– Водородный показатель p. H = –lg[H+] = 10– 7 p. H = –lg 10–](https://present5.com/presentation/43238305_452147941/image-25.jpg) Водородный показатель p. H = –lg[H+] = 10– 7 p. H = –lg 10– 7 = 7 нейтральная среда p. H < 7 кислая среда p. H > 7 щелочная среда
Водородный показатель p. H = –lg[H+] = 10– 7 p. H = –lg 10– 7 = 7 нейтральная среда p. H < 7 кислая среда p. H > 7 щелочная среда
![[H+] = 10– 2 моль/л p. H = ? p. H = –lg[H+] = [H+] = 10– 2 моль/л p. H = ? p. H = –lg[H+] =](https://present5.com/presentation/43238305_452147941/image-26.jpg) [H+] = 10– 2 моль/л p. H = ? p. H = –lg[H+] = –lg 10– 2 = 2 кис. ср. [ОH–] = 10– 4 моль/л p. H = ? [H+][OH–] = 10– 14 [H+] 10– 4 = 10– 14 [ H+] = 10– 10 p. H = –lg 10– 10 = 10 щел. ср.
[H+] = 10– 2 моль/л p. H = ? p. H = –lg[H+] = –lg 10– 2 = 2 кис. ср. [ОH–] = 10– 4 моль/л p. H = ? [H+][OH–] = 10– 14 [H+] 10– 4 = 10– 14 [ H+] = 10– 10 p. H = –lg 10– 10 = 10 щел. ср.
 ГИДРОЛИЗ СОЛЕЙ 1. Гидролиз соли, образованной сильным основанием и слабой кислотой. Na 2 CO 3 ⇄ 2 Na+ + CO 32– Na. OН Сильное основание p. H > 7 H 2 CO 3 Слабая кислота
ГИДРОЛИЗ СОЛЕЙ 1. Гидролиз соли, образованной сильным основанием и слабой кислотой. Na 2 CO 3 ⇄ 2 Na+ + CO 32– Na. OН Сильное основание p. H > 7 H 2 CO 3 Слабая кислота
 I ст. CO 32– + H+OН– ⇄ HCO 3– + OН– p. H > 7 Na 2 CO 3 + H 2 O ⇄ Na. HCO 3 + Na. OН –+ II ст. HCO 3 +OН– H ⇄ H 2 CO 3 0+ – OН p. H > 7 Na. HCO 3 + H 2 O ⇄ H 2 CO 3 + Na. OН
I ст. CO 32– + H+OН– ⇄ HCO 3– + OН– p. H > 7 Na 2 CO 3 + H 2 O ⇄ Na. HCO 3 + Na. OН –+ II ст. HCO 3 +OН– H ⇄ H 2 CO 3 0+ – OН p. H > 7 Na. HCO 3 + H 2 O ⇄ H 2 CO 3 + Na. OН
 2. Гидролиз соли, образованной слабым основанием и сильной кислотой. Zn. SO 4 ⇄ Zn 2+ + SO 42– Zn(OН)2 Слабое основание H 2 SO 4 Сильная кислота p. H < 7
2. Гидролиз соли, образованной слабым основанием и сильной кислотой. Zn. SO 4 ⇄ Zn 2+ + SO 42– Zn(OН)2 Слабое основание H 2 SO 4 Сильная кислота p. H < 7
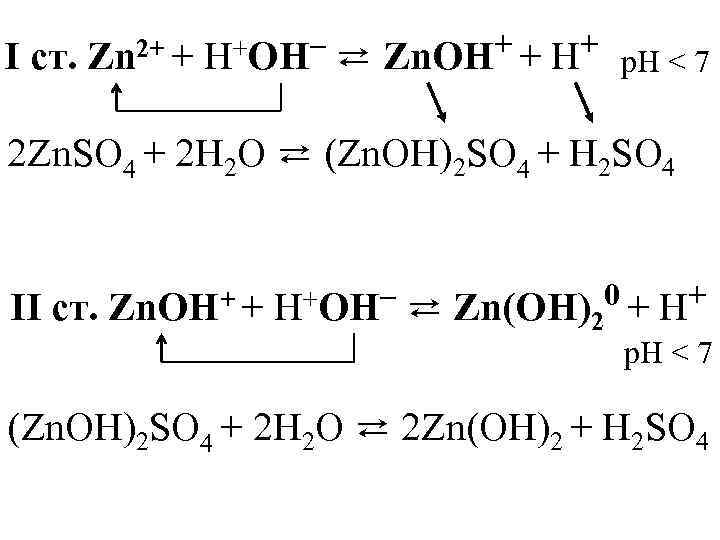 I ст. Zn 2+ + +OН– H ⇄ ++ Zn. OH + Н p. H < 7 2 Zn. SO 4 + 2 H 2 O ⇄ (Zn. OH)2 SO 4 + H 2 SO 4 II ст. Zn. OH+ + H+OН– ⇄ Zn(OH)20 + Н+ p. H < 7 (Zn. OH)2 SO 4 + 2 H 2 O ⇄ 2 Zn(OH)2 + H 2 SO 4
I ст. Zn 2+ + +OН– H ⇄ ++ Zn. OH + Н p. H < 7 2 Zn. SO 4 + 2 H 2 O ⇄ (Zn. OH)2 SO 4 + H 2 SO 4 II ст. Zn. OH+ + H+OН– ⇄ Zn(OH)20 + Н+ p. H < 7 (Zn. OH)2 SO 4 + 2 H 2 O ⇄ 2 Zn(OH)2 + H 2 SO 4
 3. Гидролиз соли, образованной слабым основанием и слабой кислотой. Al 2 S 3 Al(OН)3 Слабое основание H 2 S Слабая кислота p. H = 7
3. Гидролиз соли, образованной слабым основанием и слабой кислотой. Al 2 S 3 Al(OН)3 Слабое основание H 2 S Слабая кислота p. H = 7
 Al 2 S 3 + 6 H 2 O ⇄ 2 Al(OH)3 + 3 H 2 S 2 Al 3+ + 3 S 2– + 6 H 2 O ⇄ 2 Al(OH)3 + 3 Н 2 S
Al 2 S 3 + 6 H 2 O ⇄ 2 Al(OH)3 + 3 H 2 S 2 Al 3+ + 3 S 2– + 6 H 2 O ⇄ 2 Al(OH)3 + 3 Н 2 S
 Соль образованная сильным основанием и сильной кислотой гидролизу не подвергается (не реагирует в водой) Na. Cl + H 2 O ≠ Na. OH HCl Сильное основание Сильная кислота p. H = 7 гидролиз не идет
Соль образованная сильным основанием и сильной кислотой гидролизу не подвергается (не реагирует в водой) Na. Cl + H 2 O ≠ Na. OH HCl Сильное основание Сильная кислота p. H = 7 гидролиз не идет
 Совместный гидролиз двух солей Al. Cl 3 + Na 2 S + H 2 O = … Записываем обменную реакцию между солями: 2 Al. Cl 3 + 3 Na 2 S = Al 2 S 3 + 6 Na. Cl Гидролизу подвергается только Al 2 S 3: Al 2 S 3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S Результат: 2 Al. Cl 3 + 3 Na 2 S + 6 H 2 O = = 2 Al(OH)3 + 3 H 2 S + 6 Na. Cl
Совместный гидролиз двух солей Al. Cl 3 + Na 2 S + H 2 O = … Записываем обменную реакцию между солями: 2 Al. Cl 3 + 3 Na 2 S = Al 2 S 3 + 6 Na. Cl Гидролизу подвергается только Al 2 S 3: Al 2 S 3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S Результат: 2 Al. Cl 3 + 3 Na 2 S + 6 H 2 O = = 2 Al(OH)3 + 3 H 2 S + 6 Na. Cl


