 Лекция № 4 Растворы
Лекция № 4 Растворы
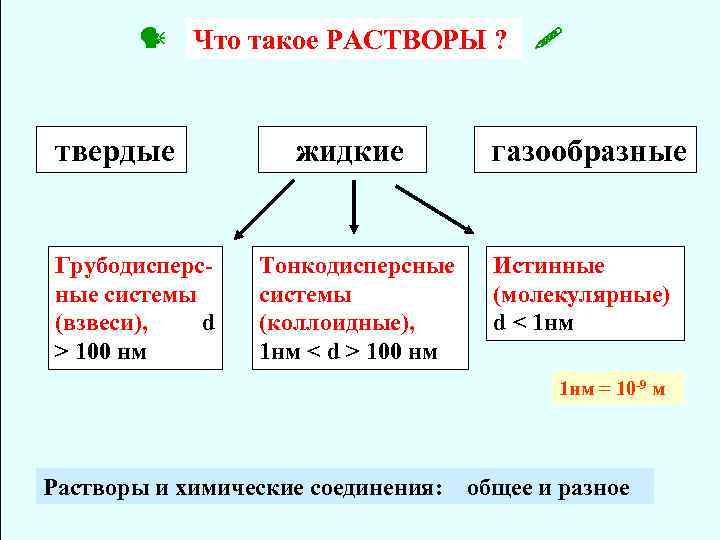 Что такое РАСТВОРЫ ? твердые Грубодисперсные системы (взвеси), d > 100 нм жидкие газообразные Тонкодисперсные системы (коллоидные), 1 нм < d > 100 нм Истинные (молекулярные) d < 1 нм = 10 -9 м Растворы и химические соединения: общее и разное
Что такое РАСТВОРЫ ? твердые Грубодисперсные системы (взвеси), d > 100 нм жидкие газообразные Тонкодисперсные системы (коллоидные), 1 нм < d > 100 нм Истинные (молекулярные) d < 1 нм = 10 -9 м Растворы и химические соединения: общее и разное
 Способы выражения концентрации растворов
Способы выражения концентрации растворов
 Процентная концентрация (C) или массовая доля ( ) Измеряется в % или долях единицы 15%-ный р-р Na. NO 3: 15 г Na. NО 3 в 100 г р-ра mв-ва С (доли ед. ) = ——— mр-ра mв-ва C(%) = ——— · 100 mр-ра m в-ва С(доли ед. ) = ———— mв-ва + mр-ля 0
Процентная концентрация (C) или массовая доля ( ) Измеряется в % или долях единицы 15%-ный р-р Na. NO 3: 15 г Na. NО 3 в 100 г р-ра mв-ва С (доли ед. ) = ——— mр-ра mв-ва C(%) = ——— · 100 mр-ра m в-ва С(доли ед. ) = ———— mв-ва + mр-ля 0
 Мольная доля растворенного вещества (или мольный процент) Обозначается i Измеряется в % или в долях единицы Представляет отношение числа молей данного вещества к общему числу молей в растворе. nв-ва Хв = ——— ni 0<х<1 nв-ва Хв = ——— 100 ni 0 < х < 100 Если В - растворенное вещество, А - растворитель, то:
Мольная доля растворенного вещества (или мольный процент) Обозначается i Измеряется в % или в долях единицы Представляет отношение числа молей данного вещества к общему числу молей в растворе. nв-ва Хв = ——— ni 0<х<1 nв-ва Хв = ——— 100 ni 0 < х < 100 Если В - растворенное вещество, А - растворитель, то:
 Молярная концентрация (или молярность) Обозначается буквами М или СМ (моль/л) 1 М р-р НСl: 1 моль или 36, 5 г НСl в 1 л р-ра mв-ва · 1000 См = —————— Mr · Vр-ра mв-ва · · 1000 СM = ——————— Mr · mр-ра
Молярная концентрация (или молярность) Обозначается буквами М или СМ (моль/л) 1 М р-р НСl: 1 моль или 36, 5 г НСl в 1 л р-ра mв-ва · 1000 См = —————— Mr · Vр-ра mв-ва · · 1000 СM = ——————— Mr · mр-ра
 Нормальная концентрация (или нормальность) Обозначается N, H, н. , CN (моль экв/л) 1 н. р-р Н 2 SO 4: 1 моль экв. или 49 г Н 2 SO 4 в 1 л р-ра mв-ва · 1000 СN = ————— Э · Vр-ра N 1 V 1 = N 2 V 2 mв-ва · · 1000 СN = ——————— Э · mр-ра N=M·Z Z – эквивалентное число, зависит от природы вещества
Нормальная концентрация (или нормальность) Обозначается N, H, н. , CN (моль экв/л) 1 н. р-р Н 2 SO 4: 1 моль экв. или 49 г Н 2 SO 4 в 1 л р-ра mв-ва · 1000 СN = ————— Э · Vр-ра N 1 V 1 = N 2 V 2 mв-ва · · 1000 СN = ——————— Э · mр-ра N=M·Z Z – эквивалентное число, зависит от природы вещества
 Моляльная концентрация (или моляльность) Обозначается буквами Сm или m (моль/1 кг р-ля) 1 m р-р Mg. Cl 2: 1 моль или 95 г Mg. Cl 2 в 1 кг Н 2 О mв-ва · 1000 Сm = ——————— Мr · (mр-ра – mв-ва)
Моляльная концентрация (или моляльность) Обозначается буквами Сm или m (моль/1 кг р-ля) 1 m р-р Mg. Cl 2: 1 моль или 95 г Mg. Cl 2 в 1 кг Н 2 О mв-ва · 1000 Сm = ——————— Мr · (mр-ра – mв-ва)
 Растворимость Что такое растворимость ? ненасыщенные С(ненасыщ. ) насыщенные < С (насыщ. ) пересыщенные < C (пересыщ. ) Растворимость (S) – концентрация насыщенного раствора данного вещества при данной температуре, [г/100 г р-ля]. S(KNO 3) = 110 г/ 100 г воды при 60°С На растворимость влияют: природа растворителя и растворенного вещества температура давление
Растворимость Что такое растворимость ? ненасыщенные С(ненасыщ. ) насыщенные < С (насыщ. ) пересыщенные < C (пересыщ. ) Растворимость (S) – концентрация насыщенного раствора данного вещества при данной температуре, [г/100 г р-ля]. S(KNO 3) = 110 г/ 100 г воды при 60°С На растворимость влияют: природа растворителя и растворенного вещества температура давление
 Природа … “Подобное растворяется в подобном” • Cоли, щелочи (полярные в-ва) - хорошо растворимы в полярных р-рителях (воде) • Кислород (неполярное в-во) - хорошо растворим в неполярных р-рителях (бензоле С 6 Н 6)
Природа … “Подобное растворяется в подобном” • Cоли, щелочи (полярные в-ва) - хорошо растворимы в полярных р-рителях (воде) • Кислород (неполярное в-во) - хорошо растворим в неполярных р-рителях (бензоле С 6 Н 6)
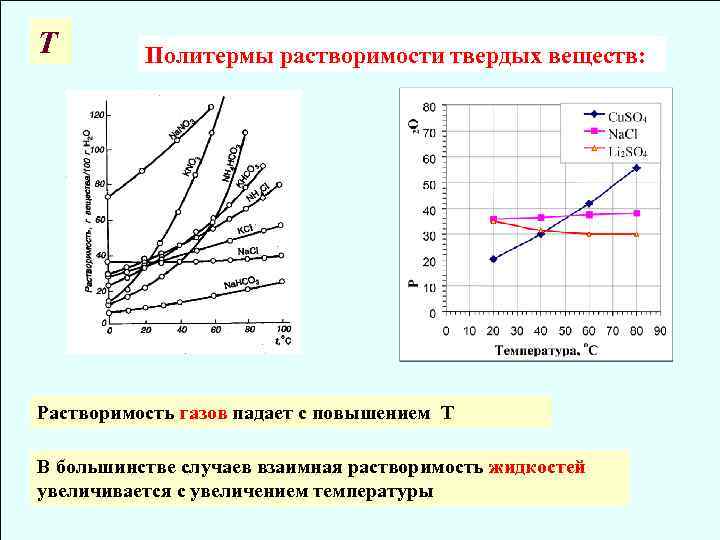 Т Политермы растворимости твердых веществ: Растворимость газов падает с повышением Т В большинстве случаев взаимная растворимость жидкостей увеличивается с увеличением температуры
Т Политермы растворимости твердых веществ: Растворимость газов падает с повышением Т В большинстве случаев взаимная растворимость жидкостей увеличивается с увеличением температуры
 Энтальпия растворения ± Н к. Дж/моль Что такое стандартная энтальпия растворения? Если Нраств > 0 (ЭНДО-), то S растет с ↑Т Если Нраств < 0 (ЭКЗО-), то S падает с ↑Т
Энтальпия растворения ± Н к. Дж/моль Что такое стандартная энтальпия растворения? Если Нраств > 0 (ЭНДО-), то S растет с ↑Т Если Нраств < 0 (ЭКЗО-), то S падает с ↑Т
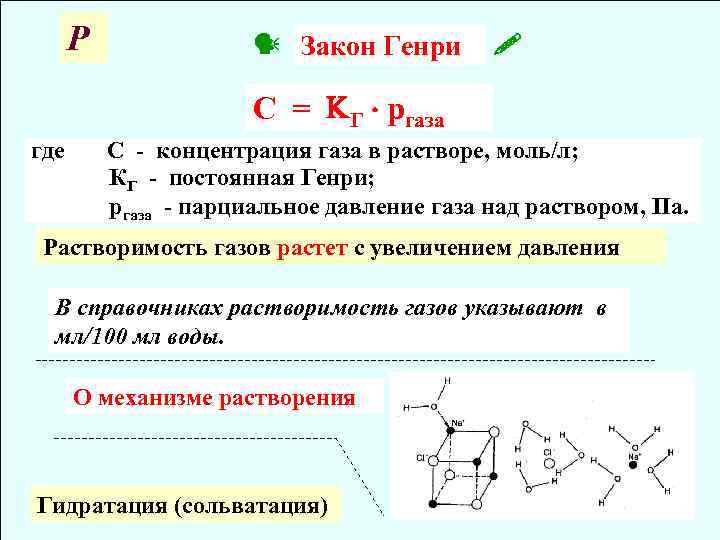 Р Закон Генри C = Г ргаза где C - концентрация газа в растворе, моль/л; КГ - постоянная Генри; ргаза - парциальное давление газа над раствором, Па. Растворимость газов растет с увеличением давления В справочниках растворимость газов указывают в мл/100 мл воды. О механизме растворения Гидратация (сольватация)
Р Закон Генри C = Г ргаза где C - концентрация газа в растворе, моль/л; КГ - постоянная Генри; ргаза - парциальное давление газа над раствором, Па. Растворимость газов растет с увеличением давления В справочниках растворимость газов указывают в мл/100 мл воды. О механизме растворения Гидратация (сольватация)
 Растворимость жидкости в жидкости Спирт и H 2 O – неограниченное растворение Эфир (1) и Н 2 О (2) – ограниченное растворение Закон распределения С 1 и С 2 – равновесные концентрации вещества в жидкостях (1) и (2) К= С 1 С 2 К -коэффициент распределения s (I 2) в хлороформе > s (I 2) в воде в 130 раз Экстрагирование Экстракция
Растворимость жидкости в жидкости Спирт и H 2 O – неограниченное растворение Эфир (1) и Н 2 О (2) – ограниченное растворение Закон распределения С 1 и С 2 – равновесные концентрации вещества в жидкостях (1) и (2) К= С 1 С 2 К -коэффициент распределения s (I 2) в хлороформе > s (I 2) в воде в 130 раз Экстрагирование Экстракция
 Области применение экстракции в металлургии Гидропроцессы в металлургии редких металлов Разделение Ta и Nb Экстрагенты: Разделение Zr и Hf ТБФ (С 4 Н 9 О)3 Р=О Разделение РЗЭ Очистка технического Ge. Cl 4 Очистка растворов солей Th от РЗЭ Экстракция Re, In, Tl, Sc, U из водных растворов О МИБК СН 3 -С-С 4 Н 9 ТОА R 3 N триоктиламин
Области применение экстракции в металлургии Гидропроцессы в металлургии редких металлов Разделение Ta и Nb Экстрагенты: Разделение Zr и Hf ТБФ (С 4 Н 9 О)3 Р=О Разделение РЗЭ Очистка технического Ge. Cl 4 Очистка растворов солей Th от РЗЭ Экстракция Re, In, Tl, Sc, U из водных растворов О МИБК СН 3 -С-С 4 Н 9 ТОА R 3 N триоктиламин
 Пример Способ извлечения таллия из растворов 1. Экстракция (из сернокислого раствора раствором иода в трибутилфосфате) Tl+водн. + I-водн. + (I 2 · 3 ТБФ)орг. = Tl. I 3 · 3 ТБФ 0, 2 – 0, 6 г/л Tl 2. Реэкстракция Tl (раствором серной кислоты c добавкой пероксида водорода) 2(Tl. I 3 · 3 ТБФ) + H 2 SO 4 + H 2 O 2 + 3 ТБФ = Tl 2 SO 4 + 3(I 2 · 3 ТБФ) + 2 H 2 O 20 – 35 г/л
Пример Способ извлечения таллия из растворов 1. Экстракция (из сернокислого раствора раствором иода в трибутилфосфате) Tl+водн. + I-водн. + (I 2 · 3 ТБФ)орг. = Tl. I 3 · 3 ТБФ 0, 2 – 0, 6 г/л Tl 2. Реэкстракция Tl (раствором серной кислоты c добавкой пероксида водорода) 2(Tl. I 3 · 3 ТБФ) + H 2 SO 4 + H 2 O 2 + 3 ТБФ = Tl 2 SO 4 + 3(I 2 · 3 ТБФ) + 2 H 2 O 20 – 35 г/л
 Посмотрите дополнительный материал на сайте кафедры - лекция № 4 Процесс экстракции
Посмотрите дополнительный материал на сайте кафедры - лекция № 4 Процесс экстракции
 СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
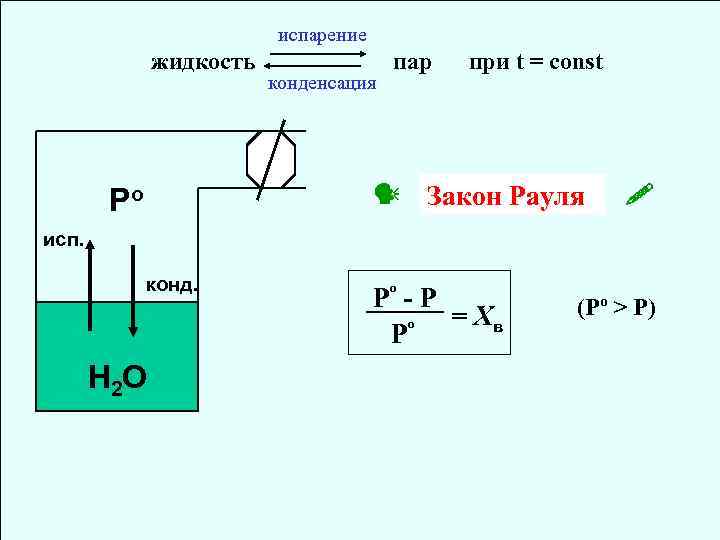 испарение жидкость конденсация пар при t = const Закон Рауля Po исп. конд. Н 2 О Pº - P = Хв º P (Рº > Р)
испарение жидкость конденсация пар при t = const Закон Рауля Po исп. конд. Н 2 О Pº - P = Хв º P (Рº > Р)
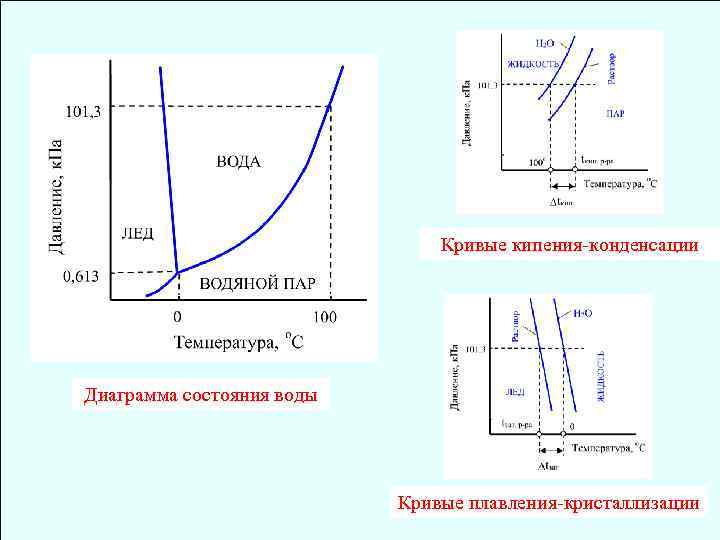 Кривые кипения-конденсации Диаграмма состояния воды Кривые плавления-кристаллизации
Кривые кипения-конденсации Диаграмма состояния воды Кривые плавления-кристаллизации
 Температура кипения раствора – это температура, при которой давление насыщенного пара раствора равно атмосферному давлению tкип. р-ра > tкип. р-ля, т. к. Pнас. р-ра < Pнас. р-ля Повышение температуры кипения раствора равно: tкип. = t кип. р-ра - 100
Температура кипения раствора – это температура, при которой давление насыщенного пара раствора равно атмосферному давлению tкип. р-ра > tкип. р-ля, т. к. Pнас. р-ра < Pнас. р-ля Повышение температуры кипения раствора равно: tкип. = t кип. р-ра - 100
 Температура затвердевания (кристаллизации) раствора – это температура, при которой давление насыщенного пара твердой фазы равно давлению насыщенного пара жидкой фазы tкр. р-ра < tкр. р-ля, т. к. Pнас. тв. < Pнас. жид. (лед – вода) Понижение температуры кристаллизации (затвердевания) раствора: tкр. = 0 - t кр. р-ра
Температура затвердевания (кристаллизации) раствора – это температура, при которой давление насыщенного пара твердой фазы равно давлению насыщенного пара жидкой фазы tкр. р-ра < tкр. р-ля, т. к. Pнас. тв. < Pнас. жид. (лед – вода) Понижение температуры кристаллизации (затвердевания) раствора: tкр. = 0 - t кр. р-ра
 Cледствия из закона Рауля Повышение температуры кипения и понижение температуры затвердевания раствора прямо пропорционально моляльной концентрации раствора t кип. = Kэб Сm t зат. = Kкр Сm Kэб. - эбулиоскопическая постоянная Ккр. - криоскопическая постоянная Для воды: Ккр. = 1, 86, Кэб. = 0, 52. Для бензола: Ккр. = 5, 10, Кэб. = 2, 57.
Cледствия из закона Рауля Повышение температуры кипения и понижение температуры затвердевания раствора прямо пропорционально моляльной концентрации раствора t кип. = Kэб Сm t зат. = Kкр Сm Kэб. - эбулиоскопическая постоянная Ккр. - криоскопическая постоянная Для воды: Ккр. = 1, 86, Кэб. = 0, 52. Для бензола: Ккр. = 5, 10, Кэб. = 2, 57.
 Лекция № 4 РАСТВОРЫ
Лекция № 4 РАСТВОРЫ
 Экстракция – это способ извлечения заданного металла из водного раствора в другую жидкую фазу, которую называют экстрагентом. Этот процесс идет успешно при условии, что жидкие фазы практически взаимно не растворимы. В качестве экстрагентов применяют органические вещества: трибутилфосфат ТБФ [(С 4 Н 9 О)3 Р=О]; метилизобутилкетон МИБК [(C 5 H 12)C=O]; триоктиламин ТОА [R 3 N] и др. Экстрагент после насыщения его извлекаемым элементом называется экстрактом. Водный раствор, из которого извлечен металл, называется рафинатом. Этапы технологии экстракции: 1 -й этап – экстракция металла из раствора в органический растворитель; 2 -й этап – разделение экстракта и рафината; 3 -й этап – реэкстракция – перевод металла из экстракта в водный раствор; 4 -й этап – восстановление технологических свойств экстрагента и возвращение его в процесс – в следующий цикл.
Экстракция – это способ извлечения заданного металла из водного раствора в другую жидкую фазу, которую называют экстрагентом. Этот процесс идет успешно при условии, что жидкие фазы практически взаимно не растворимы. В качестве экстрагентов применяют органические вещества: трибутилфосфат ТБФ [(С 4 Н 9 О)3 Р=О]; метилизобутилкетон МИБК [(C 5 H 12)C=O]; триоктиламин ТОА [R 3 N] и др. Экстрагент после насыщения его извлекаемым элементом называется экстрактом. Водный раствор, из которого извлечен металл, называется рафинатом. Этапы технологии экстракции: 1 -й этап – экстракция металла из раствора в органический растворитель; 2 -й этап – разделение экстракта и рафината; 3 -й этап – реэкстракция – перевод металла из экстракта в водный раствор; 4 -й этап – восстановление технологических свойств экстрагента и возвращение его в процесс – в следующий цикл.
 Для экстракции преимущественно применяют аппараты двух типов: каскад смесителей-отстойников и экстракционные колонны с пульсацией. В экстракционных колонная процесс осуществляется по схеме противотока: Cверху вниз движется тяжелый исходный водный раствор 1. Навстречу, снизу вверх, поднимается более легкая органическая фаза – экстрагент 3. В верхней части происходит вывод экстракта 2. Водный раствор после обработки выводится из колонны снизу 4. Cхема экстракционной колонны с насадкой
Для экстракции преимущественно применяют аппараты двух типов: каскад смесителей-отстойников и экстракционные колонны с пульсацией. В экстракционных колонная процесс осуществляется по схеме противотока: Cверху вниз движется тяжелый исходный водный раствор 1. Навстречу, снизу вверх, поднимается более легкая органическая фаза – экстрагент 3. В верхней части происходит вывод экстракта 2. Водный раствор после обработки выводится из колонны снизу 4. Cхема экстракционной колонны с насадкой
 Разделение продуктов экстракции (экстракта и рафината) производят в отстойниках. Реэкстракцию органической фазы (после промывки в воде) осуществляют горячей водой, растворами кислот, щелочей солей Процесс экстракции широко используется в лабораторной практике, в химической промышленности, в металлургии. В частности, в гидропроцессах металлургии редких металлов экстракция применяется для разделения Ta и Nb, Zr и Hf, РЗЭ, получения из водных растворов таких элементов как Re, In, Tl, Sc, U и др. Примеры процессов экстракции. 1. Экстракция рения из водных растворов. Экстракция из растворов с H 2 SO 4 протекает по механизму межфазного анионного обмена. Экстрагент – ТОА тироктиламин [(R 3 NH)+] (R 3 NH)HSO 4 + Re. O 4 - (R 3 NH)Re. O 4 + HSO 4 -
Разделение продуктов экстракции (экстракта и рафината) производят в отстойниках. Реэкстракцию органической фазы (после промывки в воде) осуществляют горячей водой, растворами кислот, щелочей солей Процесс экстракции широко используется в лабораторной практике, в химической промышленности, в металлургии. В частности, в гидропроцессах металлургии редких металлов экстракция применяется для разделения Ta и Nb, Zr и Hf, РЗЭ, получения из водных растворов таких элементов как Re, In, Tl, Sc, U и др. Примеры процессов экстракции. 1. Экстракция рения из водных растворов. Экстракция из растворов с H 2 SO 4 протекает по механизму межфазного анионного обмена. Экстрагент – ТОА тироктиламин [(R 3 NH)+] (R 3 NH)HSO 4 + Re. O 4 - (R 3 NH)Re. O 4 + HSO 4 -
 Реэкстракцию рения проводят 5 -10 % раствором аммиака. Из аммиачных растворов выделяют перренат аммония. В результате экстракции раствора, содержащего 20 -30 мг/л рения, получили раствор с содержанием рения – 1 -2 г/л. Концентрация рения увеличилась в 50 -70 раз. 2. Экстракция индия описывается реакцией: In 3+ + 3(HRe 2 PO 4)2 = In(R 2 PO 4)3 · 3 HR 2 PO 4 + 3 H+ HRe 2 PO 4 – экстрагент – одноосновная кислота (R – радикал) Реэкстракцию проводят 8 -10 н. cоляной кислотой. В результате из растворов с концентрацией In 0, 03 -0, 09 г/л получают реэкстракты с концентрацией In 25 -55 г/л, из которых цементацией на цинке выделяют черновой индий.
Реэкстракцию рения проводят 5 -10 % раствором аммиака. Из аммиачных растворов выделяют перренат аммония. В результате экстракции раствора, содержащего 20 -30 мг/л рения, получили раствор с содержанием рения – 1 -2 г/л. Концентрация рения увеличилась в 50 -70 раз. 2. Экстракция индия описывается реакцией: In 3+ + 3(HRe 2 PO 4)2 = In(R 2 PO 4)3 · 3 HR 2 PO 4 + 3 H+ HRe 2 PO 4 – экстрагент – одноосновная кислота (R – радикал) Реэкстракцию проводят 8 -10 н. cоляной кислотой. В результате из растворов с концентрацией In 0, 03 -0, 09 г/л получают реэкстракты с концентрацией In 25 -55 г/л, из которых цементацией на цинке выделяют черновой индий.
 3. Экстракция урана из растворов. UO 22+ + 2(HR 2 PO 4)2 = UO 2(R 2 PO 4)2 · 2 HR 2 PO 4 + 2 H+ Реэкстракция: раствором HCl (10 н. ) или растворами карбоната натрия или аммония. Эффективность этого способа следующая: содержание урана в исходном растворе после выщелачивания руды – 0, 8 -1, 4 г/л; в реэкстракте – 17 -43 г/л. Концентрация раствора увеличилась в 20 -30 раз.
3. Экстракция урана из растворов. UO 22+ + 2(HR 2 PO 4)2 = UO 2(R 2 PO 4)2 · 2 HR 2 PO 4 + 2 H+ Реэкстракция: раствором HCl (10 н. ) или растворами карбоната натрия или аммония. Эффективность этого способа следующая: содержание урана в исходном растворе после выщелачивания руды – 0, 8 -1, 4 г/л; в реэкстракте – 17 -43 г/л. Концентрация раствора увеличилась в 20 -30 раз.


