 Лекция № 4 Производные пиррола и индола.
Лекция № 4 Производные пиррола и индола.
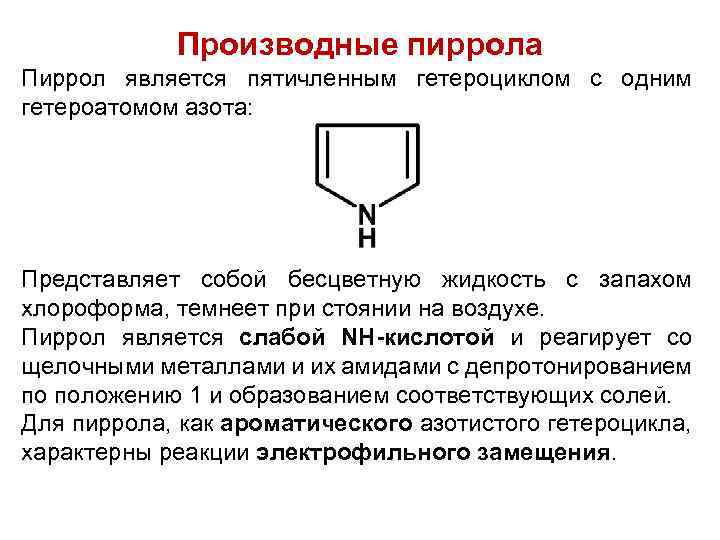 Производные пиррола Пиррол является пятичленным гетероциклом с одним гетероатомом азота: Представляет собой бесцветную жидкость с запахом хлороформа, темнеет при стоянии на воздухе. Пиррол является слабой NH-кислотой и реагирует со щелочными металлами и их амидами с депротонированием по положению 1 и образованием соответствующих солей. Для пиррола, как ароматического азотистого гетероцикла, характерны реакции электрофильного замещения.
Производные пиррола Пиррол является пятичленным гетероциклом с одним гетероатомом азота: Представляет собой бесцветную жидкость с запахом хлороформа, темнеет при стоянии на воздухе. Пиррол является слабой NH-кислотой и реагирует со щелочными металлами и их амидами с депротонированием по положению 1 и образованием соответствующих солей. Для пиррола, как ароматического азотистого гетероцикла, характерны реакции электрофильного замещения.
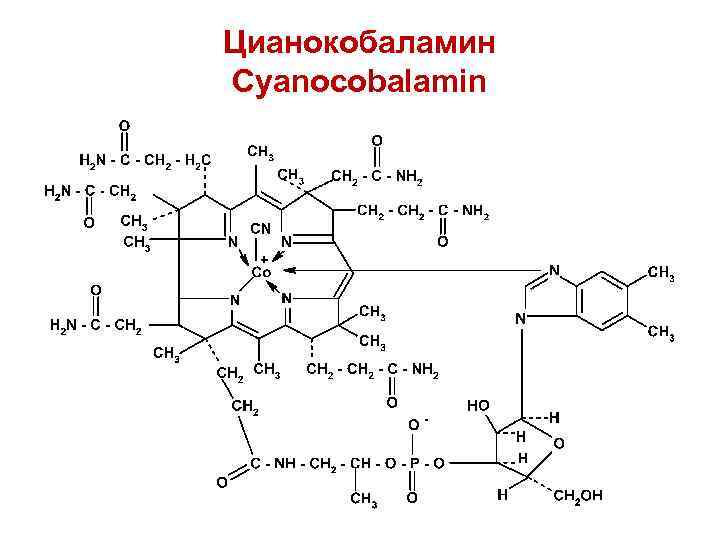 Цианокобаламин Cyanocobalamin
Цианокобаламин Cyanocobalamin
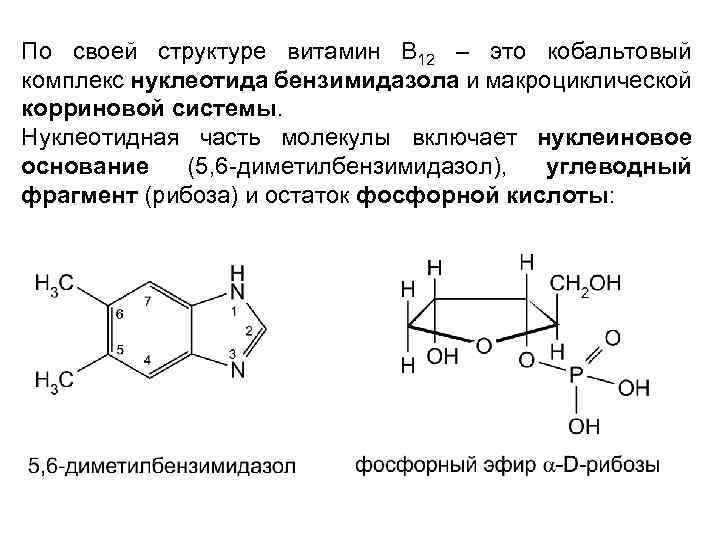 По своей структуре витамин В 12 – это кобальтовый комплекс нуклеотида бензимидазола и макроциклической корриновой системы. Нуклеотидная часть молекулы включает нуклеиновое основание (5, 6 -диметилбензимидазол), углеводный фрагмент (рибоза) и остаток фосфорной кислоты:
По своей структуре витамин В 12 – это кобальтовый комплекс нуклеотида бензимидазола и макроциклической корриновой системы. Нуклеотидная часть молекулы включает нуклеиновое основание (5, 6 -диметилбензимидазол), углеводный фрагмент (рибоза) и остаток фосфорной кислоты:
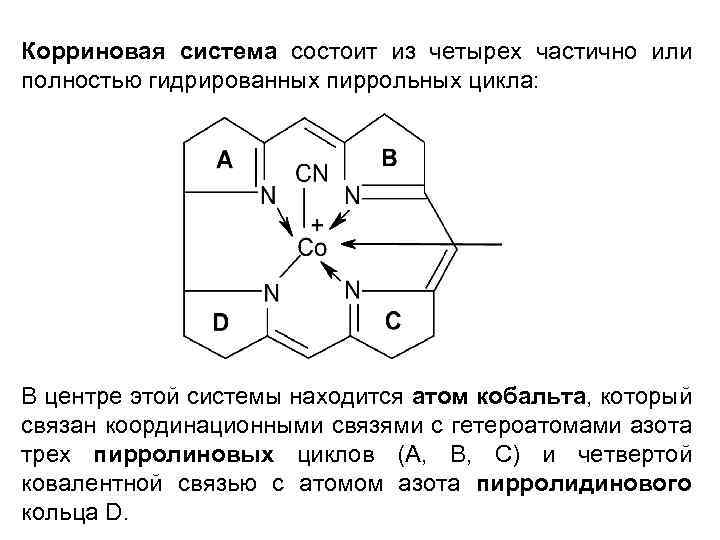 Корриновая система состоит из четырех частично или полностью гидрированных пиррольных цикла: В центре этой системы находится атом кобальта, который связан координационными связями с гетероатомами азота трех пирролиновых циклов (А, В, С) и четвертой ковалентной связью с атомом азота пирролидинового кольца D.
Корриновая система состоит из четырех частично или полностью гидрированных пиррольных цикла: В центре этой системы находится атом кобальта, который связан координационными связями с гетероатомами азота трех пирролиновых циклов (А, В, С) и четвертой ковалентной связью с атомом азота пирролидинового кольца D.
 Кобальт также связан ковалентной связью с цианогруппой и координационной связью с гетероатомом азота 5, 6 диметилбензимидазола. Связь кобальта с остатком кислоты фосфорной является электровалентной, т. е. положительный заряд кобальта частично нейтрализован отрицательным зарядом кислоты фосфорной. В молеуле цианокобаламина имеется несколько ассиметрических атомов углерода, поэтому лекарственные вещества этой группы оптически активны (левовращающие).
Кобальт также связан ковалентной связью с цианогруппой и координационной связью с гетероатомом азота 5, 6 диметилбензимидазола. Связь кобальта с остатком кислоты фосфорной является электровалентной, т. е. положительный заряд кобальта частично нейтрализован отрицательным зарядом кислоты фосфорной. В молеуле цианокобаламина имеется несколько ассиметрических атомов углерода, поэтому лекарственные вещества этой группы оптически активны (левовращающие).
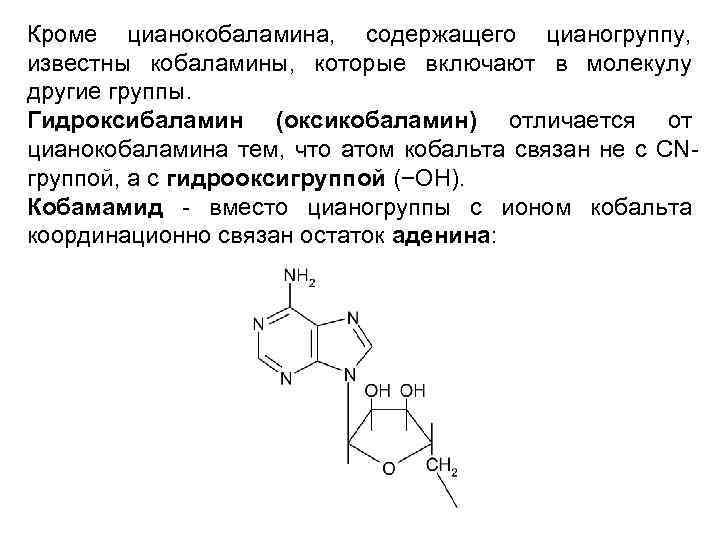 Кроме цианокобаламина, содержащего цианогруппу, известны кобаламины, которые включают в молекулу другие группы. Гидроксибаламин (оксикобаламин) отличается от цианокобаламина тем, что атом кобальта связан не с CNгруппой, а с гидрооксигруппой (−ОН). Кобамамид - вместо цианогруппы с ионом кобальта координационно связан остаток аденина:
Кроме цианокобаламина, содержащего цианогруппу, известны кобаламины, которые включают в молекулу другие группы. Гидроксибаламин (оксикобаламин) отличается от цианокобаламина тем, что атом кобальта связан не с CNгруппой, а с гидрооксигруппой (−ОН). Кобамамид - вместо цианогруппы с ионом кобальта координационно связан остаток аденина:
 Физические свойства По внешнему виду цианокобаламин – кристаллический порошок темно-красного цвета. Умеренно и медленно растворим в воде (1: 80), растворим в 95% спирте, практически нерастворим в эфире, хлороформе, ацетоне. Получение Цианокобаламин был выделен из печени. Получение цианокобаламина из печени животных неэкономично вследствие ничтожного выхода (из 1 т около 0, 02 г). В настоящее время в промышленности получают цианокобаламин путем микробиологического синтеза как побочный продукт при производстве стрептомицина. В организме человека вырабатывается микрофлорой кишечника.
Физические свойства По внешнему виду цианокобаламин – кристаллический порошок темно-красного цвета. Умеренно и медленно растворим в воде (1: 80), растворим в 95% спирте, практически нерастворим в эфире, хлороформе, ацетоне. Получение Цианокобаламин был выделен из печени. Получение цианокобаламина из печени животных неэкономично вследствие ничтожного выхода (из 1 т около 0, 02 г). В настоящее время в промышленности получают цианокобаламин путем микробиологического синтеза как побочный продукт при производстве стрептомицина. В организме человека вырабатывается микрофлорой кишечника.
 Подлинность 1. УФ-спектр в водном растворе должен иметь три полосы поглощения с максимумами при 278, 361 и 550 нм: - поглощение при 278 нм обусловлено наличием фрагмента 5, 6 -диметилбензимидазола, - при 361 нм – корриновой системой с шестью сопряженными двойными связями, - при 550 нм – наличием атома кобальта. Устанавливают отношение величин оптических плотностей: - отношение (А 361/А 278) должно быть от 1, 70 до 1, 88 - отношение (А 361/А 550) должно быть от 3, 15 до 3, 40
Подлинность 1. УФ-спектр в водном растворе должен иметь три полосы поглощения с максимумами при 278, 361 и 550 нм: - поглощение при 278 нм обусловлено наличием фрагмента 5, 6 -диметилбензимидазола, - при 361 нм – корриновой системой с шестью сопряженными двойными связями, - при 550 нм – наличием атома кобальта. Устанавливают отношение величин оптических плотностей: - отношение (А 361/А 278) должно быть от 1, 70 до 1, 88 - отношение (А 361/А 550) должно быть от 3, 15 до 3, 40
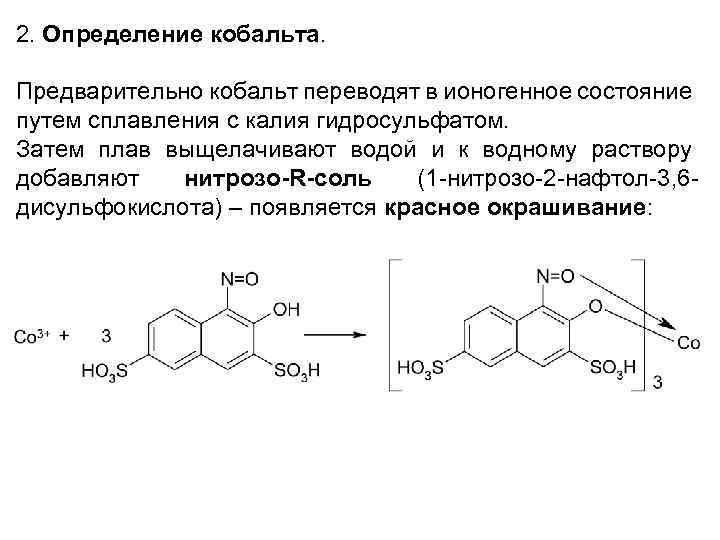 2. Определение кобальта. Предварительно кобальт переводят в ионогенное состояние путем сплавления с калия гидросульфатом. Затем плав выщелачивают водой и к водному раствору добавляют нитрозо-R-соль (1 -нитрозо-2 -нафтол-3, 6 дисульфокислота) – появляется красное окрашивание:
2. Определение кобальта. Предварительно кобальт переводят в ионогенное состояние путем сплавления с калия гидросульфатом. Затем плав выщелачивают водой и к водному раствору добавляют нитрозо-R-соль (1 -нитрозо-2 -нафтол-3, 6 дисульфокислота) – появляется красное окрашивание:
 Чистота Посторонние примеси – определяют методом ТСХ Остаточные органические растворители (ацетон) – определяют методом ГЖХ. Количественное определение Проводят спектрофотометрическим методом при 361 нм.
Чистота Посторонние примеси – определяют методом ТСХ Остаточные органические растворители (ацетон) – определяют методом ГЖХ. Количественное определение Проводят спектрофотометрическим методом при 361 нм.
 Стабильность и хранение Цианокобаламин хранят, учитывая гигроскопичность, в хорошо укупоренной таре, соблюдая асептические условия, так как микрофлора поглощает витамин B 12. Разрушается от действия окислителей и восстановителей. Необходимо предохранять от действия света. Водные растворы цианокобаламина устойчивы при р. H 4, 0 – 6, 0. Применение Цианокобаламин проявляет противоанемическое, гепатопротекторное, нейропотекторное действие. Назначают для лечения злокачественного малокровия, различных видов анемии, при лучевой болезни, заболеваниях печени, нервной системы, кожных и других заболеваниях. Вводят цианокобаламин внутримышечно, подкожно, внутривенно по 100 – 200 мкг, реже до 500 мкг.
Стабильность и хранение Цианокобаламин хранят, учитывая гигроскопичность, в хорошо укупоренной таре, соблюдая асептические условия, так как микрофлора поглощает витамин B 12. Разрушается от действия окислителей и восстановителей. Необходимо предохранять от действия света. Водные растворы цианокобаламина устойчивы при р. H 4, 0 – 6, 0. Применение Цианокобаламин проявляет противоанемическое, гепатопротекторное, нейропотекторное действие. Назначают для лечения злокачественного малокровия, различных видов анемии, при лучевой болезни, заболеваниях печени, нервной системы, кожных и других заболеваниях. Вводят цианокобаламин внутримышечно, подкожно, внутривенно по 100 – 200 мкг, реже до 500 мкг.
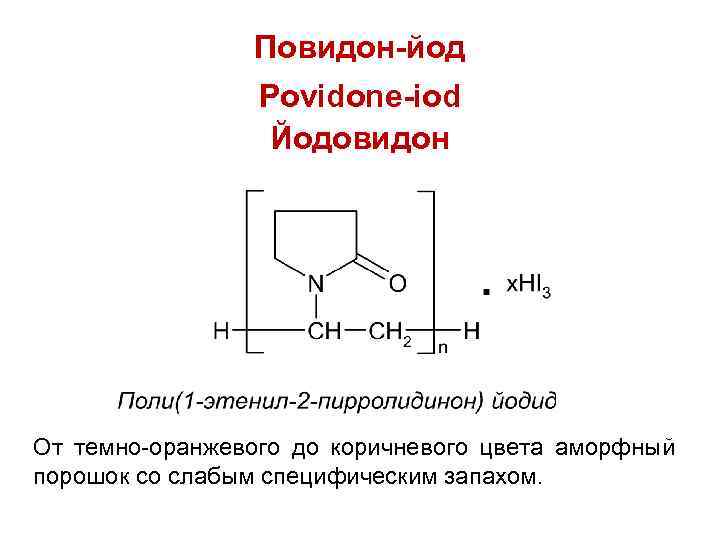 Повидон-йод Povidone-iod Йодовидон От темно-оранжевого до коричневого цвета аморфный порошок со слабым специфическим запахом.
Повидон-йод Povidone-iod Йодовидон От темно-оранжевого до коричневого цвета аморфный порошок со слабым специфическим запахом.
 Подлинность 1. ИК-спектр препарата, снятый в области от 400 до 4000 см-1, должен быть идентичен но положению и относительной интенсивности полос поглощения спектру стандартного образца. 2. Препарат дает характерную реакцию на йод – с раствором крахмала сине-бурое oкрашивание. Относительная вязкость От 1, 5 до 2, 5 вискозиметры. (метод Оствальда) - капиллярные
Подлинность 1. ИК-спектр препарата, снятый в области от 400 до 4000 см-1, должен быть идентичен но положению и относительной интенсивности полос поглощения спектру стандартного образца. 2. Препарат дает характерную реакцию на йод – с раствором крахмала сине-бурое oкрашивание. Относительная вязкость От 1, 5 до 2, 5 вискозиметры. (метод Оствальда) - капиллярные
 Количественное определение 1. Определение общего йода. Растворяют в воде и прибавляют раствор натрия бисульфита: Na. HSO 3 + I 2 + H 2 O → Na. HSO 4 + 2 HI Йодиды определяют аргентометрически по Фольгарду: I- + Hl + Ag. NO 3 → 2 Agl↓ + HNO 3 Ag. NO 3 + NH 4 SCN → Ag. SCN↓ + NH 4 NO 3 3 NH 4 SCN + (NH 4)Fe(SO 4)2 → Fe(SCN)3 + 2(NH 4)2 SO 4 2. Определение активного йода. I 2 + 2 Na 2 S 2 O 3 → 2 Na. I + Na 2 S 4 O 6 3. Содержание йодид-иона. Определяют как разность между процентным содержанием общего и активного йода. 4. Определение общего азота. Метод Кьельдаля.
Количественное определение 1. Определение общего йода. Растворяют в воде и прибавляют раствор натрия бисульфита: Na. HSO 3 + I 2 + H 2 O → Na. HSO 4 + 2 HI Йодиды определяют аргентометрически по Фольгарду: I- + Hl + Ag. NO 3 → 2 Agl↓ + HNO 3 Ag. NO 3 + NH 4 SCN → Ag. SCN↓ + NH 4 NO 3 3 NH 4 SCN + (NH 4)Fe(SO 4)2 → Fe(SCN)3 + 2(NH 4)2 SO 4 2. Определение активного йода. I 2 + 2 Na 2 S 2 O 3 → 2 Na. I + Na 2 S 4 O 6 3. Содержание йодид-иона. Определяют как разность между процентным содержанием общего и активного йода. 4. Определение общего азота. Метод Кьельдаля.
 Применение Фармакологическое действие антисептическое, дезинфицирующее, бактерицидное, противогрибковое, противопротозойное, противовирусное. Формы выпуска: - раствор для местного и наружного применения 10% - мазь для наружного применения 10% - суппозитории вагинальные 200 мг Торговые наименования: Бетадин, Йодовидон, Йодосепт
Применение Фармакологическое действие антисептическое, дезинфицирующее, бактерицидное, противогрибковое, противопротозойное, противовирусное. Формы выпуска: - раствор для местного и наружного применения 10% - мазь для наружного применения 10% - суппозитории вагинальные 200 мг Торговые наименования: Бетадин, Йодовидон, Йодосепт
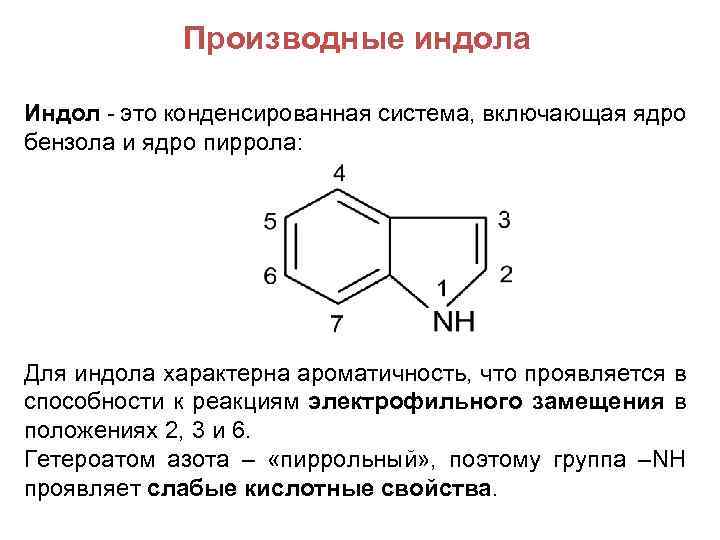 Производные индола Индол - это конденсированная система, включающая ядро бензола и ядро пиррола: Для индола характерна ароматичность, что проявляется в способности к реакциям электрофильного замещения в положениях 2, 3 и 6. Гетероатом азота – «пиррольный» , поэтому группа –NH проявляет слабые кислотные свойства.
Производные индола Индол - это конденсированная система, включающая ядро бензола и ядро пиррола: Для индола характерна ароматичность, что проявляется в способности к реакциям электрофильного замещения в положениях 2, 3 и 6. Гетероатом азота – «пиррольный» , поэтому группа –NH проявляет слабые кислотные свойства.
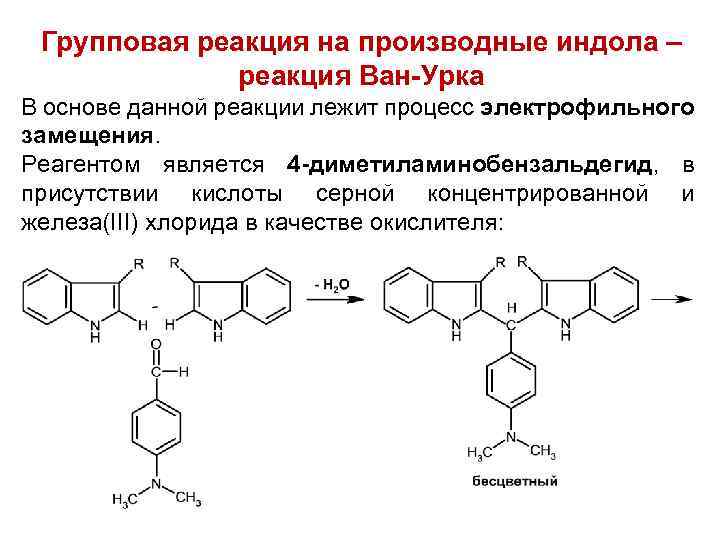 Групповая реакция на производные индола – реакция Ван-Урка В основе данной реакции лежит процесс электрофильного замещения. Реагентом является 4 -диметиламинобензальдегид, в присутствии кислоты серной концентрированной и железа(III) хлорида в качестве окислителя:
Групповая реакция на производные индола – реакция Ван-Урка В основе данной реакции лежит процесс электрофильного замещения. Реагентом является 4 -диметиламинобензальдегид, в присутствии кислоты серной концентрированной и железа(III) хлорида в качестве окислителя:
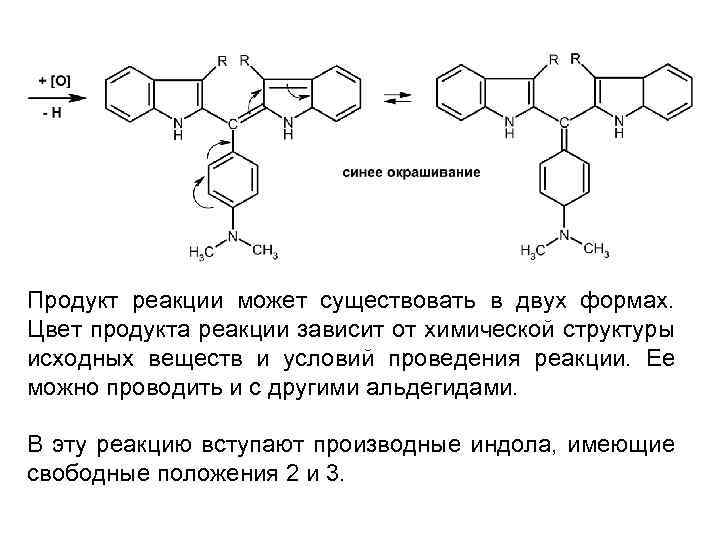 Продукт реакции может существовать в двух формах. Цвет продукта реакции зависит от химической структуры исходных веществ и условий проведения реакции. Ее можно проводить и с другими альдегидами. В эту реакцию вступают производные индола, имеющие свободные положения 2 и 3.
Продукт реакции может существовать в двух формах. Цвет продукта реакции зависит от химической структуры исходных веществ и условий проведения реакции. Ее можно проводить и с другими альдегидами. В эту реакцию вступают производные индола, имеющие свободные положения 2 и 3.
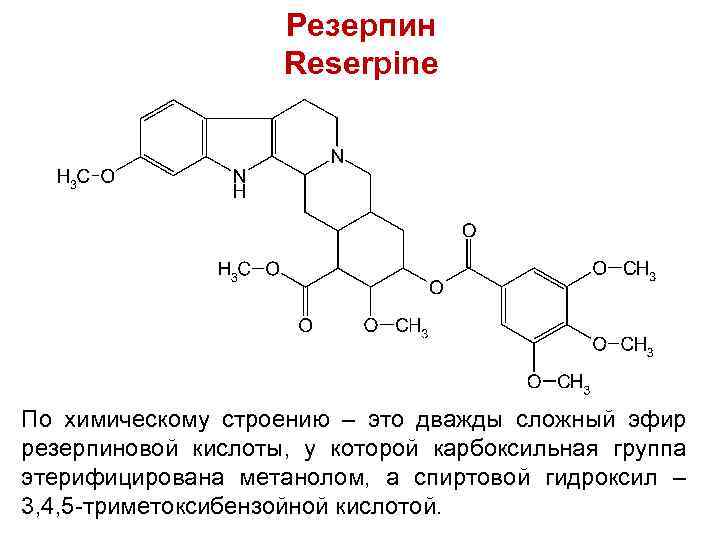 Резерпин Reserpinе По химическому строению – это дважды сложный эфир резерпиновой кислоты, у которой карбоксильная группа этерифицирована метанолом, а спиртовой гидроксил – 3, 4, 5 -триметоксибензойной кислотой.
Резерпин Reserpinе По химическому строению – это дважды сложный эфир резерпиновой кислоты, у которой карбоксильная группа этерифицирована метанолом, а спиртовой гидроксил – 3, 4, 5 -триметоксибензойной кислотой.
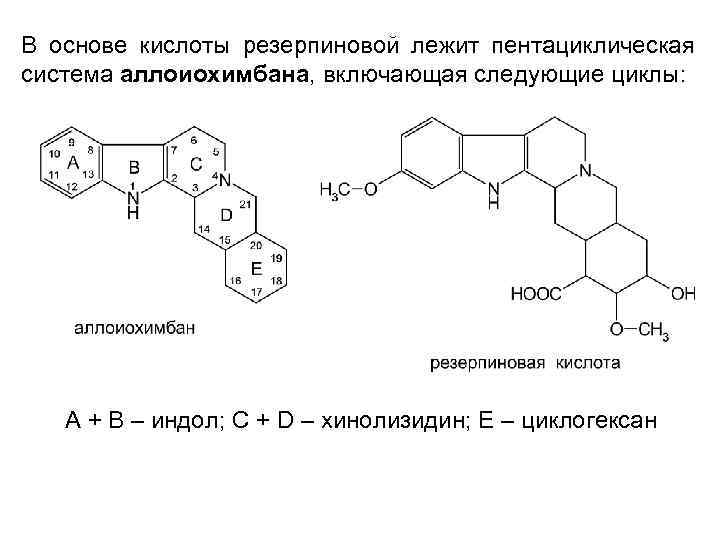 В основе кислоты резерпиновой лежит пентациклическая система аллоиохимбана, включающая следующие циклы: А + В – индол; С + D – хинолизидин; Е – циклогексан
В основе кислоты резерпиновой лежит пентациклическая система аллоиохимбана, включающая следующие циклы: А + В – индол; С + D – хинолизидин; Е – циклогексан
 Получение Резерпин получают из корней раувольфии змеиной: - обработка измельченных корней раствором аммиака; - экстракция эфиром; - резерпин выделяют из суммы алкалоидов хроматографической колонке. на Резерпин содержит 6 асимметрических атомов углерода (С 3; С 15; С 16; С 17; С 18; С 20), поэтому оптически активен. В медицине применяют левовращающий оптический изомер основания резерпина. Физические свойства Белый или желтоватый порошок, очень малорастворимый в воде и спирте, легко растворим в хлороформе и уксусной кислоте.
Получение Резерпин получают из корней раувольфии змеиной: - обработка измельченных корней раствором аммиака; - экстракция эфиром; - резерпин выделяют из суммы алкалоидов хроматографической колонке. на Резерпин содержит 6 асимметрических атомов углерода (С 3; С 15; С 16; С 17; С 18; С 20), поэтому оптически активен. В медицине применяют левовращающий оптический изомер основания резерпина. Физические свойства Белый или желтоватый порошок, очень малорастворимый в воде и спирте, легко растворим в хлороформе и уксусной кислоте.
 Кислотно-основные свойства Резерпин – слабое однокислотное основание. Центром основности является атом азота в положении 4 хинолизидинового цикла, имеющего локализованную пару электронов. Группа NH, где атом азота пиррольный, является центром кислотности.
Кислотно-основные свойства Резерпин – слабое однокислотное основание. Центром основности является атом азота в положении 4 хинолизидинового цикла, имеющего локализованную пару электронов. Группа NH, где атом азота пиррольный, является центром кислотности.
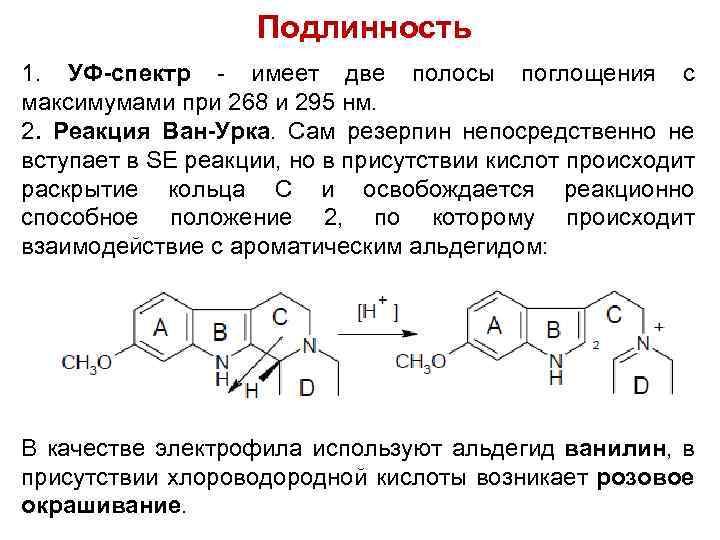 Подлинность 1. УФ-спектр - имеет две полосы поглощения с максимумами при 268 и 295 нм. 2. Реакция Ван-Урка. Сам резерпин непосредственно не вступает в SE реакции, но в присутствии кислот происходит раскрытие кольца С и освобождается реакционно способное положение 2, по которому происходит взаимодействие с ароматическим альдегидом: В качестве электрофила используют альдегид ванилин, в присутствии хлороводородной кислоты возникает розовое окрашивание.
Подлинность 1. УФ-спектр - имеет две полосы поглощения с максимумами при 268 и 295 нм. 2. Реакция Ван-Урка. Сам резерпин непосредственно не вступает в SE реакции, но в присутствии кислот происходит раскрытие кольца С и освобождается реакционно способное положение 2, по которому происходит взаимодействие с ароматическим альдегидом: В качестве электрофила используют альдегид ванилин, в присутствии хлороводородной кислоты возникает розовое окрашивание.
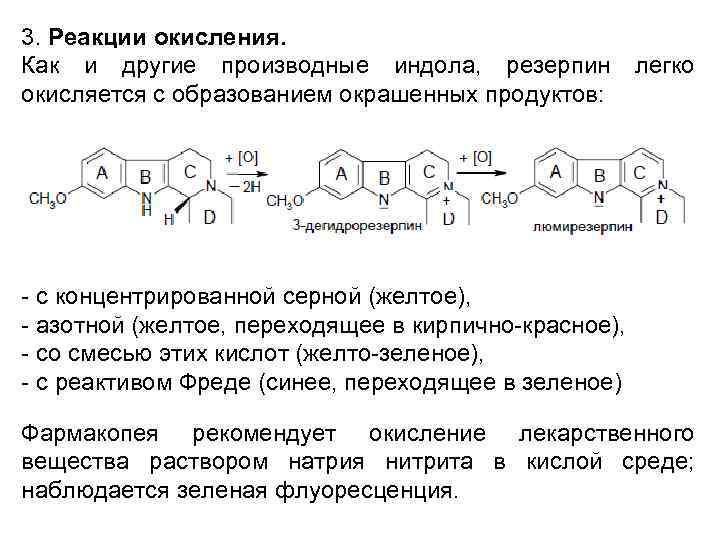 3. Реакции окисления. Как и другие производные индола, резерпин окисляется с образованием окрашенных продуктов: легко - с концентрированной серной (желтое), - азотной (желтое, переходящее в кирпично-красное), - со смесью этих кислот (желто-зеленое), - с реактивом Фреде (синее, переходящее в зеленое) Фармакопея рекомендует окисление лекарственного вещества раствором натрия нитрита в кислой среде; наблюдается зеленая флуоресценция.
3. Реакции окисления. Как и другие производные индола, резерпин окисляется с образованием окрашенных продуктов: легко - с концентрированной серной (желтое), - азотной (желтое, переходящее в кирпично-красное), - со смесью этих кислот (желто-зеленое), - с реактивом Фреде (синее, переходящее в зеленое) Фармакопея рекомендует окисление лекарственного вещества раствором натрия нитрита в кислой среде; наблюдается зеленая флуоресценция.
 4. Гидроксамовая проба. Данная реакция обусловлена наличием сложно-эфирных групп. 5. Как азотсодержащее органическое основание, резерпин дает осадки комплексных солей с общеалкалоидными реактивами: - пикриновой кислотой образует пикрат (т. пл. 186°C).
4. Гидроксамовая проба. Данная реакция обусловлена наличием сложно-эфирных групп. 5. Как азотсодержащее органическое основание, резерпин дает осадки комплексных солей с общеалкалоидными реактивами: - пикриновой кислотой образует пикрат (т. пл. 186°C).
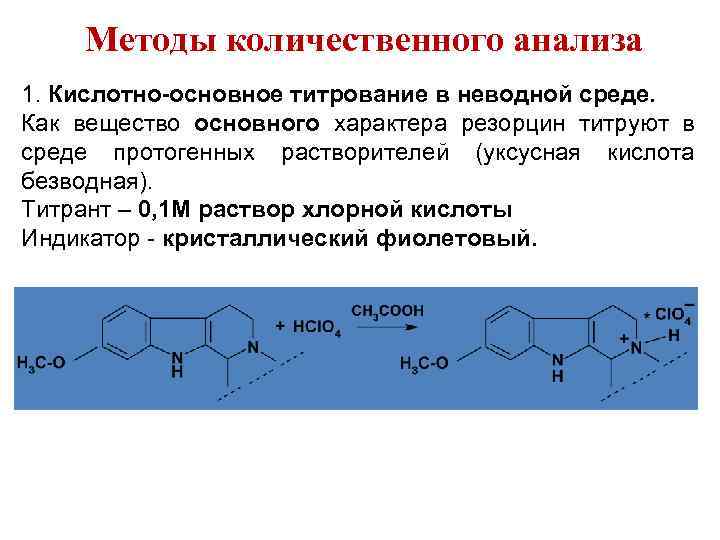 Методы количественного анализа 1. Кислотно-основное титрование в неводной среде. Как вещество основного характера резорцин титруют в среде протогенных растворителей (уксусная кислота безводная). Титрант – 0, 1 М раствор хлорной кислоты Индикатор - кристаллический фиолетовый.
Методы количественного анализа 1. Кислотно-основное титрование в неводной среде. Как вещество основного характера резорцин титруют в среде протогенных растворителей (уксусная кислота безводная). Титрант – 0, 1 М раствор хлорной кислоты Индикатор - кристаллический фиолетовый.
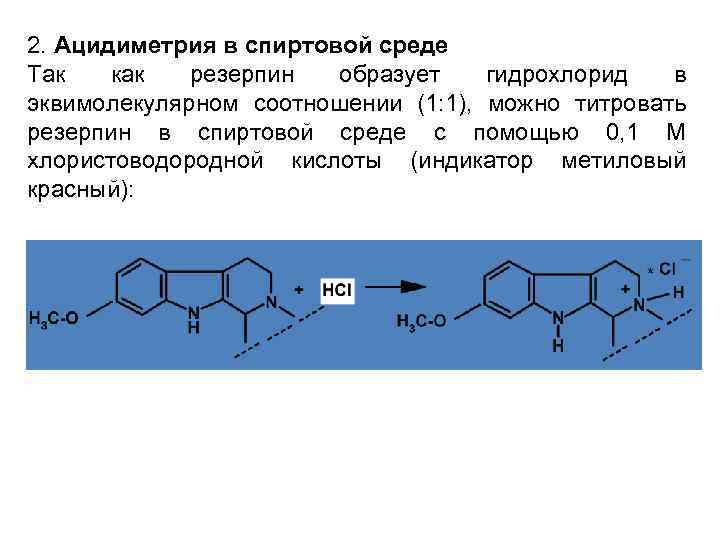 2. Ацидиметрия в спиртовой среде Так как резерпин образует гидрохлорид в эквимолекулярном соотношении (1: 1), можно титровать резерпин в спиртовой среде с помощью 0, 1 М хлористоводородной кислоты (индикатор метиловый красный):
2. Ацидиметрия в спиртовой среде Так как резерпин образует гидрохлорид в эквимолекулярном соотношении (1: 1), можно титровать резерпин в спиртовой среде с помощью 0, 1 М хлористоводородной кислоты (индикатор метиловый красный):
 Хранение Резерпин хранят в хорошо укупоренных банках оранжевого стекла, в прохладном, защищенном от света месте. Он способен к изомеризации и окислению под действием света, воздуха, нагревания. Применение Относится к группе симпатолитиков - вещества, уменьшающие количество медиатора, выделяющегося в окончаниях симпатических нервов, и тормозящие таким образом передачу адренергического возбуждения. Применяют в качестве нейролептического и гипотензивного средства. Выпускают резерпин в таблетках по 0, 1 и 0, 25 мг. Входит в состав сложных лекарственных форм (Адельфан Эзидрекс).
Хранение Резерпин хранят в хорошо укупоренных банках оранжевого стекла, в прохладном, защищенном от света месте. Он способен к изомеризации и окислению под действием света, воздуха, нагревания. Применение Относится к группе симпатолитиков - вещества, уменьшающие количество медиатора, выделяющегося в окончаниях симпатических нервов, и тормозящие таким образом передачу адренергического возбуждения. Применяют в качестве нейролептического и гипотензивного средства. Выпускают резерпин в таблетках по 0, 1 и 0, 25 мг. Входит в состав сложных лекарственных форм (Адельфан Эзидрекс).
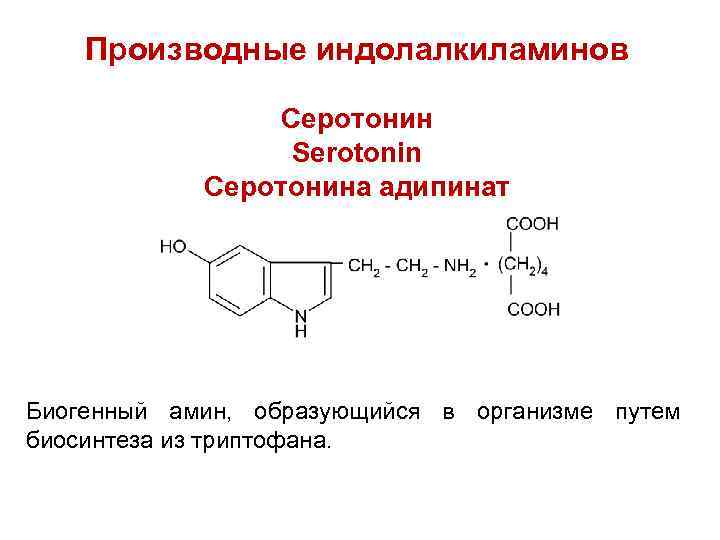 Производные индолалкиламинов Серотонин Serotonin Серотонина адипинат Биогенный амин, образующийся в организме путем биосинтеза из триптофана.
Производные индолалкиламинов Серотонин Serotonin Серотонина адипинат Биогенный амин, образующийся в организме путем биосинтеза из триптофана.
 Белый или с кремоватым оттенком кристаллический порошок. Растворим в воде, мало растворим в этаноле, практически нерастворим в хлороформе. Подлинность 1. ИК – спектроскопия. 2. УФ - спектр должен иметь полосы поглощения с максимумами при 277 и 303 нм и минимумы поглощения при 249 и 295 нм. 3. С раствором нингидрина в нейтральной среде при нагревании даёт красное окрашивание. 4. Могут быть использованы и другие реакции, характерные для фенолов и производных индола.
Белый или с кремоватым оттенком кристаллический порошок. Растворим в воде, мало растворим в этаноле, практически нерастворим в хлороформе. Подлинность 1. ИК – спектроскопия. 2. УФ - спектр должен иметь полосы поглощения с максимумами при 277 и 303 нм и минимумы поглощения при 249 и 295 нм. 3. С раствором нингидрина в нейтральной среде при нагревании даёт красное окрашивание. 4. Могут быть использованы и другие реакции, характерные для фенолов и производных индола.
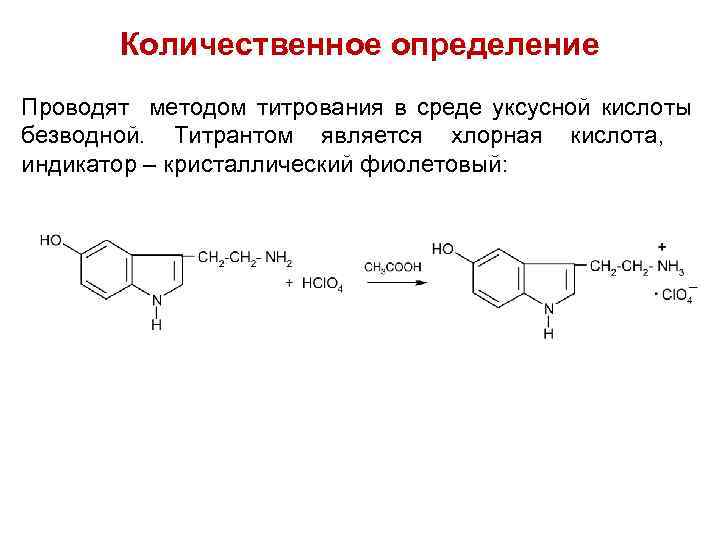 Количественное определение Проводят методом титрования в среде уксусной кислоты безводной. Титрантом является хлорная кислота, индикатор – кристаллический фиолетовый:
Количественное определение Проводят методом титрования в среде уксусной кислоты безводной. Титрантом является хлорная кислота, индикатор – кристаллический фиолетовый:
 Применение Гемостатическое средство. Эффект связан с периферическим сосудосуживающим действием, способностью повышать агрегацию тромбоцитов и укорачивать время кровотечения; вызывает сужение сосудов почек и оказывает антидиуретическое действие. Применяют для лечения геморрагического синдрома. Вводят внутривенно и внутримышечно по 0, 005 -0, 01 г в виде 1%-ного раствора. Выпускается в виде 1% раствора в ампулах по 1 мл.
Применение Гемостатическое средство. Эффект связан с периферическим сосудосуживающим действием, способностью повышать агрегацию тромбоцитов и укорачивать время кровотечения; вызывает сужение сосудов почек и оказывает антидиуретическое действие. Применяют для лечения геморрагического синдрома. Вводят внутривенно и внутримышечно по 0, 005 -0, 01 г в виде 1%-ного раствора. Выпускается в виде 1% раствора в ампулах по 1 мл.
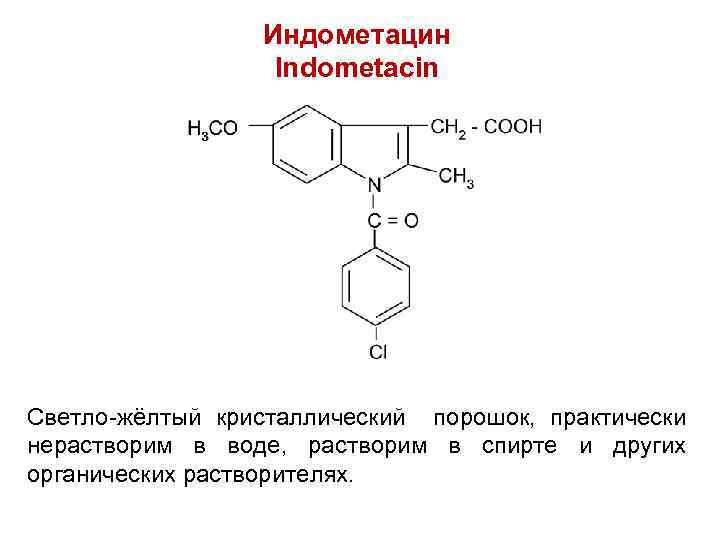 Индометацин Indometacin Светло-жёлтый кристаллический порошок, практически нерастворим в воде, растворим в спирте и других органических растворителях.
Индометацин Indometacin Светло-жёлтый кристаллический порошок, практически нерастворим в воде, растворим в спирте и других органических растворителях.
 Подлинность ИК- и УФ-спектроскопия. Химические методы анализа связаны молекуле карбоксильной, амидной и функциональных групп: с наличием метоксидной 1. Кислотно-основные свойства. Индометацин из-за наличия карбоксильной группы относится к –ОН кислотам: - растворим в растворах щелочей и аммиака с образованием солей - вступает в реакции комплексообразования с ионами тяжелых металлов (Cu 2+ и Fe 3+) с образованием нерастворимых окрашенных осадков.
Подлинность ИК- и УФ-спектроскопия. Химические методы анализа связаны молекуле карбоксильной, амидной и функциональных групп: с наличием метоксидной 1. Кислотно-основные свойства. Индометацин из-за наличия карбоксильной группы относится к –ОН кислотам: - растворим в растворах щелочей и аммиака с образованием солей - вступает в реакции комплексообразования с ионами тяжелых металлов (Cu 2+ и Fe 3+) с образованием нерастворимых окрашенных осадков.
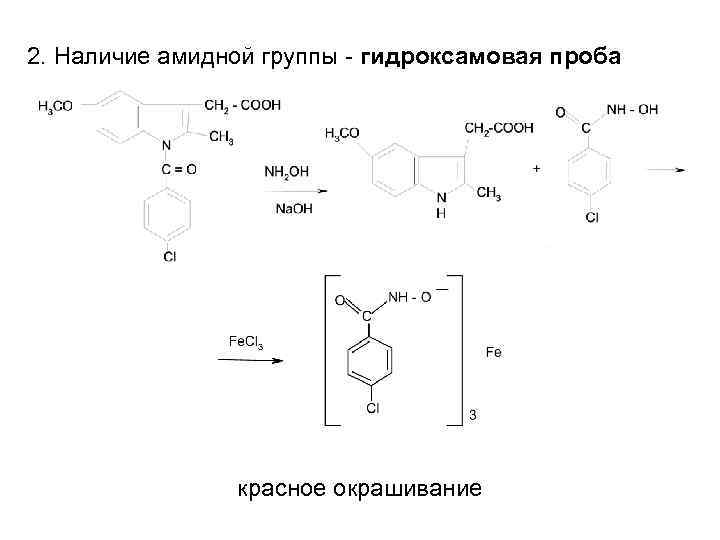 2. Наличие амидной группы - гидроксамовая проба красное окрашивание
2. Наличие амидной группы - гидроксамовая проба красное окрашивание
 Количественное определение Кислотные свойства (наличие карбоксильной группы) позволяют проводить количественное определение методом алкалиметрии. Растворитель – ацетон. Титруют по фенолфталеину 0, 1 М раствором натрия гидроксида. R-COOH + Na. OH → R-COONa + H 2 O Применение Проявляет болеутоляющее, жаропонижающее и противовоспалительное действие. Назначают при артритах, при воспалении суставов, при невралгиях в дозах от 0, 025 до 0, 1 г. Выпускают в таблетках по 0, 005; 0, 01 г, в капсулах по 0, 025; 0, 05 г, в виде мазей 10%, в виде суппозиториев по 0, 05 г и 0, 1 г и 5% геля.
Количественное определение Кислотные свойства (наличие карбоксильной группы) позволяют проводить количественное определение методом алкалиметрии. Растворитель – ацетон. Титруют по фенолфталеину 0, 1 М раствором натрия гидроксида. R-COOH + Na. OH → R-COONa + H 2 O Применение Проявляет болеутоляющее, жаропонижающее и противовоспалительное действие. Назначают при артритах, при воспалении суставов, при невралгиях в дозах от 0, 025 до 0, 1 г. Выпускают в таблетках по 0, 005; 0, 01 г, в капсулах по 0, 025; 0, 05 г, в виде мазей 10%, в виде суппозиториев по 0, 05 г и 0, 1 г и 5% геля.
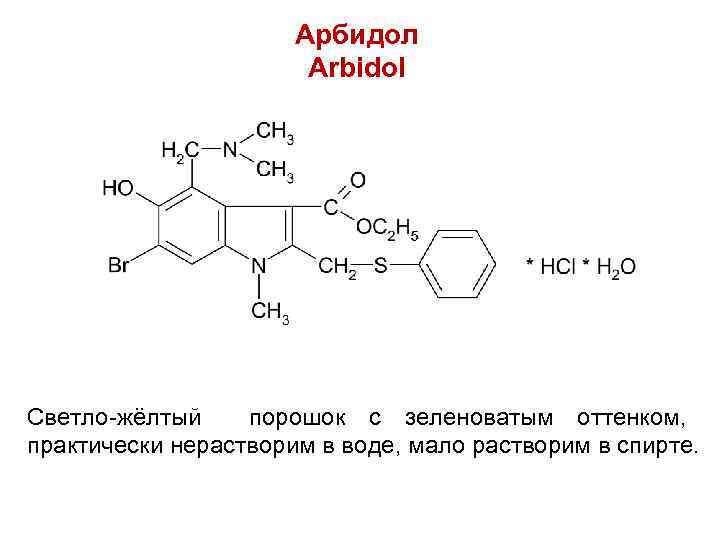 Арбидол Arbidol Светло-жёлтый порошок с зеленоватым оттенком, практически нерастворим в воде, мало растворим в спирте.
Арбидол Arbidol Светло-жёлтый порошок с зеленоватым оттенком, практически нерастворим в воде, мало растворим в спирте.
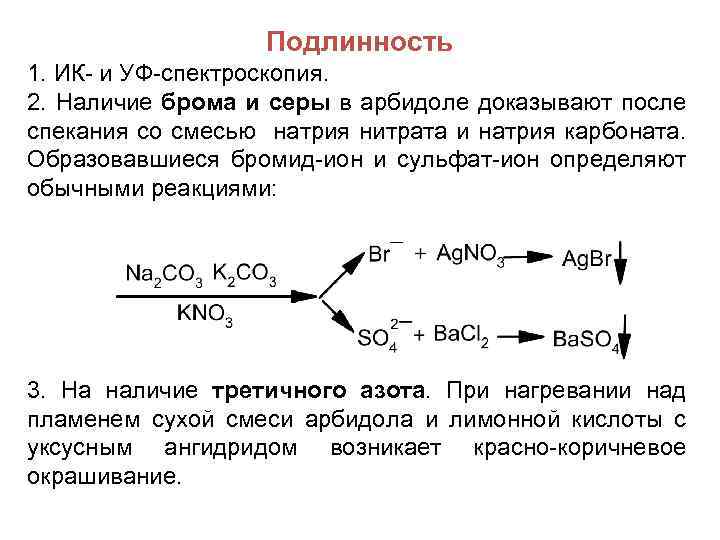 Подлинность 1. ИК- и УФ-спектроскопия. 2. Наличие брома и серы в арбидоле доказывают после спекания со смесью натрия нитрата и натрия карбоната. Образовавшиеся бромид-ион и сульфат-ион определяют обычными реакциями: 3. На наличие третичного азота. При нагревании над пламенем сухой смеси арбидола и лимонной кислоты с уксусным ангидридом возникает красно-коричневое окрашивание.
Подлинность 1. ИК- и УФ-спектроскопия. 2. Наличие брома и серы в арбидоле доказывают после спекания со смесью натрия нитрата и натрия карбоната. Образовавшиеся бромид-ион и сульфат-ион определяют обычными реакциями: 3. На наличие третичного азота. При нагревании над пламенем сухой смеси арбидола и лимонной кислоты с уксусным ангидридом возникает красно-коричневое окрашивание.
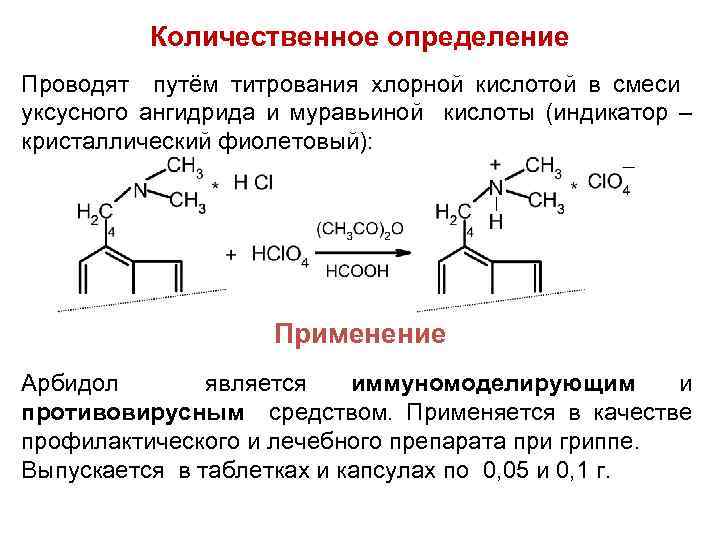 Количественное определение Проводят путём титрования хлорной кислотой в смеси уксусного ангидрида и муравьиной кислоты (индикатор – кристаллический фиолетовый): Применение Арбидол является иммуномоделирующим и противовирусным средством. Применяется в качестве профилактического и лечебного препарата при гриппе. Выпускается в таблетках и капсулах по 0, 05 и 0, 1 г.
Количественное определение Проводят путём титрования хлорной кислотой в смеси уксусного ангидрида и муравьиной кислоты (индикатор – кристаллический фиолетовый): Применение Арбидол является иммуномоделирующим и противовирусным средством. Применяется в качестве профилактического и лечебного препарата при гриппе. Выпускается в таблетках и капсулах по 0, 05 и 0, 1 г.
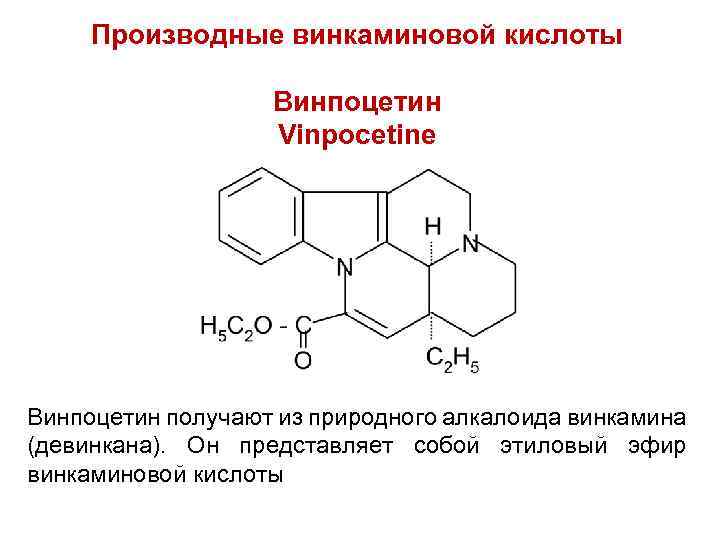 Производные винкаминовой кислоты Винпоцетин Vinpocetine Винпоцетин получают из природного алкалоида винкамина (девинкана). Он представляет собой этиловый эфир винкаминовой кислоты
Производные винкаминовой кислоты Винпоцетин Vinpocetine Винпоцетин получают из природного алкалоида винкамина (девинкана). Он представляет собой этиловый эфир винкаминовой кислоты
 Подлинность 1. ИК- и УФ-спектроскопия. 2. Раствор винпоцетина в растворе хлористоводородной кислоты даёт осадки с реактивом Драгендорфа (раствор висмута йодида в растворе калия йодида), с пикриновой кислотой. Количественное определение Проводят методом титрования 0, 1 М хлорной кислотой в среде уксусной кислоты безводной (индикатор – кристаллический фиолетовый). Применение Избирательно расширяет сосуды головного мозга, улучшает кровоснабжение ишемизированных областей мозга, снижает повышенную вязкость крови. Выпускается в таблетках по 0, 005 г и в виде 0, 5% раствора для инъекций. Торговое наименование Кавинтон.
Подлинность 1. ИК- и УФ-спектроскопия. 2. Раствор винпоцетина в растворе хлористоводородной кислоты даёт осадки с реактивом Драгендорфа (раствор висмута йодида в растворе калия йодида), с пикриновой кислотой. Количественное определение Проводят методом титрования 0, 1 М хлорной кислотой в среде уксусной кислоты безводной (индикатор – кристаллический фиолетовый). Применение Избирательно расширяет сосуды головного мозга, улучшает кровоснабжение ишемизированных областей мозга, снижает повышенную вязкость крови. Выпускается в таблетках по 0, 005 г и в виде 0, 5% раствора для инъекций. Торговое наименование Кавинтон.
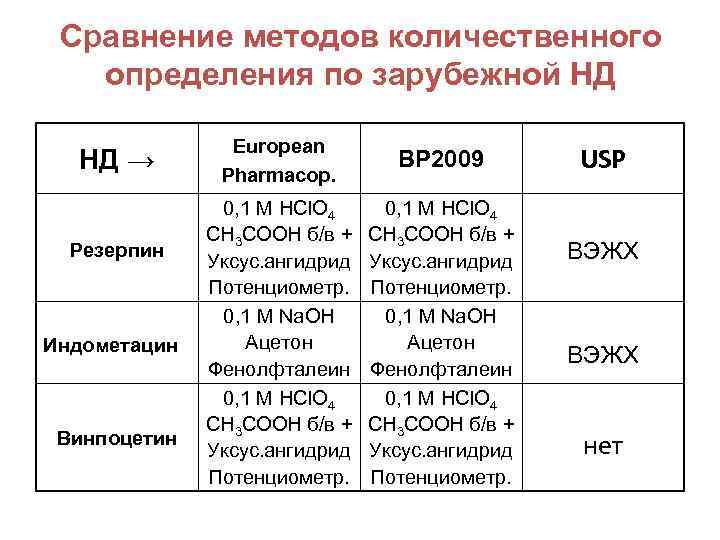 Сравнение методов количественного определения по зарубежной НД НД → Резерпин Индометацин Винпоцетин European Pharmacop. BP 2009 0, 1 М HCl. O 4 CH 3 COOH б/в + Уксус. ангидрид Потенциометр. 0, 1 М Na. OH Ацетон Фенолфталеин 0, 1 М HCl. O 4 CH 3 COOH б/в + Уксус. ангидрид Потенциометр. USP ВЭЖХ нет
Сравнение методов количественного определения по зарубежной НД НД → Резерпин Индометацин Винпоцетин European Pharmacop. BP 2009 0, 1 М HCl. O 4 CH 3 COOH б/в + Уксус. ангидрид Потенциометр. 0, 1 М Na. OH Ацетон Фенолфталеин 0, 1 М HCl. O 4 CH 3 COOH б/в + Уксус. ангидрид Потенциометр. USP ВЭЖХ нет


