Лекция 4 Клеточный цикл Чекпойнт-контроль в норме и









































lekciya_4-5-spbgpu-2014-2015.ppt
- Размер: 4.3 Мб
- Автор:
- Количество слайдов: 63
Описание презентации Лекция 4 Клеточный цикл Чекпойнт-контроль в норме и по слайдам
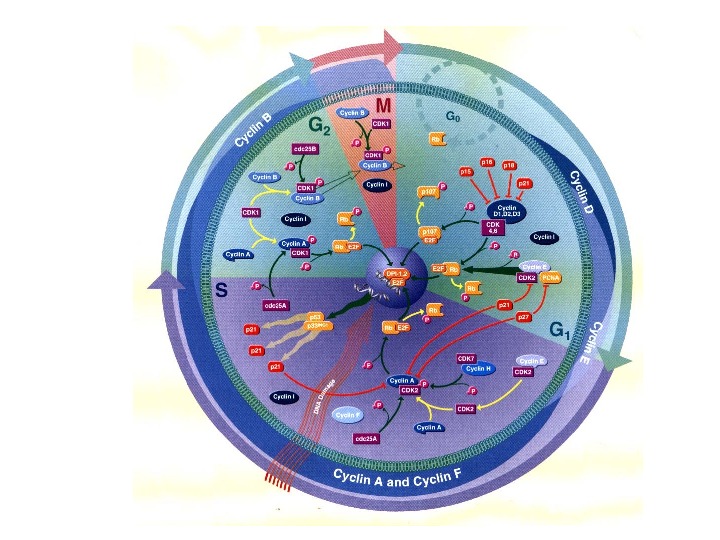
 Лекция 4 Клеточный цикл Чекпойнт-контроль в норме и при повреждении ДНК
Лекция 4 Клеточный цикл Чекпойнт-контроль в норме и при повреждении ДНК

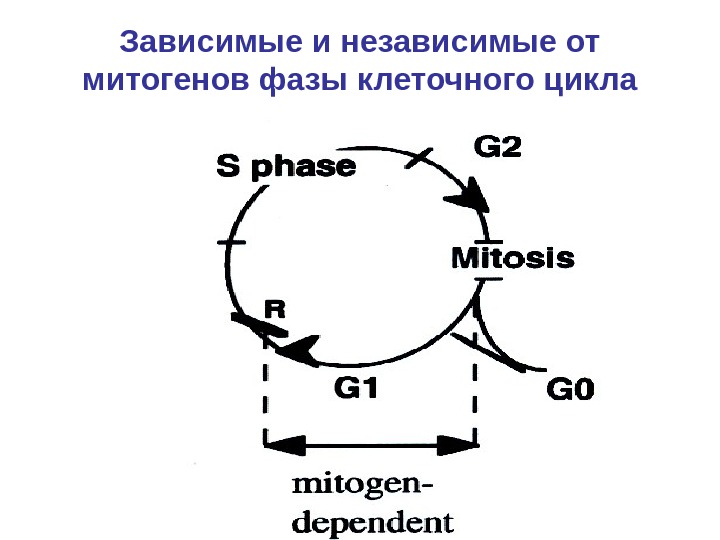
 Зависимые и независимые от митогенов фазы клеточного цикла
Зависимые и независимые от митогенов фазы клеточного цикла
 Основные принципы регуляции прохождения клетки по циклу • Активация Cdks управляется последовательно экспрессией и объединением с циклинами. • Активность каждой пары Cdk -циклин необходима для активации последующей. • Разрушение циклинов приводит к однонаправленному клеточному циклу • Ингибирование комплексов Cdks -циклины путем фосфорилирования или путем связывания с белками-ингибиторами задерживает активацию Cdks и замедляет движение клетки по циклу в неблагоприятных условиях.
Основные принципы регуляции прохождения клетки по циклу • Активация Cdks управляется последовательно экспрессией и объединением с циклинами. • Активность каждой пары Cdk -циклин необходима для активации последующей. • Разрушение циклинов приводит к однонаправленному клеточному циклу • Ингибирование комплексов Cdks -циклины путем фосфорилирования или путем связывания с белками-ингибиторами задерживает активацию Cdks и замедляет движение клетки по циклу в неблагоприятных условиях.
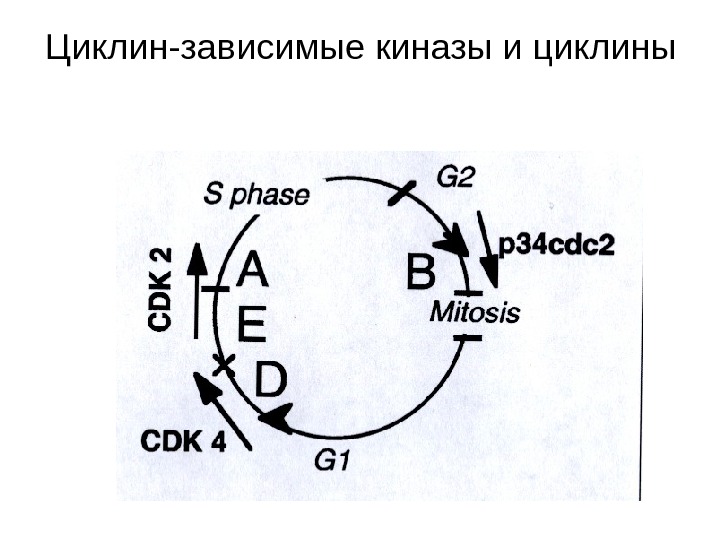
 Циклин-зависимые киназы и циклины
Циклин-зависимые киназы и циклины
 Активация и дезактивация Cdks Различные клеточные процессы, необходимые для успешной репликации и деления клеток, управляются последовательной активаций и дезактивацией семейства циклин-зависимых киназ ( Cdks ). Активация преимущественно управляется периодической экспрессией циклинов и нуждается в активирующем фосфорилировании. Полная активация требует фосфорилирования по треонину в С-конце. Киназы, способные к такому активирующему фосфорилированию Cdks называются Cdk — activating kinases ( Cak ). Инактивация контролируется • 1) ингибирующим фосфорилированием киназ, • 2) убиквитин-опосредованной деградацией циклинов 3) взаимодействием всего комплекса с малыми ингибирующими белками.
Активация и дезактивация Cdks Различные клеточные процессы, необходимые для успешной репликации и деления клеток, управляются последовательной активаций и дезактивацией семейства циклин-зависимых киназ ( Cdks ). Активация преимущественно управляется периодической экспрессией циклинов и нуждается в активирующем фосфорилировании. Полная активация требует фосфорилирования по треонину в С-конце. Киназы, способные к такому активирующему фосфорилированию Cdks называются Cdk — activating kinases ( Cak ). Инактивация контролируется • 1) ингибирующим фосфорилированием киназ, • 2) убиквитин-опосредованной деградацией циклинов 3) взаимодействием всего комплекса с малыми ингибирующими белками.
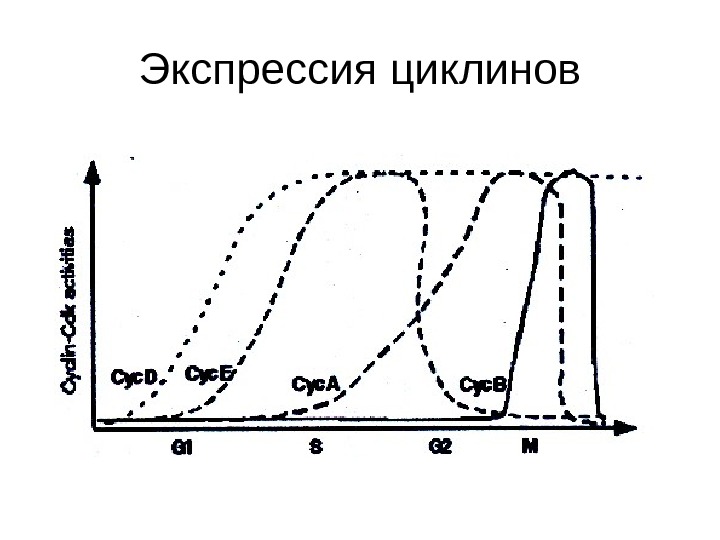
 Экспрессия циклинов
Экспрессия циклинов
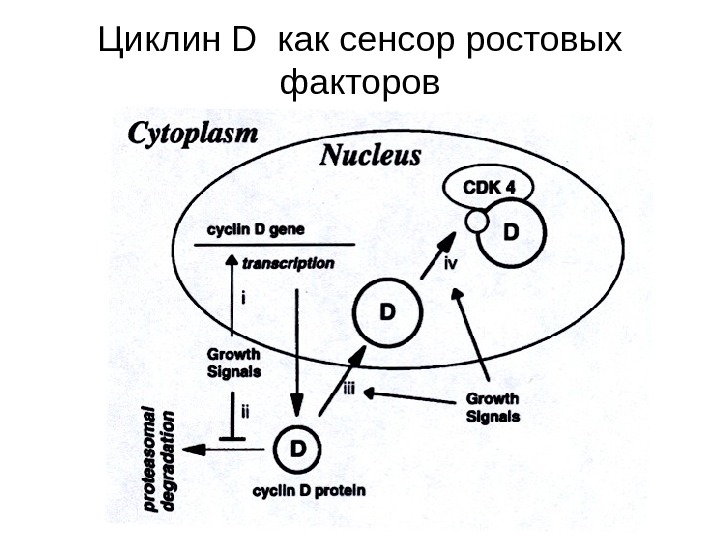
 Циклин D как сенсор ростовых факторов
Циклин D как сенсор ростовых факторов
 Регуляция циклина D ростовыми факторами 1. Индукция транскрипции, 2. Стабилизация белка циклина D , 3. Перемещение в ядро, 4. Объединение с каталитическими партнерами Cdk -4 Cdk -6. Экспрессия циклина D , его продвижение в ядро, стабилизация и ассоциация с Cdks 4/6 в активный киназный комплекс регулируется ростовыми факторами. Следовательно, циклин D является сенсором ростовых факторов.
Регуляция циклина D ростовыми факторами 1. Индукция транскрипции, 2. Стабилизация белка циклина D , 3. Перемещение в ядро, 4. Объединение с каталитическими партнерами Cdk -4 Cdk -6. Экспрессия циклина D , его продвижение в ядро, стабилизация и ассоциация с Cdks 4/6 в активный киназный комплекс регулируется ростовыми факторами. Следовательно, циклин D является сенсором ростовых факторов.
 Циклин D 1 • Циклин D 1 подвергается убиквитинированию и протеосомной деградации после фосфорилирования по треонину-286. Это фосфорилирование может быть ингибировано через сигнальный путь, в котором частично задействованы Ras , Pi 3 -киназа и протеинкиназа В ( Act ). Такой оборот циклина D 1 является митоген-зависимым, а перенос в ядро и ассоциация с Cdk 4 – митоген-независимым.
Циклин D 1 • Циклин D 1 подвергается убиквитинированию и протеосомной деградации после фосфорилирования по треонину-286. Это фосфорилирование может быть ингибировано через сигнальный путь, в котором частично задействованы Ras , Pi 3 -киназа и протеинкиназа В ( Act ). Такой оборот циклина D 1 является митоген-зависимым, а перенос в ядро и ассоциация с Cdk 4 – митоген-независимым.
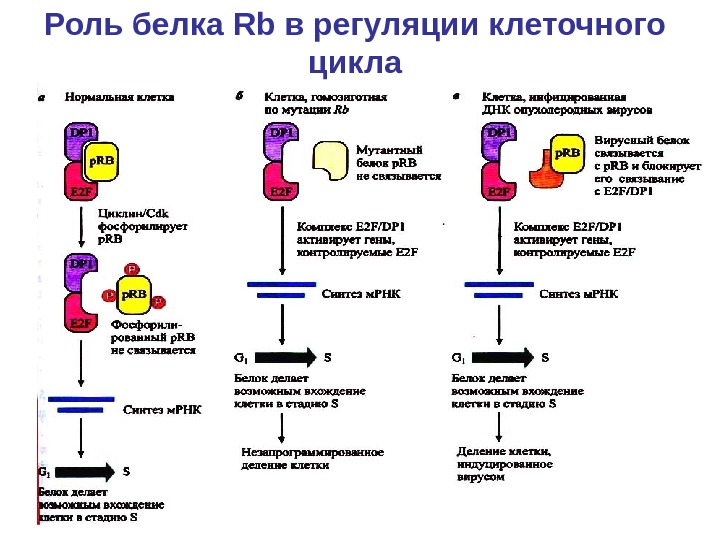
 Роль белка Rb в регуляции клеточного цикла
Роль белка Rb в регуляции клеточного цикла
 Rb • Способность циклин D –зависимых киназ начинать фосфорилирование Rb в средней и поздней G 1 показывает, что инактивация Rb как фактора супрессирующего клеточный рост, также является митоген-зависимым шагом. Rb участвует в контроле G 1/ S перехода, связывая семейство транскрипционных факторов E 2 F. Отсутствие функционально активной Rb достаточно для вхождения в фазу S в условиях, ограничивающих клеточный рост. E 2 F -1 накопление приводит к преодолению G 1 -ареста, являющегося результатом ингибирования активности G 1 -циклин- Cdks киназной активности. • Зависимость от ростовых факторов заканчивается в момент полного фосфорилирования Rb
Rb • Способность циклин D –зависимых киназ начинать фосфорилирование Rb в средней и поздней G 1 показывает, что инактивация Rb как фактора супрессирующего клеточный рост, также является митоген-зависимым шагом. Rb участвует в контроле G 1/ S перехода, связывая семейство транскрипционных факторов E 2 F. Отсутствие функционально активной Rb достаточно для вхождения в фазу S в условиях, ограничивающих клеточный рост. E 2 F -1 накопление приводит к преодолению G 1 -ареста, являющегося результатом ингибирования активности G 1 -циклин- Cdks киназной активности. • Зависимость от ростовых факторов заканчивается в момент полного фосфорилирования Rb
 Роль белка ретинобластомы в клеточном цикле • Белок Rb в гипофосфорилированном состоянии связывает и ингибирует факторы транскрипции Е 2 F , необходимые для перехода клетки из G 1 в S фазу, контролируя тем самым клеточный цикл. «Страж генома» р53, а также независимо от р53 белок р 16 INK 4 супрессирует сигнальные пути, приводящие к фосфорилированию р Rb и освобождению Е
Роль белка ретинобластомы в клеточном цикле • Белок Rb в гипофосфорилированном состоянии связывает и ингибирует факторы транскрипции Е 2 F , необходимые для перехода клетки из G 1 в S фазу, контролируя тем самым клеточный цикл. «Страж генома» р53, а также независимо от р53 белок р 16 INK 4 супрессирует сигнальные пути, приводящие к фосфорилированию р Rb и освобождению Е
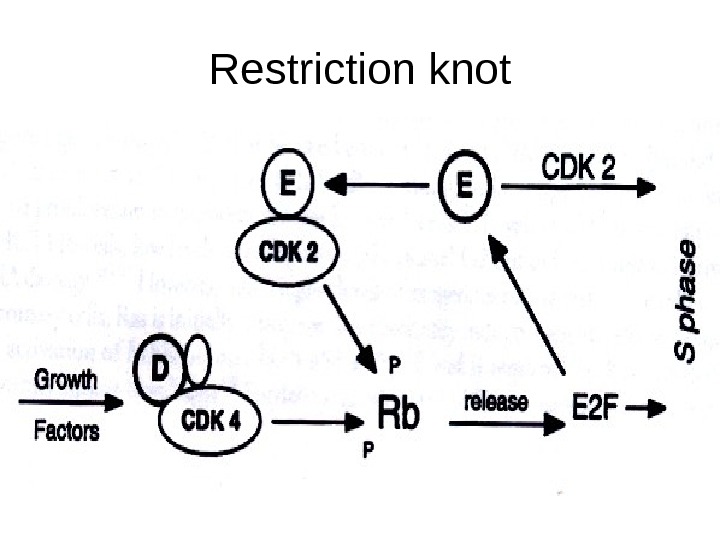
 Restriction knot
Restriction knot
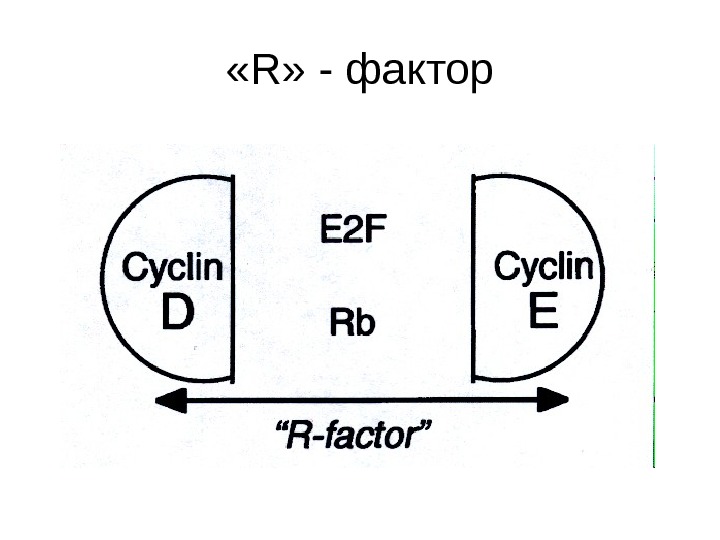
 « R » — фактор
« R » — фактор
 Переход из G 1 в S • Переход из G 1 в S сопровождается множественными петлями обратной связи, приводящими к ситуациям, при которых нижележащие события связаны с регуляцией самих себя на более высоком уровне. • Например, и Rb /р130 и р27 оба являются негативными регуляторами циклина Е. Экспрессия с- myc зависит от р21, CDKs и E 2 F , при том, что c — myc сам является регулятором р21 и CDKs. • Таким же образом циклин Е расположен ниже по отношению к Rb и E 2 F -1, так как он трансактивируется E 2 F -1. В тоже время завершение фосфорилирования Rb циклином Е и приводит к высвобождению E 2 F. Тот же циклин Е, единожды экспрессировавшись, становиться в дальнейшем независимым от митоген-зависимого циклина D.
Переход из G 1 в S • Переход из G 1 в S сопровождается множественными петлями обратной связи, приводящими к ситуациям, при которых нижележащие события связаны с регуляцией самих себя на более высоком уровне. • Например, и Rb /р130 и р27 оба являются негативными регуляторами циклина Е. Экспрессия с- myc зависит от р21, CDKs и E 2 F , при том, что c — myc сам является регулятором р21 и CDKs. • Таким же образом циклин Е расположен ниже по отношению к Rb и E 2 F -1, так как он трансактивируется E 2 F -1. В тоже время завершение фосфорилирования Rb циклином Е и приводит к высвобождению E 2 F. Тот же циклин Е, единожды экспрессировавшись, становиться в дальнейшем независимым от митоген-зависимого циклина D.
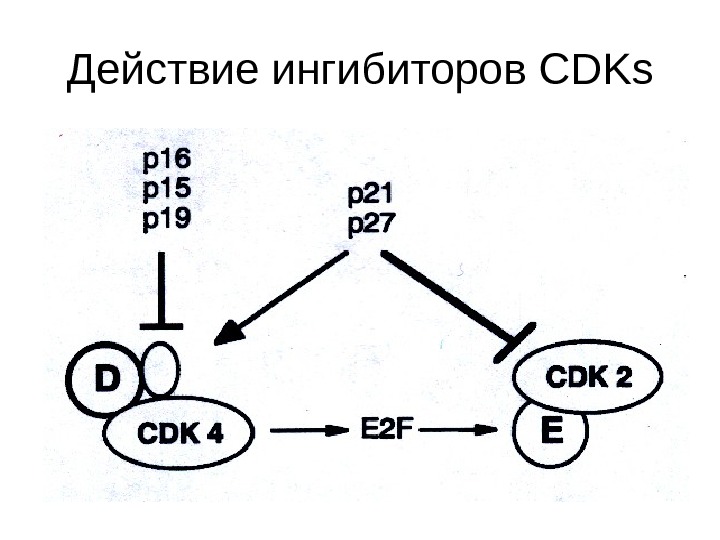
 Действие ингибиторов CDKs
Действие ингибиторов CDKs
 Ингибиторы CDKs • Семейство Ink 4 (р15, р16, р18 и р19), названные так по способности ингибировать Cdk 4, связываются с мономерами Cdk 4 и Cdk 6. Ингибиторы связываются с ними в той же области, что и циклин D. • Второе семейство CKIs , Cip / Kip семейство (р21 cip , p 27 kip и р57 kip ) ингибируют комплексы, содержащие Cdk 2. Это семейство ингибиторов связывается с формирующимися комплексами, блокируя таким образом доступ к субстрату. • Skp — Cullin F box complex ( SCF ) и Anaphase promoting complex ( APC ) – факторы протеосомной деградации циклинов.
Ингибиторы CDKs • Семейство Ink 4 (р15, р16, р18 и р19), названные так по способности ингибировать Cdk 4, связываются с мономерами Cdk 4 и Cdk 6. Ингибиторы связываются с ними в той же области, что и циклин D. • Второе семейство CKIs , Cip / Kip семейство (р21 cip , p 27 kip и р57 kip ) ингибируют комплексы, содержащие Cdk 2. Это семейство ингибиторов связывается с формирующимися комплексами, блокируя таким образом доступ к субстрату. • Skp — Cullin F box complex ( SCF ) и Anaphase promoting complex ( APC ) – факторы протеосомной деградации циклинов.
 Ингибиторное фосфорилирование • Ингибиторное фосфорилирование осуществляется рядом с N -концом с АТР-связывающим сайтом киназной субъединицы, у человеческой Cdk 1 это треонин-14 и тирозин-15. Фосфорилирование по тирозину-15 в основном осуществляется ядерной киназой Wee 1, в то время как фосфорилирование по треонину-14 ведет Myt 1, цитоплазматический белок, связанный с мембранами цитоплазматического ретикулума и Гольджи. • Различная локализация этих киназ предполагает механизм, по которому Cdk 1 может негативно регулироваться как в ядре, так и в цитоплазме. Ингибирующие фосфорилирование Cdks снимается семейством Cdc 25 фосфатаз двойной специфичности. Сами Cdc 25 являются субстратами для Cdks : Cdc 25 А фосфорилируется и активируется циклин Е/ Cdk 2 , а Cdc 25 С — циклин В/ Cdk 1.
Ингибиторное фосфорилирование • Ингибиторное фосфорилирование осуществляется рядом с N -концом с АТР-связывающим сайтом киназной субъединицы, у человеческой Cdk 1 это треонин-14 и тирозин-15. Фосфорилирование по тирозину-15 в основном осуществляется ядерной киназой Wee 1, в то время как фосфорилирование по треонину-14 ведет Myt 1, цитоплазматический белок, связанный с мембранами цитоплазматического ретикулума и Гольджи. • Различная локализация этих киназ предполагает механизм, по которому Cdk 1 может негативно регулироваться как в ядре, так и в цитоплазме. Ингибирующие фосфорилирование Cdks снимается семейством Cdc 25 фосфатаз двойной специфичности. Сами Cdc 25 являются субстратами для Cdks : Cdc 25 А фосфорилируется и активируется циклин Е/ Cdk 2 , а Cdc 25 С — циклин В/ Cdk 1.
 Специфичность и временная правильность деградации циклинов • В случае SCF , распознающие белки, известные как F — box белки, привлекают белки-мишени к SCF -комплексу. Р 27 и циклин Е распознаются только в том случае, если они фосфорилированы Cdks. Таким образом их деградация находится под прямым контролем Cdk -активности. • В случае АРС -комплекса были идентифицированы два специальных фактора – Cdc 20 и Cdh 1. Анафаза завершается деградацией белков, предотвращающих расхождение сестринских хроматид. Регуляция начала анафазы строго контролируется чекпойнтом веретена, который гарантирует, что сегрегация не может осуществиться до того, как все хромосомы правильно прикрепятся к митотическому веретену. Увеличение экспрессии Cdc 20 в митозе инициирует деградацию субстратов АРС- Cdc 20. Фосфорилирование Cdc 20 и компонентов кора АРС комплексом циклин В – Cdk 1 в дальнейшем стимулирует их убиквитин-лигазную активность. Циклин В и Cdc 20 оба являются субстратами АРС. Таким образом они сами стимулируют ту активность, которая является причиной их деструкции. Активность АРС- Cdh 1 в ранней G 1 гарантирует разрушение всех митотических белков до инициации репликации ДНК в следующем цикле.
Специфичность и временная правильность деградации циклинов • В случае SCF , распознающие белки, известные как F — box белки, привлекают белки-мишени к SCF -комплексу. Р 27 и циклин Е распознаются только в том случае, если они фосфорилированы Cdks. Таким образом их деградация находится под прямым контролем Cdk -активности. • В случае АРС -комплекса были идентифицированы два специальных фактора – Cdc 20 и Cdh 1. Анафаза завершается деградацией белков, предотвращающих расхождение сестринских хроматид. Регуляция начала анафазы строго контролируется чекпойнтом веретена, который гарантирует, что сегрегация не может осуществиться до того, как все хромосомы правильно прикрепятся к митотическому веретену. Увеличение экспрессии Cdc 20 в митозе инициирует деградацию субстратов АРС- Cdc 20. Фосфорилирование Cdc 20 и компонентов кора АРС комплексом циклин В – Cdk 1 в дальнейшем стимулирует их убиквитин-лигазную активность. Циклин В и Cdc 20 оба являются субстратами АРС. Таким образом они сами стимулируют ту активность, которая является причиной их деструкции. Активность АРС- Cdh 1 в ранней G 1 гарантирует разрушение всех митотических белков до инициации репликации ДНК в следующем цикле.
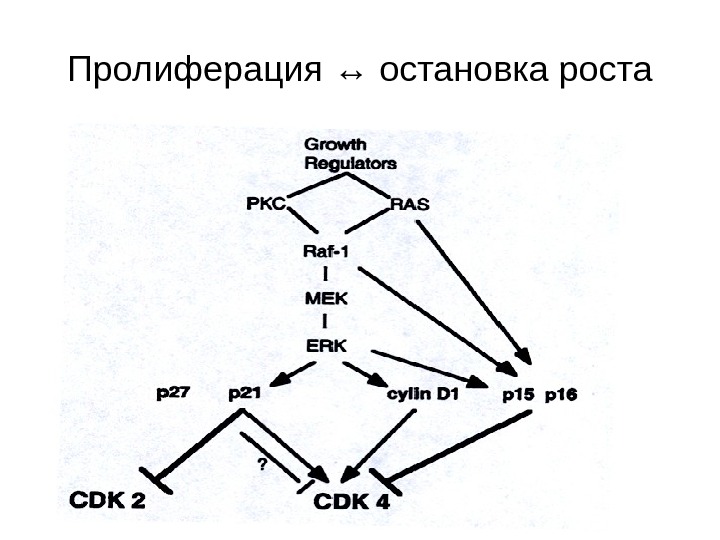
 Пролиферация ↔ остановка роста
Пролиферация ↔ остановка роста
 Пролиферация ↔ остановка роста • Хорошо известно, что экзогенные стимулы, такие как EGF , TGFβ , CSF -1, интерлейкины и форболовые эфиры, а также внутриклеточные сигнальные молекулы, такие как Ras , PKC , Raf -1, ERK могут вызывать как продвижение по циклу, так и арест. • Стимуляция роста происходит тогда, когда агент действует на покоящуюся клетку, в то время как остановка цикла – при его действии на клетку пролиферирующую.
Пролиферация ↔ остановка роста • Хорошо известно, что экзогенные стимулы, такие как EGF , TGFβ , CSF -1, интерлейкины и форболовые эфиры, а также внутриклеточные сигнальные молекулы, такие как Ras , PKC , Raf -1, ERK могут вызывать как продвижение по циклу, так и арест. • Стимуляция роста происходит тогда, когда агент действует на покоящуюся клетку, в то время как остановка цикла – при его действии на клетку пролиферирующую.
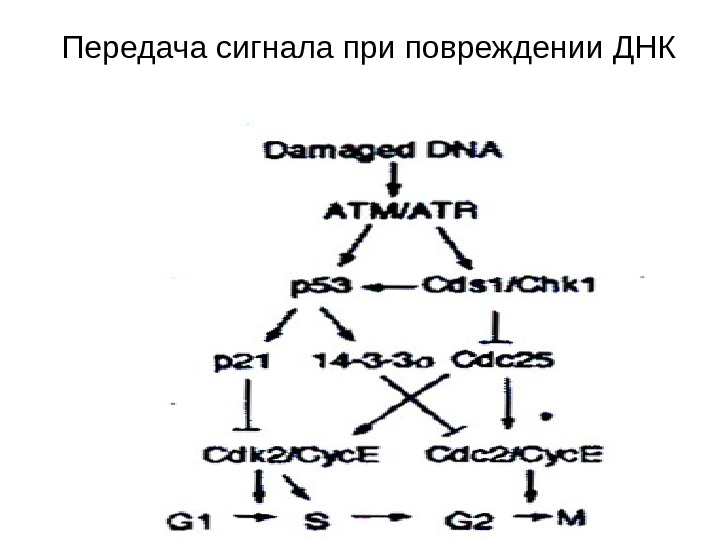
 Передача сигнала при повреждении ДНК
Передача сигнала при повреждении ДНК
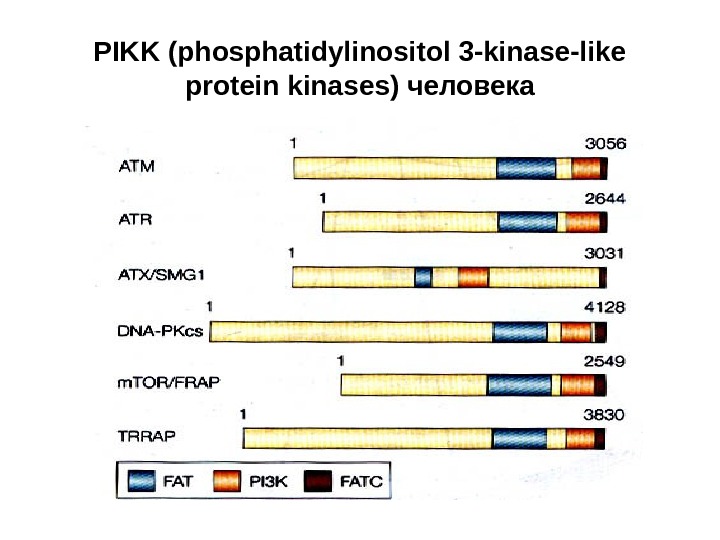
 PIKK (phosphatidylinositol 3 -kinase-like protein kinases) человека
PIKK (phosphatidylinositol 3 -kinase-like protein kinases) человека
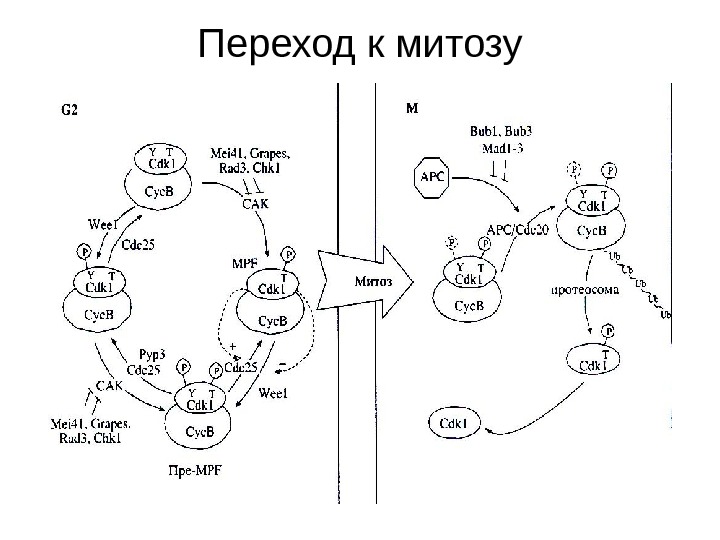
 Переход к митозу
Переход к митозу
 Митоз • Обособление и последующее расхождение сестринских центросом до особых точек, определяющих расположение полюсов веретена. • Реорганизация сети интерфазных микротрубочек в полярные нити веретена, исходящие от центросомы (- у центросомы, + на кинетохоре) • Реорганизация диффузного интерфазного хроматина в хромосомы. • Образование на центромере кинетохора. • Полное обособление сестринских хроматид и расхождение дочерних хромосом до полюсов в анафазе с последующим расхождение полюсов.
Митоз • Обособление и последующее расхождение сестринских центросом до особых точек, определяющих расположение полюсов веретена. • Реорганизация сети интерфазных микротрубочек в полярные нити веретена, исходящие от центросомы (- у центросомы, + на кинетохоре) • Реорганизация диффузного интерфазного хроматина в хромосомы. • Образование на центромере кинетохора. • Полное обособление сестринских хроматид и расхождение дочерних хромосом до полюсов в анафазе с последующим расхождение полюсов.
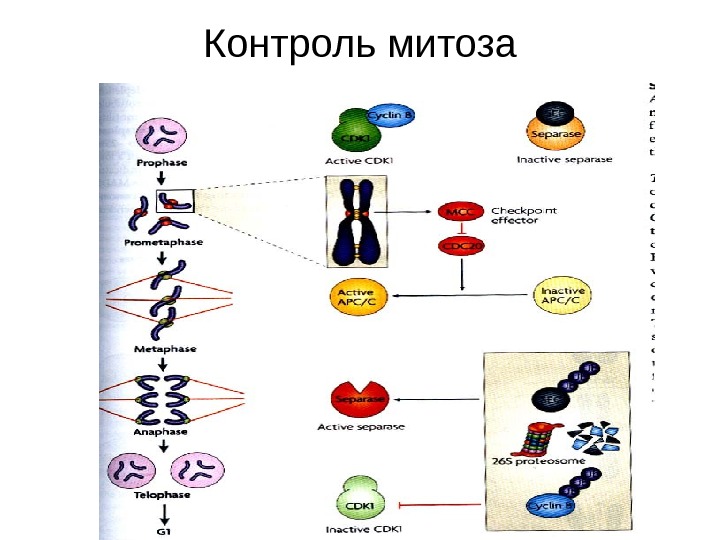
 Контроль митоза
Контроль митоза
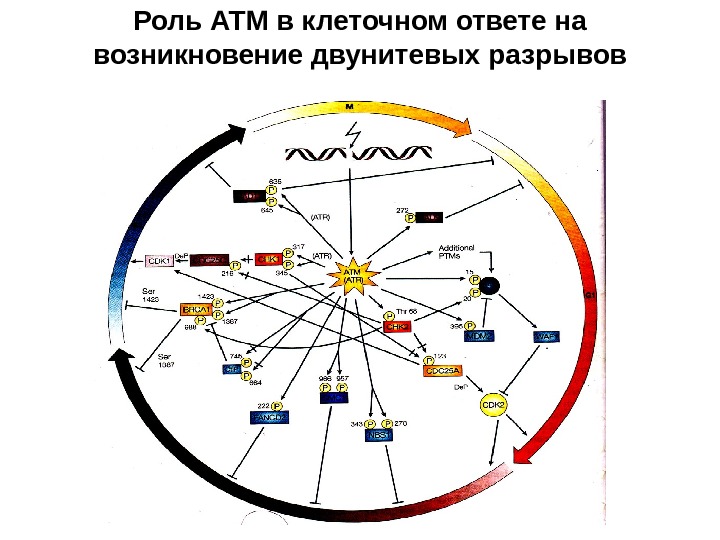
 Роль АТМ в клеточном ответе на возникновение двунитевых разрывов
Роль АТМ в клеточном ответе на возникновение двунитевых разрывов
 Лекция 5 Метилирование генома. Убиквитинирование Роль протеасом в клеточном цикле.
Лекция 5 Метилирование генома. Убиквитинирование Роль протеасом в клеточном цикле.
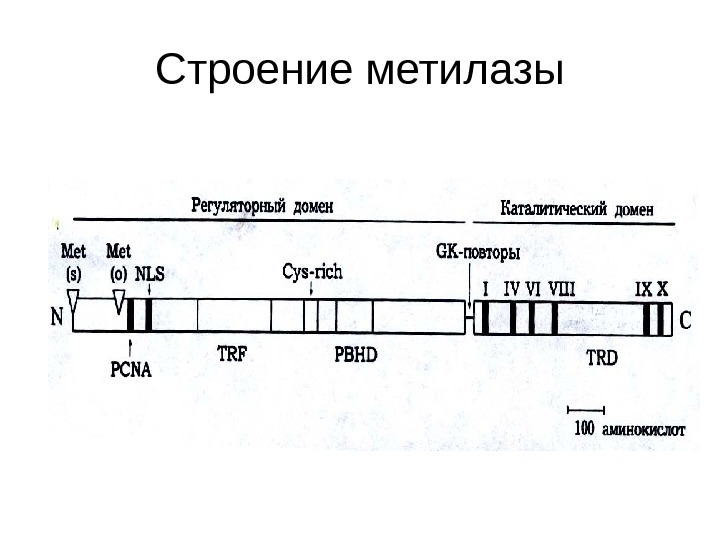
 Строение метилазы
Строение метилазы
 Структура Dnmt 1 -семейства ДНК-метилтрансфераз. • N — и С-концевые домены белка разделены G К-повторами. • Римские цифры — основные консервативные мотивы С-концевого каталитического домена; • TRD — область, ответственная за узнавание специфической метилируемой последовательности. • В N -концевом регуляторном домене отмечены функциональные последовательности, детерминирующие связывание ядерного антигена пролиферируюших клеток (РС N А), сигнал ядерной локализации (N LS ), нацеливание белка в точки репликации ДНК (Т RF ), связывание с ионами Zn 2+ (Су s — rich ), гомологию с полибромо-1 -белком (РВН D ). • Ме t ( s ))и Ме t (о)- N-концевые положения соответственно соматической и ооцит-специфической форм белка.
Структура Dnmt 1 -семейства ДНК-метилтрансфераз. • N — и С-концевые домены белка разделены G К-повторами. • Римские цифры — основные консервативные мотивы С-концевого каталитического домена; • TRD — область, ответственная за узнавание специфической метилируемой последовательности. • В N -концевом регуляторном домене отмечены функциональные последовательности, детерминирующие связывание ядерного антигена пролиферируюших клеток (РС N А), сигнал ядерной локализации (N LS ), нацеливание белка в точки репликации ДНК (Т RF ), связывание с ионами Zn 2+ (Су s — rich ), гомологию с полибромо-1 -белком (РВН D ). • Ме t ( s ))и Ме t (о)- N-концевые положения соответственно соматической и ооцит-специфической форм белка.
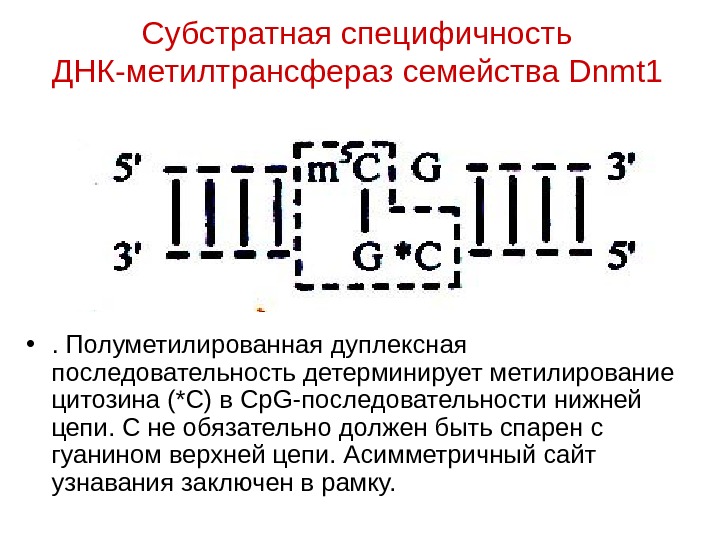
 Субстратная специфичность ДНК-метилтрансфераз семейства Dnmt 1 • . Полуметилированная дуплексная последовательность детерминирует метилирование цитозина (*С) в Ср G -последовательности нижней цепи. С не обязательно должен быть спарен с гуанином верхней цепи. Асимметричный сайт узнавания заключен в рамку.
Субстратная специфичность ДНК-метилтрансфераз семейства Dnmt 1 • . Полуметилированная дуплексная последовательность детерминирует метилирование цитозина (*С) в Ср G -последовательности нижней цепи. С не обязательно должен быть спарен с гуанином верхней цепи. Асимметричный сайт узнавания заключен в рамку.
 • Dnmt 1 человека может избирательно узнавать и модифицировать полуметилированные асимметричные дуплексные субстраты, состоящие из «целевой мишени» Ср G на одной цепи и спаренного с ней метилированного цитидинового остатка в комплементарной цепи. При этом соседство этого метилированного цитидина в своей цепи с гуанозином не обязательно: соседом может быть любой нуклеозид или его производное. Оптимальные для метилирования de novo субстраты содержат между немодифицированными динуклеотидами Ср G другие последовательности длиной 13 -17 нуклеотидов.
• Dnmt 1 человека может избирательно узнавать и модифицировать полуметилированные асимметричные дуплексные субстраты, состоящие из «целевой мишени» Ср G на одной цепи и спаренного с ней метилированного цитидинового остатка в комплементарной цепи. При этом соседство этого метилированного цитидина в своей цепи с гуанозином не обязательно: соседом может быть любой нуклеозид или его производное. Оптимальные для метилирования de novo субстраты содержат между немодифицированными динуклеотидами Ср G другие последовательности длиной 13 -17 нуклеотидов.
 Белки, ассоциирующие с Dnmt 1 Dnmt 3 a Dnmt 3 b HD АС 1 Н D АС 2 SUV 39 Н 1 Rb РМ L — RAR D МАР 1 h $ NF 2 Н РС N А МВ D 2 МВ D З Ме. СР 2 НР 1β RNApol. II de novo ДНК-метилтрансфераза деанетилаза гистонов метилтрансфераза гистона НЗ Lys 9 супрессор опухолей онкогенный фактор транскрипции корепрессор транскрипции хроматин-ремоделирующий белок фактор репликации ДНК связывание с Ср G -метилированной ДНК белок гетерохроматина РНК-полимераза II
Белки, ассоциирующие с Dnmt 1 Dnmt 3 a Dnmt 3 b HD АС 1 Н D АС 2 SUV 39 Н 1 Rb РМ L — RAR D МАР 1 h $ NF 2 Н РС N А МВ D 2 МВ D З Ме. СР 2 НР 1β RNApol. II de novo ДНК-метилтрансфераза деанетилаза гистонов метилтрансфераза гистона НЗ Lys 9 супрессор опухолей онкогенный фактор транскрипции корепрессор транскрипции хроматин-ремоделирующий белок фактор репликации ДНК связывание с Ср G -метилированной ДНК белок гетерохроматина РНК-полимераза II
 Белки, ассоциирующие с Dnmt 3 a Dnmt 1 Dnmt. L HD АС 1 Н D АС 2 SUV 39 Н 1 РМ L — RAR RP 58 НР 1 β SUMO-1 поддерживаюшая ДНК-метилаза репрессор транскрипции деацетилаза гистонов метилтрансфераза гистона НЗ Lys 9 онкогенный фактор транскрипции корепрессор транскрипции белок гетерохроматина убиквитиноподобный пептид
Белки, ассоциирующие с Dnmt 3 a Dnmt 1 Dnmt. L HD АС 1 Н D АС 2 SUV 39 Н 1 РМ L — RAR RP 58 НР 1 β SUMO-1 поддерживаюшая ДНК-метилаза репрессор транскрипции деацетилаза гистонов метилтрансфераза гистона НЗ Lys 9 онкогенный фактор транскрипции корепрессор транскрипции белок гетерохроматина убиквитиноподобный пептид
 Белки, ассоциирующие с Dnm 3 b Dnmt 1 Dnmt. L HD АС 1 SUMO-1 Dnmt. L Dnmt 3 a Dnmt 3 b HD АС 1 поддерживаюшая ДНК-метилаза репрессор транскрипции деацетилаза гистонов убиквитиноподобный пептид de novo ДНК-метилтрансфераза деацетилаза гистонов
Белки, ассоциирующие с Dnm 3 b Dnmt 1 Dnmt. L HD АС 1 SUMO-1 Dnmt. L Dnmt 3 a Dnmt 3 b HD АС 1 поддерживаюшая ДНК-метилаза репрессор транскрипции деацетилаза гистонов убиквитиноподобный пептид de novo ДНК-метилтрансфераза деацетилаза гистонов
 • Ген Dnmt 1 мыши (>56 т. п. н. ) состоит из 39 экзонов размером от 32 до 352 п. н. • Экспрессия Dnmt 1 может происходить с одного главного и трех минорных участков инициации и регулироваться независимыми промоторами и энхансерами. • Большая изоформа ДНК-метилазы Dnmt 1 транслируется с третьего АТ G -кодона первого экзона и присутствует в эмбриональных стволовых клетках и соматических тканях, в то время как короткая изоформа транслируется с четвертого АТ G -кодона четвертого экзона и обнаружена в ооцитах и преимплантированных эмбрионах. • Два секс-специфических экзона гена Dnmt 1 контролируют его экспрессию в ооцитах млекопитающих. • Область главного промотора гена Dnmt 1 Р 1 отличается высоким содержанием последовательностей Ср G , характерным для «хаус-киппинг» генов, а область минорных промоторов Р 2—Р 4 — дефицитом этих последовательностей.
• Ген Dnmt 1 мыши (>56 т. п. н. ) состоит из 39 экзонов размером от 32 до 352 п. н. • Экспрессия Dnmt 1 может происходить с одного главного и трех минорных участков инициации и регулироваться независимыми промоторами и энхансерами. • Большая изоформа ДНК-метилазы Dnmt 1 транслируется с третьего АТ G -кодона первого экзона и присутствует в эмбриональных стволовых клетках и соматических тканях, в то время как короткая изоформа транслируется с четвертого АТ G -кодона четвертого экзона и обнаружена в ооцитах и преимплантированных эмбрионах. • Два секс-специфических экзона гена Dnmt 1 контролируют его экспрессию в ооцитах млекопитающих. • Область главного промотора гена Dnmt 1 Р 1 отличается высоким содержанием последовательностей Ср G , характерным для «хаус-киппинг» генов, а область минорных промоторов Р 2—Р 4 — дефицитом этих последовательностей.
 • Метилирование самого ДНК-метилазного гена может регулировать его экспрессию. В эмбриональных стволовых клетках все динуклеотиды Ср G в промоторной области Dnmt 1 не метилированы, в то время как они метилированы в дифференцированных клетках и тканях. • Между промоторами Р 1 и Р 2—Р 4 расположены три энхансера, активируемых протоонкогенным сигналом Ras -с- jun и репрессируемые Rb -супрессором опухолей. • В структуре гена Dnmt 1 мыши содержится регуляторный элемент АР-1, активируемый Ras — jun -протоонкогенным сигнальным путем. • В АР-1 -регуляторной области расположены 29 динуклеотидов Ср G , выполняющих функцию сенсора состояния метилирования генома. • Выдвинута гипотеза о регуляции экспрессии гена Dnmt 1 по принципу обратной связи.
• Метилирование самого ДНК-метилазного гена может регулировать его экспрессию. В эмбриональных стволовых клетках все динуклеотиды Ср G в промоторной области Dnmt 1 не метилированы, в то время как они метилированы в дифференцированных клетках и тканях. • Между промоторами Р 1 и Р 2—Р 4 расположены три энхансера, активируемых протоонкогенным сигналом Ras -с- jun и репрессируемые Rb -супрессором опухолей. • В структуре гена Dnmt 1 мыши содержится регуляторный элемент АР-1, активируемый Ras — jun -протоонкогенным сигнальным путем. • В АР-1 -регуляторной области расположены 29 динуклеотидов Ср G , выполняющих функцию сенсора состояния метилирования генома. • Выдвинута гипотеза о регуляции экспрессии гена Dnmt 1 по принципу обратной связи.
 ДНК-метилазы Dnmt З • Функцию метилирования ДНК de novo выполняют ДНК-метилазы Dnmt 3 а и Dnmt 3 b. На это указывает равная эффективность модификации ими последовательностей Ср G в полуметилированных и неметилированных нативных и синтетических субстратах, а также значительное уменьшение их активности в зрелых соматических клетках. • Dnmt 3 а и Dnmt 3 b человека состоят из 908 и 859 аминокислотных остатков соответственно, причем ген DNMT 3 B путем альтернативного сплайсинга может кодировать и ряд более коротких полипептидов. • Высокая экспрессия генов DNMT 3 A и DNMT 3 B отмечена в недифференцированных эмбриональных стволовых клетках. В этих клетках метилазы Dnmt За и Dnmt З b играют важную роль не только в установлении, но и в поддержании обшей картины метилирования ДНК. В то же время при дифференцировке этих клеток и в соматических тканях взрослого организма экспрессия этих генов крайне мала. • Эти гены существенны также для нормального постэмбрионального развития мышей: дефектные по этим генам животные погибали спустя четыре недели после рождения.
ДНК-метилазы Dnmt З • Функцию метилирования ДНК de novo выполняют ДНК-метилазы Dnmt 3 а и Dnmt 3 b. На это указывает равная эффективность модификации ими последовательностей Ср G в полуметилированных и неметилированных нативных и синтетических субстратах, а также значительное уменьшение их активности в зрелых соматических клетках. • Dnmt 3 а и Dnmt 3 b человека состоят из 908 и 859 аминокислотных остатков соответственно, причем ген DNMT 3 B путем альтернативного сплайсинга может кодировать и ряд более коротких полипептидов. • Высокая экспрессия генов DNMT 3 A и DNMT 3 B отмечена в недифференцированных эмбриональных стволовых клетках. В этих клетках метилазы Dnmt За и Dnmt З b играют важную роль не только в установлении, но и в поддержании обшей картины метилирования ДНК. В то же время при дифференцировке этих клеток и в соматических тканях взрослого организма экспрессия этих генов крайне мала. • Эти гены существенны также для нормального постэмбрионального развития мышей: дефектные по этим генам животные погибали спустя четыре недели после рождения.
 Dnmt 3 b • Dnmt 3 b отвечает за метилирование центромерных линкерных сателлитных повторов. • Мутации гена DNMT 3 B у человека приводят к развитию ICF -синдрома ( immunodeficiency , centromeric instability , facial anomalies ). I С F — c индром — редкое аутосомное рецессивное заболевание, характеризующееся различными иммунологическими дефектами и аномальным строением лица. Он связан с нестабильностью центромерного гетерохроматина. При I С F -синдроме отмечается гипометилирование сателлитных ДНК II и III — главных компонентов конститутивного гетерохроматина. • Обнаружена тканеспецифичность различных изоформ ДНК-метилазы Dnmt З b человека.
Dnmt 3 b • Dnmt 3 b отвечает за метилирование центромерных линкерных сателлитных повторов. • Мутации гена DNMT 3 B у человека приводят к развитию ICF -синдрома ( immunodeficiency , centromeric instability , facial anomalies ). I С F — c индром — редкое аутосомное рецессивное заболевание, характеризующееся различными иммунологическими дефектами и аномальным строением лица. Он связан с нестабильностью центромерного гетерохроматина. При I С F -синдроме отмечается гипометилирование сателлитных ДНК II и III — главных компонентов конститутивного гетерохроматина. • Обнаружена тканеспецифичность различных изоформ ДНК-метилазы Dnmt З b человека.
 • Метилирование ДНК растений арабидопсиса в последовательностях Ср N р G контролируется первичным метилированием гистона НЗ. Этот процесс осуществляется через взаимодействие хромометилазы СМТЗ с гомологом гетерохроматинового белка НР 1, который, в свою очередь, взаимодействует с метилированным лизином 9 гистона НЗ ( НЗ lys 9, me H 3 K 9 ), модифицированным специфической лизиновой гистон-НЗ-метилтрансферазой. • У N. с rass а экспрессия активности ДНК-метилазы dim -2 контролируется также гистоновой Н 3 lys 9 -метил-трансферазой. • В свою очередь, метилирование Lys 9 в гистоне НЗ может зависеть от первичного метилирования в ДНК последовательностей Ср G.
• Метилирование ДНК растений арабидопсиса в последовательностях Ср N р G контролируется первичным метилированием гистона НЗ. Этот процесс осуществляется через взаимодействие хромометилазы СМТЗ с гомологом гетерохроматинового белка НР 1, который, в свою очередь, взаимодействует с метилированным лизином 9 гистона НЗ ( НЗ lys 9, me H 3 K 9 ), модифицированным специфической лизиновой гистон-НЗ-метилтрансферазой. • У N. с rass а экспрессия активности ДНК-метилазы dim -2 контролируется также гистоновой Н 3 lys 9 -метил-трансферазой. • В свою очередь, метилирование Lys 9 в гистоне НЗ может зависеть от первичного метилирования в ДНК последовательностей Ср G.
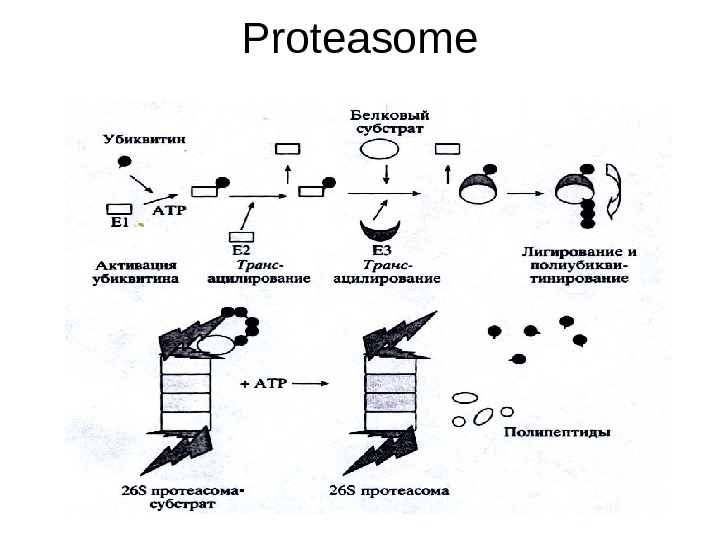
 Деградация белков • На сегодняшний день известно, что эукариотическая клетка имеет две основные системы деградации белков. • Первая — это лизосомы, содержащие набор кислых протеаз и других гидролаз. Однако лизосомы участвуют только в разрушении белков, ассоциированных с мембранами, и чужеродных белков, захваченных во время эндоцитоза. • Вторая система — это гидролиз белка по АТР- и убиквитин-зависимому протеолитичеекому пути, основным действующим элементом которого является мультисубъединичный белковый комплекс, называемый 26 S протеасомой. • Протеасома найдена как у самых примитивных эукариот, так и у высших организмов, и присутствует как в ядре, так и в цитоплазме, а некоторые частицы ассоциированы с эндоплазматическим ретикулумом и цитоскелетом.
Деградация белков • На сегодняшний день известно, что эукариотическая клетка имеет две основные системы деградации белков. • Первая — это лизосомы, содержащие набор кислых протеаз и других гидролаз. Однако лизосомы участвуют только в разрушении белков, ассоциированных с мембранами, и чужеродных белков, захваченных во время эндоцитоза. • Вторая система — это гидролиз белка по АТР- и убиквитин-зависимому протеолитичеекому пути, основным действующим элементом которого является мультисубъединичный белковый комплекс, называемый 26 S протеасомой. • Протеасома найдена как у самых примитивных эукариот, так и у высших организмов, и присутствует как в ядре, так и в цитоплазме, а некоторые частицы ассоциированы с эндоплазматическим ретикулумом и цитоскелетом.
 Proteasome
Proteasome
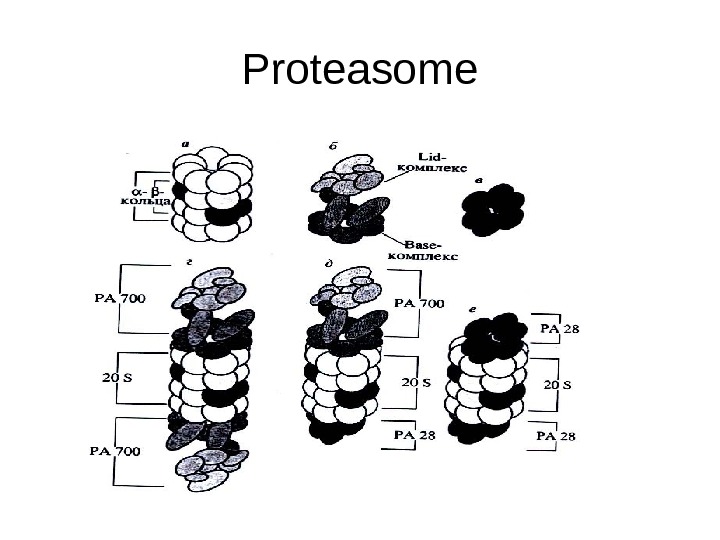
 • Схематичное изображение различных форм протеасомы и активаторов: а – 20 S протеасома, б — активатор РА 700, в — активатор РА 28, г – 26 S протеасома (РА 700 -20 S -РА 700). д — гибридная протеасома (РА 700 -20 S -РА 28), е — РА 28 -20 S -РА 28. Обозначения: О — α-субъединица, О — конституционная β-субъединица, • — β-субъединица. замещающаяся под действием γ-интерферона на свою изоформу. • В последнее время распространение получило также следующее обозначение: СР (Со r е Р arti с1 е) для 20 S протеасомы, R Р ( Regulatory Ра rtic 1 е) для РА 700 и, соответственно. R Р-СРдля 26 S протеасомы.
• Схематичное изображение различных форм протеасомы и активаторов: а – 20 S протеасома, б — активатор РА 700, в — активатор РА 28, г – 26 S протеасома (РА 700 -20 S -РА 700). д — гибридная протеасома (РА 700 -20 S -РА 28), е — РА 28 -20 S -РА 28. Обозначения: О — α-субъединица, О — конституционная β-субъединица, • — β-субъединица. замещающаяся под действием γ-интерферона на свою изоформу. • В последнее время распространение получило также следующее обозначение: СР (Со r е Р arti с1 е) для 20 S протеасомы, R Р ( Regulatory Ра rtic 1 е) для РА 700 и, соответственно. R Р-СРдля 26 S протеасомы.
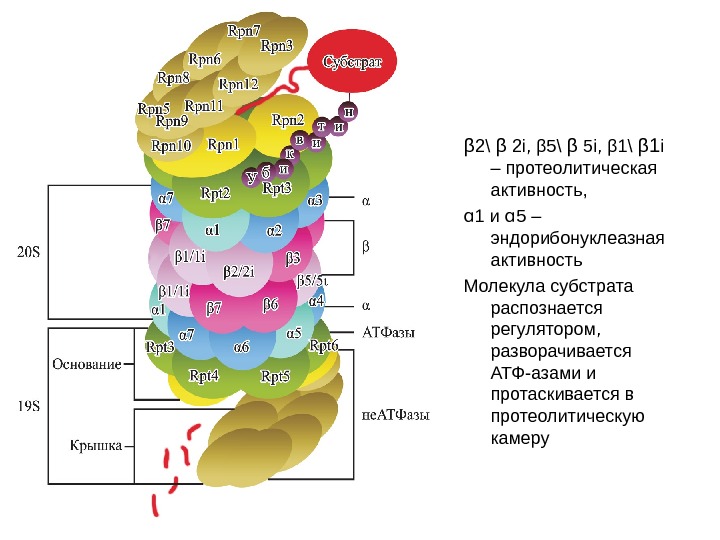
 β 2\ β 2 i, β 5\ β 5 i, β 1\ β 1 i – протеолитическая активность, ɑ 1 и ɑ 5 – эндорибонуклеазная активность Молекула субстрата распознается регулятором, разворачивается АТФ-азами и протаскивается в протеолитическую камеру
β 2\ β 2 i, β 5\ β 5 i, β 1\ β 1 i – протеолитическая активность, ɑ 1 и ɑ 5 – эндорибонуклеазная активность Молекула субстрата распознается регулятором, разворачивается АТФ-азами и протаскивается в протеолитическую камеру
 • По данным рентгеноструктурного анализа 20 S протеасома представляет собой полый цилиндр длиной 15 -17 нм и диаметром 11 -12 нм, состоящий из четырех лежащих друг на друге колец, каждое из которых образовано семью белковыми субъединицами с молекулярной массой от 20 до 35 к. Да. Полная масса 20 S частицы составляет 750 к. Да. • Периферические кольца сформированы семью субъединицами α-типа, а центральные –субъединицами β-типа. Внутри цилиндра имеется канал с тремя расширениями — камерами: одной большой, центральной, и двумя меньшими, по краям. В центральной полости и осуществляется протеолиз поступающих в протеасому белков. У дрожжей известно 7 различных субъединиц α-типа и 7 — β-типа. У млекопитающих это число выше, так как существуют изоформы некоторых субъединиц. • В культуре клеток γ-интерферон стимулирует экспрессию трех дополнительных протеолитически активных β-субъединиц (называемых индуцибельными, или иммунными), каждая из которых замещает определенную конституционно-экспрессируемую β-субъединицу (рис. а).
• По данным рентгеноструктурного анализа 20 S протеасома представляет собой полый цилиндр длиной 15 -17 нм и диаметром 11 -12 нм, состоящий из четырех лежащих друг на друге колец, каждое из которых образовано семью белковыми субъединицами с молекулярной массой от 20 до 35 к. Да. Полная масса 20 S частицы составляет 750 к. Да. • Периферические кольца сформированы семью субъединицами α-типа, а центральные –субъединицами β-типа. Внутри цилиндра имеется канал с тремя расширениями — камерами: одной большой, центральной, и двумя меньшими, по краям. В центральной полости и осуществляется протеолиз поступающих в протеасому белков. У дрожжей известно 7 различных субъединиц α-типа и 7 — β-типа. У млекопитающих это число выше, так как существуют изоформы некоторых субъединиц. • В культуре клеток γ-интерферон стимулирует экспрессию трех дополнительных протеолитически активных β-субъединиц (называемых индуцибельными, или иммунными), каждая из которых замещает определенную конституционно-экспрессируемую β-субъединицу (рис. а).
 • Активатор РА 700 имеет молекулярную массу более 800 к. Да и состоит, по крайней мере, из 17 различных полипептидов с молекулярной массой от 25 до 110 к. Да. Он функционирует как «рот» для 20 S протеолитического ядра, его субъединицы формируют два структурно и функционально различных комплекса, называемые lid — и base -комплексами. Lid -комплекс содержит 8 субъединиц ( Rpn 3, 5, 6, 7, 8, 9, 11, 12) ( Regulatory particle non — ATPase ), не обладающих АТРазной активностью и отвечающих за распознавание и подготовку убиквитинированных субстратов к деградации и за взаимодействие с некоторыми непротеасомными белками. • В ase -комплекс, расположенный на границе с 20 S ядром, включает три регуляторных субъединицы ( Rpn 1, 2, 10) и шесть АТРаз ( Rpt 1 -6) ( Regulatory particle triple — A protein ), которые играют важнейшую роль в работе 26 S протеасомы. • АТРазы РА 700 относятся к АТРазам семейства ААА (АТР ase associated with different cellular activities ) и участвуют в АТР-зависимом процессе объединения РА 700 и 20 S протеасомы и в гидролизе АТР на нескольких этапах деградации убиквитинированных белков.
• Активатор РА 700 имеет молекулярную массу более 800 к. Да и состоит, по крайней мере, из 17 различных полипептидов с молекулярной массой от 25 до 110 к. Да. Он функционирует как «рот» для 20 S протеолитического ядра, его субъединицы формируют два структурно и функционально различных комплекса, называемые lid — и base -комплексами. Lid -комплекс содержит 8 субъединиц ( Rpn 3, 5, 6, 7, 8, 9, 11, 12) ( Regulatory particle non — ATPase ), не обладающих АТРазной активностью и отвечающих за распознавание и подготовку убиквитинированных субстратов к деградации и за взаимодействие с некоторыми непротеасомными белками. • В ase -комплекс, расположенный на границе с 20 S ядром, включает три регуляторных субъединицы ( Rpn 1, 2, 10) и шесть АТРаз ( Rpt 1 -6) ( Regulatory particle triple — A protein ), которые играют важнейшую роль в работе 26 S протеасомы. • АТРазы РА 700 относятся к АТРазам семейства ААА (АТР ase associated with different cellular activities ) и участвуют в АТР-зависимом процессе объединения РА 700 и 20 S протеасомы и в гидролизе АТР на нескольких этапах деградации убиквитинированных белков.
 • Генетика протеасомных генов достаточно хорошо исследована на дрожжах. Показано, что делеции в 13 из 14 генов, кодирующих субъединицы 20 S протеасомы, и в генах, кодирующих большинство компонентов РА 700 (например, всех АТРаз), летальны. • Недавно у дрожжей S. се reviseae обнаружена система централизованной регуляции транскрипции генов, кодирующих субъединицы протеасомы. Это неизвестный ранее класс регуляторных последовательностей, названных РАСЕ-последовательностями (Р roteasome — associated control element ), расположенных в промоторных областях 27 из 33 протеасомных генов. • Короткоживущий белок Rpn 4, присоединяясь к РАСЕ, функционирует как общий транскрипционный активатор генов, кодирующих субъединицы протеасомы и ряд белков, связанных с убиквитин-протеасомным протеолитическим путем.
• Генетика протеасомных генов достаточно хорошо исследована на дрожжах. Показано, что делеции в 13 из 14 генов, кодирующих субъединицы 20 S протеасомы, и в генах, кодирующих большинство компонентов РА 700 (например, всех АТРаз), летальны. • Недавно у дрожжей S. се reviseae обнаружена система централизованной регуляции транскрипции генов, кодирующих субъединицы протеасомы. Это неизвестный ранее класс регуляторных последовательностей, названных РАСЕ-последовательностями (Р roteasome — associated control element ), расположенных в промоторных областях 27 из 33 протеасомных генов. • Короткоживущий белок Rpn 4, присоединяясь к РАСЕ, функционирует как общий транскрипционный активатор генов, кодирующих субъединицы протеасомы и ряд белков, связанных с убиквитин-протеасомным протеолитическим путем.

 Proteasome
Proteasome
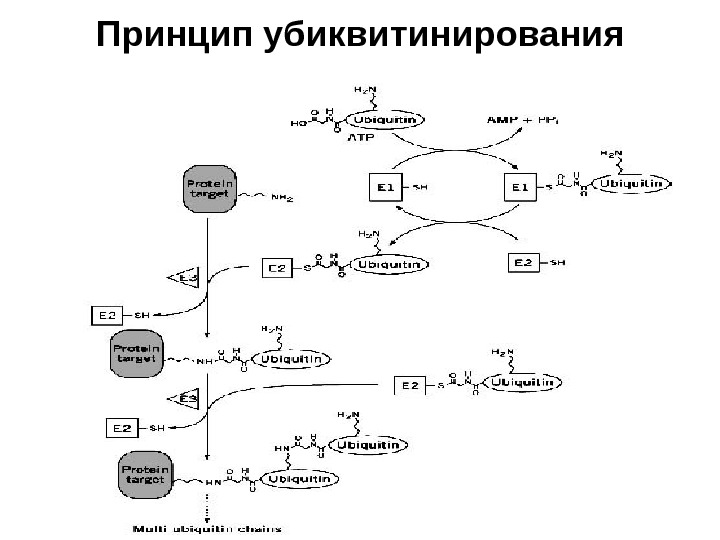
 Принцип убиквитинирования
Принцип убиквитинирования
 СИСТЕМА УБИКВИТИНИРОВАНИЯ • Основным субстратом 26 S протеасомы являются белковые молекулы, несущие цепи полиубнквитина. Убиквитин — это небольшой полипептид, состоящий из 76 аминокислотных остатков. В его составе имеется семь остатков лизина, однако присоединение других молекул этого белка с образованием полиубиквитиновой цепи происходит в данном случае через остаток L у s -48.
СИСТЕМА УБИКВИТИНИРОВАНИЯ • Основным субстратом 26 S протеасомы являются белковые молекулы, несущие цепи полиубнквитина. Убиквитин — это небольшой полипептид, состоящий из 76 аминокислотных остатков. В его составе имеется семь остатков лизина, однако присоединение других молекул этого белка с образованием полиубиквитиновой цепи происходит в данном случае через остаток L у s -48.
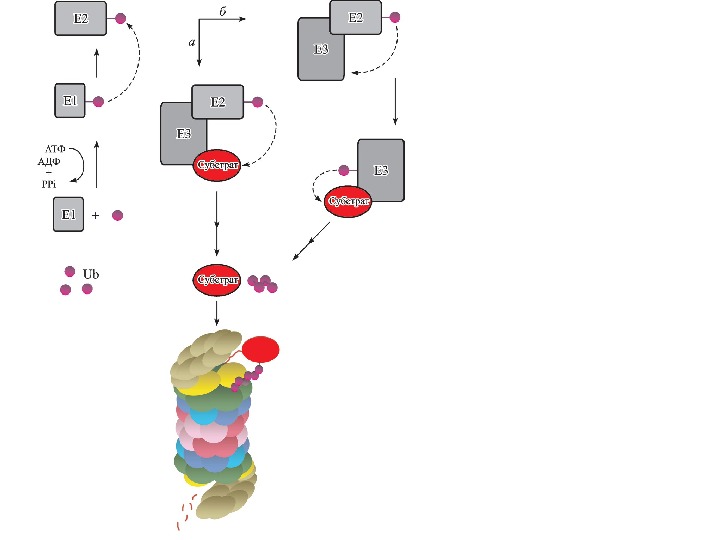
 СИСТЕМА УБИКВИТИНИРОВАНИЯ • В эукариотических клетках существует специальная система ферментов ( Е 1 ( Uba ) – Ubiquitin — activated enzyme , Е 2 ( Ubc ) – Ubiquitin — conjugating enzyme , ЕЗ ( Ubr ) – Ubiquitin — recognition factor или Ubiquitin — protein — ligase ), которая узнает белки, несущие специальные деградационные сигналы, и осуществляет их конъюгацию с убиквитином через — NH 2: -группу остатка лизина белкового субстрата
СИСТЕМА УБИКВИТИНИРОВАНИЯ • В эукариотических клетках существует специальная система ферментов ( Е 1 ( Uba ) – Ubiquitin — activated enzyme , Е 2 ( Ubc ) – Ubiquitin — conjugating enzyme , ЕЗ ( Ubr ) – Ubiquitin — recognition factor или Ubiquitin — protein — ligase ), которая узнает белки, несущие специальные деградационные сигналы, и осуществляет их конъюгацию с убиквитином через — NH 2: -группу остатка лизина белкового субстрата
 СИСТЕМА УБИКВИТИНИРОВАНИЯ • Высокая специфичность и селективность системы достигается за счет ее иерархичности. В клетке существует только один фермент Е 1 , который активирует молекулу убиквитина, образуя тиоэфирную связь с карбоксильной группой остатка Gl у-76, и передает ее на один из членов семейства убиквитин-конъюгирующих ферментов — Е 2. Геном дрожжей S. cerevis ае кодирует 13 Е 2 -подобных белков, у млекопитающих их количество гораздо больше. • Каждый Е 2 участвует в определенном клеточном процессе. Ub с2/ RAD 6 вовлечен в регуляцию репарации ДНК, а Ubc З/С D С 34 необходим в регуляции перехода от G 1 — к S -фазе клеточного цикла. • Фермент из Е 2 семейства взаимодействует с одним или несколькими представителями семейства ЕЗ , функция которых заключается в ковалентном присоединении полиубиквитина к молекуле белка через изопептидную связь между остатком Lys субстрата и Gl у-76 убиквитина. Минимальным сигналом для эффективного присоединения к протеасоме является цепочка из четырех убиквитиновых звеньев.
СИСТЕМА УБИКВИТИНИРОВАНИЯ • Высокая специфичность и селективность системы достигается за счет ее иерархичности. В клетке существует только один фермент Е 1 , который активирует молекулу убиквитина, образуя тиоэфирную связь с карбоксильной группой остатка Gl у-76, и передает ее на один из членов семейства убиквитин-конъюгирующих ферментов — Е 2. Геном дрожжей S. cerevis ае кодирует 13 Е 2 -подобных белков, у млекопитающих их количество гораздо больше. • Каждый Е 2 участвует в определенном клеточном процессе. Ub с2/ RAD 6 вовлечен в регуляцию репарации ДНК, а Ubc З/С D С 34 необходим в регуляции перехода от G 1 — к S -фазе клеточного цикла. • Фермент из Е 2 семейства взаимодействует с одним или несколькими представителями семейства ЕЗ , функция которых заключается в ковалентном присоединении полиубиквитина к молекуле белка через изопептидную связь между остатком Lys субстрата и Gl у-76 убиквитина. Минимальным сигналом для эффективного присоединения к протеасоме является цепочка из четырех убиквитиновых звеньев.
 СИСТЕМА УБИКВИТИНИРОВАНИЯ • Известно около ста различных убиквитин-протеин-лигаз , которые и определяют высокую специфичность системы. Убиквнтинирование субстрата, несущего определенный деградационный сигнал, осуществляется различными группами ферментов ЕЗ, причем они могут соединяться с субстратом напрямую или через вспомогательный белок. • 1 -ый класс — ферменты ЕЗ, содержащие НЕСТ -домены — консервативную область в 350 аминокислотных остатков, гомологичную С-концу Е 6 -АР, наиболее хорошо изученного ЕЗ ( Homology to E 6 — AP carboxyl terminus ); • 2 -ой класс — ферменты ЕЗ , содержащие RING ( real interesting new gene) — finger — домены — мотив из восьми цистеиновых и гистидиновых остатков, которые удерживают два иона цинка; • 3 -ий класс — ферменты ЕЗ , содержащие U — box -домены (70 aa) — новый класс убиквитин-протеин-лигаз с третичной структурой близкой к RING — finger , но без металл-хелатирующих аминокислотных остатков.
СИСТЕМА УБИКВИТИНИРОВАНИЯ • Известно около ста различных убиквитин-протеин-лигаз , которые и определяют высокую специфичность системы. Убиквнтинирование субстрата, несущего определенный деградационный сигнал, осуществляется различными группами ферментов ЕЗ, причем они могут соединяться с субстратом напрямую или через вспомогательный белок. • 1 -ый класс — ферменты ЕЗ, содержащие НЕСТ -домены — консервативную область в 350 аминокислотных остатков, гомологичную С-концу Е 6 -АР, наиболее хорошо изученного ЕЗ ( Homology to E 6 — AP carboxyl terminus ); • 2 -ой класс — ферменты ЕЗ , содержащие RING ( real interesting new gene) — finger — домены — мотив из восьми цистеиновых и гистидиновых остатков, которые удерживают два иона цинка; • 3 -ий класс — ферменты ЕЗ , содержащие U — box -домены (70 aa) — новый класс убиквитин-протеин-лигаз с третичной структурой близкой к RING — finger , но без металл-хелатирующих аминокислотных остатков.
 Генерация антигенных полипептидов, представляемых на поверхность клетки молекулами класса 1 МНС (Ма jor Histocompartability Со m р lex ) • Синтезирующиеся в клетке аномальные и чужеродные белки подвергаются деградации 26 S протеасомой по АТР- и убиквитин-зависимому пути. В результате гидролиза образуется набор полипептидов длиной от 5 до 24 аминокислот, часть из которых может являться антигенными эпитопами. Полипептиды длиной от 8 до 11 аминокислот соединяются в цитозоле с ТАР ( Transporter associated with antigen presentation ) и переносятся в эндоплазматический ретикулум, где они связываются в комплекс с молекулами класса I МНС и выносятся на поверхность клетки. Представление этих антигенов дает возможность иммунной системе при помощи цитотоксических Т-лимфоцитов обнаруживать и разрушать клетки, экспрессирующие вирусные или другие необычные полипептиды.
Генерация антигенных полипептидов, представляемых на поверхность клетки молекулами класса 1 МНС (Ма jor Histocompartability Со m р lex ) • Синтезирующиеся в клетке аномальные и чужеродные белки подвергаются деградации 26 S протеасомой по АТР- и убиквитин-зависимому пути. В результате гидролиза образуется набор полипептидов длиной от 5 до 24 аминокислот, часть из которых может являться антигенными эпитопами. Полипептиды длиной от 8 до 11 аминокислот соединяются в цитозоле с ТАР ( Transporter associated with antigen presentation ) и переносятся в эндоплазматический ретикулум, где они связываются в комплекс с молекулами класса I МНС и выносятся на поверхность клетки. Представление этих антигенов дает возможность иммунной системе при помощи цитотоксических Т-лимфоцитов обнаруживать и разрушать клетки, экспрессирующие вирусные или другие необычные полипептиды.
 Субстраты, протеолиз которых осуществляется 26 S протеасомой Факторы транскрипции NF -к. В – р105 (предшественник р50), 1 к. Вα (ингибитор NF -к. В) YYI АТ F 2 (Activating transcription factor 2) Н IF 1 (Hypoxia inducible factor 1) Двуступенчатая активация N F -к. В, иммунный и воспалительный ответ Дифференцировка мышц, репрессор транскрипции α-актиновых генов Ответ на стрессовые воздействия, мишенью которых являются гены циклина А, ДНК полимеразы β, Е-селектина и другие, отвечающие за клеточный рост и дифференцировку Регуляция энергетического обмена клетки и ангиогенеза в ответ на дефицит кислорода
Субстраты, протеолиз которых осуществляется 26 S протеасомой Факторы транскрипции NF -к. В – р105 (предшественник р50), 1 к. Вα (ингибитор NF -к. В) YYI АТ F 2 (Activating transcription factor 2) Н IF 1 (Hypoxia inducible factor 1) Двуступенчатая активация N F -к. В, иммунный и воспалительный ответ Дифференцировка мышц, репрессор транскрипции α-актиновых генов Ответ на стрессовые воздействия, мишенью которых являются гены циклина А, ДНК полимеразы β, Е-селектина и другие, отвечающие за клеточный рост и дифференцировку Регуляция энергетического обмена клетки и ангиогенеза в ответ на дефицит кислорода
 ICER (Inducible c-AMP early repressor) Муо D RXRα (Retinoid X receptor α) МАТ α 2 Gcn 4 Rpn 4 IRF 1 (Interferon regulatory factor 1) Е 2 F Регуляция с. АМР-зависимой антипролиферативной активности в нейроэндокринной системе Тканеспецифичный активатор транскрипции при дифференцировке скелетных мышц, ингибитор клеточного цикла в G 1 -фазе 1 Ядерный рецептор, связанный с гепатоканцерогенезом Репрессор транскрипции » mating — type » генов у дрожжей, контроль слияния гаплоидных клеток Активатор транскрипции, синтез аминокислот и пуринов Регуляция транскрипции генов протеасомы, активатор Регуляция транскрипции генов интерферона и интерферон-индуцируемых генов, клеточный рост и апоптоз Семейство факторов транскрипции, регуляция клеточного цикла, пролиферативный ответ
ICER (Inducible c-AMP early repressor) Муо D RXRα (Retinoid X receptor α) МАТ α 2 Gcn 4 Rpn 4 IRF 1 (Interferon regulatory factor 1) Е 2 F Регуляция с. АМР-зависимой антипролиферативной активности в нейроэндокринной системе Тканеспецифичный активатор транскрипции при дифференцировке скелетных мышц, ингибитор клеточного цикла в G 1 -фазе 1 Ядерный рецептор, связанный с гепатоканцерогенезом Репрессор транскрипции » mating — type » генов у дрожжей, контроль слияния гаплоидных клеток Активатор транскрипции, синтез аминокислот и пуринов Регуляция транскрипции генов протеасомы, активатор Регуляция транскрипции генов интерферона и интерферон-индуцируемых генов, клеточный рост и апоптоз Семейство факторов транскрипции, регуляция клеточного цикла, пролиферативный ответ
 Регуляторы клеточного цикла Дрожжи CLN 1, CLN 2, CLN 3 Sic 1 F аг 1 р С lb 5 Dbf 4 Циклины G 1 -фазы клеточного цикла Ингибитор С D К S -фазы (С D С 28 -С lb 5, 6), задержка в G 1 -фазе Ингибитор С D К, остановка в G 1 -фазе под действием феромонов Циклин S -фазы Поддержание клеточного гомеостаза
Регуляторы клеточного цикла Дрожжи CLN 1, CLN 2, CLN 3 Sic 1 F аг 1 р С lb 5 Dbf 4 Циклины G 1 -фазы клеточного цикла Ингибитор С D К S -фазы (С D С 28 -С lb 5, 6), задержка в G 1 -фазе Ингибитор С D К, остановка в G 1 -фазе под действием феромонов Циклин S -фазы Поддержание клеточного гомеостаза
 Регуляторы клеточного цикла Высшие эукариоты Сус lin D 1 p 27 kip p 21 cip Сус lin А, сус lin В CUT 2, PDS 1 Germinin Cdc 6 Сус lin Е СЕ N Р — Е , NI МА , PIMPLES Циклин G 1 -фазы, переход к S -фазе Ингибитор С D К S -фазы, остановка в G 1 Митотические циклины, выход из митоза Ингибиторы анафазы Ингибитор репликации ДНК Компонент пререпликативного комплекса Поздняя G 1 -фаза и ранняя S -фаза, поддержание кариотипа и нормального клеточного гомеостаза Контроль митоза и морфогенез веретена у млекопитающих, Drosophila , Aspergillus
Регуляторы клеточного цикла Высшие эукариоты Сус lin D 1 p 27 kip p 21 cip Сус lin А, сус lin В CUT 2, PDS 1 Germinin Cdc 6 Сус lin Е СЕ N Р — Е , NI МА , PIMPLES Циклин G 1 -фазы, переход к S -фазе Ингибитор С D К S -фазы, остановка в G 1 Митотические циклины, выход из митоза Ингибиторы анафазы Ингибитор репликации ДНК Компонент пререпликативного комплекса Поздняя G 1 -фаза и ранняя S -фаза, поддержание кариотипа и нормального клеточного гомеостаза Контроль митоза и морфогенез веретена у млекопитающих, Drosophila , Aspergillus
 Онкобелки и белки- c упр e ссоры опухолей с- jun с -fos С -mos E 2 A p 53 c-myc Продукт протоонкогена, активатор транскрипции, клеточный рост и дифференцировка Клеточный рост, дифференцировка и трансформация, продукт протоонкогена Продукт протоонкогена, ключевой регулятор клеточного цикла Контроль клеточного роста и дифференцировки, трансформация. Соотношение процессов роста и апоптоза, супрессия опухолей Фактор транскрипции, контролирующий клеточный цикл и пролиферацию, продукт протоонкогена.
Онкобелки и белки- c упр e ссоры опухолей с- jun с -fos С -mos E 2 A p 53 c-myc Продукт протоонкогена, активатор транскрипции, клеточный рост и дифференцировка Клеточный рост, дифференцировка и трансформация, продукт протоонкогена Продукт протоонкогена, ключевой регулятор клеточного цикла Контроль клеточного роста и дифференцировки, трансформация. Соотношение процессов роста и апоптоза, супрессия опухолей Фактор транскрипции, контролирующий клеточный цикл и пролиферацию, продукт протоонкогена.
 Ферменты РНК полимераза II (большая субъединица) ДНК-топоизомераза II ДНК- топоизомераза I Орнитиндекарбоксилаза Фруктозо-1 , 6 -дифосфатаза Репарация ДНК Ядерный фермент, модифицирующий топологию ДНК Релаксация суперскрученной ДНК , эмбриональное развитие Ключевой фермент биосинтеза полиамннов Обмен гликогена, ключевой фермент глюконеогенеза .
Ферменты РНК полимераза II (большая субъединица) ДНК-топоизомераза II ДНК- топоизомераза I Орнитиндекарбоксилаза Фруктозо-1 , 6 -дифосфатаза Репарация ДНК Ядерный фермент, модифицирующий топологию ДНК Релаксация суперскрученной ДНК , эмбриональное развитие Ключевой фермент биосинтеза полиамннов Обмен гликогена, ключевой фермент глюконеогенеза .
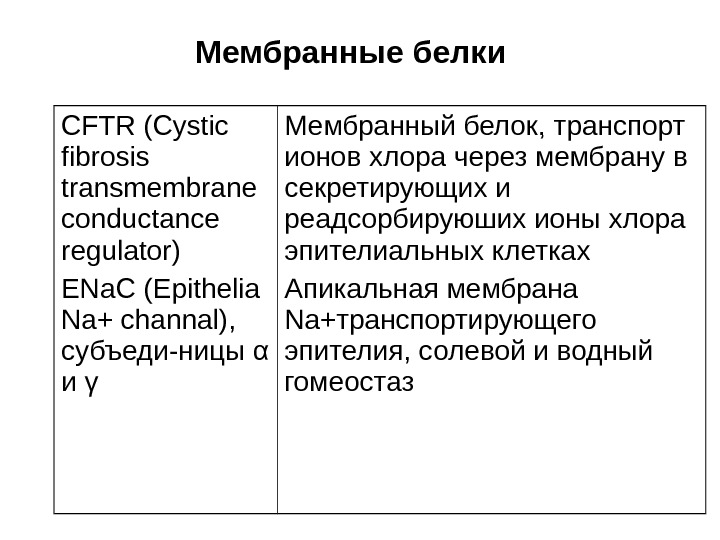
 Мембранные белки CFTR (Cystic fibrosis transmembrane conductance regulator) Е N а. С (Epithelia Na+ channal), субъеди — ницы α и γ Мембранный белок, транспорт ионов хлора через мембрану в секретирующих и реадсорбируюших ионы хлора эпителиальных клетках Апикальная мембрана Na +транспортирующего эпителия, солевой и водный гомеостаз
Мембранные белки CFTR (Cystic fibrosis transmembrane conductance regulator) Е N а. С (Epithelia Na+ channal), субъеди — ницы α и γ Мембранный белок, транспорт ионов хлора через мембрану в секретирующих и реадсорбируюших ионы хлора эпителиальных клетках Апикальная мембрана Na +транспортирующего эпителия, солевой и водный гомеостаз

