Гал+спирти 2014.ppt
- Количество слайдов: 32
 Лекція № 4 Галогенопохідні вуглеводнів. Спирти 1. 2. 3. 4. 5. 6. Програмні питання: Галогенопохідні вуглеводнів та класифікація. Способи одержання. Хімічні властивості. Спирти та їх класифікація. Способи одержання. Фізичні та хімічні властивості. Література: див. лекцію № 1. їх
Лекція № 4 Галогенопохідні вуглеводнів. Спирти 1. 2. 3. 4. 5. 6. Програмні питання: Галогенопохідні вуглеводнів та класифікація. Способи одержання. Хімічні властивості. Спирти та їх класифікація. Способи одержання. Фізичні та хімічні властивості. Література: див. лекцію № 1. їх
 1 Галогенопохідні вуглеводнів Вуглеводні, в яких один або декілька атомів Гідрогену заміщені на Галоген, називаються галогенопохідними вуглеводнів. Галогенопохідні вуглеводнів утворюють гомологічний ряд з загальною формулою R – Hal, де R – вуглеводневий радикал, Hal – атом Галогену.
1 Галогенопохідні вуглеводнів Вуглеводні, в яких один або декілька атомів Гідрогену заміщені на Галоген, називаються галогенопохідними вуглеводнів. Галогенопохідні вуглеводнів утворюють гомологічний ряд з загальною формулою R – Hal, де R – вуглеводневий радикал, Hal – атом Галогену.
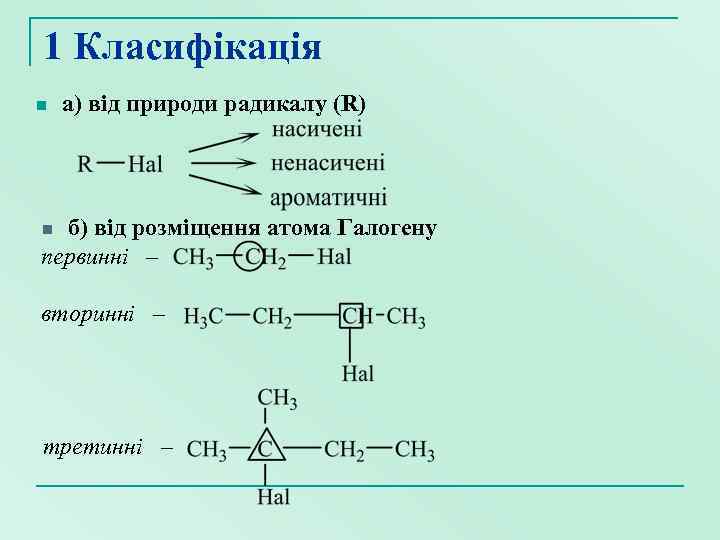 1 Класифікація n а) від природи радикалу (R) б) від розміщення атома Галогену первинні – вторинні – n третинні –
1 Класифікація n а) від природи радикалу (R) б) від розміщення атома Галогену первинні – вторинні – n третинні –
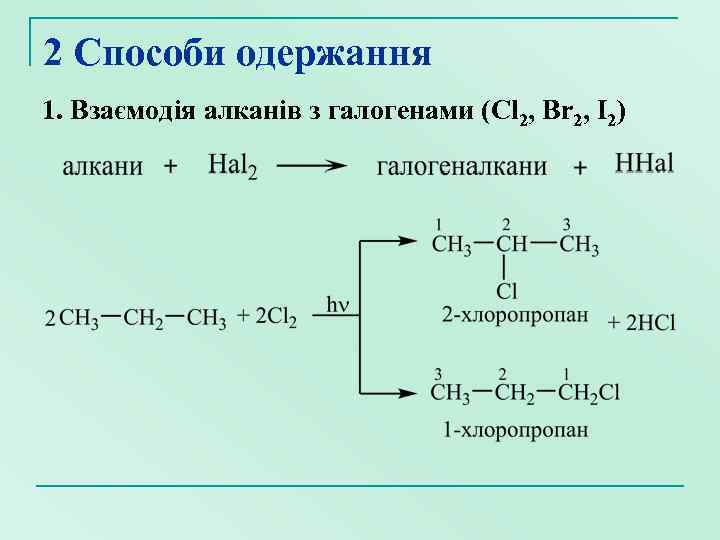 2 Способи одержання 1. Взаємодія алканів з галогенами (Cl 2, Br 2, I 2)
2 Способи одержання 1. Взаємодія алканів з галогенами (Cl 2, Br 2, I 2)
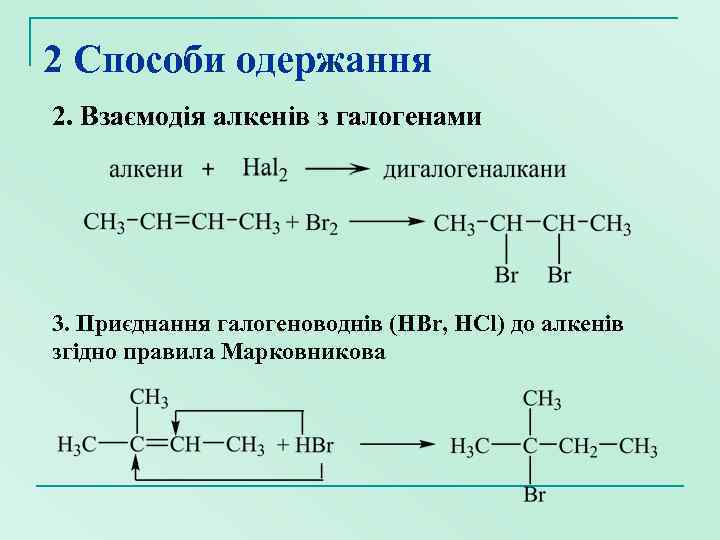 2 Способи одержання 2. Взаємодія алкенів з галогенами 3. Приєднання галогеноводнів (HBr, HCl) до алкенів згідно правила Марковникова
2 Способи одержання 2. Взаємодія алкенів з галогенами 3. Приєднання галогеноводнів (HBr, HCl) до алкенів згідно правила Марковникова
 2 Способи одержання 4. Заміщення групи –ОН в спиртах на галоген: а) б) в) г)
2 Способи одержання 4. Заміщення групи –ОН в спиртах на галоген: а) б) в) г)
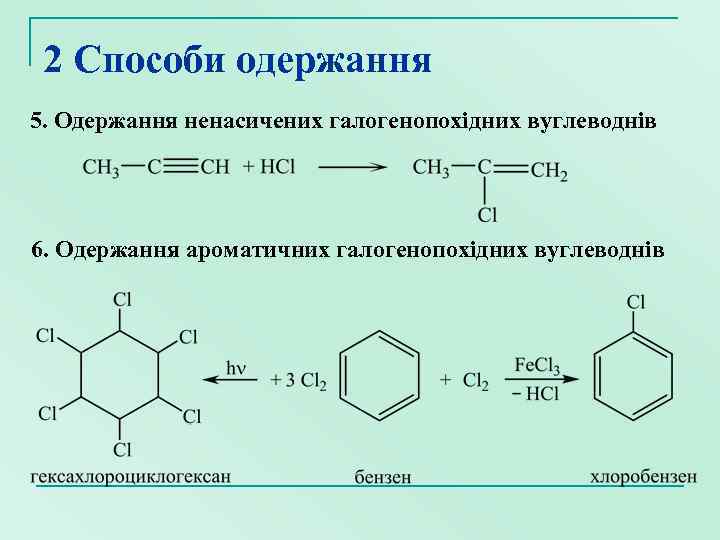 2 Способи одержання 5. Одержання ненасичених галогенопохідних вуглеводнів 6. Одержання ароматичних галогенопохідних вуглеводнів
2 Способи одержання 5. Одержання ненасичених галогенопохідних вуглеводнів 6. Одержання ароматичних галогенопохідних вуглеводнів
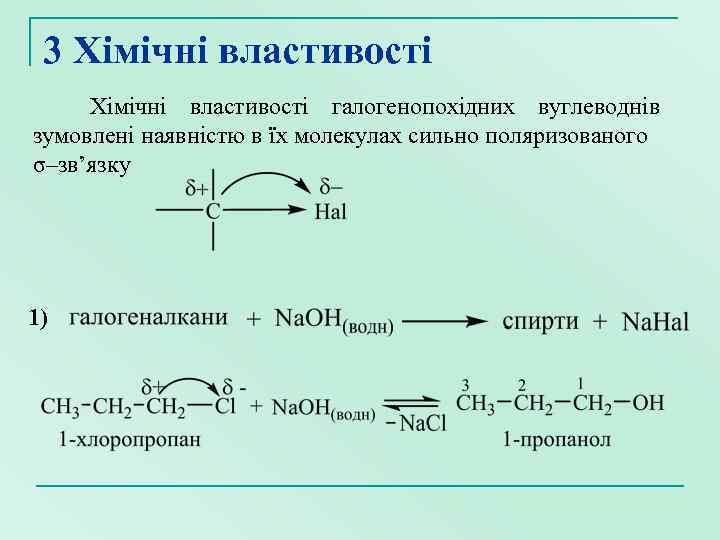 3 Хімічні властивості галогенопохідних вуглеводнів зумовлені наявністю в їх молекулах сильно поляризованого σ–зв’язку 1)
3 Хімічні властивості галогенопохідних вуглеводнів зумовлені наявністю в їх молекулах сильно поляризованого σ–зв’язку 1)
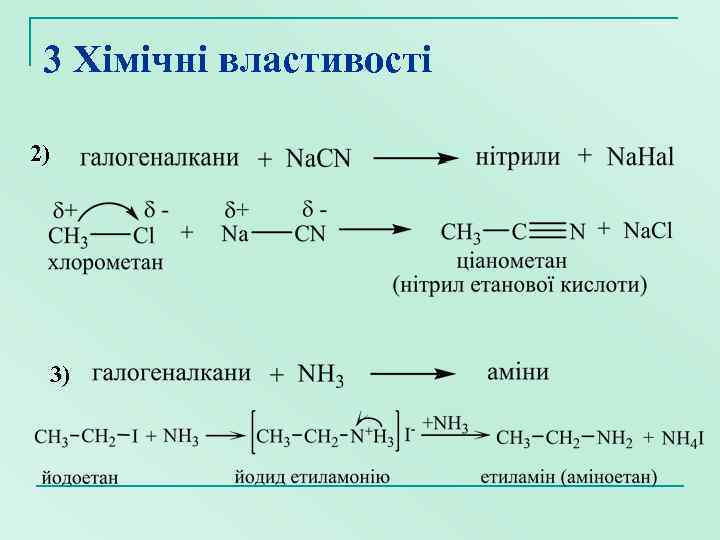 3 Хімічні властивості 2) 3)
3 Хімічні властивості 2) 3)
 3 Хімічні властивості 4) 5) Взаємодія з металами (утворення реактивів Гриньяра)
3 Хімічні властивості 4) 5) Взаємодія з металами (утворення реактивів Гриньяра)
 Реакції відщеплення (Е-реакції)
Реакції відщеплення (Е-реакції)
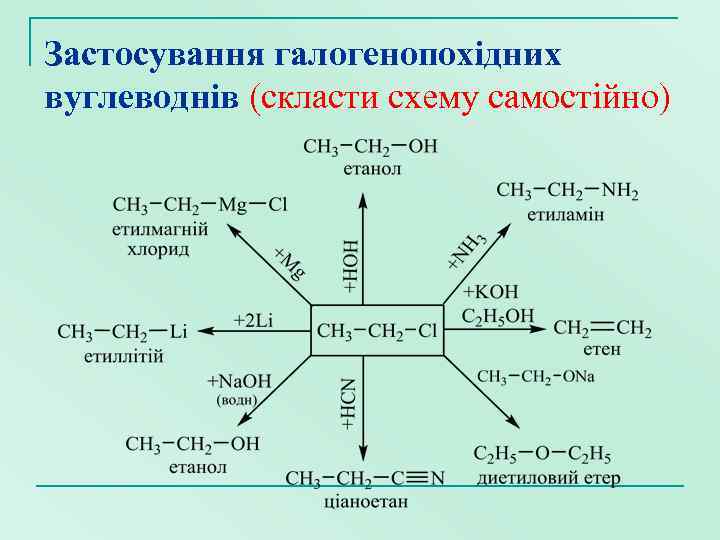 Застосування галогенопохідних вуглеводнів (скласти схему самостійно)
Застосування галогенопохідних вуглеводнів (скласти схему самостійно)
 4 Спирти Гідроксисполуки (спирти) – це похідні вуглеводнів, в яких один чи декілька атомів Гідрогену заміщені на відповідну кількість гідроксильних груп (-ОН - груп). Загальна формула спиртів R – OH, де R – вуглеводневий радикал.
4 Спирти Гідроксисполуки (спирти) – це похідні вуглеводнів, в яких один чи декілька атомів Гідрогену заміщені на відповідну кількість гідроксильних груп (-ОН - груп). Загальна формула спиртів R – OH, де R – вуглеводневий радикал.
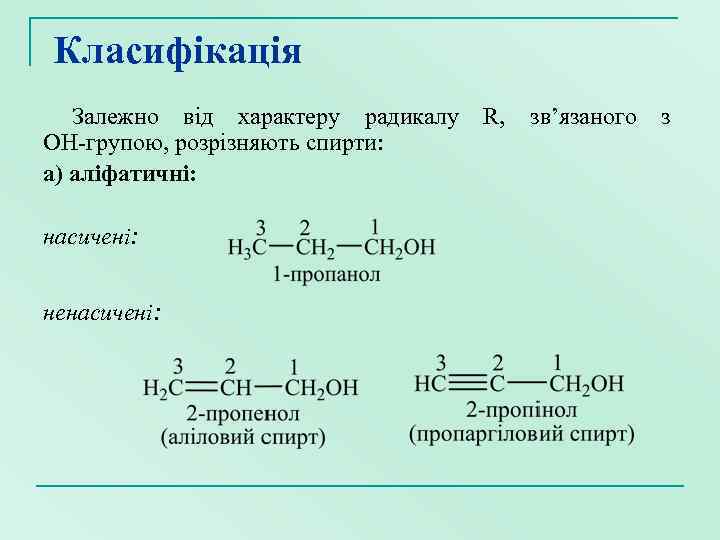 Класифікація Залежно від характеру радикалу R, зв’язаного з ОН-групою, розрізняють спирти: а) аліфатичні: насичені: ненасичені:
Класифікація Залежно від характеру радикалу R, зв’язаного з ОН-групою, розрізняють спирти: а) аліфатичні: насичені: ненасичені:
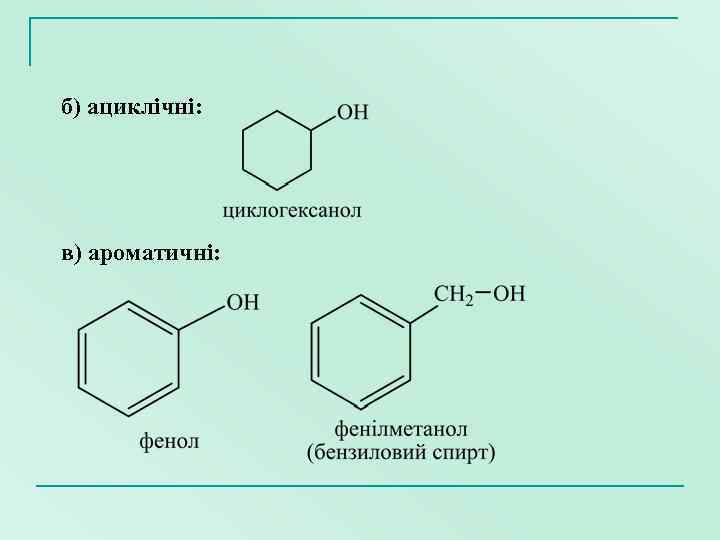 б) ациклічні: в) ароматичні:
б) ациклічні: в) ароматичні:
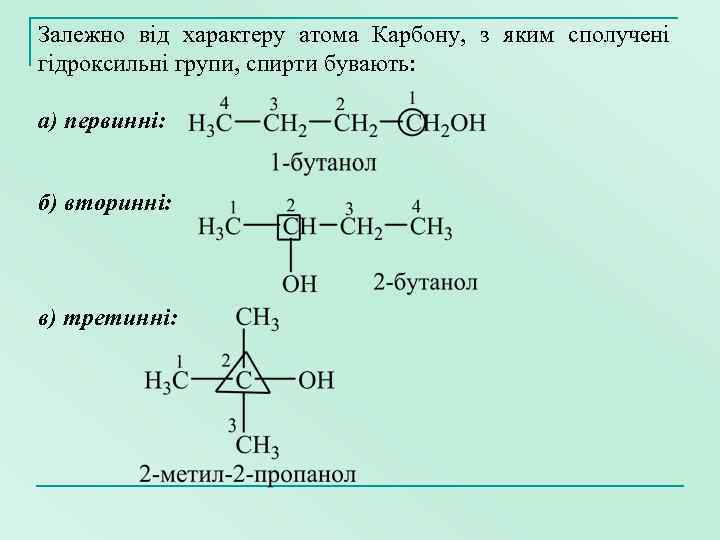 Залежно від характеру атома Карбону, з яким сполучені гідроксильні групи, спирти бувають: а) первинні: б) вторинні: в) третинні:
Залежно від характеру атома Карбону, з яким сполучені гідроксильні групи, спирти бувають: а) первинні: б) вторинні: в) третинні:
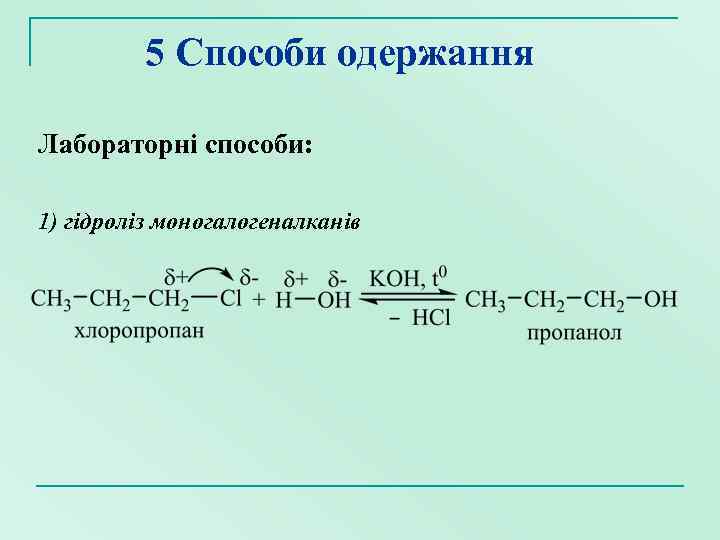 5 Способи одержання Лабораторні способи: 1) гідроліз моногалогеналканів
5 Способи одержання Лабораторні способи: 1) гідроліз моногалогеналканів
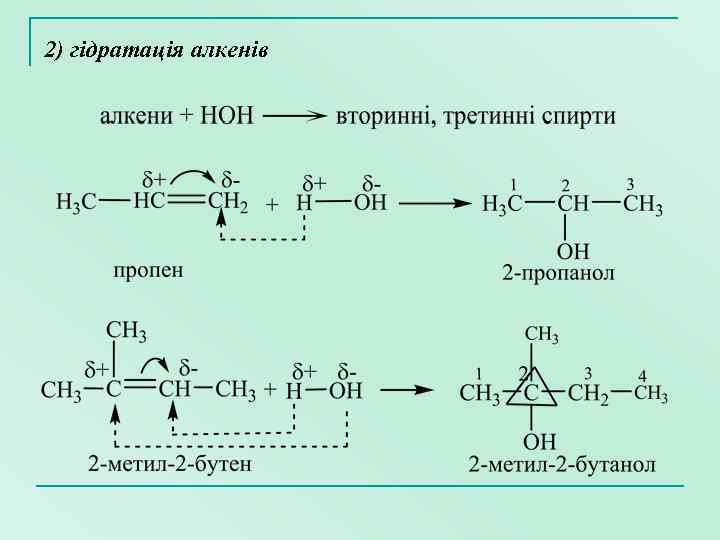 2) гідратація алкенів
2) гідратація алкенів
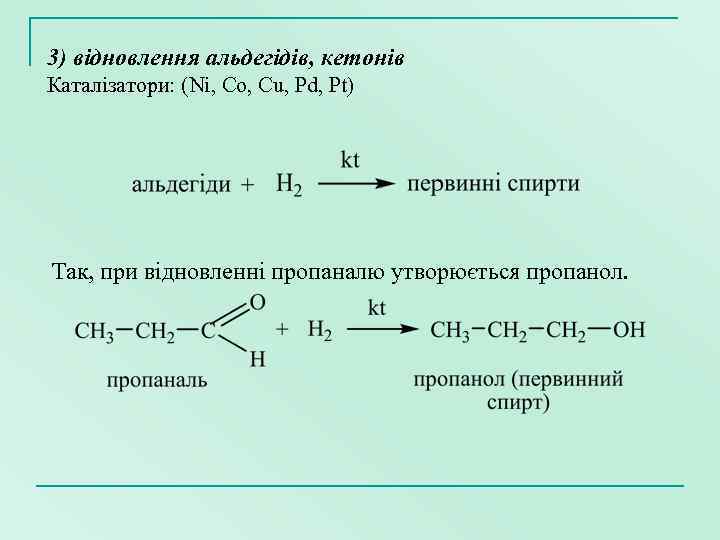 3) відновлення альдегідів, кетонів Каталізатори: (Ni, Co, Cu, Pd, Pt) Так, при відновленні пропаналю утворюється пропанол.
3) відновлення альдегідів, кетонів Каталізатори: (Ni, Co, Cu, Pd, Pt) Так, при відновленні пропаналю утворюється пропанол.
 При відновленні кетонів утворюються вторинні спирти за загальною схемою: Так, 2 -бутанон легко відновлюється воднем до 2 -бутанолу:
При відновленні кетонів утворюються вторинні спирти за загальною схемою: Так, 2 -бутанон легко відновлюється воднем до 2 -бутанолу:
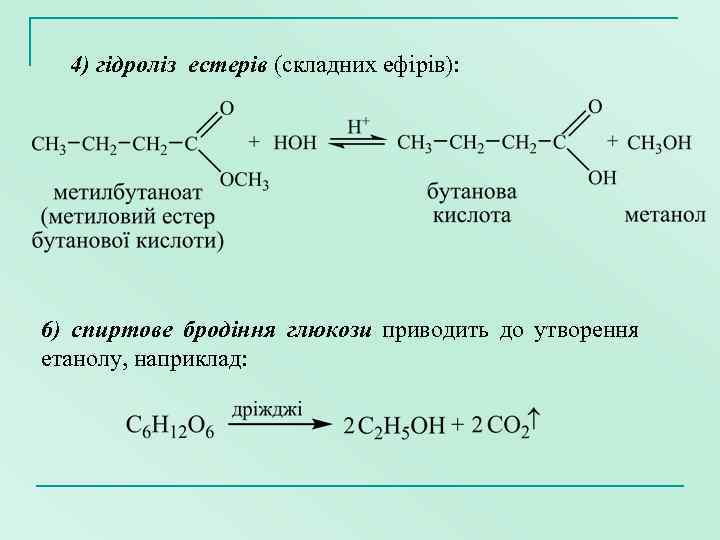 4) гідроліз естерів (складних ефірів): 6) спиртове бродіння глюкози приводить до утворення етанолу, наприклад:
4) гідроліз естерів (складних ефірів): 6) спиртове бродіння глюкози приводить до утворення етанолу, наприклад:
 6 Хімічні властивості 1) а) утворення алканолятів з активними металами (Na, K, Ca, Al)
6 Хімічні властивості 1) а) утворення алканолятів з активними металами (Na, K, Ca, Al)
 6 Хімічні властивості б) взаємодія з реактивами Гриньяра: в) взаємодія з мінеральними та органічними кислотами:
6 Хімічні властивості б) взаємодія з реактивами Гриньяра: в) взаємодія з мінеральними та органічними кислотами:
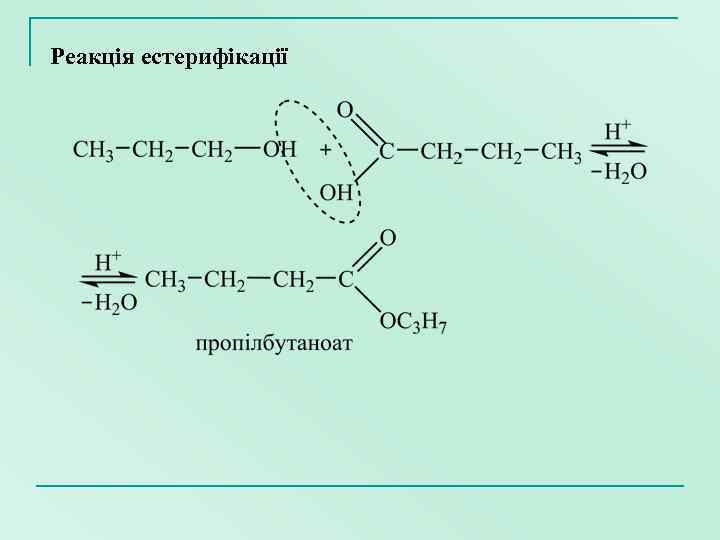 Реакція естерифікації
Реакція естерифікації
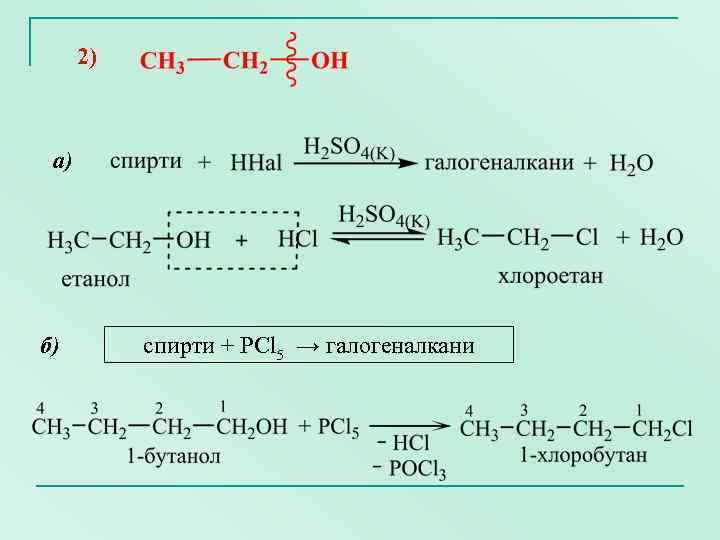 2) а) б) спирти + PCl 5 → галогеналкани
2) а) б) спирти + PCl 5 → галогеналкани
 Реакції дегідратації (відщеплення молекули води) Внутрішньомолекулярна дегідратація t - 160 ºС, kt - (H 2 SO 4 (конц. ), H 3 PO 4, Al 2 O 3; продукти – алкени. Найлегше дегідратуються третинні, потім вторинні, а далі первинні спирти.
Реакції дегідратації (відщеплення молекули води) Внутрішньомолекулярна дегідратація t - 160 ºС, kt - (H 2 SO 4 (конц. ), H 3 PO 4, Al 2 O 3; продукти – алкени. Найлегше дегідратуються третинні, потім вторинні, а далі первинні спирти.
 Міжмолекулярна дегідратація t - 130– 140 ºС, kt - H 2 SO 4 (конц. ), H 3 PO 4, Al 2 O 3; продукти – етери (прості ефіри).
Міжмолекулярна дегідратація t - 130– 140 ºС, kt - H 2 SO 4 (конц. ), H 3 PO 4, Al 2 O 3; продукти – етери (прості ефіри).
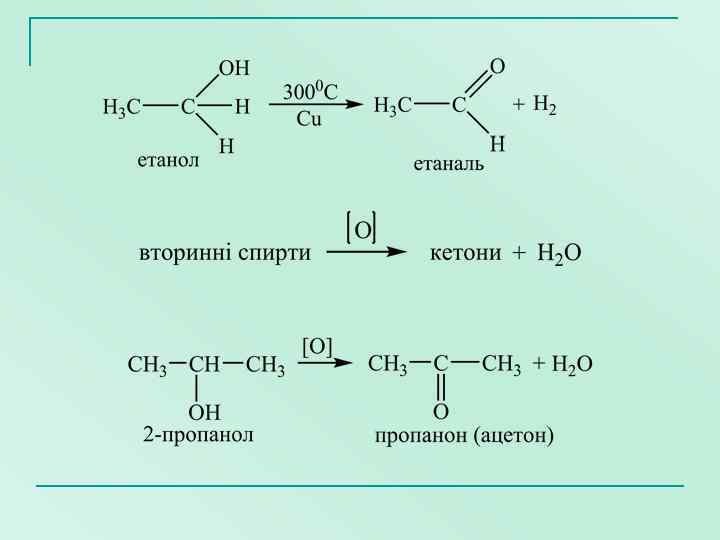
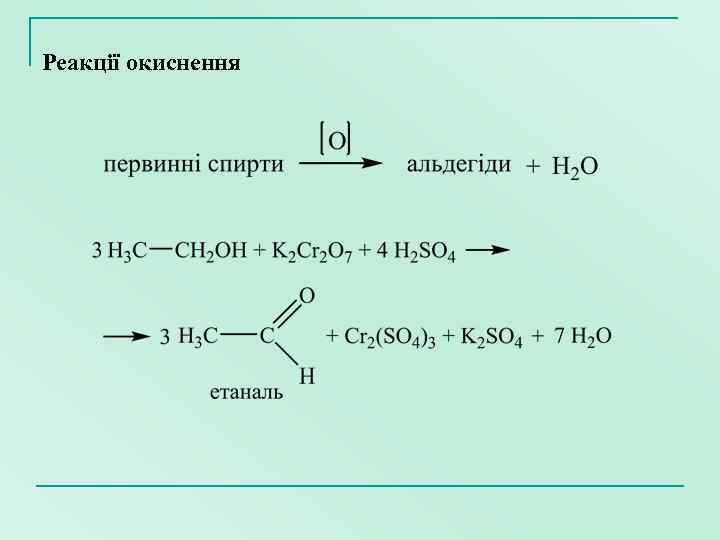 Реакції окиснення
Реакції окиснення
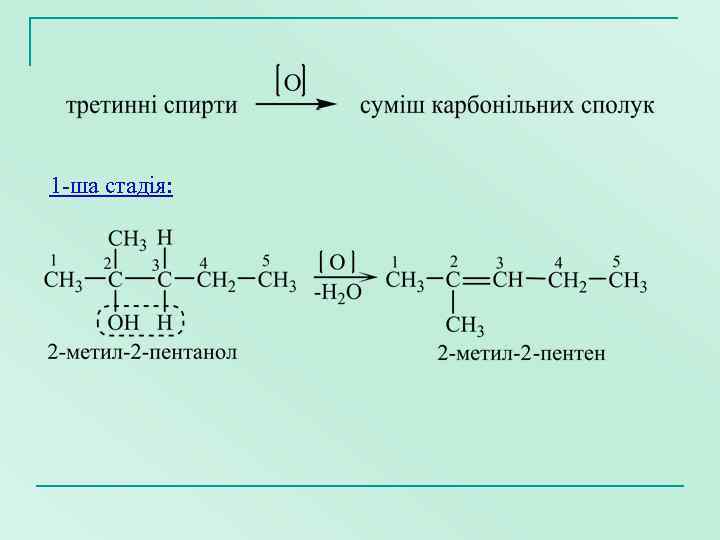 1 -ша стадія:
1 -ша стадія:
 2 -га стадія:
2 -га стадія:
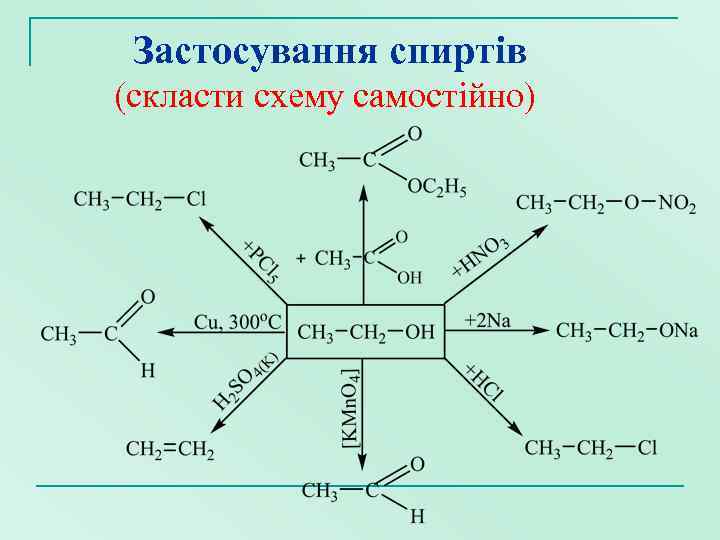 Застосування спиртів (скласти схему самостійно)
Застосування спиртів (скласти схему самостійно)


