Lektsia_OKh_4_rus.ppt
- Количество слайдов: 18
 Лекция № 4 Ароматические углеводороды
Лекция № 4 Ароматические углеводороды
 План лекции: 1. Строение. Ароматичность. 2. Реакции электрофильного замещения SE. Механизм реакции. 3. Влияние электроно-донорных и электроноакцепторных заместителей на реакции электрофильного замещения SE. Ориентанты 1 и 2 рода. 4. Реакции в боковой цепи. 5. Реакции окисления и восстановления.
План лекции: 1. Строение. Ароматичность. 2. Реакции электрофильного замещения SE. Механизм реакции. 3. Влияние электроно-донорных и электроноакцепторных заместителей на реакции электрофильного замещения SE. Ориентанты 1 и 2 рода. 4. Реакции в боковой цепи. 5. Реакции окисления и восстановления.
 Ароматические углеводороды по составу соответствуют формуле Сn H 2 n – 6, при n≥ 6. Строение Электронографические исследования бензола показали, что молекула имеет высокую симметрию. Она представляет собой правильный плоский шестиугольник. Все связи С-С одинаковые и их длина не соответствует ни одинарной (1, 54 нм), ни двойной (1, 33 нм) связи, а имеет промежуточное положение (1, 39 нм).
Ароматические углеводороды по составу соответствуют формуле Сn H 2 n – 6, при n≥ 6. Строение Электронографические исследования бензола показали, что молекула имеет высокую симметрию. Она представляет собой правильный плоский шестиугольник. Все связи С-С одинаковые и их длина не соответствует ни одинарной (1, 54 нм), ни двойной (1, 33 нм) связи, а имеет промежуточное положение (1, 39 нм).
 Валентные углы тригональные -120 о, углеродные атомы в системе бензола находятся в SP 2 гибридизации. Каждый углеродный атом образует три связи σ- и предоставляют одну р- орбиталь для образования сопряженной системы из 6 π -электронов. Молекула бензола имеет тенденцию сохранять свою сопряженную систему, поэтому во многих реакциях кратковременное нарушение сопряженной системы быстро регенерируются.
Валентные углы тригональные -120 о, углеродные атомы в системе бензола находятся в SP 2 гибридизации. Каждый углеродный атом образует три связи σ- и предоставляют одну р- орбиталь для образования сопряженной системы из 6 π -электронов. Молекула бензола имеет тенденцию сохранять свою сопряженную систему, поэтому во многих реакциях кратковременное нарушение сопряженной системы быстро регенерируются.
 Понятие ароматичности: Соединение ароматично, если оно имеет: плоский замкнутый цикл сопряжённую π - электронную систему, охватывающую все атомы цикла и содержащую (4 n+2) π -электронов – правило Хюккеля. Нафталин, антрацен фенантрен менее термодинамически стабильны, т. к. у них нет полной выравниваемости π -электронной плотности. Реакции электрофильного замещения у них протекают легче, чем у бензола, они активны и в реакциях присоединения и окисления.
Понятие ароматичности: Соединение ароматично, если оно имеет: плоский замкнутый цикл сопряжённую π - электронную систему, охватывающую все атомы цикла и содержащую (4 n+2) π -электронов – правило Хюккеля. Нафталин, антрацен фенантрен менее термодинамически стабильны, т. к. у них нет полной выравниваемости π -электронной плотности. Реакции электрофильного замещения у них протекают легче, чем у бензола, они активны и в реакциях присоединения и окисления.
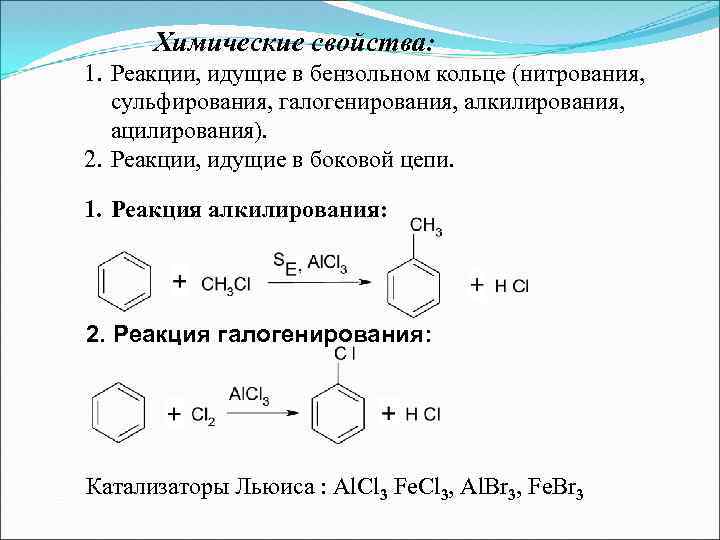 Химические свойства: 1. Реакции, идущие в бензольном кольце (нитрования, сульфирования, галогенирования, алкилирования, ацилирования). 2. Реакции, идущие в боковой цепи. 1. Реакция алкилирования: 2. Реакция галогенирования: Катализаторы Льюиса : Al. Cl 3 Fe. Cl 3, Al. Br 3, Fe. Br 3
Химические свойства: 1. Реакции, идущие в бензольном кольце (нитрования, сульфирования, галогенирования, алкилирования, ацилирования). 2. Реакции, идущие в боковой цепи. 1. Реакция алкилирования: 2. Реакция галогенирования: Катализаторы Льюиса : Al. Cl 3 Fe. Cl 3, Al. Br 3, Fe. Br 3
 Механизм реакции SЕ: На первой стадии бензол и его гомологи с электрофильными реагентами образуют - комплекс (быстрая стадия). На второй стадии - комплекс превращается в σкомплекс, где первый углерод находится в состоянии SP 3 – гибридизации и т. к. электрофил забирает два электрона для образования σ связи, наблюдается недостаток электронов, что указываем зарядом «+» (медленная стадия). На третьей стадии - комплекс неустойчив, поскольку происходит разрушение 6 - электронной системы бензола. Поэтому σ- комплекс легко отщепляет протон и образуется замещенный арен (восстановление ароматичности быстро).
Механизм реакции SЕ: На первой стадии бензол и его гомологи с электрофильными реагентами образуют - комплекс (быстрая стадия). На второй стадии - комплекс превращается в σкомплекс, где первый углерод находится в состоянии SP 3 – гибридизации и т. к. электрофил забирает два электрона для образования σ связи, наблюдается недостаток электронов, что указываем зарядом «+» (медленная стадия). На третьей стадии - комплекс неустойчив, поскольку происходит разрушение 6 - электронной системы бензола. Поэтому σ- комплекс легко отщепляет протон и образуется замещенный арен (восстановление ароматичности быстро).
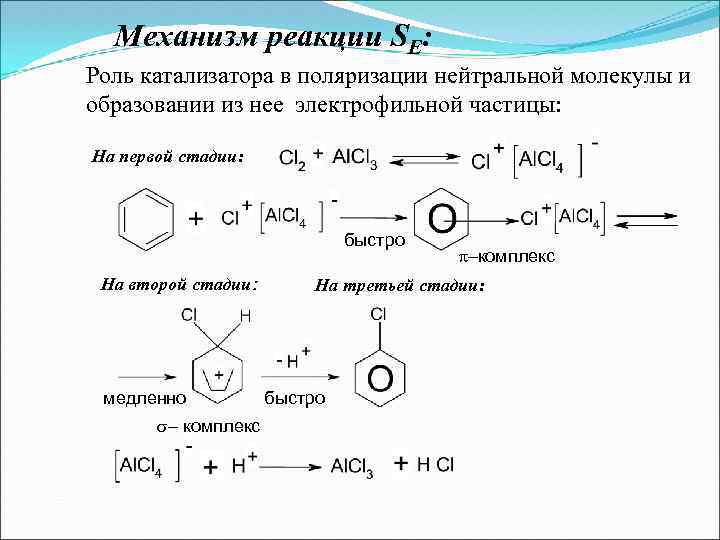 Механизм реакции SЕ: Роль катализатора в поляризации нейтральной молекулы и образовании из нее электрофильной частицы: На первой стадии: быстро На второй стадии: медленно комплекс На третьей стадии: быстро
Механизм реакции SЕ: Роль катализатора в поляризации нейтральной молекулы и образовании из нее электрофильной частицы: На первой стадии: быстро На второй стадии: медленно комплекс На третьей стадии: быстро
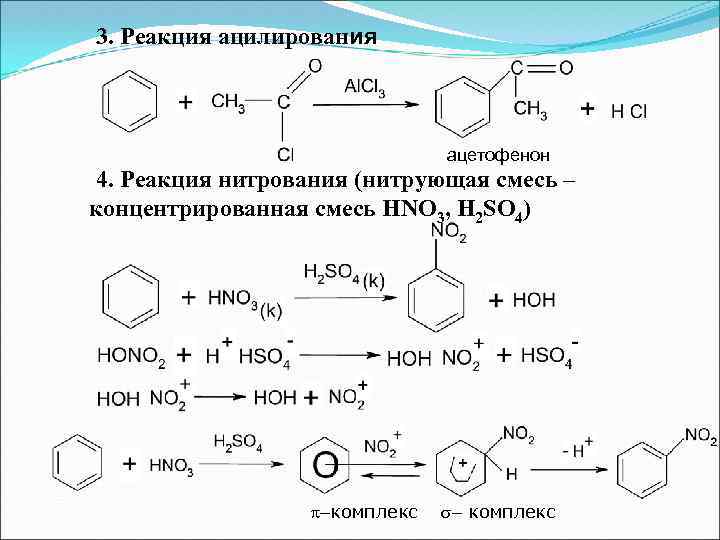 3. Реакция ацилирования ацетофенон 4. Реакция нитрования (нитрующая смесь – концентрированная смесь HNO 3, H 2 SO 4) комплекс
3. Реакция ацилирования ацетофенон 4. Реакция нитрования (нитрующая смесь – концентрированная смесь HNO 3, H 2 SO 4) комплекс
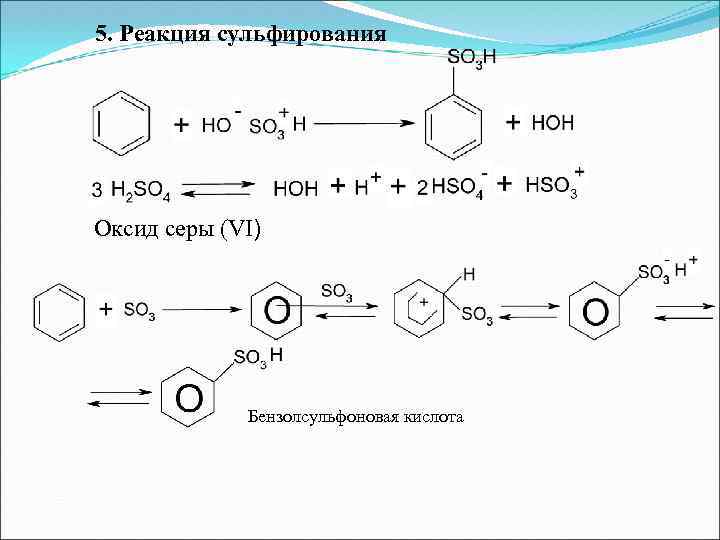 5. Реакция сульфирования Оксид серы (VI) Бензолсульфоновая кислота
5. Реакция сульфирования Оксид серы (VI) Бензолсульфоновая кислота
 Ориентирующее действие заместителей в бензольном ядре. • Молекула бензола симметрична и все атомы углерода совершенно равноценны, поэтому электрофильная частица при образовании π - комплекса может атаковать с равной вероятностью любой из атомов углерода. • Совсем иначе идёт замещение в монозамещенных соединениях. Симметрия -электронного облака нарушается и электрофильная частица (Е+) будет атаковать атом «С» с наибольшей электронной плотностью.
Ориентирующее действие заместителей в бензольном ядре. • Молекула бензола симметрична и все атомы углерода совершенно равноценны, поэтому электрофильная частица при образовании π - комплекса может атаковать с равной вероятностью любой из атомов углерода. • Совсем иначе идёт замещение в монозамещенных соединениях. Симметрия -электронного облака нарушается и электрофильная частица (Е+) будет атаковать атом «С» с наибольшей электронной плотностью.
 По влиянию на реакции электрофильного замещения заместители делятся на две группы: Заместители (ориентанты) 1 рода -OH, -NH 2, -NHR, -NR 2, -OR, -NHCOR, Hal (-J, +M), -CH 3 (любой алкил) (+J, +M) Заместители 1 рода (кроме галогенов) облегчают электрофильные замещения по сравнению с бензолом и направляют входящую группу в орто- и пара- положения. Заместители (ориентанты) 2 рода: +NH ; -NO ; -SO H; -CH=O; -C(O)R; -C(O)OH; -C≡N 3 2 3 -C(O)OR; (-J, -M) Они затрудняют реакций электрофильного замещения по сравнению с бензолом. Реакция проходит в жестких условиях, входящая группа вступает в мето-положение.
По влиянию на реакции электрофильного замещения заместители делятся на две группы: Заместители (ориентанты) 1 рода -OH, -NH 2, -NHR, -NR 2, -OR, -NHCOR, Hal (-J, +M), -CH 3 (любой алкил) (+J, +M) Заместители 1 рода (кроме галогенов) облегчают электрофильные замещения по сравнению с бензолом и направляют входящую группу в орто- и пара- положения. Заместители (ориентанты) 2 рода: +NH ; -NO ; -SO H; -CH=O; -C(O)R; -C(O)OH; -C≡N 3 2 3 -C(O)OR; (-J, -M) Они затрудняют реакций электрофильного замещения по сравнению с бензолом. Реакция проходит в жестких условиях, входящая группа вступает в мето-положение.
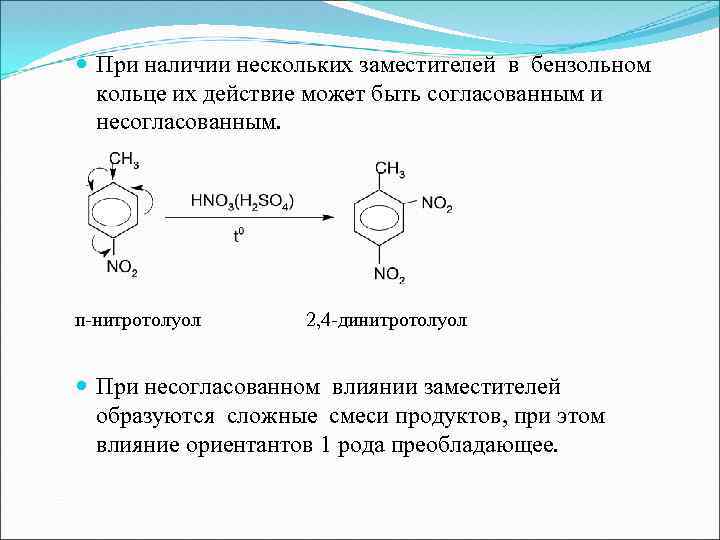 При наличии нескольких заместителей в бензольном кольце их действие может быть согласованным и несогласованным. п-нитротолуол 2, 4 -динитротолуол При несогласованном влиянии заместителей образуются сложные смеси продуктов, при этом влияние ориентантов 1 рода преобладающее.
При наличии нескольких заместителей в бензольном кольце их действие может быть согласованным и несогласованным. п-нитротолуол 2, 4 -динитротолуол При несогласованном влиянии заместителей образуются сложные смеси продуктов, при этом влияние ориентантов 1 рода преобладающее.
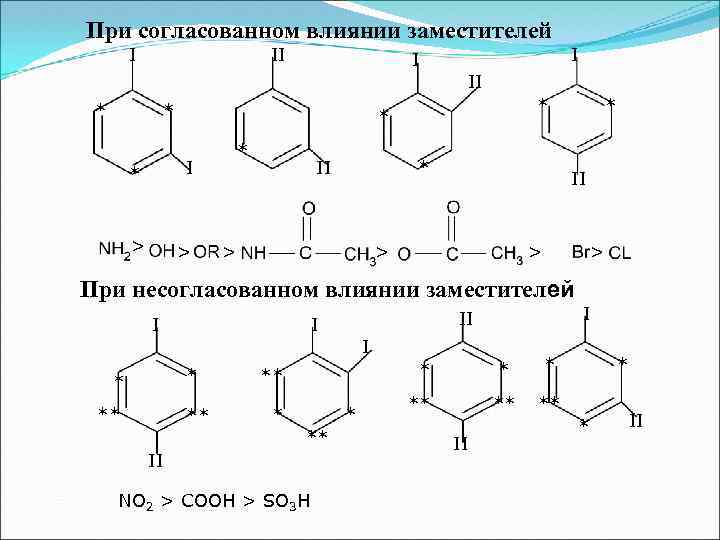 При согласованном влиянии заместителей I II I I II * * * I * > * * > II * > * II > > > При несогласованном влиянии заместителей I II I I * * ** ** II NO 2 > COOH > SO 3 H ** II * ** * II
При согласованном влиянии заместителей I II I I II * * * I * > * * > II * > * II > > > При несогласованном влиянии заместителей I II I I * * ** ** II NO 2 > COOH > SO 3 H ** II * ** * II
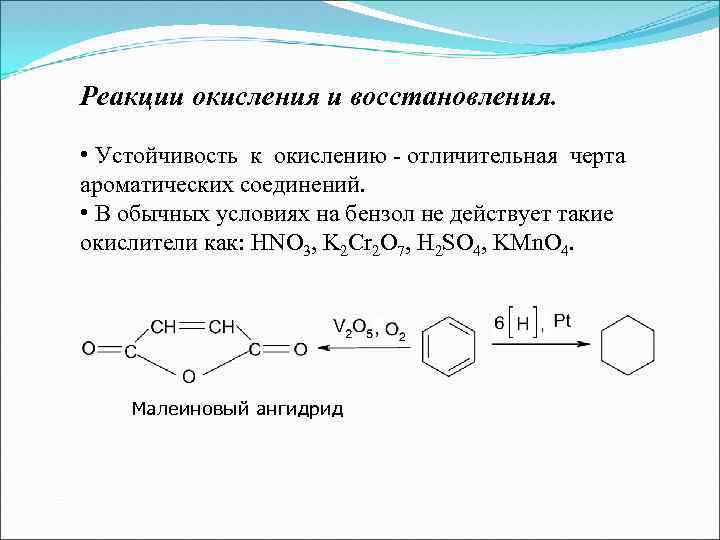 Реакции окисления и восстановления. • Устойчивость к окислению - отличительная черта ароматических соединений. • В обычных условиях на бензол не действует такие окислители как: HNO 3, K 2 Cr 2 O 7, H 2 SO 4, KMn. O 4. Малеиновый ангидрид
Реакции окисления и восстановления. • Устойчивость к окислению - отличительная черта ароматических соединений. • В обычных условиях на бензол не действует такие окислители как: HNO 3, K 2 Cr 2 O 7, H 2 SO 4, KMn. O 4. Малеиновый ангидрид
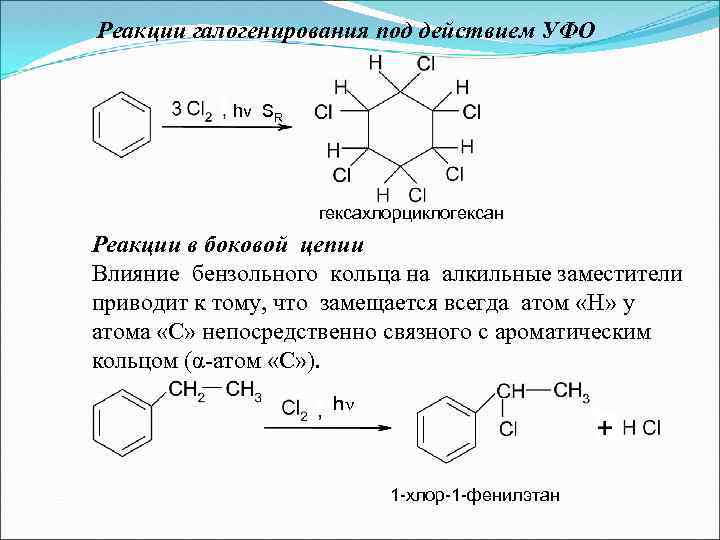 Реакции галогенирования под действием УФО hν SR гексахлорциклогексан Реакции в боковой цепии Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом «Н» у атома «С» непосредственно связного с ароматическим кольцом (α-атом «С» ). h 1 -хлор-1 -фенилэтан
Реакции галогенирования под действием УФО hν SR гексахлорциклогексан Реакции в боковой цепии Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом «Н» у атома «С» непосредственно связного с ароматическим кольцом (α-атом «С» ). h 1 -хлор-1 -фенилэтан
 Реакции окисления гомологов бензола • Боковой алкильный радикал независимо от длины углеродной цепи окисляется в карбоксильную группу под действием HNO 3, K 2 Cr 2 O 7 + H 2 SO 4, KMn. O 4 + H 2 SO 4. • Окисляемые соединения должны иметь хотя бы один атом «Н» и α -атом «С» . бензойная кислота
Реакции окисления гомологов бензола • Боковой алкильный радикал независимо от длины углеродной цепи окисляется в карбоксильную группу под действием HNO 3, K 2 Cr 2 O 7 + H 2 SO 4, KMn. O 4 + H 2 SO 4. • Окисляемые соединения должны иметь хотя бы один атом «Н» и α -атом «С» . бензойная кислота
 ЛИТЕРАТУРА: Основная: 1. Тюкавкина Н. А. « Органическая химия» , Кн. 1: Основной курс-М. , «Дрофа» , 2002, 640 с. , Кн. 2: Специальный курс-М. , «Дрофа» , 2008, 592 с. 2. «Руководство к лабораторным занятиям по органической химии» под редакцией Тюкавкиной Н. А. , М. , «Дрофа» , 2003, 384 с. Дополнительная: 1. Тюкавкина Н. А. , Бауков Ю. И. « Биоорганическая химия» , М. , 2006, 544 с. 2. Ильясова М. И. , Алмабекова А. А. « Тестовые задания по органической химии для самостоятельной работы студентов» , Алматы, 2006, 40
ЛИТЕРАТУРА: Основная: 1. Тюкавкина Н. А. « Органическая химия» , Кн. 1: Основной курс-М. , «Дрофа» , 2002, 640 с. , Кн. 2: Специальный курс-М. , «Дрофа» , 2008, 592 с. 2. «Руководство к лабораторным занятиям по органической химии» под редакцией Тюкавкиной Н. А. , М. , «Дрофа» , 2003, 384 с. Дополнительная: 1. Тюкавкина Н. А. , Бауков Ю. И. « Биоорганическая химия» , М. , 2006, 544 с. 2. Ильясова М. И. , Алмабекова А. А. « Тестовые задания по органической химии для самостоятельной работы студентов» , Алматы, 2006, 40


