 Лекция 4 Алкадиены
Лекция 4 Алкадиены
 А Л К А Д И Е Н Ы. (Диены, ненасыщенные, непредельные углеводороды). . ¡ Алкадиены (или просто диены)- это углеводороды, в молекулах которых имеется две двойные связи. Общая формула Сп С 2 п-2.
А Л К А Д И Е Н Ы. (Диены, ненасыщенные, непредельные углеводороды). . ¡ Алкадиены (или просто диены)- это углеводороды, в молекулах которых имеется две двойные связи. Общая формула Сп С 2 п-2.
 1. Общие сведения. 1). Классификация В зависимости от взаимного расположения двойных связей различают: ¡ диены с кумулированными двойными связями, например: СН 2=С=СН 2 аллен ¡ диены с сопряженными (конъюгированными) двойными связями: СН 2=СН-СН=СН 2 дивинил ¡ диены с изолированными двойными связями СН 2=СН-СН 2 -СН=СН 2 1, 4 -пентадиен
1. Общие сведения. 1). Классификация В зависимости от взаимного расположения двойных связей различают: ¡ диены с кумулированными двойными связями, например: СН 2=С=СН 2 аллен ¡ диены с сопряженными (конъюгированными) двойными связями: СН 2=СН-СН=СН 2 дивинил ¡ диены с изолированными двойными связями СН 2=СН-СН 2 -СН=СН 2 1, 4 -пентадиен
 2). Строение, гибридизация Атомы углерода при двойных связях находятся в состоянии гибридизации sp 2, строение зависит от типа диена. Так, у аллена две двойные связи находятся в перпендикулярных плоскостях. В сопряженных диенах обе двойные связи лежат в одной плоскости, все четыре негибридизованные рорбитали перекрываются друг с другом и образуют единое электронное облако, что обуславливает ряд специфических свойств этих диенов. Диены с изолированными связями имеют строение и химические свойства, как и обычные алкены (реакции идут сначала по одной, затем по другой двойной связи).
2). Строение, гибридизация Атомы углерода при двойных связях находятся в состоянии гибридизации sp 2, строение зависит от типа диена. Так, у аллена две двойные связи находятся в перпендикулярных плоскостях. В сопряженных диенах обе двойные связи лежат в одной плоскости, все четыре негибридизованные рорбитали перекрываются друг с другом и образуют единое электронное облако, что обуславливает ряд специфических свойств этих диенов. Диены с изолированными связями имеют строение и химические свойства, как и обычные алкены (реакции идут сначала по одной, затем по другой двойной связи).
 3). Изомерия а) Межклассовая - диены изомерны алкинам. б) Структурная - по положению двойных связей - по строению углеродного скелета в) пространственная (цис-трансизомерия)
3). Изомерия а) Межклассовая - диены изомерны алкинам. б) Структурная - по положению двойных связей - по строению углеродного скелета в) пространственная (цис-трансизомерия)
 4). Номенклатура а) тривиальная б) систематическая Аналогична номенклатуре алкенов, с добавлением суффикса «ди» перед окончанием «ен» . Двумя цифрами указывается положение двух двойных связей в цепи. Примеры: формула тривиальное назв. систематическое назв. СН 2=С=СН 2 аллен 1, 2 - пропадиен СН 2=СН-СН=СН 2 дивинил 1, 3 -бутадиен СН 2=С-СН=СН 2 изопрен 2 -метил-1, 3 -бутадиен CН 3
4). Номенклатура а) тривиальная б) систематическая Аналогична номенклатуре алкенов, с добавлением суффикса «ди» перед окончанием «ен» . Двумя цифрами указывается положение двух двойных связей в цепи. Примеры: формула тривиальное назв. систематическое назв. СН 2=С=СН 2 аллен 1, 2 - пропадиен СН 2=СН-СН=СН 2 дивинил 1, 3 -бутадиен СН 2=С-СН=СН 2 изопрен 2 -метил-1, 3 -бутадиен CН 3
 2. Методы получения 1. Дегидрирование алканов 2. Дегидрогалогенирование замещенных дигалогенпроизводных 3. Дегидратация двухатомных спиртов. 4. Специфический метод - получение по реакции Лебедева: Zn. O, Al 2 O 3 2 СН 3 -СН 2 -ОН t ~ 370 o. C СН 2=СН-СН=СН 2 + + 2 Н 2 О + Н 2
2. Методы получения 1. Дегидрирование алканов 2. Дегидрогалогенирование замещенных дигалогенпроизводных 3. Дегидратация двухатомных спиртов. 4. Специфический метод - получение по реакции Лебедева: Zn. O, Al 2 O 3 2 СН 3 -СН 2 -ОН t ~ 370 o. C СН 2=СН-СН=СН 2 + + 2 Н 2 О + Н 2
 3. Физические свойства ¡ Аллен, дивинил - газы, далее - жидкости с резким запахом, плохо растворяются в воде. Высшие диены- твердые вещества.
3. Физические свойства ¡ Аллен, дивинил - газы, далее - жидкости с резким запахом, плохо растворяются в воде. Высшие диены- твердые вещества.
 4. Химические свойства Особый интерес представляют химические свойства сопряженных диенов. В реакциях гидрирования, галогенирования, гидрогалогенирования присоединение проходит не только в положения 1, 2 - по месту разрыва двойной связи, но и в положение 1. 4 - с появлением новой двойной связи в положении 2 -3. Пример: 2 СН 2=СН-СН=СН 2 + 2 Br 2 СН 2 -СН-СН=СН 2+ СН 2 -СН=СН-СН 2 Br Br Особое значение имеет реакция полимеризации сопряженных диенов. На ее основе получают каучуки, а затем после их вулканизации серой - резины. Пример: R· n СН 2=С-СН=СН 2 - (-СН 2 -С=СН-СН 2 -)n | CH 3 изопрен полиизопреновый каучук, аналог натурального
4. Химические свойства Особый интерес представляют химические свойства сопряженных диенов. В реакциях гидрирования, галогенирования, гидрогалогенирования присоединение проходит не только в положения 1, 2 - по месту разрыва двойной связи, но и в положение 1. 4 - с появлением новой двойной связи в положении 2 -3. Пример: 2 СН 2=СН-СН=СН 2 + 2 Br 2 СН 2 -СН-СН=СН 2+ СН 2 -СН=СН-СН 2 Br Br Особое значение имеет реакция полимеризации сопряженных диенов. На ее основе получают каучуки, а затем после их вулканизации серой - резины. Пример: R· n СН 2=С-СН=СН 2 - (-СН 2 -С=СН-СН 2 -)n | CH 3 изопрен полиизопреновый каучук, аналог натурального
 5. Применение диенов ¡ Диены используются для синтеза различных органических веществ, однако основное их количество идет на получение каучуков и резин.
5. Применение диенов ¡ Диены используются для синтеза различных органических веществ, однако основное их количество идет на получение каучуков и резин.
 Алкины (ацетиленовые, непредельные, ненасыщенные углеводороды) Общая формула – Сn. H 2 n-2
Алкины (ацетиленовые, непредельные, ненасыщенные углеводороды) Общая формула – Сn. H 2 n-2
 1. Общие сведения. 1). Строение, гибридизация ¡ Атомы углерода при тройной связи находятся в состоянии гибридизации sp. Две гибридизованные орбитали этих атомов находятся под углом 180 о друг относительно друга. Две негибридизованные р-орбитали расположены перпендикулярно друг к другу. Перекрываясь боками с аналогичными орбиталями соседнего атома углерода, находящегося также в состоянии гибридизации sp, эти орбитали образуют две перпендикулярные π-связи. Получается, что два атома углерода связаны одной σ и двумя π связями. Такая связь называется тройной связью.
1. Общие сведения. 1). Строение, гибридизация ¡ Атомы углерода при тройной связи находятся в состоянии гибридизации sp. Две гибридизованные орбитали этих атомов находятся под углом 180 о друг относительно друга. Две негибридизованные р-орбитали расположены перпендикулярно друг к другу. Перекрываясь боками с аналогичными орбиталями соседнего атома углерода, находящегося также в состоянии гибридизации sp, эти орбитали образуют две перпендикулярные π-связи. Получается, что два атома углерода связаны одной σ и двумя π связями. Такая связь называется тройной связью.
 2). Изомерия а) межклассовая Алкины изомерны алкадиенам. б) структурная 1. По строению углеродного скелета 2. По положению тройной связи в цепи.
2). Изомерия а) межклассовая Алкины изомерны алкадиенам. б) структурная 1. По строению углеродного скелета 2. По положению тройной связи в цепи.
 3). Номенклатура а) Названия некоторых радикалов с тройной связью Углеводород НС ≡ СН этин (ацетил ен) НС≡С- СН 3 пропин (метилацетиле н) Радикал Название радикала НС ≡ С- ацетиленил, этинил НС≡С-СН 2 - пропаргил 2 - пропинил
3). Номенклатура а) Названия некоторых радикалов с тройной связью Углеводород НС ≡ СН этин (ацетил ен) НС≡С- СН 3 пропин (метилацетиле н) Радикал Название радикала НС ≡ С- ацетиленил, этинил НС≡С-СН 2 - пропаргил 2 - пропинил
 Б)рациональная номенклатура ¡ Все алкины называются как производные родоначальника ряда – ацетилена.
Б)рациональная номенклатура ¡ Все алкины называются как производные родоначальника ряда – ацетилена.
 В) систематическая номенклатура ¡ Аналогична номенклатуре алкенов, с заменой окончания «ен» на «ин» .
В) систематическая номенклатура ¡ Аналогична номенклатуре алкенов, с заменой окончания «ен» на «ин» .
 Г) Примеры: Углеводород Название систематическое рациональное НС ≡ СН ацетилен этин НС≡С- СН 3 метилацетилен пропин СН 3 -С≡С-СН 2 - СН 3 метилэтилацетилен пентин-2 СН 3 -С≡С- СН-СН 3 метилизопропилацетилен 4 -метилпентин-2 | CH 3
Г) Примеры: Углеводород Название систематическое рациональное НС ≡ СН ацетилен этин НС≡С- СН 3 метилацетилен пропин СН 3 -С≡С-СН 2 - СН 3 метилэтилацетилен пентин-2 СН 3 -С≡С- СН-СН 3 метилизопропилацетилен 4 -метилпентин-2 | CH 3
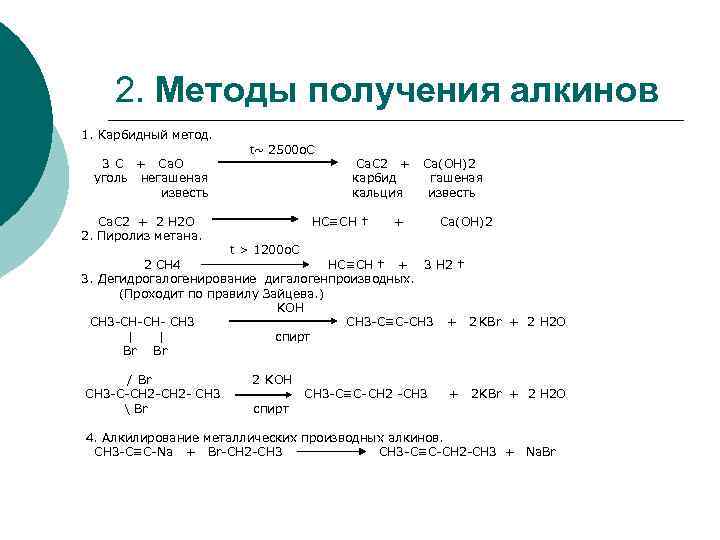 2. Методы получения алкинов 1. Карбидный метод. t~ 2500 o. C 3 С + Ca. O Ca. C 2 + Ca(OH)2 уголь негашеная карбид гашеная известь кальция известь Са. С 2 + 2 Н 2 О НС≡СН † + Са(ОН)2 2. Пиролиз метана. t > 1200 o. C 2 СН 4 НС≡СН † + 3 Н 2 † 3. Дегидрогалогенирование дигалогенпроизводных. (Проходит по правилу Зайцева. ) KOH СН 3 -СН-СН- СН 3 СН 3 -С≡С-СН 3 + 2 KBr + 2 H 2 O | | спирт Br / Br 2 KOH СН 3 -С-СH 2 -СН 2 - СН 3 СН 3 -С≡С-CH 2 -СН 3 + 2 KBr + 2 H 2 O Br спирт 4. Алкилирование металлических производных алкинов. СН 3 -С≡С-Na + Br-CH 2 -CH 3 CH 3 -C≡C-CH 2 -CH 3 + Na. Br
2. Методы получения алкинов 1. Карбидный метод. t~ 2500 o. C 3 С + Ca. O Ca. C 2 + Ca(OH)2 уголь негашеная карбид гашеная известь кальция известь Са. С 2 + 2 Н 2 О НС≡СН † + Са(ОН)2 2. Пиролиз метана. t > 1200 o. C 2 СН 4 НС≡СН † + 3 Н 2 † 3. Дегидрогалогенирование дигалогенпроизводных. (Проходит по правилу Зайцева. ) KOH СН 3 -СН-СН- СН 3 СН 3 -С≡С-СН 3 + 2 KBr + 2 H 2 O | | спирт Br / Br 2 KOH СН 3 -С-СH 2 -СН 2 - СН 3 СН 3 -С≡С-CH 2 -СН 3 + 2 KBr + 2 H 2 O Br спирт 4. Алкилирование металлических производных алкинов. СН 3 -С≡С-Na + Br-CH 2 -CH 3 CH 3 -C≡C-CH 2 -CH 3 + Na. Br
 Физические свойства Алкины С 2 - С 4 - газы, С 5 - С 15 - жидкости, С 16 и выше - твердые вещества. Алкины плохо растворяются в воде, но лучше, чем алканы и алкены. Хорошо растворяются в органических растворителях. Родоначальник ряда ацетилен склонен к взрывному разложению: С 2 Н 2 С + Н 2 В связи с этим хранят его в сжатом виде в баллонах, наполненных адсорбентом, пропитанном ацетоном (реже другим растворителем).
Физические свойства Алкины С 2 - С 4 - газы, С 5 - С 15 - жидкости, С 16 и выше - твердые вещества. Алкины плохо растворяются в воде, но лучше, чем алканы и алкены. Хорошо растворяются в органических растворителях. Родоначальник ряда ацетилен склонен к взрывному разложению: С 2 Н 2 С + Н 2 В связи с этим хранят его в сжатом виде в баллонах, наполненных адсорбентом, пропитанном ацетоном (реже другим растворителем).
 4. Химические свойства 1) Гидрирование. В присутствии палладиевого катализатора возможно из алкина получить алкен, в прсутствии платины или никелевого катализатора гидрирование идет полностью до алкана. Pd НС≡С-СН 3 + Н 2 Н 2 С=СН-СН 3 Pt , Ni НС≡С-СН 3 + 2 Н 2 СН 3 -СН 2 -СН 3 2) Галогенирование Br Br | | НС≡С-СН 3 + Br 2 Н С=С-СН 3 Н С -С-СН 3 | | Br Br Br Br 3) Гидрогалогенирование (проходит по правилу Марковникова) Br HBr | НС≡С-СН 3 + HBr Н 2 С=С-СН 3 Н 3 С -С-СН 3 | Br Br
4. Химические свойства 1) Гидрирование. В присутствии палладиевого катализатора возможно из алкина получить алкен, в прсутствии платины или никелевого катализатора гидрирование идет полностью до алкана. Pd НС≡С-СН 3 + Н 2 Н 2 С=СН-СН 3 Pt , Ni НС≡С-СН 3 + 2 Н 2 СН 3 -СН 2 -СН 3 2) Галогенирование Br Br | | НС≡С-СН 3 + Br 2 Н С=С-СН 3 Н С -С-СН 3 | | Br Br Br Br 3) Гидрогалогенирование (проходит по правилу Марковникова) Br HBr | НС≡С-СН 3 + HBr Н 2 С=С-СН 3 Н 3 С -С-СН 3 | Br Br
 Химические свойства 4) Гидратация по Кучерову Hg. SO 4 НС≡СН + H-ОН [ Н 2 С=С- OН] Н 3 С -С=O H 2 SO 4 H уксусный альдегид Hg. SO 4 НС≡С-СН 3 + H-ОН [ Н 2 С=С-СН 3] Н 3 С -С-СН 3 H 2 SO 4 || ОН O ацетон 5) Металлирование. СН 3 -С≡С-Н + Na. NH 2 СН 3 -С≡С- Na + NH 3 6)Тримеризация ацетилена. уголь акт. 3 Н-С≡С-Н 4 600
Химические свойства 4) Гидратация по Кучерову Hg. SO 4 НС≡СН + H-ОН [ Н 2 С=С- OН] Н 3 С -С=O H 2 SO 4 H уксусный альдегид Hg. SO 4 НС≡С-СН 3 + H-ОН [ Н 2 С=С-СН 3] Н 3 С -С-СН 3 H 2 SO 4 || ОН O ацетон 5) Металлирование. СН 3 -С≡С-Н + Na. NH 2 СН 3 -С≡С- Na + NH 3 6)Тримеризация ацетилена. уголь акт. 3 Н-С≡С-Н 4 600
 5. Применение В настоящее время практическое применение находит в основном ацетилен. Так, ацетилен горит ярким пламенем, температура пламени очень высока ( 2800 -3000 о. С). 2 С 2 Н 2 + 5 О 2 4 СО 2 + 2 Н 2 О + Q Это позволяет широко использовать ацетилен для сварки и резки металлов. Ацетилен также широко используется для получения уксусного альдегида и затем уксусной кислоты, для получения галогенпроизводных и многих других важных химических продуктов.
5. Применение В настоящее время практическое применение находит в основном ацетилен. Так, ацетилен горит ярким пламенем, температура пламени очень высока ( 2800 -3000 о. С). 2 С 2 Н 2 + 5 О 2 4 СО 2 + 2 Н 2 О + Q Это позволяет широко использовать ацетилен для сварки и резки металлов. Ацетилен также широко используется для получения уксусного альдегида и затем уксусной кислоты, для получения галогенпроизводных и многих других важных химических продуктов.


