Лекция № 4 АДСОРБЦИЯ ИЗ РАСТВОРОВ НА РАЗНЫХ












- Размер: 840 Кб
- Количество слайдов: 27
Описание презентации Лекция № 4 АДСОРБЦИЯ ИЗ РАСТВОРОВ НА РАЗНЫХ по слайдам
 Лекция № 4 АДСОРБЦИЯ ИЗ РАСТВОРОВ НА РАЗНЫХ ПОВЕРХНОСТЯХ РАЗДЕЛА ФАЗ
Лекция № 4 АДСОРБЦИЯ ИЗ РАСТВОРОВ НА РАЗНЫХ ПОВЕРХНОСТЯХ РАЗДЕЛА ФАЗ
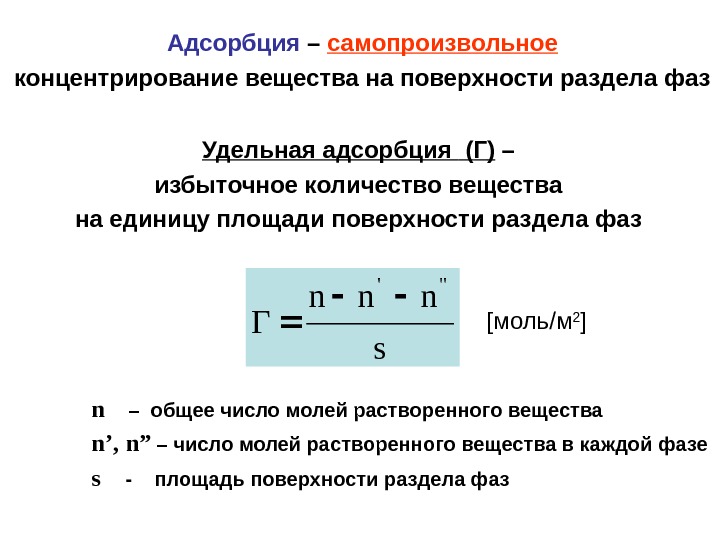
 Удельная адсорбция ( Г ) – избыточное количество вещества на единицу площади поверхности раздела фаз s nnn Γ «‘ n – общее число молей растворенного вещества n’, n” – число молей растворенного вещества в каждой фазе s — площадь поверхности раздела фаз Адсорбция – самопроизвольное концентрирование вещества на поверхности раздела фаз [ моль / м 2 ]
Удельная адсорбция ( Г ) – избыточное количество вещества на единицу площади поверхности раздела фаз s nnn Γ «‘ n – общее число молей растворенного вещества n’, n” – число молей растворенного вещества в каждой фазе s — площадь поверхности раздела фаз Адсорбция – самопроизвольное концентрирование вещества на поверхности раздела фаз [ моль / м 2 ]
 δcΓ ‘cc δcс. Г (S) 22 2 (S) 2 ‘ 2 (s) 22 Гексиловый спирт – вода: = 0 , 7 нм с 2 ( S) =5, 8. 10 -2 моль/л 6· 10 — 6 моль/м 2 c 2 ” = 0 Определение величины адсорбции Г
δcΓ ‘cc δcс. Г (S) 22 2 (S) 2 ‘ 2 (s) 22 Гексиловый спирт – вода: = 0 , 7 нм с 2 ( S) =5, 8. 10 -2 моль/л 6· 10 — 6 моль/м 2 c 2 ” = 0 Определение величины адсорбции Г
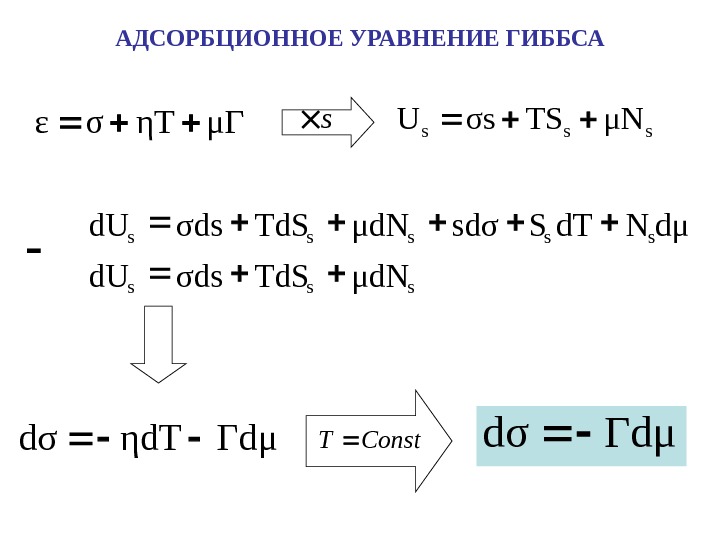
 АДСОРБЦИОННОЕ УРАВНЕНИЕ ГИББСА μ ГηTσε sssμNTSσs. U s Гdμηd. Tdσ Const. T Гdμdσ sssss μd. NTd. Sσdsd. U dμNd. TSsd σμd. NTd. Sσdsd. U
АДСОРБЦИОННОЕ УРАВНЕНИЕ ГИББСА μ ГηTσε sssμNTSσs. U s Гdμηd. Tdσ Const. T Гdμdσ sssss μd. NTd. Sσdsd. U dμNd. TSsd σμd. NTd. Sσdsd. U
 dcd σ RT c Γ αc αcd RTdμ αc. RTlnμμ 0 АДСОРБЦИОННОЕ УРАВНЕНИЕ ГИББСА при α =
dcd σ RT c Γ αc αcd RTdμ αc. RTlnμμ 0 АДСОРБЦИОННОЕ УРАВНЕНИЕ ГИББСА при α =
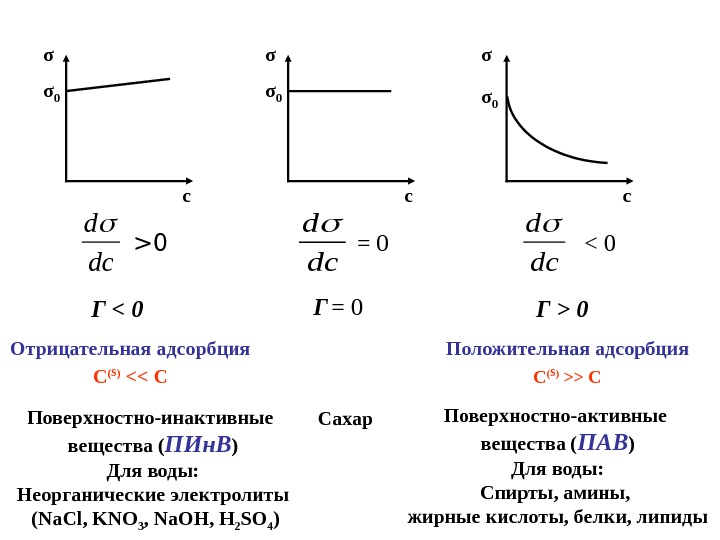
 σ cσ 0 > 0 dcd dc d = 0 dc d 0 Г = 0 Г < 0 Отрицательная адсорбция С ( s ) <> C Поверхностно-активные вещества ( ПАВ ) Для воды: Спирты, амины, жирные кислоты, белки, липиды
σ cσ 0 > 0 dcd dc d = 0 dc d 0 Г = 0 Г < 0 Отрицательная адсорбция С ( s ) <> C Поверхностно-активные вещества ( ПАВ ) Для воды: Спирты, амины, жирные кислоты, белки, липиды
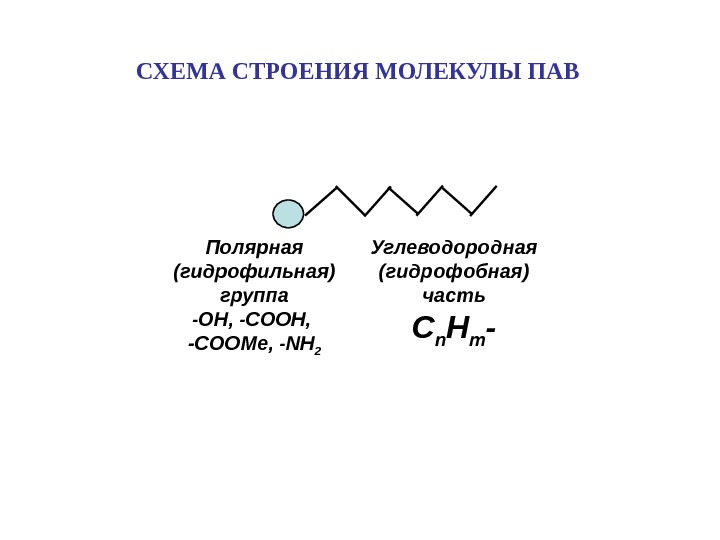
 Углеводородная (гидрофобная) часть С n H m -Полярная (гидрофильная) группа — OH, — COOH, -COOMe, — NH 2 СХЕМА СТРОЕНИЯ МОЛЕКУЛЫ ПАВ
Углеводородная (гидрофобная) часть С n H m -Полярная (гидрофильная) группа — OH, — COOH, -COOMe, — NH 2 СХЕМА СТРОЕНИЯ МОЛЕКУЛЫ ПАВ
 ЭНТРОПИЙНАЯ ПРИРОДА ПРОЦЕССА АДСОРБЦИИ H 2 O + ПАВ H 2 OΔ G = Δ H — T Δ S <
ЭНТРОПИЙНАЯ ПРИРОДА ПРОЦЕССА АДСОРБЦИИ H 2 O + ПАВ H 2 OΔ G = Δ H — T Δ S <
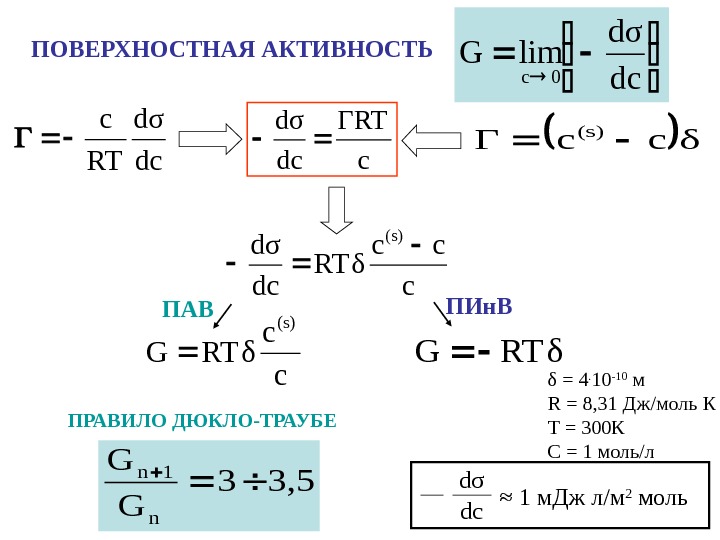
 dc dσ lim. G 0 c. ПОВЕРХНОСТНАЯ АКТИВНОСТЬ ПРАВИЛО ДЮКЛО-ТРАУБЕ 3, 53 G G n 1 n dcd σ RT c c ГRT dc dσ δcс. Г (s) c cc RTδ dc dσ (s) c c RTδG (s)RTδGПАВ ПИн. В δ = 4. 10 -10 м R = 8, 31 Дж / моль К Т = 300 К С = 1 моль / л d σ dc ≈ 1 м. Дж л / м 2 моль
dc dσ lim. G 0 c. ПОВЕРХНОСТНАЯ АКТИВНОСТЬ ПРАВИЛО ДЮКЛО-ТРАУБЕ 3, 53 G G n 1 n dcd σ RT c c ГRT dc dσ δcс. Г (s) c cc RTδ dc dσ (s) c c RTδG (s)RTδGПАВ ПИн. В δ = 4. 10 -10 м R = 8, 31 Дж / моль К Т = 300 К С = 1 моль / л d σ dc ≈ 1 м. Дж л / м 2 моль
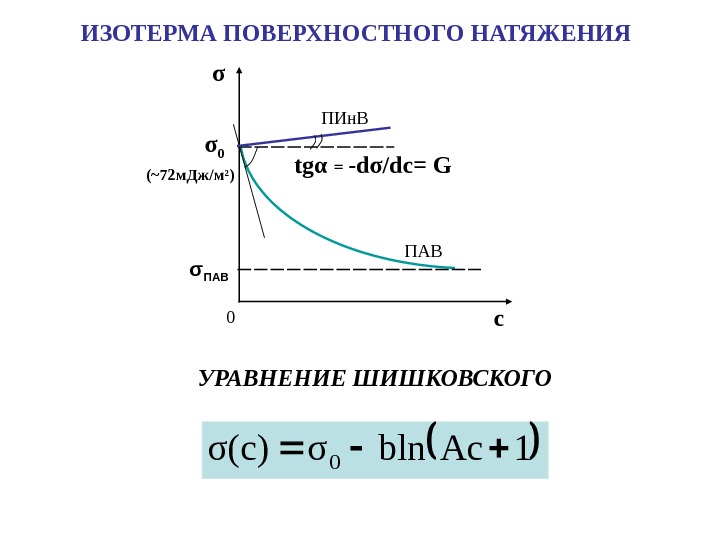
 УРАВНЕНИЕ ШИШКОВСКОГО σ cσ 0 tg α = -d σ /dc = G 0( ~72 м. Дж / м 2 ) ПИн. В ПАВ σ ПАВ 1 Acblnσσ(c) 0 ИЗОТЕРМА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
УРАВНЕНИЕ ШИШКОВСКОГО σ cσ 0 tg α = -d σ /dc = G 0( ~72 м. Дж / м 2 ) ПИн. В ПАВ σ ПАВ 1 Acblnσσ(c) 0 ИЗОТЕРМА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
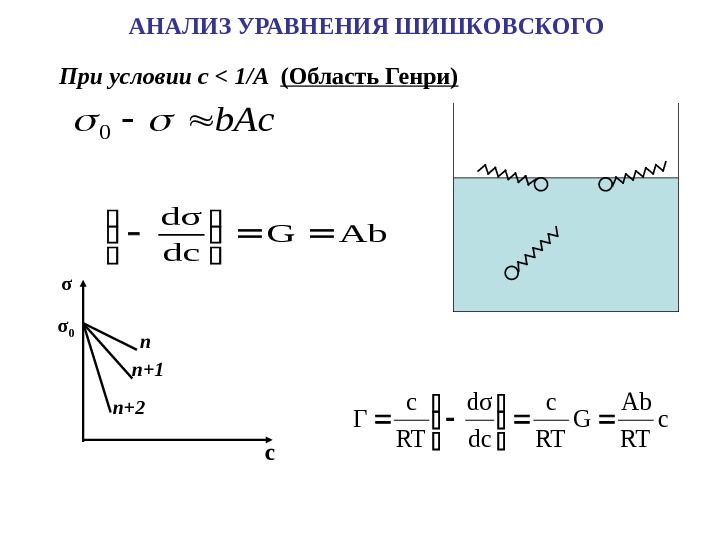
 b. Ac 0 При условии c < 1/A Ab. G dc dσ c RT Ab G RT c dc dσ RT c Γ АНАЛИЗ УРАВНЕНИЯ ШИШКОВСКОГО σ 0σ n n+1 n+2 с (Область Генри)
b. Ac 0 При условии c < 1/A Ab. G dc dσ c RT Ab G RT c dc dσ RT c Γ АНАЛИЗ УРАВНЕНИЯ ШИШКОВСКОГО σ 0σ n n+1 n+2 с (Область Генри)

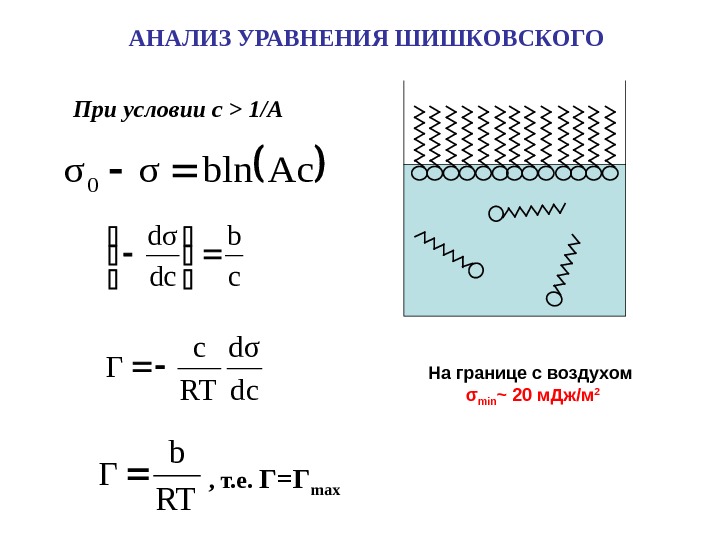
 Acblnσσ0 При условии c > 1/A АНАЛИЗ УРАВНЕНИЯ ШИШКОВСКОГО RT b Г cb dcd σ RT c Γ , т. е. Г=Г max На границе с воздухом σ min ~ 20 м. Дж / м
Acblnσσ0 При условии c > 1/A АНАЛИЗ УРАВНЕНИЯ ШИШКОВСКОГО RT b Г cb dcd σ RT c Γ , т. е. Г=Г max На границе с воздухом σ min ~ 20 м. Дж / м
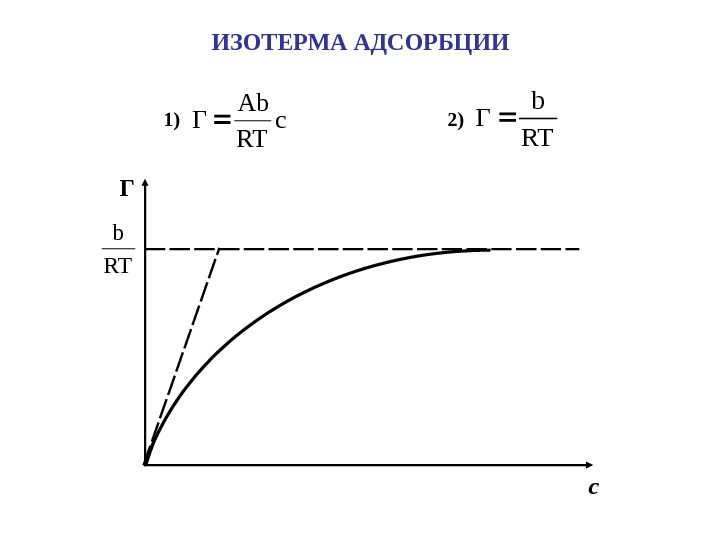
 ИЗОТЕРМА АДСОРБЦИИ 1) c RT Ab Г 2)RT b Г Г с. RT b
ИЗОТЕРМА АДСОРБЦИИ 1) c RT Ab Г 2)RT b Г Г с. RT b
 1 Ac Ac ΓΓmax 1) C <> 1/A , Ac+1≈ Ac Г = Г max A c. УРАВНЕНИЕ ЛЕНГМЮРА Г с max. Г Г max /2 1/A. дес адс k k Aравн. K Адсорбционная активность ( Коэффициенты уравнения Шишковского: b = RT Г max ; А = К равн. )
1 Ac Ac ΓΓmax 1) C <> 1/A , Ac+1≈ Ac Г = Г max A c. УРАВНЕНИЕ ЛЕНГМЮРА Г с max. Г Г max /2 1/A. дес адс k k Aравн. K Адсорбционная активность ( Коэффициенты уравнения Шишковского: b = RT Г max ; А = К равн. )
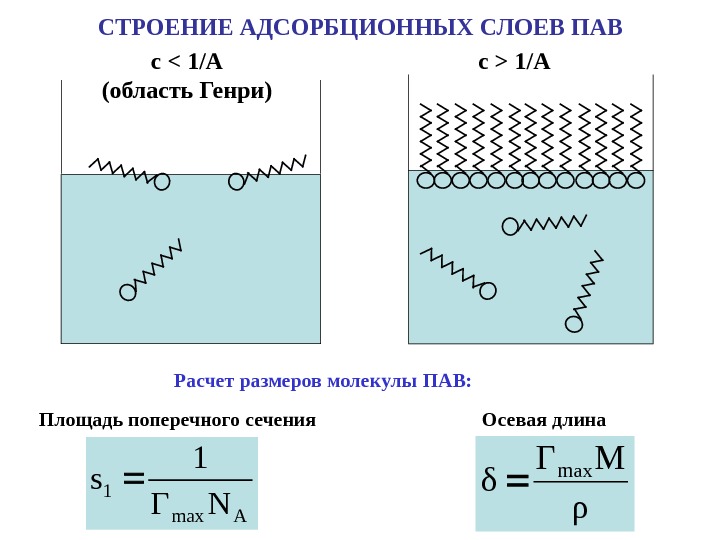
 СТРОЕНИЕ АДСОРБЦИОННЫХ СЛОЕВ ПАВ с 1/A Расчет размеров молекулы ПАВ: Площадь поперечного сечения Осевая длина Amax 1 NГ 1 s ρ MГ δ max
СТРОЕНИЕ АДСОРБЦИОННЫХ СЛОЕВ ПАВ с 1/A Расчет размеров молекулы ПАВ: Площадь поперечного сечения Осевая длина Amax 1 NГ 1 s ρ MГ δ max
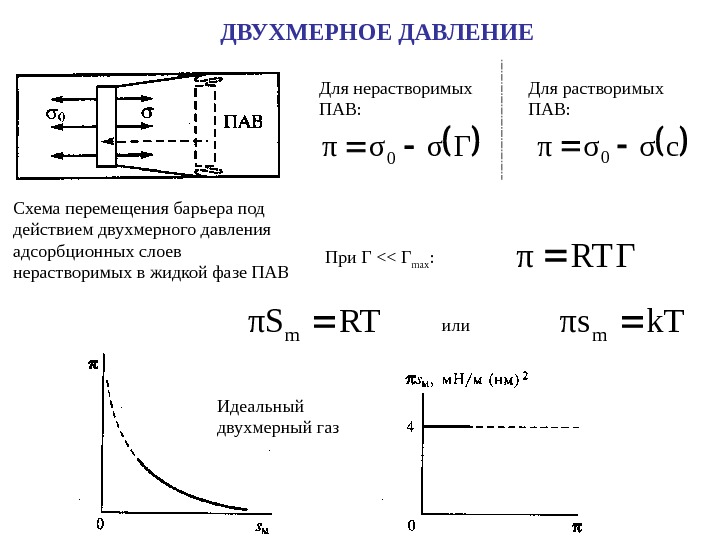
 ДВУХМЕРНОЕ ДАВЛЕНИЕ Схема перемещения барьера под действием двухмерного давления адсорбционных слоев нерастворимых в жидкой фазе ПАВΓσσπ0 Для нерастворимых ПАВ: cσσπ 0 Для растворимых ПАВ: При Г << Г max : RTΓπ RTπS m или k. Tπsm Идеальный двухмерный газ
ДВУХМЕРНОЕ ДАВЛЕНИЕ Схема перемещения барьера под действием двухмерного давления адсорбционных слоев нерастворимых в жидкой фазе ПАВΓσσπ0 Для нерастворимых ПАВ: cσσπ 0 Для растворимых ПАВ: При Г << Г max : RTΓπ RTπS m или k. Tπsm Идеальный двухмерный газ
 ВАННА ЛЕНГМЮРА Схема прибора Ленгмюра для измерения адсорбционных слоев нерастворимых ПАВk. Tssm 1 Учет площади молекул дает:
ВАННА ЛЕНГМЮРА Схема прибора Ленгмюра для измерения адсорбционных слоев нерастворимых ПАВk. Tssm 1 Учет площади молекул дает:
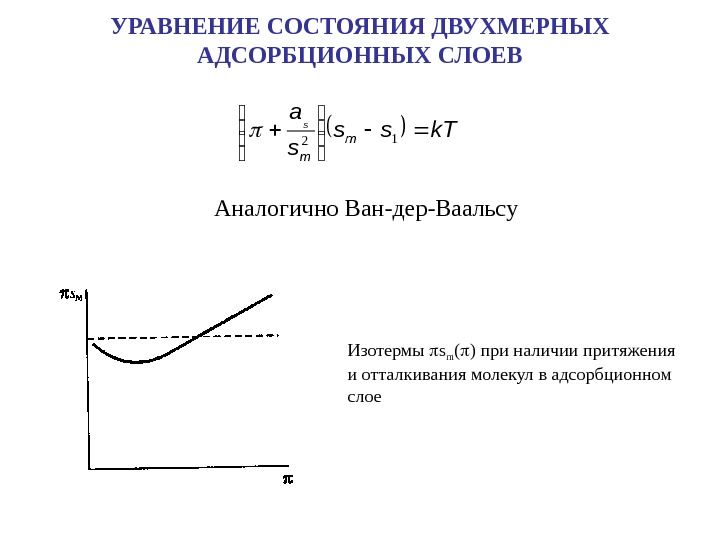
 УРАВНЕНИЕ СОСТОЯНИЯ ДВУХМЕРНЫХ АДСОРБЦИОННЫХ СЛОЕВ Аналогично Ван-дер-Ваальсу k. Tss s a m m s 1 2 Изотермы s m ( ) при наличии притяжения и отталкивания молекул в адсорбционном слое
УРАВНЕНИЕ СОСТОЯНИЯ ДВУХМЕРНЫХ АДСОРБЦИОННЫХ СЛОЕВ Аналогично Ван-дер-Ваальсу k. Tss s a m m s 1 2 Изотермы s m ( ) при наличии притяжения и отталкивания молекул в адсорбционном слое
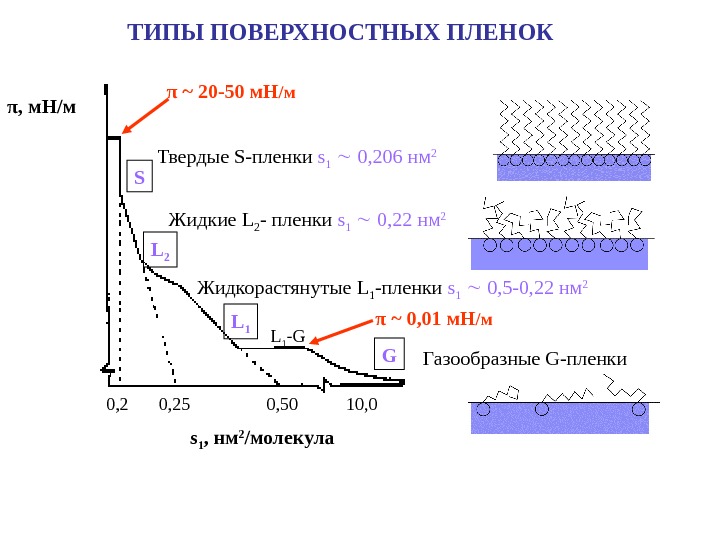
 ТИПЫ ПОВЕРХНОСТНЫХ ПЛЕНОК π , м. Н/м 0, 25 0, 50 10, 0 s 1 , нм 2 /молекула. S L 2 L 1 -G GЖидкорастянутые L 1 — пленки s 1 0, 5 -0, 22 нм 2 Жидкие L 2 — пленки s 1 0, 22 нм 2 Твердые S- пленки s 1 0, 2 06 нм 2 Газообразные G- пленкиπ ~ 20 -50 м. Н /м π ~ 0, 01 м. Н /м
ТИПЫ ПОВЕРХНОСТНЫХ ПЛЕНОК π , м. Н/м 0, 25 0, 50 10, 0 s 1 , нм 2 /молекула. S L 2 L 1 -G GЖидкорастянутые L 1 — пленки s 1 0, 5 -0, 22 нм 2 Жидкие L 2 — пленки s 1 0, 22 нм 2 Твердые S- пленки s 1 0, 2 06 нм 2 Газообразные G- пленкиπ ~ 20 -50 м. Н /м π ~ 0, 01 м. Н /м
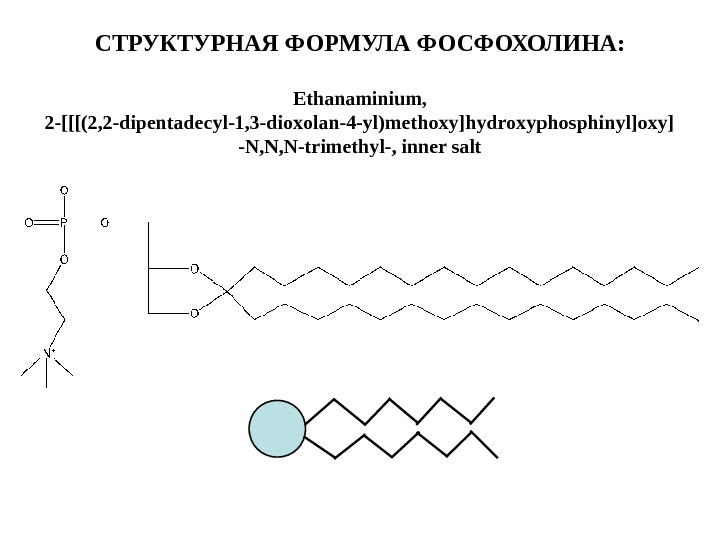
![СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2 -[[[(2, 2 -dipentadecyl-1, 3 -dioxolan-4 -yl)methoxy]hydroxyphosphinyl]oxy] -N, N, СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2 -[[[(2, 2 -dipentadecyl-1, 3 -dioxolan-4 -yl)methoxy]hydroxyphosphinyl]oxy] -N, N,](/docs//lecture4_fall_12_images/lecture4_fall_12_20.jpg) СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2 -[[[(2, 2 -dipentadecyl-1, 3 -dioxolan-4 -yl)methoxy]hydroxyphosphinyl]oxy] -N, N, N-trimethyl-, inner salt
СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2 -[[[(2, 2 -dipentadecyl-1, 3 -dioxolan-4 -yl)methoxy]hydroxyphosphinyl]oxy] -N, N, N-trimethyl-, inner salt
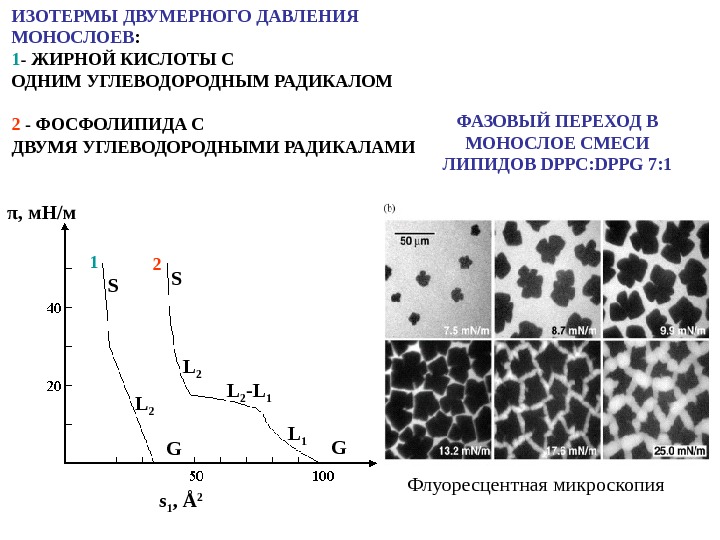
 ИЗОТЕРМЫ ДВУМЕРНОГО ДАВЛЕНИЯ МОНОСЛОЕВ : 1 — ЖИРНОЙ КИСЛОТЫ С ОДНИМ УГЛЕВОДОРОДНЫМ РАДИКАЛОМ 2 — ФОСФОЛИПИДА С ДВУМЯ УГЛЕВОДОРОДНЫМИ РАДИКАЛАМИ Флуоресцентная микроскопия ФАЗОВЫЙ ПЕРЕХОД В МОНОСЛОЕ СМЕСИ ЛИПИДОВ DPPC : DPPG 7: 1 S L 2 L 1 L 2 -L 1 s 1 , Å 2π , м. Н / м G G
ИЗОТЕРМЫ ДВУМЕРНОГО ДАВЛЕНИЯ МОНОСЛОЕВ : 1 — ЖИРНОЙ КИСЛОТЫ С ОДНИМ УГЛЕВОДОРОДНЫМ РАДИКАЛОМ 2 — ФОСФОЛИПИДА С ДВУМЯ УГЛЕВОДОРОДНЫМИ РАДИКАЛАМИ Флуоресцентная микроскопия ФАЗОВЫЙ ПЕРЕХОД В МОНОСЛОЕ СМЕСИ ЛИПИДОВ DPPC : DPPG 7: 1 S L 2 L 1 L 2 -L 1 s 1 , Å 2π , м. Н / м G G
 140 нм 2 s 1 , нм 2π , м. Н / м. ИЗОТЕРМЫ ДВУМЕРНОГО ДАВЛЕНИЯ МОНОСЛОЕВ : ГЛИАДИНА (гликопротеин, получаемый из пшеницы) НА ПОВЕРХНОСТИ РАЗДЕЛА ВОДА-ВОЗДУХ СЫВОРОТОЧНОГО АЛЬБУМИНА (белок плазмы крови крупного рогатого скота) НА ПОВЕРХНОСТИ РАЗДЕЛА: 1 — ВОДА-ВОЗДУХ 2 — ВОДА-УГЛЕВОДОРОД π , м. Н/м
140 нм 2 s 1 , нм 2π , м. Н / м. ИЗОТЕРМЫ ДВУМЕРНОГО ДАВЛЕНИЯ МОНОСЛОЕВ : ГЛИАДИНА (гликопротеин, получаемый из пшеницы) НА ПОВЕРХНОСТИ РАЗДЕЛА ВОДА-ВОЗДУХ СЫВОРОТОЧНОГО АЛЬБУМИНА (белок плазмы крови крупного рогатого скота) НА ПОВЕРХНОСТИ РАЗДЕЛА: 1 — ВОДА-ВОЗДУХ 2 — ВОДА-УГЛЕВОДОРОД π , м. Н/м
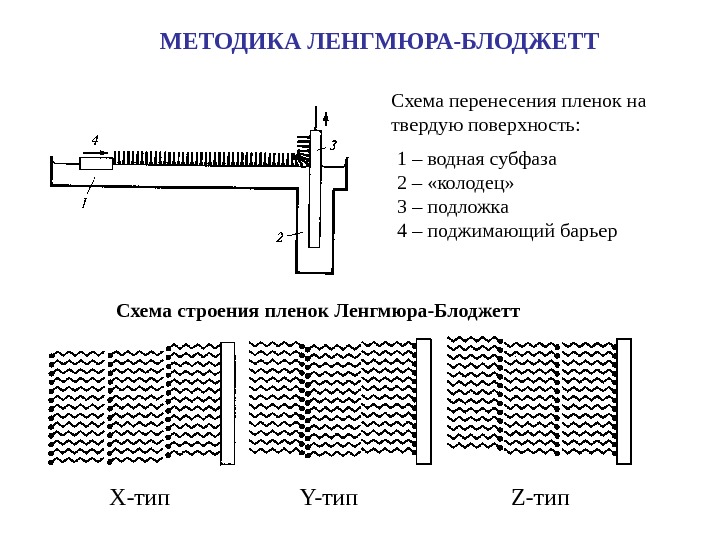
 МЕТОДИКА ЛЕНГМЮРА-БЛОДЖЕТТ Схема перенесения пленок на твердую поверхность: 1 – водная субфаза 2 – «колодец» 3 – подложка 4 – поджимающий барьер Схема строения пленок Ленгмюра-Блоджетт X- тип Y- тип Z- тип
МЕТОДИКА ЛЕНГМЮРА-БЛОДЖЕТТ Схема перенесения пленок на твердую поверхность: 1 – водная субфаза 2 – «колодец» 3 – подложка 4 – поджимающий барьер Схема строения пленок Ленгмюра-Блоджетт X- тип Y- тип Z- тип
 АДСОРБЦИЯ НА ГРАНИЦЕ ДВУХ КОНДЕНСИРОВАННЫХ ФАЗ Правило уравнивания полярностей Ребиндера : Для границы 2 -х конденсированных фаз поверхностно-активным является вещество, имеющее промежуточную полярность по сравнению с конденсированными фазами. Его молекулы размещаются на границе 2 -х конденсированных фаз таким образом, чтобы снизить разность полярностей, существующую между контактирующими фазами. ОСОБЕННОСТИ АДСОРБЦИИ НА ГРАНИЦЕ ДВУХ НЕСМЕШИВАЮЩИХСЯ ЖИДКОСТЕЙ 2. На границе с неполярной жидкостью σ min ~ 1 м. Дж / м 2 , но может быть и 0, 01 — 0, 1 м. Дж / м 2 3. Выход из воды – энтропийная природа адсорбции; выход из масла – энтальпийная. 4. Правило Дюкло-Траубе работает при выходе из воды, не работает при выходе из масла. Вода. Масло 1. Область Генри:
АДСОРБЦИЯ НА ГРАНИЦЕ ДВУХ КОНДЕНСИРОВАННЫХ ФАЗ Правило уравнивания полярностей Ребиндера : Для границы 2 -х конденсированных фаз поверхностно-активным является вещество, имеющее промежуточную полярность по сравнению с конденсированными фазами. Его молекулы размещаются на границе 2 -х конденсированных фаз таким образом, чтобы снизить разность полярностей, существующую между контактирующими фазами. ОСОБЕННОСТИ АДСОРБЦИИ НА ГРАНИЦЕ ДВУХ НЕСМЕШИВАЮЩИХСЯ ЖИДКОСТЕЙ 2. На границе с неполярной жидкостью σ min ~ 1 м. Дж / м 2 , но может быть и 0, 01 — 0, 1 м. Дж / м 2 3. Выход из воды – энтропийная природа адсорбции; выход из масла – энтальпийная. 4. Правило Дюкло-Траубе работает при выходе из воды, не работает при выходе из масла. Вода. Масло 1. Область Генри:
 АДСОРБЦИЯ ИЗ РАСТВОРОВ НА ТВЕРДОЙ ПОВЕРХНОСТИm )Vc(c Γ равн. 0 С 0 – исходная концентрация ПАВ; С равн – равновесная концентрация ПАВ (концентрация ПАВ после установления адсорбционного равновесия); V – объем раствора; m — масса адсорбента [ моль / г ]
АДСОРБЦИЯ ИЗ РАСТВОРОВ НА ТВЕРДОЙ ПОВЕРХНОСТИm )Vc(c Γ равн. 0 С 0 – исходная концентрация ПАВ; С равн – равновесная концентрация ПАВ (концентрация ПАВ после установления адсорбционного равновесия); V – объем раствора; m — масса адсорбента [ моль / г ]
 Химическая адсорбция УПРАВЛЕНИЕ СМАЧИВАНИЕМ С ПОМОЩЬЮ ПАВ Вода Al 2 O 3 Вода Масло. C Al 2 O 3 А Б В Физическая адсорбция. АДСОРБЦИЯ НА ПОВЕРХНОСТИ ТВЕРДОГО ТЕЛА
Химическая адсорбция УПРАВЛЕНИЕ СМАЧИВАНИЕМ С ПОМОЩЬЮ ПАВ Вода Al 2 O 3 Вода Масло. C Al 2 O 3 А Б В Физическая адсорбция. АДСОРБЦИЯ НА ПОВЕРХНОСТИ ТВЕРДОГО ТЕЛА

