Lektsia_4_2010.ppt
- Количество слайдов: 14

Лекция 4 (12. 10. 2010) I. Колебания двухатомных молекул 1. Гармонический осциллятор 2. Ангармонический осциллятор 3. Колебательно-вращательные спектры II. Колебания многоатомных молекул 1. Нормальные колебания 2. Форма нормальных колебаний 3. Характеристические и нехарактеристические частоты 4. Методы КР при изучении колебаний 5. Техника ИК- и КР-спектрометрии

Колебания двухатомной молекулы: Еэл=0, Екол 0, Гармонический осциллятор Екол = Eпот ядер в поле электронов=U(r- re) Обозначим: re= r 1 +r 2 , M=m 1 m 2/(m 1+m 2) В области малых отклонений (r- re): U(r- re)=(k/2) (r- re)2, где k=( 2 U/ r 2)r=re при r re Ядра движутся под действием силы упругости: F=М re”= - k (r-re) – уравнение движения гармонического осциллятора с массой М и частотой 0 0=(1/2 ) (k/M)- собственная частота гармонического осциллятора – • • • двухатомной молекулы с энергией, описываемой параболой U(r- re), согласно классической теории. В квантовой теории, которая описывает образование спектра, колебательная энергия Екол квантуется, т. е. должна принимать только определенные значения: • Екол =( +1/2)h 0 где =0, 1, 2, . . . , - колебательное квантовое число, а 0 - собственная частота: т. е. Екол представлена системой равноотстоящих энергетических уровней. В соответствие с правилами отбора: = 1, спектр гармонического осциллятора
![Ангармонический осциллятор U(r-re)=D[1 -e-a(r-re)]2 – потенциал Морзе: а=const – характеризует форму кривой; D- энергия Ангармонический осциллятор U(r-re)=D[1 -e-a(r-re)]2 – потенциал Морзе: а=const – характеризует форму кривой; D- энергия](https://present5.com/presentation/221284683_276856201/image-3.jpg)
Ангармонический осциллятор U(r-re)=D[1 -e-a(r-re)]2 – потенциал Морзе: а=const – характеризует форму кривой; D- энергия диссоциации; а)при r , U(r-re) D б)при r re: U(r-re) D[1 -1+а(rre)+. . . ]2 U(r-re) Da 2(r-re)2 уравнение гармонического осциллятора: k=2 Da 2 • 0=(a 2 D/M)/2 , более тяжелые атомы в молекуле и связи с малой D дают низкочастотные колебания. Екол =( +1/2)h 0 - (h 2 02) ( +1/2)2/4 D =0, 1, 2. . . - колебательное квантовое число; =1, 2, 3. . . *= 0(1 -2 Х) фундаментальная *1=2 0(1 -3 Х) 1 ый обертон *2=3 0(1 -4 Х) 2 ой обертон, и т. д. D D/h; сплошной спектр; Х=h 0/4 D Определяемые параметры молекул: D, М либо а, U(r-re), т. е. форма потенциальной кривой и re
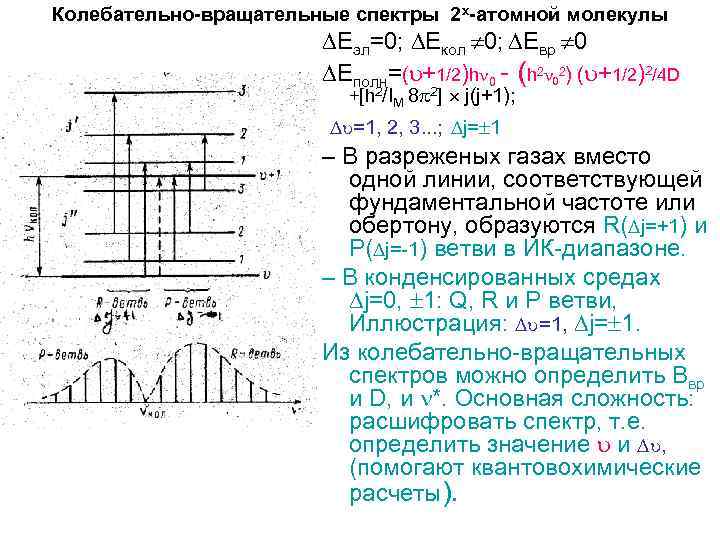
Колебательно-вращательные спектры 2 х-атомной молекулы Еэл=0; Екол 0; Евр 0 Еполн=( +1/2)h 0 - (h 2 02) ( +1/2)2/4 D +[h 2/IM 8 2] j(j+1); =1, 2, 3. . . ; j= 1 – В разреженых газах вместо одной линии, соответствующей фундаментальной частоте или обертону, образуются R( j=+1) и P( j=-1) ветви в ИК-диапазоне. – В конденсированных средах j=0, 1: Q, R и P ветви, Иллюстрация: =1, j= 1. Из колебательно-вращательных спектров можно определить Ввр и D, и *. Основная сложность: расшифровать спектр, т. е. определить значение и , (помогают квантовохимические расчеты).

Колебания многоатомных молекул. Нормальные колебания В многоатомной молекуле из N атомов существует 3 N-6 (3 N-5 для линейных молекул) колебательных степеней свободы (3 N-6 колебаний). Чтобы не рассматривать колебание каждой связи отдельно, считается, что в молекуле существует 3 N-6 нормальных колебаний, в каждое из которых вкладываются колебания разных связей с определенным весом (долей). • Нормальным называется колебание, при котором изменения N координат • • • атомов происходит с одной и той же частотой, например, фундаментальной: *= 0(1 -2 Х), и в одинаковой фазе. При этом колебание каждой связи вкладывается в нормальное колебание с определенным, коэффициентам Сi ; Соотношение коэффициентов определяет форму нормального колебания, в котором определяется нормальная координата: Qi= Ciq Нормальные колебания бывают разных форм: • Валентные: изменяется длина связей - , т. е. Сi 0 для деформационных колебаний • Деформационные: изменяются углы между связями: крутильные, веерные, ножничные, маятниковые, зонтичные и т. д. - ; т. е. Сi 0 для валентных колебаний.

Характеристичные и нехарактеристичные колебания • • Т. о. , колебания в многоатомной молекуле будем рассматривать как нормальные, характеризуемые набором коэффициентов Сi. Характеристичные колебания: некоторые группы атомов проявляются в колебательных спектрах разных молекул с близкой частотой: Схар 1 С=О=1600 -1875 см-1. О-Н=3450 – 3700 см-1 Характеристическими становятся частоты: 0=(1/2 )a 2 D/M- если М или D отдельной атомной группировки существенно отличается от всех других: (состоят из более легких или, наоборот, более тяжелых атомов: О-Н, N-Н, СН, N-M, либо С=О, С=С, С N (в ненасыщенных связях D -велика), другие связи в это колебание вкладываются слабо: Сi 0 – такие частоты называются характеристичными или групповыми. Наоборот: Область 1400 – 700 см-1 – нехарактеристичные частоты (finger prints) невозможно отнести к отдельным связям – все колебания в молекуле сильно взаимодействуют, поэтому Сi –по величине мало отличаются. Изменение одной из связей (соседнее влияние) изменяет частоту колебаний, т. е. это существенно индивидуальные для данного соединения частоты, именно по нехарактеристичным частотам проводится качественный и количественный анализ соединений. Отсутствие полос в области характеристичных частот свидетельствует об отсутствии такой группы в молекуле, но присутствие полос в этой области не является подтверждением наличия этих групп, следует анализировать нехарактеристичные частоты по положению и интенсивности.
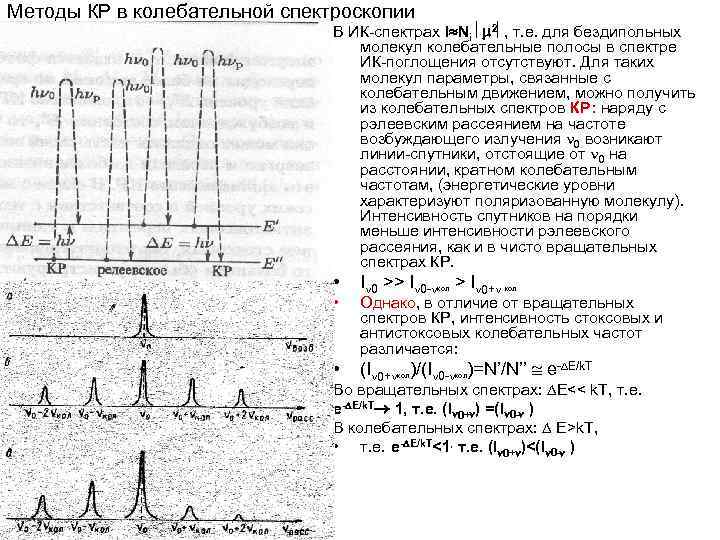
Методы КР в колебательной спектроскопии В ИК-спектрах I Ni 2 , т. е. для бездипольных молекул колебательные полосы в спектре ИК-поглощения отсутствуют. Для таких молекул параметры, связанные с колебательным движением, можно получить из колебательных спектров КР: наряду с рэлеевским рассеянием на частоте возбуждающего излучения 0 возникают линии-спутники, отстоящие от 0 на расстоянии, кратном колебательным частотам, (энергетические уровни характеризуют поляризованную молекулу). Интенсивность спутников на порядки меньше интенсивности рэлеевского рассеяния, как и в чисто вращательных спектрах КР. • • • I 0 >> I 0 - кол > I 0+ кол Однако, в отличие от вращательных спектров КР, интенсивность стоксовых и антистоксовых колебательных частот различается: (I 0+ кол)/(I 0 - кол)=N’/N’’ е- Е/k. T Во вращательных спектрах: Е<< k. T, т. е. е- Е/k. T 1, т. е. (I 0+ ) =(I 0 - ) В колебательных спектрах: Е>k. T, • т. е. е- Е/k. T<1, т. е. (I 0+ )<(I 0 - )
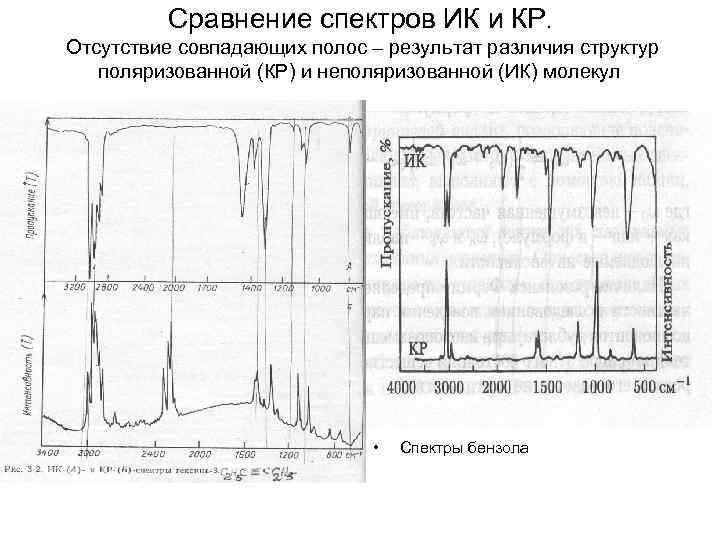
Сравнение спектров ИК и КР. Отсутствие совпадающих полос – результат различия структур поляризованной (КР) и неполяризованной (ИК) молекул • Спектры бензола

Техника дифракционной ИК- и КР-спектрометрии • ИК • • • 1 – Источник ИК-излучения (штифт Нернста) 2 – зеркала 3 – образец 4 – компенсатор фона 5 – прерыватель-модулятор 6 – входная щель 7 – диспергирующий элемент (дифракционная решетка эшеллет) 8 – выходная щель 9 – 14 – система детектирования (болометры, ПП фотоэлементы • • ) КР 1 – лазер 2 – зеркала 3 – образец 4 – призма-анализатор 5 – щели 6 -7 двойной монохроматор 8 -10 - система детектирования
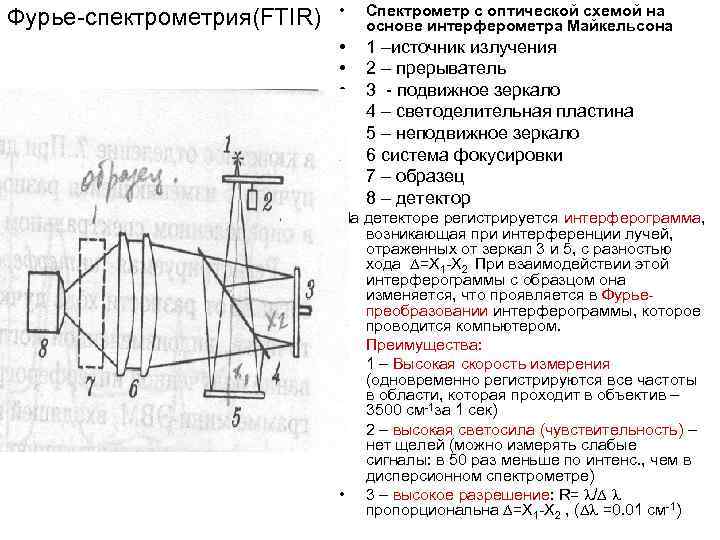
Фурье-спектрометрия(FTIR) • Спектрометр с оптической схемой на основе интерферометра Майкельсона • • 1 –источник излучения 2 – прерыватель 3 - подвижное зеркало 4 – светоделительная пластина 5 – неподвижное зеркало 6 система фокусировки 7 – образец 8 – детектор На детекторе регистрируется интерферограмма, возникающая при интерференции лучей, отраженных от зеркал 3 и 5, с разностью хода =Х 1 -Х 2 При взаимодействии этой интерферограммы с образцом она изменяется, что проявляется в Фурьепреобразовании интерферограммы, которое проводится компьютером. • Преимущества: • 1 – Высокая скорость измерения (одновременно регистрируются все частоты в области, которая проходит в объектив – 3500 см-1 за 1 сек) • 2 – высокая светосила (чувствительность) – нет щелей (можно измерять слабые сигналы: в 50 раз меньше по интенс. , чем в дисперсионном спектрометре) • 3 – высокое разрешение: R= / пропорциональна =Х 1 -Х 2 , ( =0. 01 см-1)
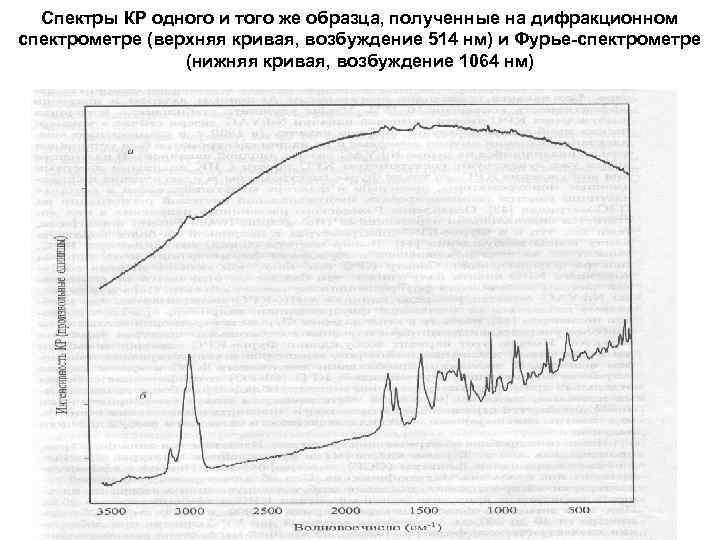
Спектры КР одного и того же образца, полученные на дифракционном спектрометре (верхняя кривая, возбуждение 514 нм) и Фурье-спектрометре (нижняя кривая, возбуждение 1064 нм)

Электронная спектроскопия 1. 2. 3. 4. 5. 6. 7. 8. Поглощение и излучение света молекулами, характеристики фотопроцессов Молекулярные орбитали Природа электронных переходов Спектры поглощения, возбуждения и люминесценции Принцип Франка-Кондона Фосфоресценция, природа триплетного состояния Поляризация люминесценции, свойства, применение Вынужденное излучение, лазеры, свойства, применение
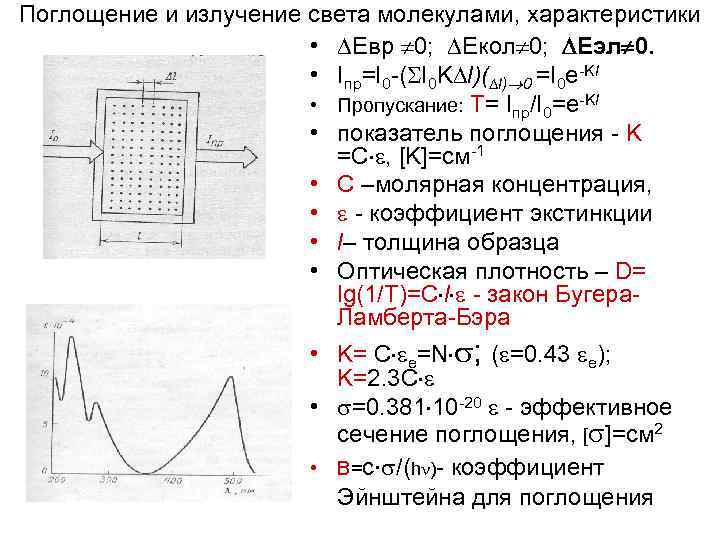
Поглощение и излучение света молекулами, характеристики • Евр 0; Екол 0; Еэл 0. • Iпр=I 0 -( I 0 K l)( l) 0 =I 0 e-Kl • Пропускание: Т= Iпр/I 0=e-Kl • показатель поглощения - K =С , [K]=см-1 • С –молярная концентрация, • - коэффициент экстинкции • l– толщина образца • Оптическая плотность – D= lg(1/T)=С l - закон Бугера. Ламберта-Бэра • K= С е=N ; ( =0. 43 е); K=2. 3 С • =0. 381 10 -20 - эффективное сечение поглощения, [ ]=см 2 • B=с /(h )- коэффициент Эйнштейна для поглощения
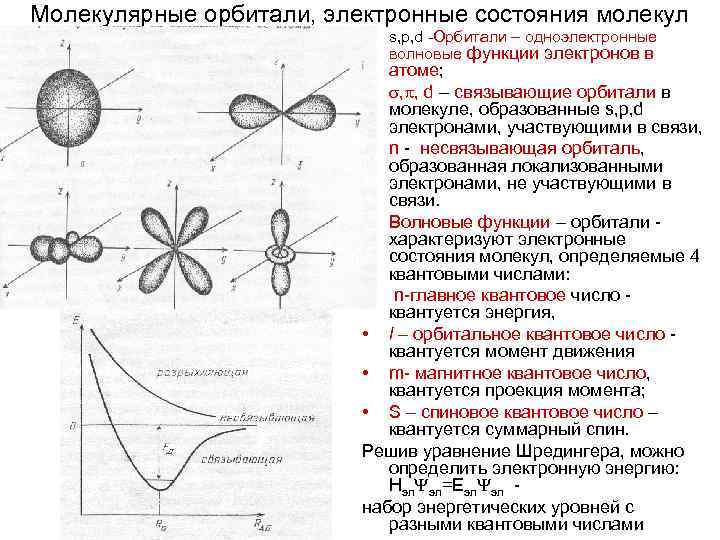
Молекулярные орбитали, электронные состояния молекул • s, p, d -Орбитали – одноэлектронные волновые функции электронов в атоме; • , , d – связывающие орбитали в молекуле, образованные s, p, d электронами, участвующими в связи, • n - несвязывающая орбиталь, образованная локализованными электронами, не участвующими в связи. • Волновые функции – орбитали характеризуют электронные состояния молекул, определяемые 4 квантовыми числами: • n-главное квантовое число квантуется энергия, • l – орбитальное квантовое число квантуется момент движения • m- магнитное квантовое число, квантуется проекция момента; • S – спиновое квантовое число – квантуется суммарный спин. Решив уравнение Шредингера, можно определить электронную энергию: Нэл эл=Еэл эл набор энергетических уровней с разными квантовыми числами
Lektsia_4_2010.ppt