Лекция 31.ppt
- Количество слайдов: 35
 Лекция № 31 Тема: Полярография. Амперометрическое титрование
Лекция № 31 Тема: Полярография. Амперометрическое титрование
 План лекции: 1. Классическая полярография. Обоснование метода. 2. Метод амперометрического титрования. 3. Инверсионная вольтамперометрия.
План лекции: 1. Классическая полярография. Обоснование метода. 2. Метод амперометрического титрования. 3. Инверсионная вольтамперометрия.
 Полярография — электрохимический метод анализа, основанный на измерении силы тока, возникающего при электровосстановлении или электроокислении вещества на микроэлектроде. Полярографический метод, предложенный Я. Гейровским, основан на изучении полярограмм, т. е. зависимости силы тока от напряжения.
Полярография — электрохимический метод анализа, основанный на измерении силы тока, возникающего при электровосстановлении или электроокислении вещества на микроэлектроде. Полярографический метод, предложенный Я. Гейровским, основан на изучении полярограмм, т. е. зависимости силы тока от напряжения.
 Полярографический метод анализа имеет следующие разновидности: 1. адсорбционный полярографический анализ, 2. амальгамная полярография, 3. дифференциальная полярография, 4. осциллографическая полярография.
Полярографический метод анализа имеет следующие разновидности: 1. адсорбционный полярографический анализ, 2. амальгамная полярография, 3. дифференциальная полярография, 4. осциллографическая полярография.
 В методе полярографического анализа для подавления миграционного тока и увеличения электропроводности раствора добавляется большой избыток электролита, называемого фоном. Фоновыми электролитами чаще служат соли щелочных металлов, кислоты, для определения самих щелочных металлов используют фоновый электролит – соли тетраалкиламмония.
В методе полярографического анализа для подавления миграционного тока и увеличения электропроводности раствора добавляется большой избыток электролита, называемого фоном. Фоновыми электролитами чаще служат соли щелочных металлов, кислоты, для определения самих щелочных металлов используют фоновый электролит – соли тетраалкиламмония.
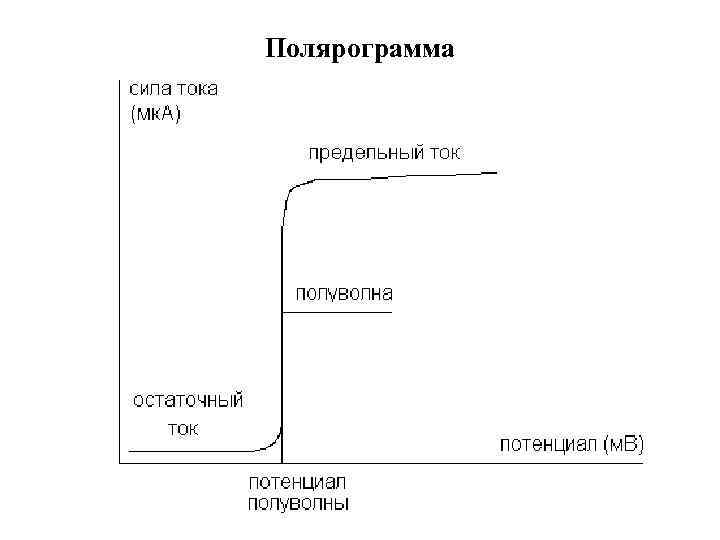
 Зависимость силы тока, получаемого при электролизе испытуемого вещества, от прилагаемого напряжения выражается в виде вольтамперной кривой, называемой обычно «полярографической волной» или полярограммой. При достижении определенного для каждого вещества значения потенциала происходит его электровосстановление (или электроокисление), сопровождающееся увеличением силы тока в цепи, который приобретает практически постоянное значение, называемое предельным (диффузионным) током или высотой волны.
Зависимость силы тока, получаемого при электролизе испытуемого вещества, от прилагаемого напряжения выражается в виде вольтамперной кривой, называемой обычно «полярографической волной» или полярограммой. При достижении определенного для каждого вещества значения потенциала происходит его электровосстановление (или электроокисление), сопровождающееся увеличением силы тока в цепи, который приобретает практически постоянное значение, называемое предельным (диффузионным) током или высотой волны.
 Полярограмма
Полярограмма
 Потенциал, при котором ток равен половине диффузионного, называется потенциалом полуволны и обозначается Е 1/2. Потенциалы полуволн представляют собой константы, которые определяются только природой восстанавливающихся веществ. Качественной характеристикой полярографируемых веществ является величина потенциала полуволны, по которой определяют состав раствора.
Потенциал, при котором ток равен половине диффузионного, называется потенциалом полуволны и обозначается Е 1/2. Потенциалы полуволн представляют собой константы, которые определяются только природой восстанавливающихся веществ. Качественной характеристикой полярографируемых веществ является величина потенциала полуволны, по которой определяют состав раствора.
 Сила, тока, соответствующая высоте ( «высота волны» ), называется предельным током. Количественный полярографический анализ основан на измерении предельного диффузионного тока, величина которого прямо пропорциональна концентрации вещества в исследуемом растворе.
Сила, тока, соответствующая высоте ( «высота волны» ), называется предельным током. Количественный полярографический анализ основан на измерении предельного диффузионного тока, величина которого прямо пропорциональна концентрации вещества в исследуемом растворе.
 Основой количественного полярографического анализа является уравнение Ильковича, выражающее связь диффузионного тока с концентрацией вещества, природой электрохимической реакции и характеристиками электрода:
Основой количественного полярографического анализа является уравнение Ильковича, выражающее связь диффузионного тока с концентрацией вещества, природой электрохимической реакции и характеристиками электрода:
 где — величина среднего диффузионного тока в микроамперах; n — число электронов, принимающих участие в реакции (мк. А); D — коэффициент диффузии в квадратных сантиметрах в секунду (см 2/с); m — количество ртути в миллиграммах, вытекающей из капилляра в секунду (мг/с); τ — время образования одной капли в секундах (с); С — концентрация определяемого вещества в миллимолях на литр (ммоль/л).
где — величина среднего диффузионного тока в микроамперах; n — число электронов, принимающих участие в реакции (мк. А); D — коэффициент диффузии в квадратных сантиметрах в секунду (см 2/с); m — количество ртути в миллиграммах, вытекающей из капилляра в секунду (мг/с); τ — время образования одной капли в секундах (с); С — концентрация определяемого вещества в миллимолях на литр (ммоль/л).
 На основании уравнения Ильковича проводится количественный анализ одним из обычных приемов, применяемых в инструментальных методах: 1. построения калибровочной кривой, 2. сравнения со стандартом, 3. метода добавок.
На основании уравнения Ильковича проводится количественный анализ одним из обычных приемов, применяемых в инструментальных методах: 1. построения калибровочной кривой, 2. сравнения со стандартом, 3. метода добавок.
 Полярографические исследования проводятся на приборах, называемых полярографами. Промышленностью выпускаются полярографы нескольких марок, которые пригодны для выполнения аналитических работ и научных исследований: ПЭ-312, КАП-225 у, ППТ-1 и др.
Полярографические исследования проводятся на приборах, называемых полярографами. Промышленностью выпускаются полярографы нескольких марок, которые пригодны для выполнения аналитических работ и научных исследований: ПЭ-312, КАП-225 у, ППТ-1 и др.
 Полярографический анализ проводят в электролитической ячейке, состоящей из сосуда для электролиза (электролизер), микрокатода, в качестве которого применяют ртутный капельный электрод, и анода, которым может быть ртуть, налитая на дно электролизера, или насыщенный каломельный электрод. Электроды соединяют с источником постоянного тока и затем постепенно повышают напряжение, наблюдая за изменением силы тока.
Полярографический анализ проводят в электролитической ячейке, состоящей из сосуда для электролиза (электролизер), микрокатода, в качестве которого применяют ртутный капельный электрод, и анода, которым может быть ртуть, налитая на дно электролизера, или насыщенный каломельный электрод. Электроды соединяют с источником постоянного тока и затем постепенно повышают напряжение, наблюдая за изменением силы тока.
 Внешний вид современного полярографа
Внешний вид современного полярографа
 Одним из наиболее важных достоинств полярографического метода анализа является возможность одновременного определения нескольких полярографически активных веществ. Полярография находит широкое применение при изучении процессов восстановления и окисления, исследовании качественного и количественного анализа электролитов, изучении кинетики электродных процессов.
Одним из наиболее важных достоинств полярографического метода анализа является возможность одновременного определения нескольких полярографически активных веществ. Полярография находит широкое применение при изучении процессов восстановления и окисления, исследовании качественного и количественного анализа электролитов, изучении кинетики электродных процессов.
 Метод полярографии применяют в фарманализе для количественного определения келлина в порошке и таблетках, никотинамида в растворе для инъекций, пиридоксина гидрохлорида в таблетках и т. д. Метрологические характеристики метода: 1. минимальная концентрация определяемого вещества - 10 -5 М, 2. относительное стандартное отклонение - 10 -2, 3. относительная ошибка - 1 -5 %.
Метод полярографии применяют в фарманализе для количественного определения келлина в порошке и таблетках, никотинамида в растворе для инъекций, пиридоксина гидрохлорида в таблетках и т. д. Метрологические характеристики метода: 1. минимальная концентрация определяемого вещества - 10 -5 М, 2. относительное стандартное отклонение - 10 -2, 3. относительная ошибка - 1 -5 %.
 Метод амперометрического титрования В результате развития полярографического метода анализа был разработан новый физикохимический метод титриметрического анализа, названный методом амперометрического титрования. Метод амперометрического титрования имеет те же теоретические основы, что и метод полярографии. Этот метод основан на измерении значений диффузионного тока, изменяющегося с изменением концентрации определяемого вещества или концентрации титранта.
Метод амперометрического титрования В результате развития полярографического метода анализа был разработан новый физикохимический метод титриметрического анализа, названный методом амперометрического титрования. Метод амперометрического титрования имеет те же теоретические основы, что и метод полярографии. Этот метод основан на измерении значений диффузионного тока, изменяющегося с изменением концентрации определяемого вещества или концентрации титранта.
 При амперометрическом титровании в растворе одновременно идут химическая реакция титрования и электродная реакция с участием титранта. При этом расход вещества в электродной реакции должен быть незначительным по сравнению с реакцией титрования.
При амперометрическом титровании в растворе одновременно идут химическая реакция титрования и электродная реакция с участием титранта. При этом расход вещества в электродной реакции должен быть незначительным по сравнению с реакцией титрования.
 В амперометрии наряду с ртутным капающим электродом, используемым в области отрицательных потенциалов (процессы восстановления), широко применяется вращающийся платиновый микроэлектрод, позволяющий работать при достаточно больших положительных значениях потенциала (от -0, 2 до 1, 2 В) и исследовать процессы окисления.
В амперометрии наряду с ртутным капающим электродом, используемым в области отрицательных потенциалов (процессы восстановления), широко применяется вращающийся платиновый микроэлектрод, позволяющий работать при достаточно больших положительных значениях потенциала (от -0, 2 до 1, 2 В) и исследовать процессы окисления.
 Пример: лекарственный препарат фитин количественно осаждается ионами свинца. На этой реакции основано амперометрическое определение фитина титрованием раствором свинца нитрата. На ртутном капающем электроде на фоне хлорида лития восстанавливаются и фитин (Е 1/2 = -1, 50 В) и ион свинца (Е 1/2 = -0, 43 В). Кривая амперометрического титрования при Е = -0, 80 В приведена на рис. 1. При потенциале -1, 70 В восстанавливается не только ион свинца, но и фитин, имеющий при этом потенциале предельное значение тока.
Пример: лекарственный препарат фитин количественно осаждается ионами свинца. На этой реакции основано амперометрическое определение фитина титрованием раствором свинца нитрата. На ртутном капающем электроде на фоне хлорида лития восстанавливаются и фитин (Е 1/2 = -1, 50 В) и ион свинца (Е 1/2 = -0, 43 В). Кривая амперометрического титрования при Е = -0, 80 В приведена на рис. 1. При потенциале -1, 70 В восстанавливается не только ион свинца, но и фитин, имеющий при этом потенциале предельное значение тока.
 В процессе титрования величина этого тока уменьшается пропорционально уменьшению концентрации фитина и становится практически равной нулю в т. э. После т. э. в растворе появляются избыточные ионы свинца, концентрация которых возрастает по мере добавления титранта, что приводит к возрастанию силы тока.
В процессе титрования величина этого тока уменьшается пропорционально уменьшению концентрации фитина и становится практически равной нулю в т. э. После т. э. в растворе появляются избыточные ионы свинца, концентрация которых возрастает по мере добавления титранта, что приводит к возрастанию силы тока.
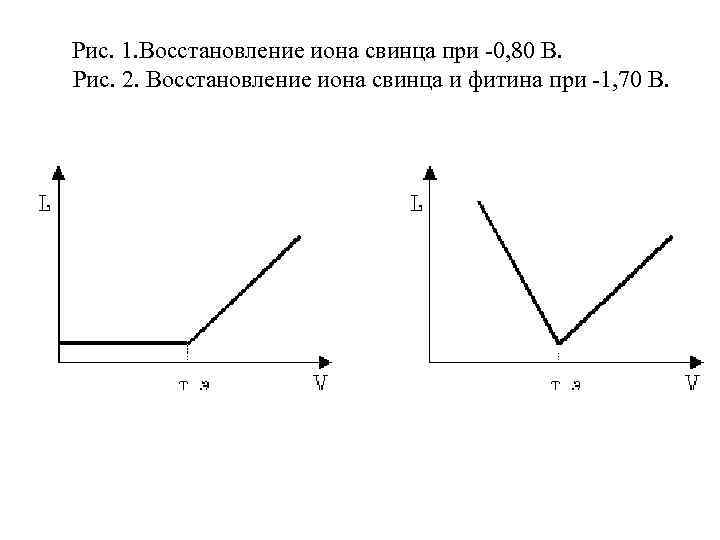 Рис. 1. Восстановление иона свинца при -0, 80 В. Рис. 2. Восстановление иона свинца и фитина при -1, 70 В.
Рис. 1. Восстановление иона свинца при -0, 80 В. Рис. 2. Восстановление иона свинца и фитина при -1, 70 В.
 Амперометрический метод анализа обладает рядом достоинств: 1. высокой чувствительностью – метод позволяет определять очень малые количества вещества (порядка 10 -4 – 10 -5 М); 2. при амперометрическом титровании могут быть использованы реакции осаждения, комплексообразования и окислениявосстановления;
Амперометрический метод анализа обладает рядом достоинств: 1. высокой чувствительностью – метод позволяет определять очень малые количества вещества (порядка 10 -4 – 10 -5 М); 2. при амперометрическом титровании могут быть использованы реакции осаждения, комплексообразования и окислениявосстановления;
 3. наличие посторонних ионов в растворе не мешает проведению титрования при условии, что они не способны к электродной реакции при заданном потенциале (индифферентны) и не вступают в химическую реакцию с реагентом (титрованным раствором); 4. метод является избирательным, т. к. подбором определенной величины потенциала индикаторного электрода можно получить определенную электродную реакцию для анализируемого вещества в присутствии посторонних веществ;
3. наличие посторонних ионов в растворе не мешает проведению титрования при условии, что они не способны к электродной реакции при заданном потенциале (индифферентны) и не вступают в химическую реакцию с реагентом (титрованным раствором); 4. метод является избирательным, т. к. подбором определенной величины потенциала индикаторного электрода можно получить определенную электродную реакцию для анализируемого вещества в присутствии посторонних веществ;
 5. возможность использования различных электродов (стационарных и вращающихся, ртутных и твердых); 6. простота аппаратурного оформления процесса титрования. Амперометрическое титрование применяют при определении разбавленных растворов, для определения неорганических соединений - ионов металлов, а также органических соединений, которые электролитически восстанавливаются на электроде.
5. возможность использования различных электродов (стационарных и вращающихся, ртутных и твердых); 6. простота аппаратурного оформления процесса титрования. Амперометрическое титрование применяют при определении разбавленных растворов, для определения неорганических соединений - ионов металлов, а также органических соединений, которые электролитически восстанавливаются на электроде.
 Инверсионная вольтамперометрия (ИВА) Армин Генрихович Стромберг - создатель и разработчик ИВА, которая дает существенное увеличение чувствительности (до 10 -10 М). Основа метода ИВА состоит в выделении определяемого элемента из очень разбавленного раствора на ртутной капле или тонкой пленке ртути на графитовом электроде или просто на графитовом электроде с помощью электролиза с последующим анодным растворением полученной амальгамы. Процесс накопления происходит при потенциале, соответствующем предельному току.
Инверсионная вольтамперометрия (ИВА) Армин Генрихович Стромберг - создатель и разработчик ИВА, которая дает существенное увеличение чувствительности (до 10 -10 М). Основа метода ИВА состоит в выделении определяемого элемента из очень разбавленного раствора на ртутной капле или тонкой пленке ртути на графитовом электроде или просто на графитовом электроде с помощью электролиза с последующим анодным растворением полученной амальгамы. Процесс накопления происходит при потенциале, соответствующем предельному току.
 Процесс накопления происходит при потенциале, соответствующем предельному току. Зависимость силы тока от напряжения при анодном растворении имеет вид характерного пика (рис. ), глубина которого h пропорциональна концентрации определяемого иона, а потенциал минимума определяется природой иона.
Процесс накопления происходит при потенциале, соответствующем предельному току. Зависимость силы тока от напряжения при анодном растворении имеет вид характерного пика (рис. ), глубина которого h пропорциональна концентрации определяемого иона, а потенциал минимума определяется природой иона.
 Предел обнаружения в методе инверсионной вольтамперометрии на 2 -3 порядка ниже предела обнаружения в обычных полярографических методиках. Чем больше продолжительность накопительного электролиза, тем большее количество металла перейдет из раствора в ртутную каплю, и тем больше возрастет чувствительность анализа.
Предел обнаружения в методе инверсионной вольтамперометрии на 2 -3 порядка ниже предела обнаружения в обычных полярографических методиках. Чем больше продолжительность накопительного электролиза, тем большее количество металла перейдет из раствора в ртутную каплю, и тем больше возрастет чувствительность анализа.
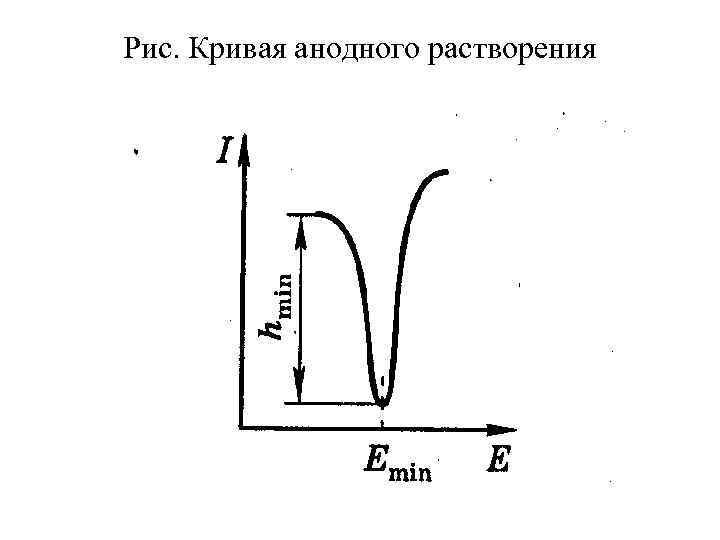 Рис. Кривая анодного растворения
Рис. Кривая анодного растворения
 Внешний вид прибора для инверсионной вольамперометрии «СТА»
Внешний вид прибора для инверсионной вольамперометрии «СТА»
 После накопления на поверхности или в объеме электрода определяемое вещество подвергается электрохимическому превращению (восстановлению или окислению), причем этот процесс можно проводить в разных режимах: 1) Потенциодинамическом (при линейном изменении потенциала электрода во времени инверсионная вольтамперометрия).
После накопления на поверхности или в объеме электрода определяемое вещество подвергается электрохимическому превращению (восстановлению или окислению), причем этот процесс можно проводить в разных режимах: 1) Потенциодинамическом (при линейном изменении потенциала электрода во времени инверсионная вольтамперометрия).
 2) Гальваностатическом (электрохимическое превращение накопленного на электроде вещества при постоянном токе - инверсионная хронопотенциометрия). 3) Потенциостатическом (при постоянном потенциале электрода – инверсионная хроноамперометрия и кулонометрия).
2) Гальваностатическом (электрохимическое превращение накопленного на электроде вещества при постоянном токе - инверсионная хронопотенциометрия). 3) Потенциостатическом (при постоянном потенциале электрода – инверсионная хроноамперометрия и кулонометрия).
 Существенными преимуществами инверсионных электрохимических методов (ИЭАМ) перед другими методами являются: ü возможность определения значительного числа химических элементов Периодической системы и многих органических веществ; ü низкие пределы обнаружения, достигающие для некоторых элементов (Cd, Bi, Tl, Pb, Sb, Ni) и органических веществ 10 -10 М;
Существенными преимуществами инверсионных электрохимических методов (ИЭАМ) перед другими методами являются: ü возможность определения значительного числа химических элементов Периодической системы и многих органических веществ; ü низкие пределы обнаружения, достигающие для некоторых элементов (Cd, Bi, Tl, Pb, Sb, Ni) и органических веществ 10 -10 М;
 ü высокая селективность методов и хорошие метрологические характеристики методик на их основе; ü легкость компьютеризации и автоматизации аналитических определений; ü относительная простота и сравнительная дешевизна приборов для анализа.
ü высокая селективность методов и хорошие метрологические характеристики методик на их основе; ü легкость компьютеризации и автоматизации аналитических определений; ü относительная простота и сравнительная дешевизна приборов для анализа.


