Лекция 31 Аминокислоты.ppt
- Количество слайдов: 18
 Лекция 31. Аминокислоты ► -Аминокислоты получение ► кислотно-основные свойства ► химические свойства ► β- и γ-Аминокислоты ► Аминоаренкарбоновые кислоты ► 1
Лекция 31. Аминокислоты ► -Аминокислоты получение ► кислотно-основные свойства ► химические свойства ► β- и γ-Аминокислоты ► Аминоаренкарбоновые кислоты ► 1
 Большинство природных α-аминокарбоновых кислот являются L-аминокислотами и имеют S-конфигурацию α-Аминокислоты являются основным элементом строения белков. В состав белков входит около 20 различных аминокислот. Часть аминокислот живой организм синтезирует сам, а часть должен принимать в составе пищи. Эти аминокислоты называются незаменимыми. Для организма человека незаменимыми аминокислотами являются: лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин и изолейцин. 2
Большинство природных α-аминокарбоновых кислот являются L-аминокислотами и имеют S-конфигурацию α-Аминокислоты являются основным элементом строения белков. В состав белков входит около 20 различных аминокислот. Часть аминокислот живой организм синтезирует сам, а часть должен принимать в составе пищи. Эти аминокислоты называются незаменимыми. Для организма человека незаменимыми аминокислотами являются: лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин и изолейцин. 2
 Получение α-аминокислот Синтез Штреккера По этому методу сначала из аммиака, альдегидов и синильной кислоты получают α-аминонитрилы, гидролиз которых дает α-аминокислоты. В качестве промежуточных образуются карбенийиммониевые ионы: Синтез Габриэля на базе α-галогенкарбоновых кислот. Как и при синтезе первичных аминов, используют фталимид калия, но его вводят в реакцию с α-галогензамещенными кислотами. 3
Получение α-аминокислот Синтез Штреккера По этому методу сначала из аммиака, альдегидов и синильной кислоты получают α-аминонитрилы, гидролиз которых дает α-аминокислоты. В качестве промежуточных образуются карбенийиммониевые ионы: Синтез Габриэля на базе α-галогенкарбоновых кислот. Как и при синтезе первичных аминов, используют фталимид калия, но его вводят в реакцию с α-галогензамещенными кислотами. 3
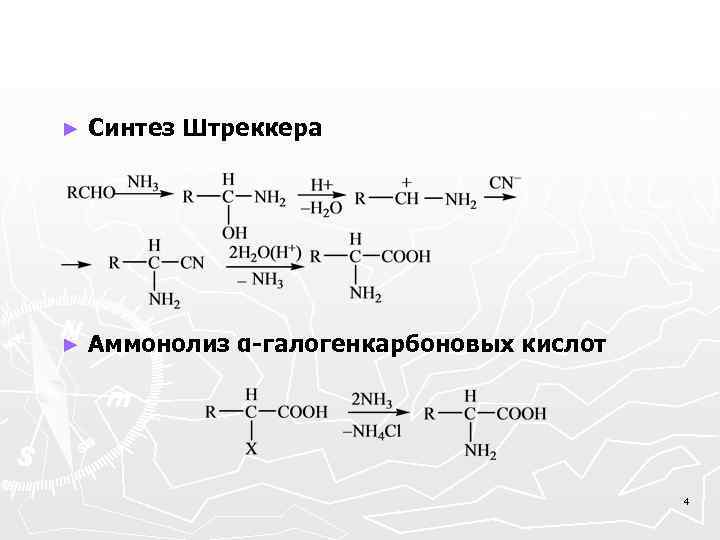 ► Синтез Штреккера ► Аммонолиз α-галогенкарбоновых кислот 4
► Синтез Штреккера ► Аммонолиз α-галогенкарбоновых кислот 4
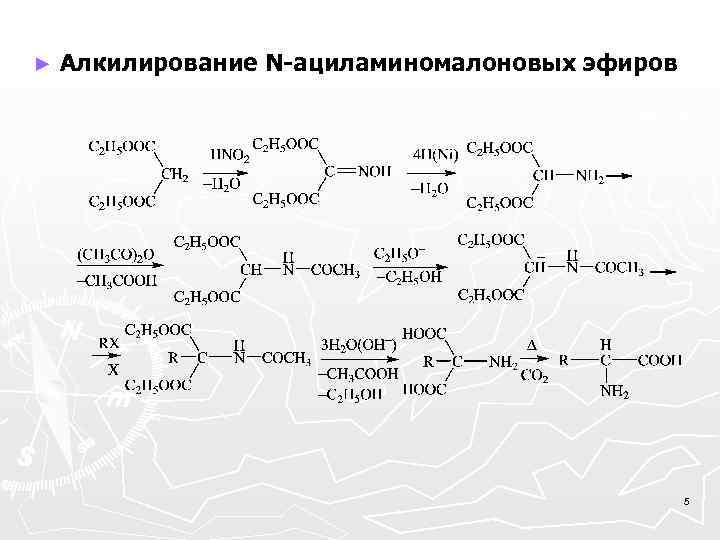 ► Алкилирование N-ациламиномалоновых эфиров 5
► Алкилирование N-ациламиномалоновых эфиров 5
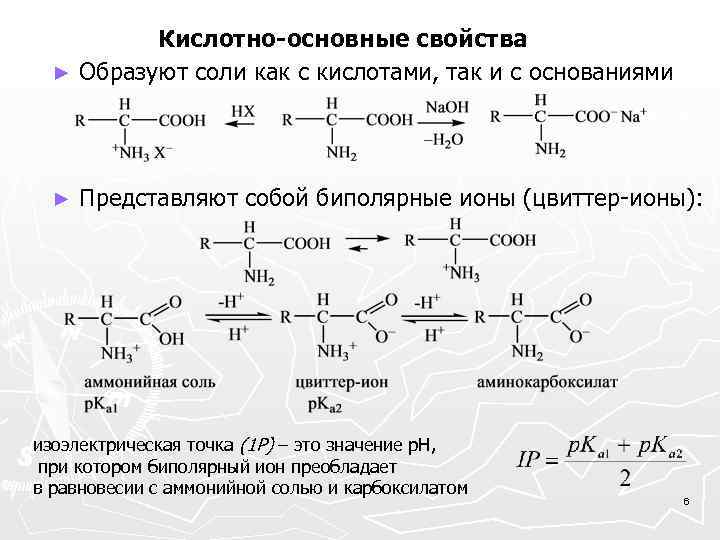 Кислотно-основные свойства ► Образуют соли как с кислотами, так и с основаниями ► Представляют собой биполярные ионы (цвиттер-ионы): изоэлектрическая точка (1 Р) – это значение р. Н, при котором биполярный ион преобладает в равновесии с аммонийной солью и карбоксилатом 6
Кислотно-основные свойства ► Образуют соли как с кислотами, так и с основаниями ► Представляют собой биполярные ионы (цвиттер-ионы): изоэлектрическая точка (1 Р) – это значение р. Н, при котором биполярный ион преобладает в равновесии с аммонийной солью и карбоксилатом 6
 В изоэлектрической точке растворимость α-аминокислоты в воде минимальна. При этом значении р. Н не происходит никакого перемещения биполярных ионов в электрическом поле, в то время как при более низких значениях р. Н наблюдается передвижение к катоду (в виде аммонийной формы), а при более высоких значениях р. Н идет передвижение (в форме карбоксилата) к аноду. Такое поведение аминокислот лежит в основе их разделения с помощью электрофореза. В изоэлектрической точке растворимость αаминокислоты в воде минимальна. 7
В изоэлектрической точке растворимость α-аминокислоты в воде минимальна. При этом значении р. Н не происходит никакого перемещения биполярных ионов в электрическом поле, в то время как при более низких значениях р. Н наблюдается передвижение к катоду (в виде аммонийной формы), а при более высоких значениях р. Н идет передвижение (в форме карбоксилата) к аноду. Такое поведение аминокислот лежит в основе их разделения с помощью электрофореза. В изоэлектрической точке растворимость αаминокислоты в воде минимальна. 7
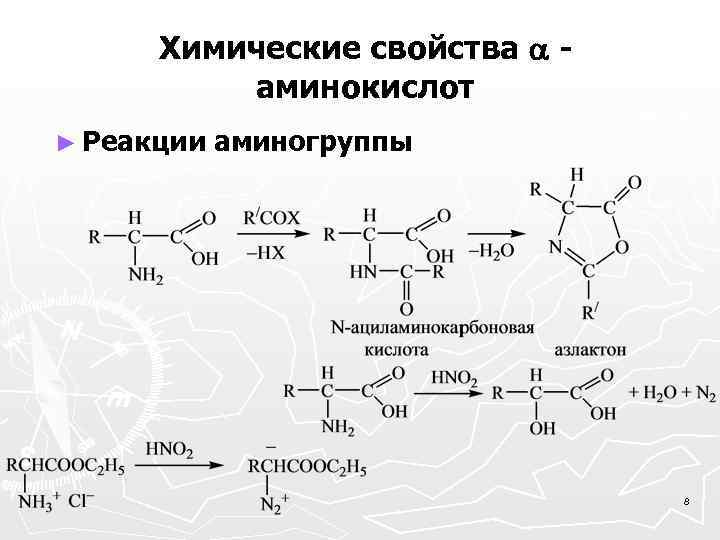 Химические свойства аминокислот ► Реакции аминогруппы 8
Химические свойства аминокислот ► Реакции аминогруппы 8
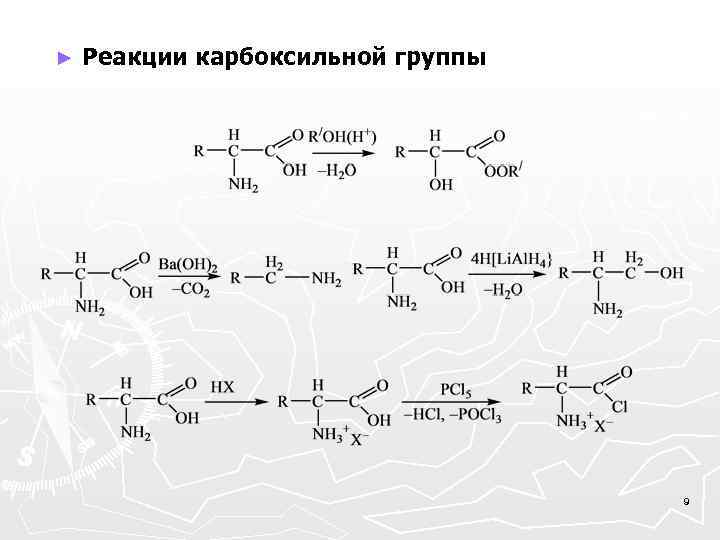 ► Реакции карбоксильной группы 9
► Реакции карбоксильной группы 9
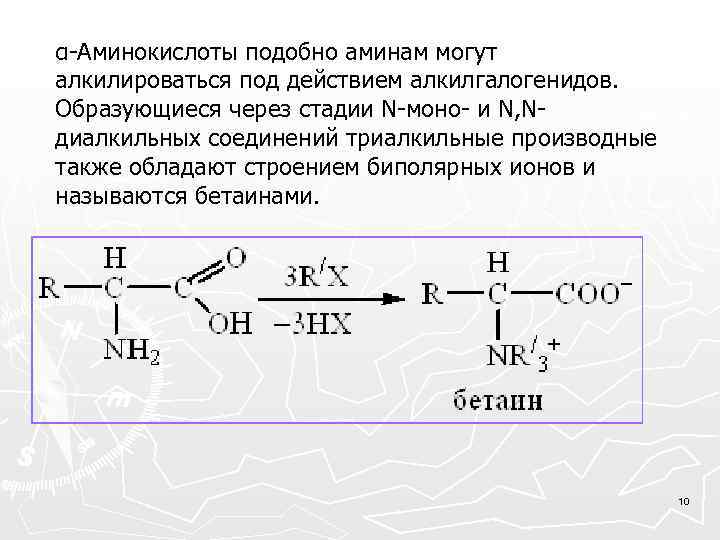 α-Аминокислоты подобно аминам могут алкилироваться под действием алкилгалогенидов. Образующиеся через стадии N-моно- и N, Nдиалкильных соединений триалкильные производные также обладают строением биполярных ионов и называются бетаинами. 10
α-Аминокислоты подобно аминам могут алкилироваться под действием алкилгалогенидов. Образующиеся через стадии N-моно- и N, Nдиалкильных соединений триалкильные производные также обладают строением биполярных ионов и называются бетаинами. 10
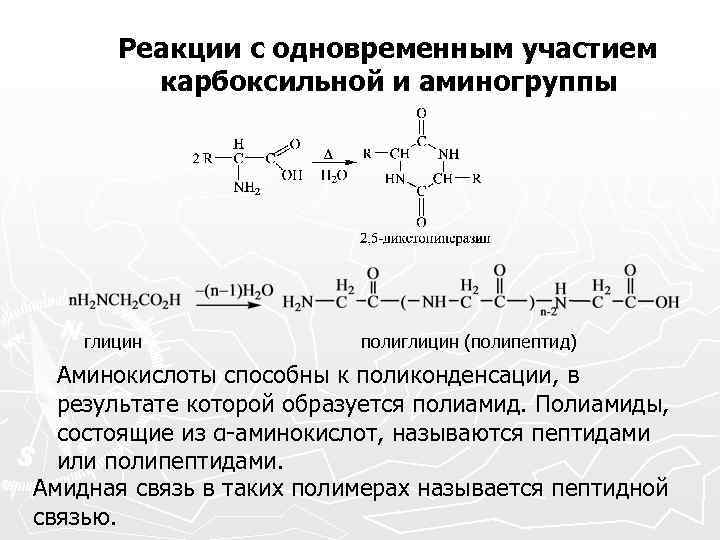 Реакции с одновременным участием карбоксильной и аминогруппы глицин полиглицин (полипептид) Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из α-аминокислот, называются пептидами или полипептидами. Амидная связь в таких полимерах называется пептидной связью.
Реакции с одновременным участием карбоксильной и аминогруппы глицин полиглицин (полипептид) Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из α-аминокислот, называются пептидами или полипептидами. Амидная связь в таких полимерах называется пептидной связью.
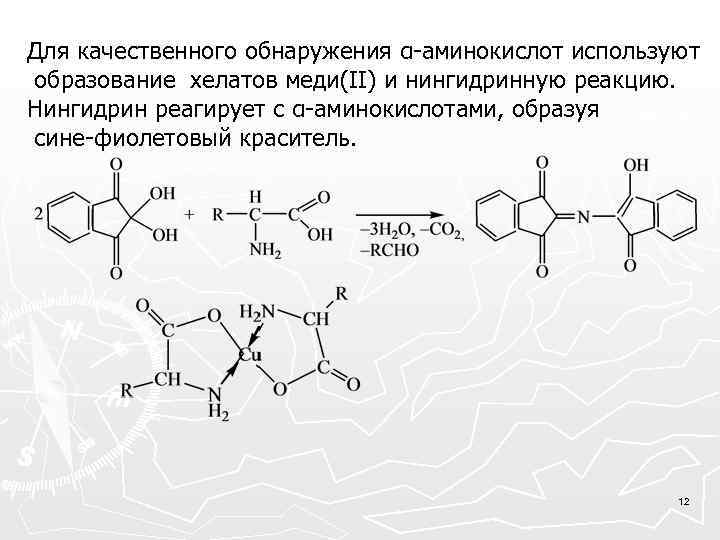 Для качественного обнаружения α-аминокислот используют образование хелатов меди(II) и нингидринную реакцию. Нингидрин реагирует с α-аминокислотами, образуя сине-фиолетовый краситель. 12
Для качественного обнаружения α-аминокислот используют образование хелатов меди(II) и нингидринную реакцию. Нингидрин реагирует с α-аминокислотами, образуя сине-фиолетовый краситель. 12
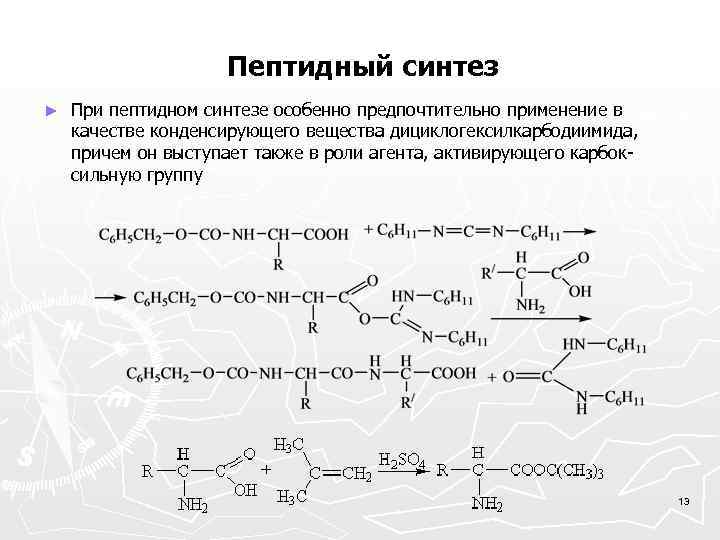 Пептидный синтез ► При пептидном синтезе особенно предпочтительно применение в качестве конденсирующего вещества дициклогексилкарбодиимида, причем он выступает также в роли агента, активирующего карбоксильную группу 13
Пептидный синтез ► При пептидном синтезе особенно предпочтительно применение в качестве конденсирующего вещества дициклогексилкарбодиимида, причем он выступает также в роли агента, активирующего карбоксильную группу 13
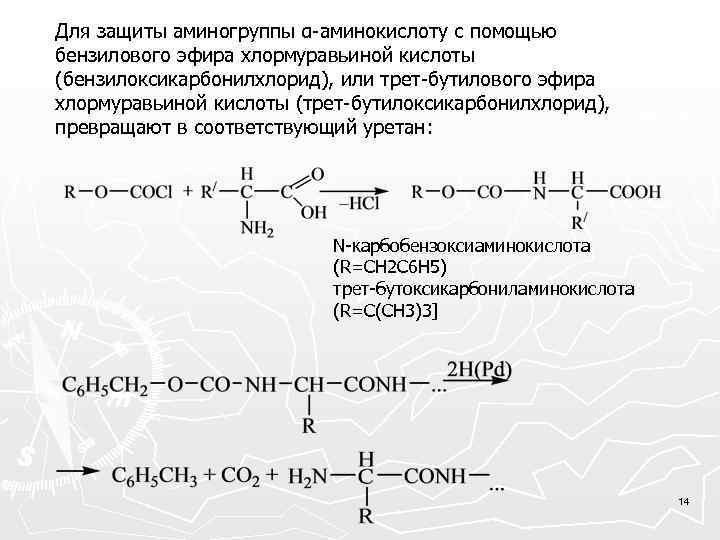 Для защиты аминогруппы α-аминокислоту с помощью бензилового эфира хлормуравьиной кислоты (бензилоксикарбонилхлорид), или трет-бутилового эфира хлормуравьиной кислоты (трет-бутилоксикарбонилхлорид), превращают в соответствующий уретан: N-карбобензоксиаминокислота (R=CH 2 C 6 H 5) трет-бутоксикарбониламинокислота (R=C(CH 3)3] 14
Для защиты аминогруппы α-аминокислоту с помощью бензилового эфира хлормуравьиной кислоты (бензилоксикарбонилхлорид), или трет-бутилового эфира хлормуравьиной кислоты (трет-бутилоксикарбонилхлорид), превращают в соответствующий уретан: N-карбобензоксиаминокислота (R=CH 2 C 6 H 5) трет-бутоксикарбониламинокислота (R=C(CH 3)3] 14
 Тетрапептид аланилсерилглицилвалин (ala-ser-gly-val) имеет в качестве N-концевой аминокислоты аланин, а на С-конце — валин. Это один из 24 тетрамеров, которые можно построить из этих четырех аминокислот. 15
Тетрапептид аланилсерилглицилвалин (ala-ser-gly-val) имеет в качестве N-концевой аминокислоты аланин, а на С-конце — валин. Это один из 24 тетрамеров, которые можно построить из этих четырех аминокислот. 15
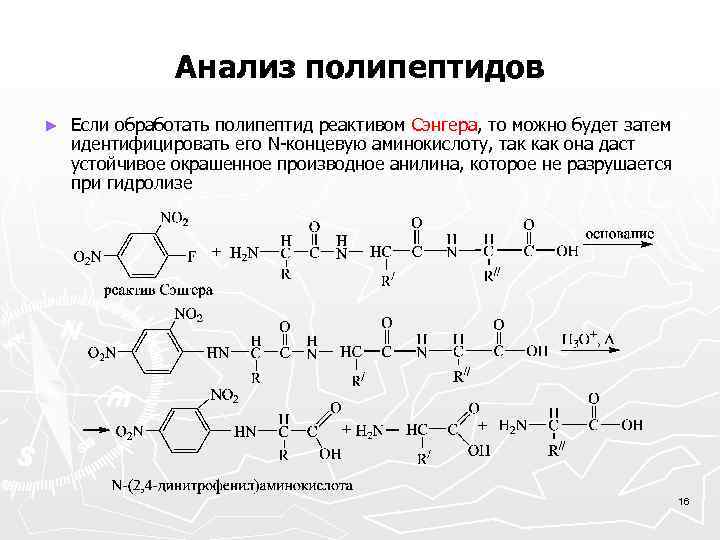 Анализ полипептидов ► Если обработать полипептид реактивом Сэнгера, то можно будет затем идентифицировать его N-концевую аминокислоту, так как она даст устойчивое окрашенное производное анилина, которое не разрушается при гидролизе 16
Анализ полипептидов ► Если обработать полипептид реактивом Сэнгера, то можно будет затем идентифицировать его N-концевую аминокислоту, так как она даст устойчивое окрашенное производное анилина, которое не разрушается при гидролизе 16
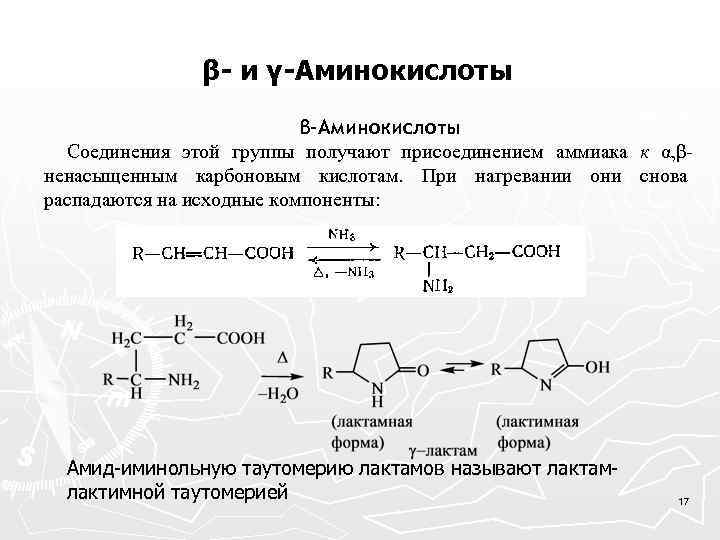 β- и γ-Аминокислоты β-Аминокислоты Соединения этой группы получают присоединением аммиака к α, βненасыщенным карбоновым кислотам. При нагревании они снова распадаются на исходные компоненты: Амид-иминольную таутомерию лактамов называют лактамлактимной таутомерией 17
β- и γ-Аминокислоты β-Аминокислоты Соединения этой группы получают присоединением аммиака к α, βненасыщенным карбоновым кислотам. При нагревании они снова распадаются на исходные компоненты: Амид-иминольную таутомерию лактамов называют лактамлактимной таутомерией 17
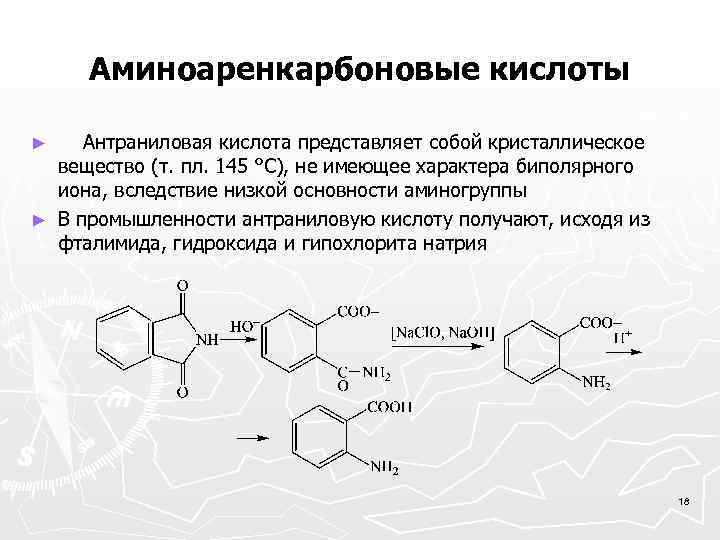 Аминоаренкарбоновые кислоты Антраниловая кислота представляет собой кристаллическое вещество (т. пл. 145 °С), не имеющее характера биполярного иона, вследствие низкой основности аминогруппы ► В промышленности антраниловую кислоту получают, исходя из фталимида, гидроксида и гипохлорита натрия ► 18
Аминоаренкарбоновые кислоты Антраниловая кислота представляет собой кристаллическое вещество (т. пл. 145 °С), не имеющее характера биполярного иона, вследствие низкой основности аминогруппы ► В промышленности антраниловую кислоту получают, исходя из фталимида, гидроксида и гипохлорита натрия ► 18


