 Лекция № 30 Тема: 15 -2 «КОНТРОЛЬ КАЧЕСТВА МИБП. СИСТЕМА КОНТРОЛЯ КАЧЕСТВА МИБП» Учебные вопросы: 1. Система контроля качества МИБП.
Лекция № 30 Тема: 15 -2 «КОНТРОЛЬ КАЧЕСТВА МИБП. СИСТЕМА КОНТРОЛЯ КАЧЕСТВА МИБП» Учебные вопросы: 1. Система контроля качества МИБП.
 Система контроля качества регламентирована в: санитарных правилах СП 3. 3. 2. 015 -94 отраслевом стандарте ОСТ 42 -510 -98
Система контроля качества регламентирована в: санитарных правилах СП 3. 3. 2. 015 -94 отраслевом стандарте ОСТ 42 -510 -98
 Предприятия, выпускающие МИБП, должны иметь: «Аттестат производства» «Сертификат качества»
Предприятия, выпускающие МИБП, должны иметь: «Аттестат производства» «Сертификат качества»
 Инструкции на предприятии: Øдолжностные обязанности персонала; Øпорядок проведения медицинских осмотров персонала; Øправила соблюдения личной и производственной гигиены персонала; Øпорядок проведения подготовки персонала к работе; Øправила приготовления растворов дезинфицирующих средств для обработки перчаток и рук персонала; Øпорядок проведения мойки рук и обработки перчаток и рук дезинфицирующими средствами; Øпорядок проведения контроля степени микробной контаминации персонала; Øпорядок проведения стирки и стерилизации технологической одежды и белья; Øпорядок проведения контроля степени микробной контаминации и ворсоотделения ткани технологической одежды.
Инструкции на предприятии: Øдолжностные обязанности персонала; Øпорядок проведения медицинских осмотров персонала; Øправила соблюдения личной и производственной гигиены персонала; Øпорядок проведения подготовки персонала к работе; Øправила приготовления растворов дезинфицирующих средств для обработки перчаток и рук персонала; Øпорядок проведения мойки рук и обработки перчаток и рук дезинфицирующими средствами; Øпорядок проведения контроля степени микробной контаминации персонала; Øпорядок проведения стирки и стерилизации технологической одежды и белья; Øпорядок проведения контроля степени микробной контаминации и ворсоотделения ткани технологической одежды.
 Классы чистоты — — 1. Класс до 3500 частиц в 1 м 3 размером 0, 5 мкм, при отсутствии живых микроорганизмов; 2. Класс до 350000 частиц в 1 м 3 размером 0, 5 мкм, до 50 живых микроорганизмов в 1 м 3; 3. Класс до 350000 частиц в 1 м 3 размером 0, 5 мкм, до 100 живых микроорганизмов в 1 м 3; 4. Класс до 3500000 частиц в 1 м 3 размером 0, 5 мкм, до 200 живых микроорганизмов в 1 м 3.
Классы чистоты — — 1. Класс до 3500 частиц в 1 м 3 размером 0, 5 мкм, при отсутствии живых микроорганизмов; 2. Класс до 350000 частиц в 1 м 3 размером 0, 5 мкм, до 50 живых микроорганизмов в 1 м 3; 3. Класс до 350000 частиц в 1 м 3 размером 0, 5 мкм, до 100 живых микроорганизмов в 1 м 3; 4. Класс до 3500000 частиц в 1 м 3 размером 0, 5 мкм, до 200 живых микроорганизмов в 1 м 3.
 Перечень контрольных тестов. Типы вакцин № n/п Наименование тестов Живые аттенуированные Инактивированные (фракционированные и нефракционированные) Рекомбинантные (не размножающиеся) 1. Отсутствие контаминации (стерильность) + + + 2. Характеристика клеточного субстрата (при использовании клеточной культуры) + (+) + Характеристика вектора (исследование введенного гена методом нуклеотидного картирования или расщепления энзимами) — — + Отсутствие посторонних вирусов (при использовании посевного вируса и/или клеточного субстрата) + (+) 3. 4.
Перечень контрольных тестов. Типы вакцин № n/п Наименование тестов Живые аттенуированные Инактивированные (фракционированные и нефракционированные) Рекомбинантные (не размножающиеся) 1. Отсутствие контаминации (стерильность) + + + 2. Характеристика клеточного субстрата (при использовании клеточной культуры) + (+) + Характеристика вектора (исследование введенного гена методом нуклеотидного картирования или расщепления энзимами) — — + Отсутствие посторонних вирусов (при использовании посевного вируса и/или клеточного субстрата) + (+) 3. 4.
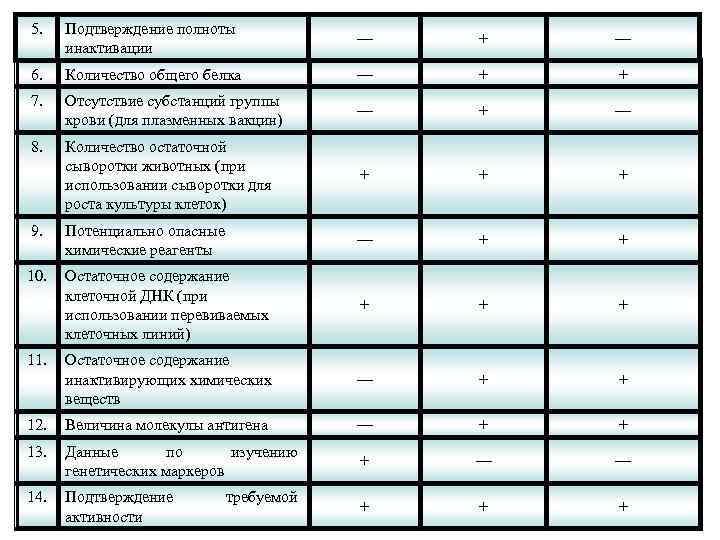 5. Подтверждение полноты инактивации — + — 6. Количество общего белка — + + 7. Отсутствие субстанций группы крови (для плазменных вакцин) — + — 8. Количество остаточной сыворотки животных (при использовании сыворотки для роста культуры клеток) + + + 9. Потенциально опасные химические реагенты — + + 10. Остаточное содержание клеточной ДНК (при использовании перевиваемых клеточных линий) + + + Остаточное содержание инактивирующих химических веществ — + + 12. Величина молекулы антигена — + + 13. Данные по изучению генетических маркеров + — — 14. Подтверждение активности + + + 11. требуемой
5. Подтверждение полноты инактивации — + — 6. Количество общего белка — + + 7. Отсутствие субстанций группы крови (для плазменных вакцин) — + — 8. Количество остаточной сыворотки животных (при использовании сыворотки для роста культуры клеток) + + + 9. Потенциально опасные химические реагенты — + + 10. Остаточное содержание клеточной ДНК (при использовании перевиваемых клеточных линий) + + + Остаточное содержание инактивирующих химических веществ — + + 12. Величина молекулы антигена — + + 13. Данные по изучению генетических маркеров + — — 14. Подтверждение активности + + + 11. требуемой
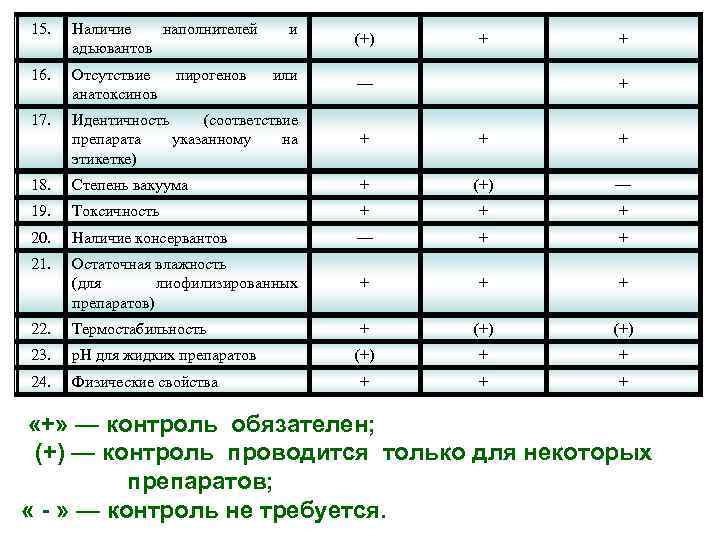 15. Наличие наполнителей адьювантов 16. Отсутствие анатоксинов 17. Идентичность (соответствие препарата указанному на этикетке) + + + 18. Степень вакуума + (+) — 19. Токсичность + + + 20. Наличие консервантов — + + 21. Остаточная влажность (для лиофилизированных препаратов) + + + 22. Термостабильность + (+) 23. р. Н для жидких препаратов (+) + + 24. Физические свойства + + + пирогенов и или (+) + — + + «+» — контроль обязателен; (+) — контроль проводится только для некоторых препаратов; « - » — контроль не требуется.
15. Наличие наполнителей адьювантов 16. Отсутствие анатоксинов 17. Идентичность (соответствие препарата указанному на этикетке) + + + 18. Степень вакуума + (+) — 19. Токсичность + + + 20. Наличие консервантов — + + 21. Остаточная влажность (для лиофилизированных препаратов) + + + 22. Термостабильность + (+) 23. р. Н для жидких препаратов (+) + + 24. Физические свойства + + + пирогенов и или (+) + — + + «+» — контроль обязателен; (+) — контроль проводится только для некоторых препаратов; « - » — контроль не требуется.