лекция 3.ppt
- Количество слайдов: 9
 Лекция 3 Введение в специальность Энергетические состояния и спектры молекул И. М. Белоусова Санкт-Петербург 2011
Лекция 3 Введение в специальность Энергетические состояния и спектры молекул И. М. Белоусова Санкт-Петербург 2011
 Атомы в молекуле Силы, удерживающие атомы в молекуле, вызваны взаимодействием внешних электронов атомов, входящих в состав молекулы Двухатомная молекула Два типа связи Атомная (ковалентная связь) H 2, N 2, C 2 и др. Внешние электроны движутся около обоих ядер. Атомная связь образуется парами электронов, спиновые моменты которых направлены в противоположную сторону Пример: Валентная связь Na. Cl, KBr и др. Электроны разделены на две группы, каждая из которых находится около одного ядра Прочная связь: избыток электронов у одного ядра, недостаток – у другого. Образуются два иона противоположных знаков Кристаллическая структура
Атомы в молекуле Силы, удерживающие атомы в молекуле, вызваны взаимодействием внешних электронов атомов, входящих в состав молекулы Двухатомная молекула Два типа связи Атомная (ковалентная связь) H 2, N 2, C 2 и др. Внешние электроны движутся около обоих ядер. Атомная связь образуется парами электронов, спиновые моменты которых направлены в противоположную сторону Пример: Валентная связь Na. Cl, KBr и др. Электроны разделены на две группы, каждая из которых находится около одного ядра Прочная связь: избыток электронов у одного ядра, недостаток – у другого. Образуются два иона противоположных знаков Кристаллическая структура
 Энергетические состояния и спектры молекул В молекулярных спектрах проявляются закономерности трех типов: а) объединение продольных линий в полосу б) объединение полос в группы в) наличие в спектре нескольких групп полос Группы молекулярных полос Энергия молекулы а) Энергия вращения молекулы как целого → Wвр б) Энергия колебаний ядер атомов, входящих в состав молекулы, около их положения равновесия → Wкол в) Энергия электронной оболочки молекулы → Wэл Полная энергия W = Wвр+ Wкол+ Wэл Частота света, испускаемая молекулой или
Энергетические состояния и спектры молекул В молекулярных спектрах проявляются закономерности трех типов: а) объединение продольных линий в полосу б) объединение полос в группы в) наличие в спектре нескольких групп полос Группы молекулярных полос Энергия молекулы а) Энергия вращения молекулы как целого → Wвр б) Энергия колебаний ядер атомов, входящих в состав молекулы, около их положения равновесия → Wкол в) Энергия электронной оболочки молекулы → Wэл Полная энергия W = Wвр+ Wкол+ Wэл Частота света, испускаемая молекулой или
 Энергетические уровни и колебательные спектры молекул. Двухатомная молекула. В верхней части потенциальной кривой сила взаимодействия отличается от квазиупругой и Wкол= (n+1/2)a - (n+1/2)2 b (2) Колебательные уровни – теснее и теснее, стремясь в пределе к значению Потенциальная кривая двухатомной Wp 0 – диссоциации молекулы и колебательные уровни молекулы Процесс испускания света Обозначим: расстояние между ядрами r соответствует переходу Равновесное состояние: r=r 0 Δn= ± 1 При малых смещениях силу взаимодействия можно считать упругой f= - k(r - r 0) При сближении ядер f положительна – отталкивание Колебательные уровни расположены При удалении ядер f отрицательна – притяжение Полная энергия колебания молекулы сравнительно близко друг от друга Wкол=(n+1/2)a (1) инфракрасная область спектра n= 0, 1, 2 – колебательное квантовое число При отступлении от квазиупругого приведенная масса взаимодействия возможно , где молекулы Δn= -2, -3, -4 и т. д. Тогда: ν=2ν 0; 3ν 0 – “обертоны” m 1, m 2 – массы обоих ядер основной частоты ν 0 Важно: при n=0 Wкол=1/2 a CO Ни при каких условиях ядра в молекуле не могут покоиться, Например, λ 0=4. 67 мкм λ 1=2. 35 мкм они всегда совершают колебания, лишь с разной 4 Обертоны λ 2=1. 58 мкм амплитудой В двухатомной молекуле ядра обоих атомов могут совершать колебания вблизи своих положений равновесия
Энергетические уровни и колебательные спектры молекул. Двухатомная молекула. В верхней части потенциальной кривой сила взаимодействия отличается от квазиупругой и Wкол= (n+1/2)a - (n+1/2)2 b (2) Колебательные уровни – теснее и теснее, стремясь в пределе к значению Потенциальная кривая двухатомной Wp 0 – диссоциации молекулы и колебательные уровни молекулы Процесс испускания света Обозначим: расстояние между ядрами r соответствует переходу Равновесное состояние: r=r 0 Δn= ± 1 При малых смещениях силу взаимодействия можно считать упругой f= - k(r - r 0) При сближении ядер f положительна – отталкивание Колебательные уровни расположены При удалении ядер f отрицательна – притяжение Полная энергия колебания молекулы сравнительно близко друг от друга Wкол=(n+1/2)a (1) инфракрасная область спектра n= 0, 1, 2 – колебательное квантовое число При отступлении от квазиупругого приведенная масса взаимодействия возможно , где молекулы Δn= -2, -3, -4 и т. д. Тогда: ν=2ν 0; 3ν 0 – “обертоны” m 1, m 2 – массы обоих ядер основной частоты ν 0 Важно: при n=0 Wкол=1/2 a CO Ни при каких условиях ядра в молекуле не могут покоиться, Например, λ 0=4. 67 мкм λ 1=2. 35 мкм они всегда совершают колебания, лишь с разной 4 Обертоны λ 2=1. 58 мкм амплитудой В двухатомной молекуле ядра обоих атомов могут совершать колебания вблизи своих положений равновесия
 Электронные уровни молекулы В молекулах, также как и в атомах, электронная оболочка может находиться в определенных энергетических состояниях. Спектр испускания более сложен, чем спектр поглощения. поглощение испускание Возникновение электронноколебательных полос Электронные энергетические уровни Wэл и W'эл Каждому электронному состоянию соответствуют свои колебания ядер Wкол и W'кол При переходе между уровнями двух групп возникают частоты Спектр флюоресценции содержит свет длин волн, равных или больших длины волны возбуждающего света, т. е. спектр испускания сдвинут в красную сторону по отношению к возбуждающему спектру – это правило Стокса Отступление: если часть молекул находится в возбужденном колебательном состоянии (например, с n=3), то или Возникновение полос возможно в спектре флюоресценции а) удовлетворяющих правилам флюоресценции наличие Стокса 5 полос с большими частотами Электронно-колебательный спектр. б) антистоксовые полосы Видимый диапазон спектра
Электронные уровни молекулы В молекулах, также как и в атомах, электронная оболочка может находиться в определенных энергетических состояниях. Спектр испускания более сложен, чем спектр поглощения. поглощение испускание Возникновение электронноколебательных полос Электронные энергетические уровни Wэл и W'эл Каждому электронному состоянию соответствуют свои колебания ядер Wкол и W'кол При переходе между уровнями двух групп возникают частоты Спектр флюоресценции содержит свет длин волн, равных или больших длины волны возбуждающего света, т. е. спектр испускания сдвинут в красную сторону по отношению к возбуждающему спектру – это правило Стокса Отступление: если часть молекул находится в возбужденном колебательном состоянии (например, с n=3), то или Возникновение полос возможно в спектре флюоресценции а) удовлетворяющих правилам флюоресценции наличие Стокса 5 полос с большими частотами Электронно-колебательный спектр. б) антистоксовые полосы Видимый диапазон спектра
 Вращательное движение молекул, вращательные спектры Кроме колебательных движений, молекула совершает вращательные движения По мере увеличения m вращательные уровни располагаются дальше друг от друга Переходы между вращательными уровнями по правилу отбора Δm=± 1 Поглощение Δm=+1; испускание Δm= - 1 Вращательные уровни молекулы (в см-1) Энергия вращения (жесткой) двухатомной молекулы Обозначим , где m'=1, 2, 3 (с уровня m'=0 нет перехода) Частоты излучения для вращательных переходов лежат в далекой инфракрасной области спектра (сотни микрон - мм) где m= 0, 1, 2, 3 и т. д. – Формула (1) приближенная. При больших скоростях вращательное квантовое число вращения молекулы равновесное состояние между ядрами J – момент инерции молекулы увеличивается из-за центробежных сил и формула (1) С
Вращательное движение молекул, вращательные спектры Кроме колебательных движений, молекула совершает вращательные движения По мере увеличения m вращательные уровни располагаются дальше друг от друга Переходы между вращательными уровнями по правилу отбора Δm=± 1 Поглощение Δm=+1; испускание Δm= - 1 Вращательные уровни молекулы (в см-1) Энергия вращения (жесткой) двухатомной молекулы Обозначим , где m'=1, 2, 3 (с уровня m'=0 нет перехода) Частоты излучения для вращательных переходов лежат в далекой инфракрасной области спектра (сотни микрон - мм) где m= 0, 1, 2, 3 и т. д. – Формула (1) приближенная. При больших скоростях вращательное квантовое число вращения молекулы равновесное состояние между ядрами J – момент инерции молекулы увеличивается из-за центробежных сил и формула (1) С
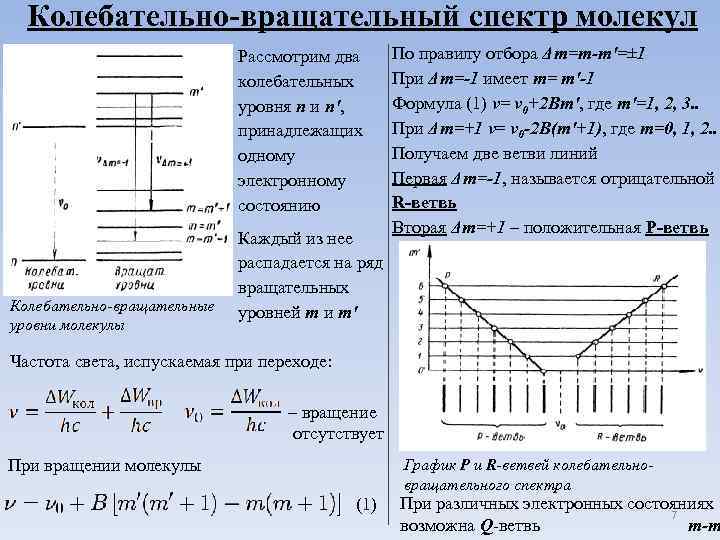 Колебательно-вращательный спектр молекул Рассмотрим два колебательных уровня n и n', принадлежащих одному электронному состоянию Колебательно-вращательные уровни молекулы Каждый из нее распадается на ряд вращательных уровней m и m' По правилу отбора Δm=m-m'=± 1 При Δm=-1 имеет m= m'-1 Формула (1) ν= ν 0+2 Bm', где m'=1, 2, 3. . При Δm=+1 ν= ν 0 -2 B(m'+1), где m=0, 1, 2. . Получаем две ветви линий Первая Δm=-1, называется отрицательной R-ветвь Вторая Δm=+1 – положительная P-ветвь Частота света, испускаемая при переходе: – вращение отсутствует При вращении молекулы График P и R-ветвей колебательновращательного спектра (1) При различных электронных состояниях 7 возможна Q-ветвь m-m
Колебательно-вращательный спектр молекул Рассмотрим два колебательных уровня n и n', принадлежащих одному электронному состоянию Колебательно-вращательные уровни молекулы Каждый из нее распадается на ряд вращательных уровней m и m' По правилу отбора Δm=m-m'=± 1 При Δm=-1 имеет m= m'-1 Формула (1) ν= ν 0+2 Bm', где m'=1, 2, 3. . При Δm=+1 ν= ν 0 -2 B(m'+1), где m=0, 1, 2. . Получаем две ветви линий Первая Δm=-1, называется отрицательной R-ветвь Вторая Δm=+1 – положительная P-ветвь Частота света, испускаемая при переходе: – вращение отсутствует При вращении молекулы График P и R-ветвей колебательновращательного спектра (1) При различных электронных состояниях 7 возможна Q-ветвь m-m
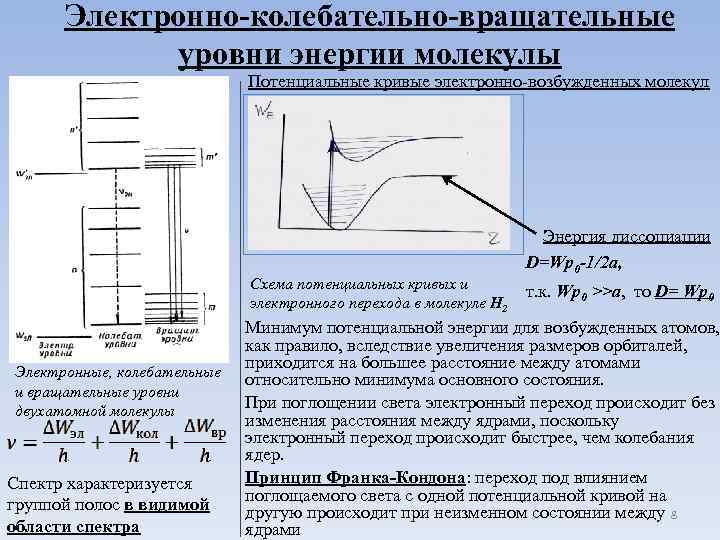 Электронно-колебательно-вращательные уровни энергии молекулы Потенциальные кривые электронно-возбужденных молекул Схема потенциальных кривых и электронного перехода в молекуле H 2 Электронные, колебательные и вращательные уровни двухатомной молекулы Спектр характеризуется группой полос в видимой области спектра Энергия диссоциации D=Wp 0 -1/2 a, т. к. Wp 0 >>a, то D= Wp 0 Минимум потенциальной энергии для возбужденных атомов, как правило, вследствие увеличения размеров орбиталей, приходится на большее расстояние между атомами относительно минимума основного состояния. При поглощении света электронный переход происходит без изменения расстояния между ядрами, поскольку электронный переход происходит быстрее, чем колебания ядер. Принцип Франка-Кондона: переход под влиянием поглощаемого света с одной потенциальной кривой на другую происходит при неизменном состоянии между 8 ядрами
Электронно-колебательно-вращательные уровни энергии молекулы Потенциальные кривые электронно-возбужденных молекул Схема потенциальных кривых и электронного перехода в молекуле H 2 Электронные, колебательные и вращательные уровни двухатомной молекулы Спектр характеризуется группой полос в видимой области спектра Энергия диссоциации D=Wp 0 -1/2 a, т. к. Wp 0 >>a, то D= Wp 0 Минимум потенциальной энергии для возбужденных атомов, как правило, вследствие увеличения размеров орбиталей, приходится на большее расстояние между атомами относительно минимума основного состояния. При поглощении света электронный переход происходит без изменения расстояния между ядрами, поскольку электронный переход происходит быстрее, чем колебания ядер. Принцип Франка-Кондона: переход под влиянием поглощаемого света с одной потенциальной кривой на другую происходит при неизменном состоянии между 8 ядрами
 Электронные состояния двухатомной молекулы Внутренние электроны в молекуле образуют около ядер те же замкнутые оболочки, что и в атомах. Внешние электроны в молекулах движутся в электрическом поле обоих ядер (слайд 1) Это электрическое поле обладает осевой симметрией, ось симметрии прямая, соединяющая оба ядра. В двухатомной молекуле нет орбитального момента электрона, а есть его проекция Plz на ось молекулы Plz=λћ, где λ – квантовое число, равное 0, 1, 2. . Квантовое число λ аналогично квантовому числу me в атомах, определяющему проекцию момента Pl на направление внешнего поля. При каждом λ – два направления проекции на ось. Электронное состояние, соответствующее различным λ, обозначается греческими буквами Значения λ Обозначение 0 σ 1 π 2. . Δ. . Если несколько электронов, то состояние оболочки характеризуется суммарным значением проекций моментов на ось молекулы, т. е. ∑Plz Значение этой суммы определяется квантовым числом Λ Λ=∑ λi Состояние оболочки обозначается: Значение Λ, равное Соответствуют буквы 0 ∑ 1 π 2 Δ Если λ 1=0 и λ 2=0 σ-электроны, то одно состояние ∑, если два π-электрона, то возможно два значения 1 -1=0 и 1+1=2 (Δ-состояние) (∑-состояние) Спиновый момент каждого электрона может принимать два значения Psz=± 1/2ћ Суммарные спиновые моменты обозначаются ∑ Полная сумма проекций: Ω = Λ+∑ Мультиплетность: при каждом Λ квантовое число ∑ может принимать 2∑+1 значений Обозначение состояния электронов в молекуле (2∑+1)Λ Ω Выполняется принцип Паули: в молекуле не может быть больше двух σ-электронов, четырех 9 π-электронов ΔΛ=0, ± 1
Электронные состояния двухатомной молекулы Внутренние электроны в молекуле образуют около ядер те же замкнутые оболочки, что и в атомах. Внешние электроны в молекулах движутся в электрическом поле обоих ядер (слайд 1) Это электрическое поле обладает осевой симметрией, ось симметрии прямая, соединяющая оба ядра. В двухатомной молекуле нет орбитального момента электрона, а есть его проекция Plz на ось молекулы Plz=λћ, где λ – квантовое число, равное 0, 1, 2. . Квантовое число λ аналогично квантовому числу me в атомах, определяющему проекцию момента Pl на направление внешнего поля. При каждом λ – два направления проекции на ось. Электронное состояние, соответствующее различным λ, обозначается греческими буквами Значения λ Обозначение 0 σ 1 π 2. . Δ. . Если несколько электронов, то состояние оболочки характеризуется суммарным значением проекций моментов на ось молекулы, т. е. ∑Plz Значение этой суммы определяется квантовым числом Λ Λ=∑ λi Состояние оболочки обозначается: Значение Λ, равное Соответствуют буквы 0 ∑ 1 π 2 Δ Если λ 1=0 и λ 2=0 σ-электроны, то одно состояние ∑, если два π-электрона, то возможно два значения 1 -1=0 и 1+1=2 (Δ-состояние) (∑-состояние) Спиновый момент каждого электрона может принимать два значения Psz=± 1/2ћ Суммарные спиновые моменты обозначаются ∑ Полная сумма проекций: Ω = Λ+∑ Мультиплетность: при каждом Λ квантовое число ∑ может принимать 2∑+1 значений Обозначение состояния электронов в молекуле (2∑+1)Λ Ω Выполняется принцип Паули: в молекуле не может быть больше двух σ-электронов, четырех 9 π-электронов ΔΛ=0, ± 1


