LECTION 3.ppt
- Количество слайдов: 30

ЛЕКЦИЯ 3. ВОДОРОДОПОДОБНЫЕ АТОМЫ В ТЕОРИИ БОРА 3. 1 Опыты Резефорфорда. Планетарная модель атома

Представление об атомах до XIX в. Представление об атомах как неделимых мельчайших частицах вещества ( «атомос» – неразложимый) возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века, во времена безграничного господства церкви, учение об атомах, будучи материалистическим, естественно, не могло получить признания, а тем более – дальнейшего развития. К началу XVIII в. атомистическая теория приобретает все большую популярность, так к этому времени в работах А. Лавуазье, М. В. Ломоносова и Д. Дальтона была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы по-прежнему считались неделимыми.

Представление об атомах до XX в. Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г. Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. экспериментально было доказано, что электрон является одной из основных составных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.

Модель атома по-Томсону Первая попытка создания модели атома принадлежит Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом R порядка 10 -10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно. Двигаясь ускоренно, электрон излучает электромагнитные волны с частотой , равной частоте колебаний электрона:

Опыты Резерфорда В 1911 г. Э. Резерфорд наблюдал рассеяние -частиц (ядер дважды ионизированного атома He с зарядом q = +2 e и массой m 4 mp), вылетающих со скоростью v = 106 – 107 м/с из контейнера K с радиоактивным веществом. Рассеяние происходило на атомах фольги Ф. Вокруг фольги располагался люминесцентный экран Э из Zn. S. Вспышки на экране регистрировались микроскопом M, положение которого на экране могло быть установлено под любым углом . В опытах подсчитывалось число -частиц, рассеянных под разными углами.

Опыты Резерфорда Резерфорд, исследуя прохождение -частиц через золотую фольгу толщиной примерно 1 мкм, показал, что основная их часть испытывает незначительные отклонения, но некоторые -частицы (примерно 1 из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как -частицы, то Резерфордом был сделан вывод, что значительное отклонение -частиц обусловлено их взаимодействием с положительным зарядом большой массы.

Опыты Резерфорда Однако значительное отклонение испытывают лишь немногие -частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. Рассеяние альфа-частицы в атоме Томсона (а) и в атоме Резерфорда (b)

Опыты Резерфорда Наименьшее расстояние, на которое частица подлетает к ядру с зарядом Ze можно найти из закона сохранения энергии: в то время как размеры атома ~ 10 -10 м. Таким образом, частицы проникают внутрь атома (чего не может быть в модели Томсона).
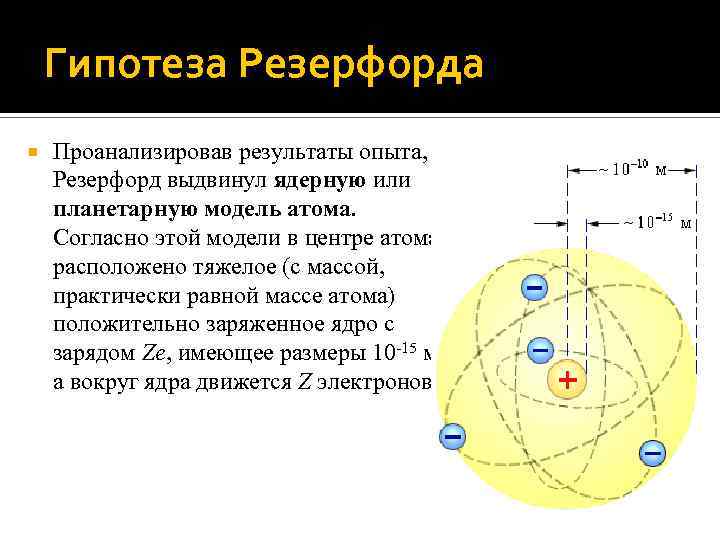
Гипотеза Резерфорда Проанализировав результаты опыта, Резерфорд выдвинул ядерную или планетарную модель атома. Согласно этой модели в центре атома расположено тяжелое (с массой, практически равной массе атома) положительно заряженное ядро с зарядом Ze, имеющее размеры 10 -15 м, а вокруг ядра движется Z электронов.

Несостоятельность теории Резерфорда Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид: где Ze – заряд ядра, e – заряд электрона, r – расстояние между электроном и ядром, m – масса электрона, v – скорость электрона. В уравнении 2 неизвестных v и r, следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Электрон, двигаясь ускоренно, излучает эту энергию непрерывно, поэтому спектры излучения атомов должны быть сплошными. В действительности, они имеют линейчатый спектр.

Несостоятельность теории Резерфорда По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10 -8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.

ЛЕКЦИЯ 3. ВОДОРОДОПОДОБНЫЕ АТОМЫ В ТЕОРИИ БОРА 3. 2 Постулаты Бора

Постулаты Бора Следующий шаг в развитии представлений об устройстве атома сделал в 1913 г. выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.

Постулаты Бора Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса L = mvr, удовлетворяющие условию

Постулаты Бора Второй постулат Бора (правило частот) гласит: при переходе электрона с одной орбиты на другую излучается (поглощается) один фотон с энергией, равной разности энергий электрона на этих орбитах: (здесь n и m – номера орбит или номера стационарных состояний атома). Набор возможных (дискретных) частот (или длин волн ) определяет линейчатый спектр излучения (поглощения) атомов.

Водородоподобные системы Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящих из ядра с зарядом Ze и одного электрона.

Радиусы орбит электрона в атоме Объединим уравнение второго закона Ньютона для вращения электрона по стационарной орбите и формулу квантования момента импульса электрона и найдем радиусы допустимых стационарных орбит: Здесь r 1 – первый боровский радиус – радиус первой орбиты электрона в атоме водорода.

Энергия электрона в водородоподобном атоме Полная энергия E электрона, движущегося по n-й стационарной орбите, складывается из его кинетической энергии и потенциальной энергии кулоновского взаимодействия (притяжения) электрона с ядром Отсюда получаем формулу квантования энергии электрона в водородоподобном атоме:

Формула Бальмера. Спектральные серии Используя третий постулат Бора, получим выражение для всех частот излучения водородоподобного атома, совпадающее с экспериментально полученной ранее Бальмером формулой: Здесь R – постоянная Ридберга. Известны следующие серии (совокупность переходов электрона на орбиту с данным номером n) в спектре излучения водородоподобных атомов: серия Лаймана (n = 1, k = 2, 3, 4, …; УФ-излучение); серия Бальмера (n = 2, k = 3, 4, 5, …; видимый свет); серия Пашена (n = 3, k = 4, 5, 6, …; ИКизлучение); серия Брэккета (n = 4, k = 5, 6, 7, …; ИК-излучение) и другие.
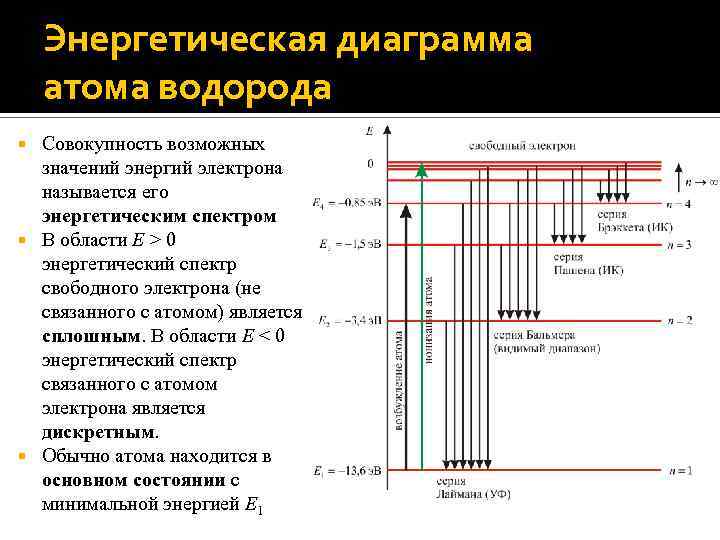
Энергетическая диаграмма атома водорода Совокупность возможных значений энергий электрона называется его энергетическим спектром В области E > 0 энергетический спектр свободного электрона (не связанного с атомом) является сплошным. В области E < 0 энергетический спектр связанного с атомом электрона является дискретным. Обычно атома находится в основном состоянии с минимальной энергией E 1
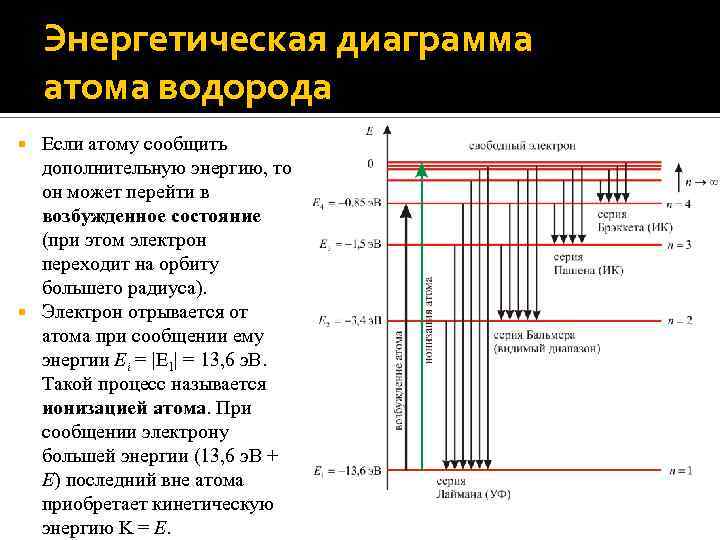
Энергетическая диаграмма атома водорода Если атому сообщить дополнительную энергию, то он может перейти в возбужденное состояние (при этом электрон переходит на орбиту большего радиуса). Электрон отрывается от атома при сообщении ему энергии Ei = |E 1| = 13, 6 э. В. Такой процесс называется ионизацией атома. При сообщении электрону большей энергии (13, 6 э. В + E) последний вне атома приобретает кинетическую энергию = E.

ЛЕКЦИЯ 3. ВОДОРОДОПОДОБНЫЕ АТОМЫ В ТЕОРИИ БОРА 3. 3 Опыты Франка – Герца

Опыты Франка – Герца (1913 г. ) В трубке с горячим катодом K, (питание катода осуществляется от батареи) с сеткой C и анодом A находятся пары ртути под низким давлением при температуре 150 С. Между катодом и сеткой приложена ускоряющая разность потенциалов (катод имеет отрицательный потенциал, сетка – положительный), которую можно менять в пределах от 0 до 60 В. Между анодом и сеткой создается небольшое замедляющее поле с разностью потенциалов 0, 5 В (электроны, имеющие кинетическую энергию, меньшую чем 0, 5 э. В, тормозятся и, не долетая анода, остаются на сетке). Очень чувствительный гальванометр G, включенный последовательно в цепь анода, служит для измерения анодного тока (~ 10 -9 A).

Вольтамперная характеристика Оказалось, что с увеличением ускоряющей разности потенциалов UКС, как и в любой электронной лампе, анодный ток возрастает, однако не монотонно: рост анодного тока сопровождается резкими спадами тока каждый раз, когда ускоряющая разность потенциалов увеличивается до 4, 9 В. Объяснение такой зависимости можно дать, рассмотрев поведение электронов, испускаемых катодом.

Структура атома ртути: связанные и внешние электроны В тяжелых атомах ртути довольно трудно удалить электроны с внутренних оболочек из-за сильного кулоновского притяжения ядер. Энергии таких электронов достигают 103 – 104 э. В. Внешние (валентные) электроны защищены от ядра экранирующим действием электронов, расположенных на внутренних оболочках. Поэтому энергия связи таких электронов составляет только несколько э. В. В опытах Франка и Герца принимают участие только такие – внешние электроны. Энергетические уровни внешних электронов называются оптическими уровнями, так как при любых переходах между ними поглощаются или испускаются фотоны, длины волн которых соответствуют видимой и соседним частям спектра.
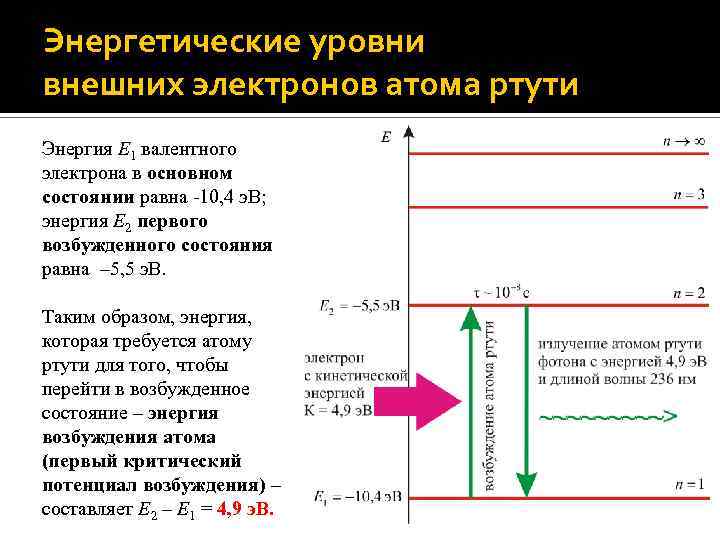
Энергетические уровни внешних электронов атома ртути Энергия E 1 валентного электрона в основном состоянии равна -10, 4 э. В; энергия E 2 первого возбужденного состояния равна – 5, 5 э. В. Таким образом, энергия, которая требуется атому ртути для того, чтобы перейти в возбужденное состояние – энергия возбуждения атома (первый критический потенциал возбуждения) – составляет E 2 – E 1 = 4, 9 э. В.
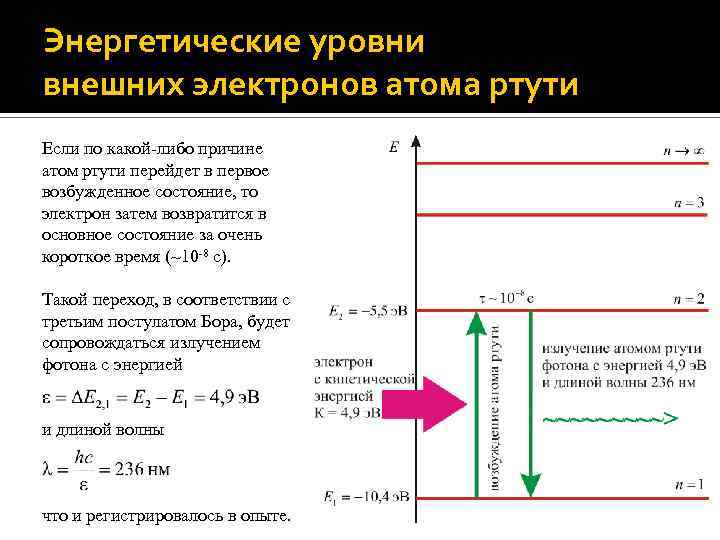
Энергетические уровни внешних электронов атома ртути Если по какой-либо причине атом ртути перейдет в первое возбужденное состояние, то электрон затем возвратится в основное состояние за очень короткое время (~10 -8 с). Такой переход, в соответствии с третьим постулатом Бора, будет сопровождаться излучением фотона с энергией и длиной волны что и регистрировалось в опыте.

Объяснение ВАХ Рассмотрим случай, когда пучок электронов, ускоренный разностью потенциалов менее 4, 9 В, проходит через пары ртути. В этом случае кинетическая энергия электронов меньше 4, 9 э. В и столкновения таких электронов с атомами ртути будут упругими. Значение кинетической энергии электрона практически не меняется (из-за соотношения масс электрона и атома ртути), и электрон до полной остановки испытывает значительное количество упругих столкновений, двигаясь при этом по зигзагообразной траектории. При этом его оставшейся кинетической энергии достаточно, чтобы преодолеть слабое задерживающее электрическое поле (0, 5 В), между сеткой и анодом. Таким образом, в результате упругих столкновений электронов с атомами ртути, электроны, попадая на анод, вызывают анодный ток. При увеличении ускоряющего напряжения от 0 до 4, 9 В анодный ток растет, поскольку увеличивается число электронов, достигающих анода в единицу времени.

Объяснение ВАХ Однако при увеличении ускоряющей разности потенциалов до значения, превышающего 4, 9 В, кинетическая энергия электрона превышает значение 4, 9 э. В, и оказываются возможными неупругие столкновения, сопровождающиеся передачей части его кинетической энергии атому ртути с переходом электрона в атоме ртути из основного состояния в первое возбужденное состояние с энергией E 2. Кинетическая энергия электрона после неупругого столкновения равна = – 4, 9 э. В. Если она мало отличается от значения 4, 9 э. В, то ее недостаточно для преодоления задерживающего поля, созданного между сеткой и анодом: электрон остается на сетке, не достигая анода, что приводит к спаду анодного тока. Если ускоряющее напряжение увеличить еще на 4, 9 В, то электроны могут испытать еще одно неупругое столкновение и потерять при этом полностью всю свою энергию. Это объясняет второй спад силы анодного тока на кривой. Третий спад соответствует электронам, которые успели испытать три неупругих столкновения, и т. д. Каждый раз, когда происходит неупругое столкновение, атом ртути переходит в возбужденное состояние и затем, возвращаясь в основное состояние, излучает фотон.

Недостатки теории Бора 1. Теория Бора основана на постулатах – утверждениях, которые основаны только на опытных данных и принимаемых без доказательств. 2. Теория является полуквантовой/полуклассической, поскольку для расчета возможных значений радиусов орбит электрона и спектра его энергии применяются как классическое уравнение второго закона Ньютона, так и условие квантования момента импульса. 3. Теория Бора не позволяет объяснить характер спектров следующего за водородом атома – гелия (хотя он является самым простым после водорода!). 4. С помощью теории Бора невозможно вычислить интенсивности излучения, соответствующего различным переходам электрона в атоме.
LECTION 3.ppt