введение в иммунологию(19ноя2014).ppt
- Количество слайдов: 156
Лекция 3 В-клеточный иммунный ответ Габибов А. Г.

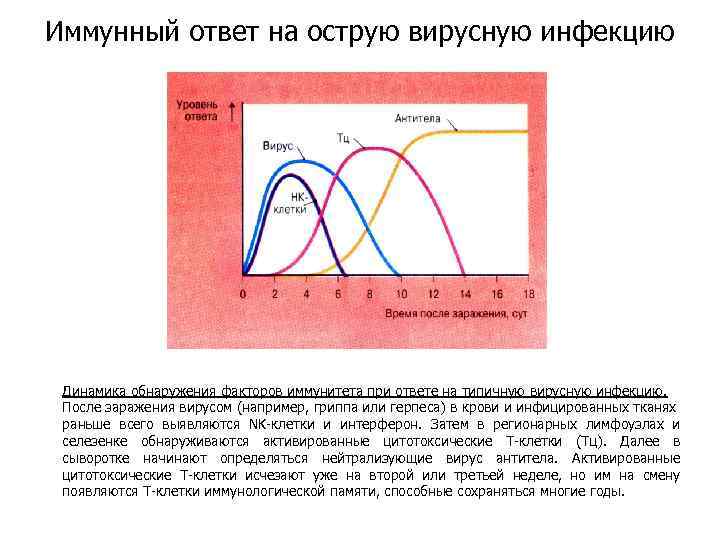
Иммунный ответ на острую вирусную инфекцию Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и инфицированных тканях раньше всего выявляются NK-клетки и интерферон. Затем в регионарных лимфоузлах и селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). Далее в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.





Гуморальный иммунный ответ
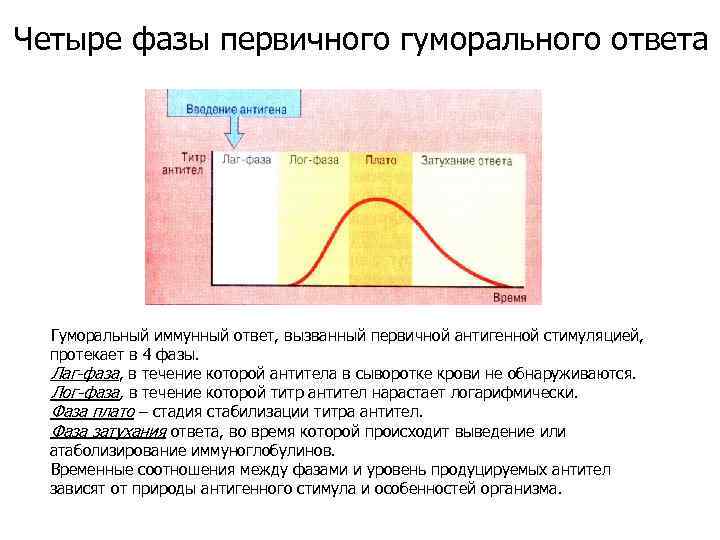
Четыре фазы первичного гуморального ответа Гуморальный иммунный ответ, вызванный первичной антигенной стимуляцией, протекает в 4 фазы. Лаг-фаза, в течение которой антитела в сыворотке крови не обнаруживаются. Лог-фаза, в течение которой титр антител нарастает логарифмически. Фаза плато – стадия стабилизации титра антител. Фаза затухания ответа, во время которой происходит выведение или атаболизирование иммуноглобулинов. Временные соотношения между фазами и уровень продуцируемых антител зависят от природы антигенного стимула и особенностей организма.
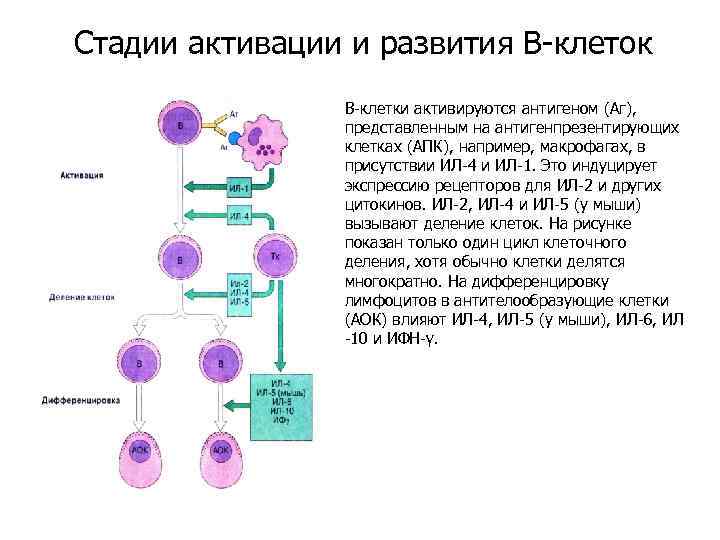
Стадии активации и развития В-клеток В-клетки активируются антигеном (Аг), представленным на антигенпрезентирующих клетках (АПК), например, макрофагах, в присутствии ИЛ-4 и ИЛ-1. Это индуцирует экспрессию рецепторов для ИЛ-2 и других цитокинов. ИЛ-2, ИЛ-4 и ИЛ-5 (у мыши) вызывают деление клеток. На рисунке показан только один цикл клеточного деления, хотя обычно клетки делятся многократно. На дифференцировку лимфоцитов в антителообразующие клетки (АОК) влияют ИЛ-4, ИЛ-5 (у мыши), ИЛ-6, ИЛ -10 и ИФН-γ.
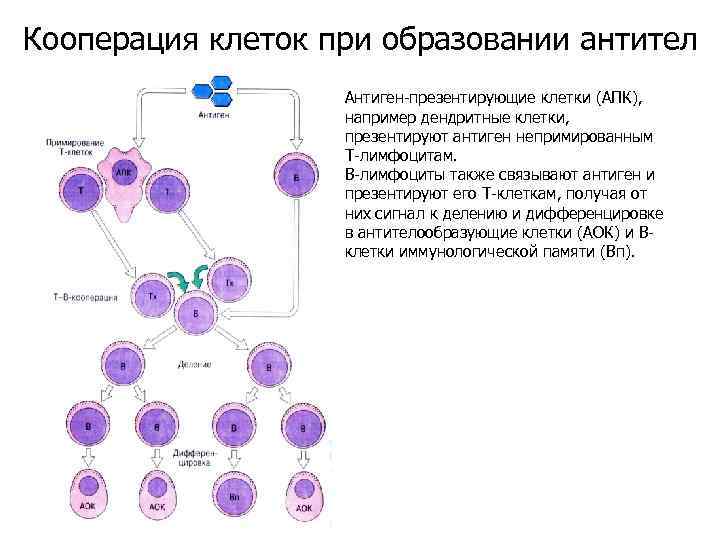
Кооперация клеток при образовании антител Антиген-презентирующие клетки (АПК), например дендритные клетки, презентируют антиген непримированным Т-лимфоцитам. В-лимфоциты также связывают антиген и презентируют его Т-клеткам, получая от них сигнал к делению и дифференцировке в антителообразующие клетки (АОК) и Вклетки иммунологической памяти (Вп).
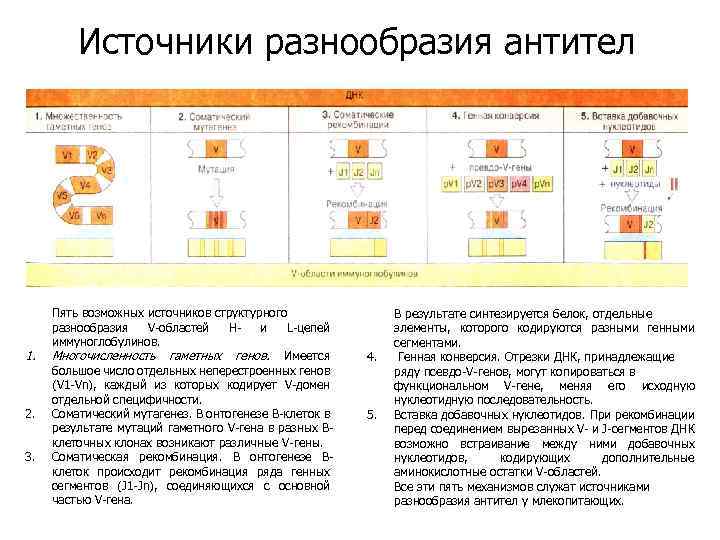
Источники разнообразия антител 1. 2. 3. Пять возможных источников структурного разнообразия V-областей Ни L-цепей иммуноглобулинов. Многочисленность гаметных генов. Имеется большое число отдельных неперестроенных генов (V 1 -Vn), каждый из которых кодирует V-домен отдельной специфичности. Соматический мутагенез. В онтогенезе В-клеток в результате мутаций гаметного V-гена в разных Вклеточных клонах возникают различные V-гены. Соматическая рекомбинация. В онтогенезе Вклеток происходит рекомбинация ряда генных сегментов (J 1 -Jn), соединяющихся с основной частью V-гена. 4. 5. В результате синтезируется белок, отдельные элементы, которого кодируются разными генными сегментами. Генная конверсия. Отрезки ДНК, принадлежащие ряду псевдо-V-генов, могут копироваться в функциональном V-гене, меняя его исходную нуклеотидную последовательность. Вставка добавочных нуклеотидов. При рекомбинации перед соединением вырезанных V- и J-сегментов ДНК возможно встраивание между ними добавочных нуклеотидов, кодирующих дополнительные аминокислотные остатки V-областей. Все эти пять механизмов служат источниками разнообразия антител у млекопитающих.
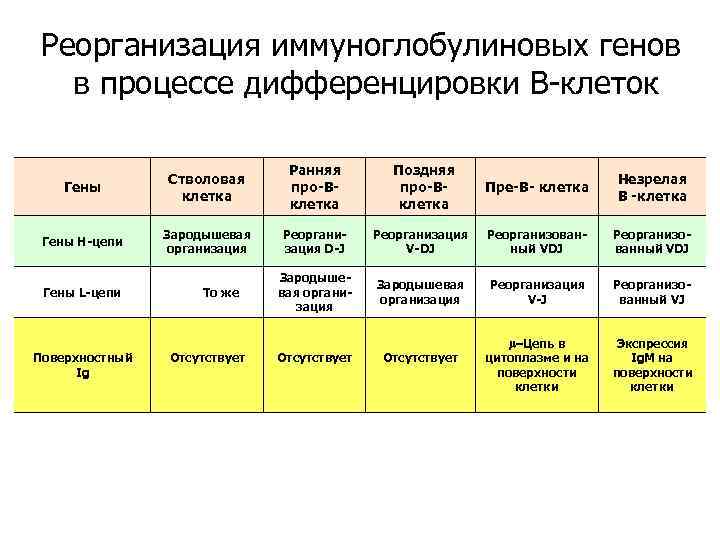
Реорганизация иммуноглобулиновых генов в процессе дифференцировки В-клеток Гены Стволовая клетка Ранняя про-Вклетка Гены Н-цепи Зародышевая организация Реорганизация D-J Зародышевая организация Гены L-цепи Поверхностный Ig То же Отсутствует Поздняя про-Вклетка Пре-В- клетка Незрелая В -клетка Реорганизация V-DJ Реорганизованный VDJ Зародышевая организация Реорганизация V-J Реорганизованный VJ -Цепь в цитоплазме и на поверхности клетки Экспрессия Ig. M на поверхности клетки Отсутствует
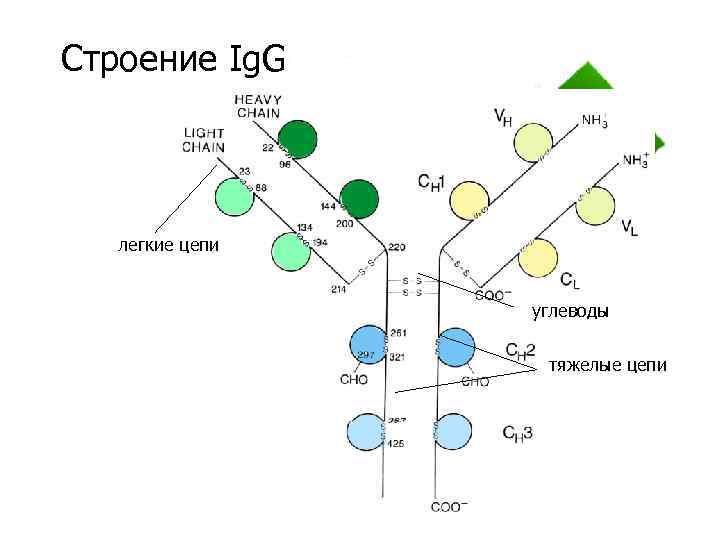
Строение Ig. G легкие цепи углеводы тяжелые цепи


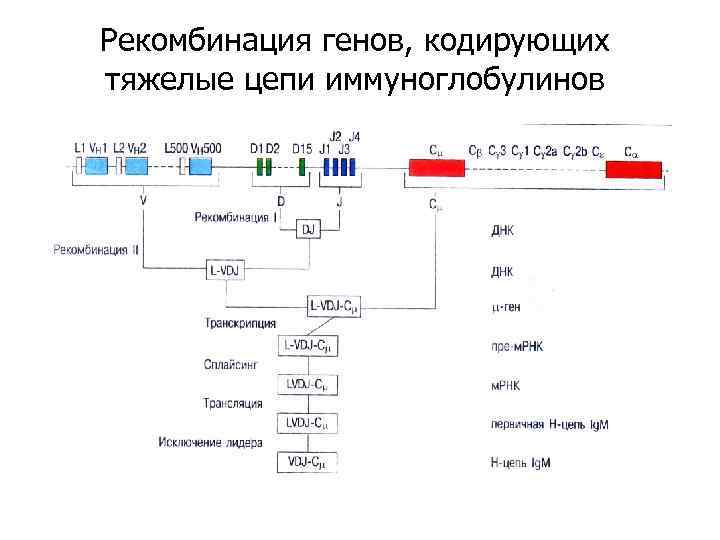
Рекомбинация генов, кодирующих тяжелые цепи иммуноглобулинов

Рекомбинация генов, кодирующих k-цепи иммуноглобулинов В некоммитированной В-клетке гены, кодирующие k-цепь иммуноглобу-линов, отделены в ДНК значительным расстоянием. Процесс рекомбинации начинается с объединения одного из Vkгенов (Vk 2) с одним из J-мини-генов (J 4). В результате формируется k-локус, контролирующий незрелую пре-м. РНК ядра. При созревании такой РНК происходит слияние (сплайсинг) VJ с Сkгеном за счет делеции некодируемой последовательности нуклеотидов. Зрелая м. РНК представляет собой единый информационный участок (LVk 2 J 4 Ck), транслирующий первичную к-цепь. При созревании k-цепи лидерная последовательность аминокислотных остатков (L) удаляется, что и приводит, наконец, к формированию полноценной k -цепи
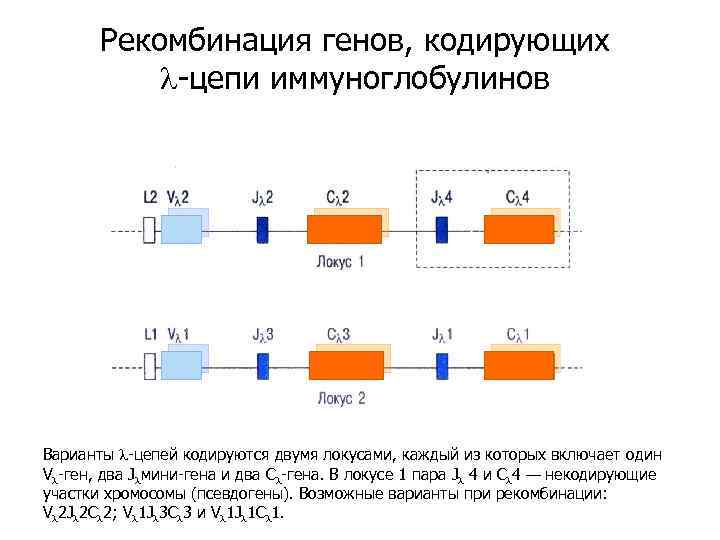
Рекомбинация генов, кодирующих l-цепи иммуноглобулинов Варианты l-цепей кодируются двумя локусами, каждый из которых включает один Vl-ген, два Jlмини-гена и два Сl-гена. В локусе 1 пара Jl 4 и Сl 4 — некодирующие участки хромосомы (псевдогены). Возможные варианты при рекомбинации: Vl 2 Jl 2 Cl 2; Vl 1 Jl 3 Cl 3 и Vl 1 Jl 1 Cl 1.

Классы и подклассы иммуноглобулинов у человека. Классы и подклассы Ig. G 1 Типы цепей Н L 1 c, l Ig. G 2 2 c, l Ig. G 3 3 c, l Ig. G 4 4 c, l Ig. A 1 1 c, l Ig. A 2 2 c, l Ig. D d c<l Ig. E e c, l Ig. M c, l

Биологическое значение синтеза иммуноглобулинов разных классов Ig. D Первичное распознавание свободного АГ, участие в активации В-лимфоцитов, участие в презентации АГ Т-лимфоцитам m. Ig. М Первичное распознавание свободного АГ, участие в регуляции пула зрелых В-клеток, модулирующая роль в активации В-лимфоцитов, участие в презентации АГ Т-лимфоцитам Ig. М Нейтрализация инфекционных свойств патогенов; элиминация антигена в корпускулярной форме из кровотока с участием комплемента; элиминация антигена путем его присоединения к поверхности эритроцитов с последующим фагоцитозом; регуляция процессов дифференцировки Т-лимфоцитов и ЕК Ig. G 1 -3 Элиминация антигена из кровотока, ЦНС: в молекулярной форформе – с участием фагоцитов, в корпускулярной форме - с участием комплемента; нейтрализация инфекционных свойств патогенов, включая вирусы; обеспечение плацентарного иммунитета; реализация антителозависимой цитотоксичности Ig. А Формирование барьера на поверхности слизистых оболочек для проникновения антигенов во внутренние среды организма, нейтрализация инфекционных свойств патогенов, в т. ч. вирусов Ig. E, G 4 Формирование тканевого барьера для распространения антигенов по организму, нейтрализация инфекционных свойств патогенов, в т. ч. гельминтов и вирусов; развитие воспаления и шока
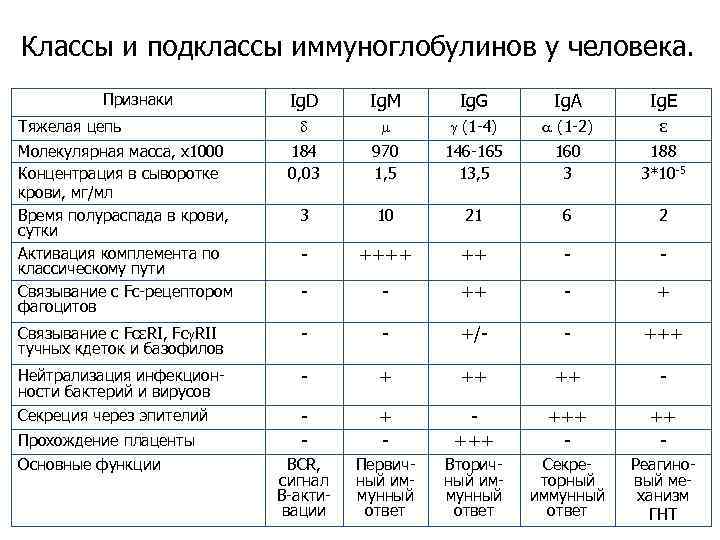
Классы и подклассы иммуноглобулинов у человека. Ig. D Ig. M Ig. G Ig. A Ig. E (1 -4) (1 -2) ε Молекулярная масса, х1000 Концентрация в сыворотке крови, мг/мл Время полураспада в крови, сутки Активация комплемента по классическому пути Связывание с Fc-рецептором фагоцитов 184 0, 03 970 1, 5 146 -165 13, 5 160 3 188 3*10 -5 3 10 21 6 2 - ++++ ++ - - ++ - + Связывание с FcεRI, Fc RII тучных кдеток и базофилов - - +/- - +++ Нейтрализация инфекционности бактерий и вирусов - + ++ ++ - Секреция через эпителий - +++ +++ - ВСR, cигнал В-активации Первичный иммунный ответ Вторичный иммунный ответ Секреторный иммунный ответ Реагиновый механизм ГНТ Признаки Тяжелая цепь Прохождение плаценты Основные функции
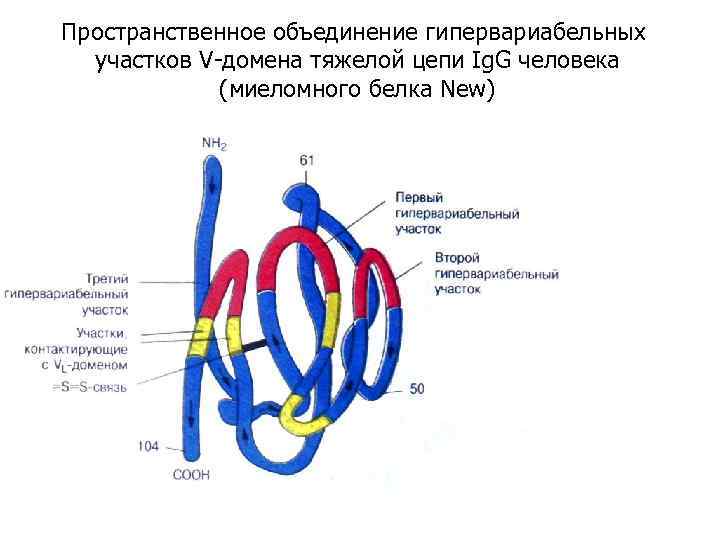
Пространственное объединение гипервариабельных участков V-домена тяжелой цепи Ig. G человека (миеломного белка New)
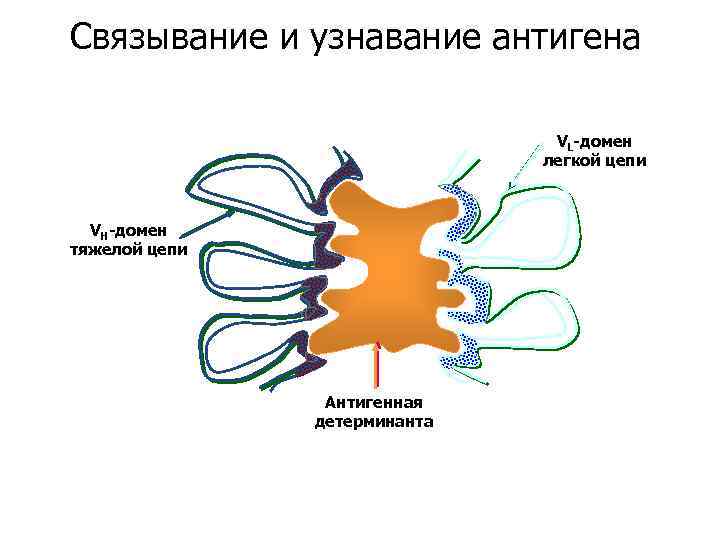
Связывание и узнавание антигена VL-домен легкой цепи VH-домен тяжелой цепи Антигенная детерминанта
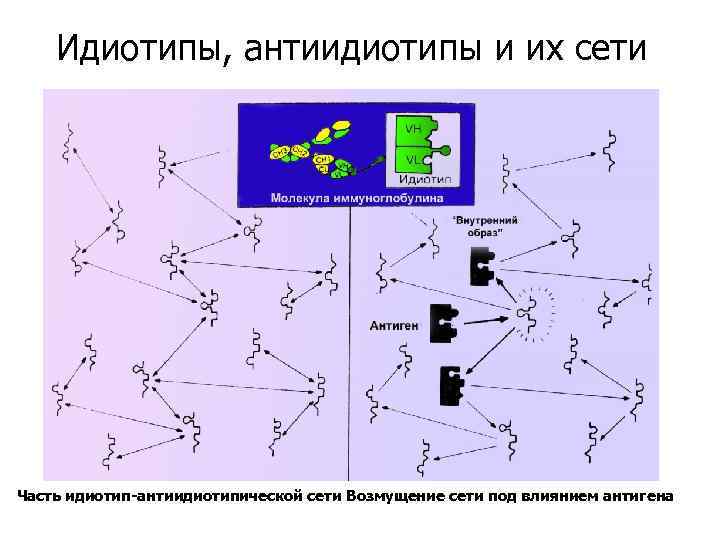
Идиотипы, антиидиотипы и их сети Часть идиотип-антиидиотипической сети Возмущение сети под влиянием антигена
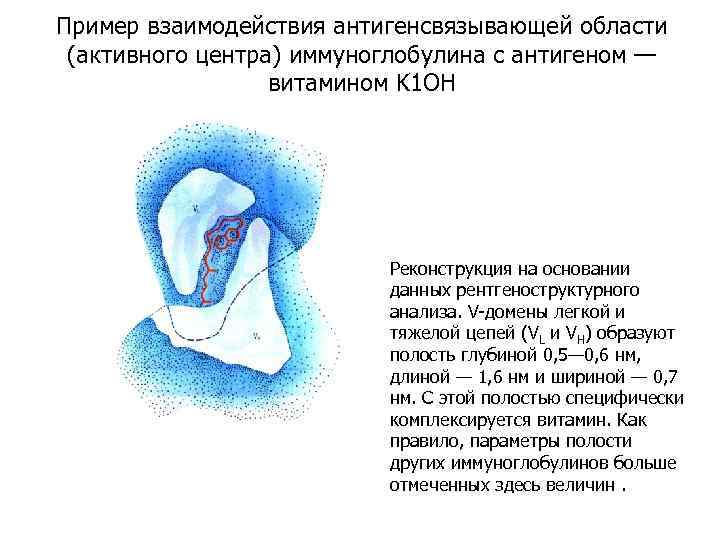
Пример взаимодействия антигенсвязывающей области (активного центра) иммуноглобулина с антигеном — витамином K 1 OH Реконструкция на основании данных рентгеноструктурного анализа. V-домены легкой и тяжелой цепей (VL и VH) образуют полость глубиной 0, 5— 0, 6 нм, длиной — 1, 6 нм и шириной — 0, 7 нм. С этой полостью специфически комплексируется витамин. Как правило, параметры полости других иммуноглобулинов больше отмеченных здесь величин.
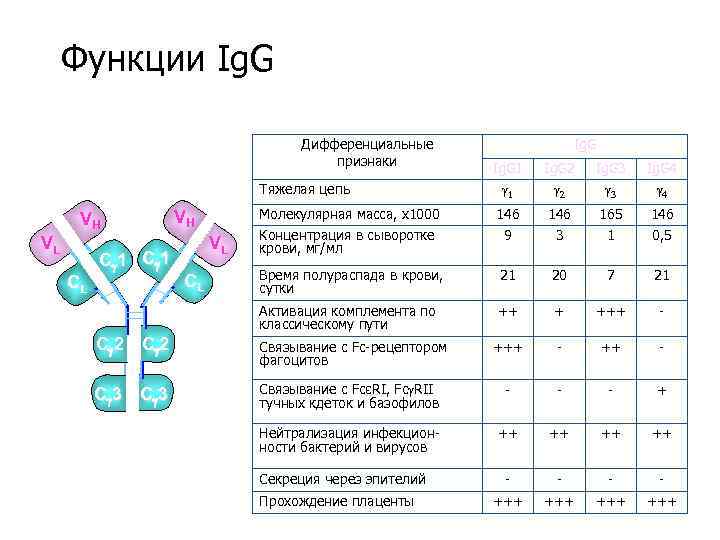
Функции Ig. G Дифференциальные признаки Ig. G 1 1 Ig. G 2 2 Ig. G 3 3 Ig. G 4 4 Молекулярная масса, х1000 Концентрация в сыворотке крови, мг/мл 146 9 146 3 165 1 146 0, 5 Время полураспада в крови, сутки 21 20 7 21 Активация комплемента по классическому пути ++ + +++ - Тяжелая цепь VH VL CL Ig. G C 1 VH VL CL C 2 Связывание с Fc-рецептором фагоцитов +++ - C 3 Связывание с FcεRI, Fc RII тучных кдеток и базофилов - - - + Нейтрализация инфекционности бактерий и вирусов ++ ++ - - +++ +++ Секреция через эпителий Прохождение плаценты
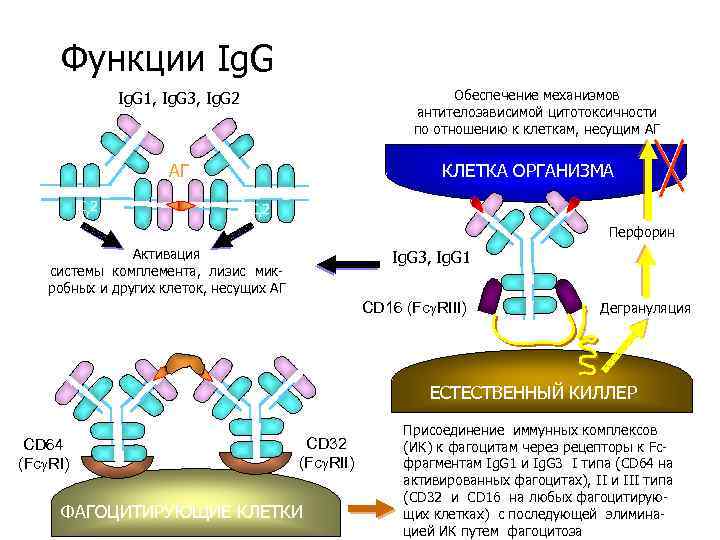
Функции Ig. G Обеспечение механизмов антителозависимой цитотоксичности по отношению к клеткам, несущим АГ Ig. G 1, Ig. G 3, Ig. G 2 АГ C 2 КЛЕТКА ОРГАНИЗМА C 2 Перфорин Активация системы комплемента, лизис микробных и других клеток, несущих АГ Ig. G 3, Ig. G 1 CD 16 (Fc RIII) Дегрануляция ЕСТЕСТВЕННЫЙ КИЛЛЕР CD 64 (Fc RI) CD 32 (Fc RII) ФАГОЦИТИРУЮЩИЕ КЛЕТКИ Присоединение иммунных комплексов (ИК) к фагоцитам через рецепторы к Fcфрагментам Ig. G 1 и Ig. G 3 I типа (СD 64 на активированных фагоцитах), II и III типа (СD 32 и СD 16 на любых фагоцитирующих клетках) с последующей элиминацией ИК путем фагоцитоза
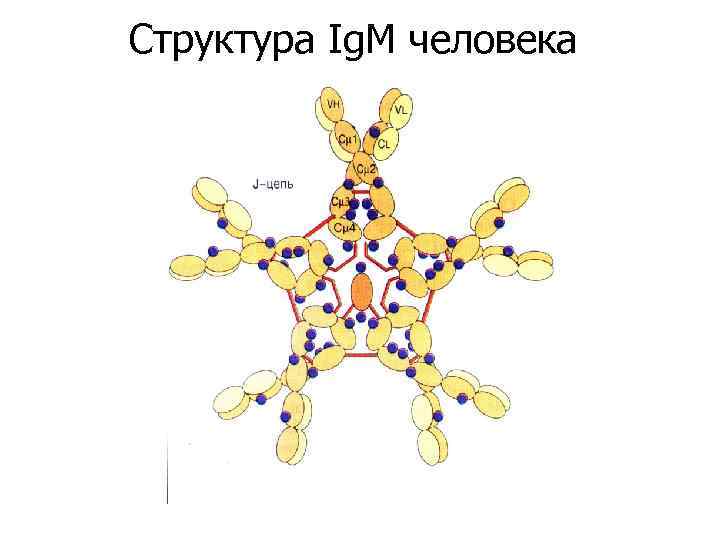
Структура Ig. M человека
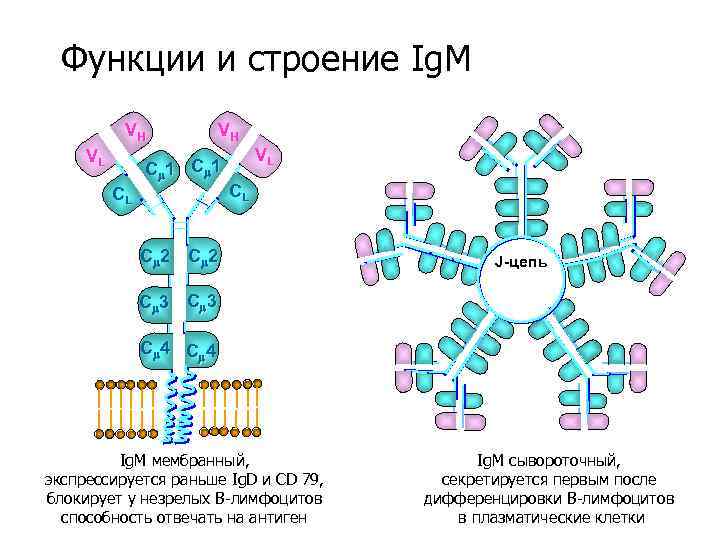
Функции и строение Ig. M VH VL VH C 1 CL VL CL C 2 J-цепь C 3 C 4 Ig. M мембранный, экспрессируется раньше Ig. D и CD 79, блокирует у незрелых В-лимфоцитов способность отвечать на антиген Ig. M сывороточный, секретируется первым после дифференцировки В-лимфоцитов в плазматические клетки
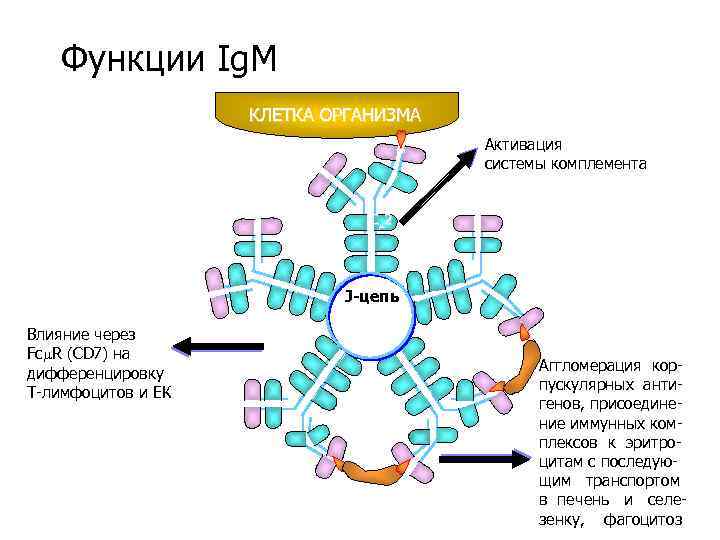
Функции Ig. M КЛЕТКА ОРГАНИЗМА Активация системы комплемента C 2 J-цепь Влияние через Fc R (CD 7) на дифференцировку Т-лимфоцитов и ЕК Аггломерация корпускулярных антигенов, присоединение иммунных комплексов к эритроцитам с последующим транспортом в печень и селезенку, фагоцитоз
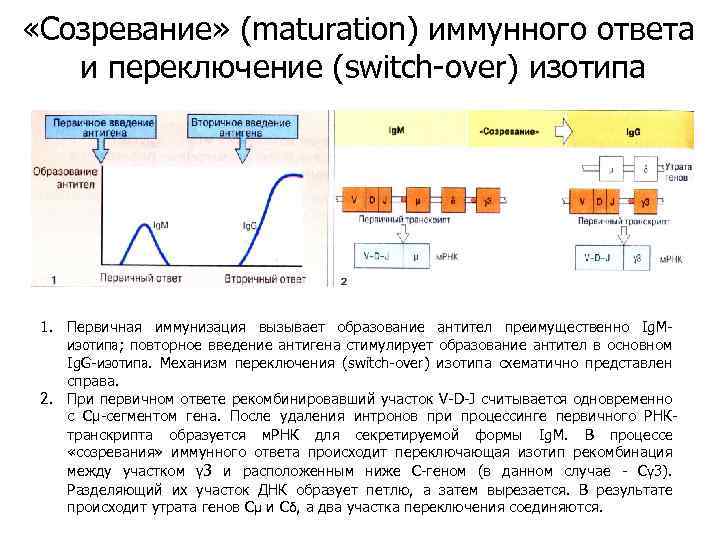
«Созревание» (maturation) иммунного ответа и переключение (switch-over) изотипа 1. Первичная иммунизация вызывает образование антител преимущественно Ig. Mизотипа; повторное введение антигена стимулирует образование антител в основном Ig. G-изотипа. Механизм переключения (switch-over) изотипа схематично представлен справа. 2. При первичном ответе рекомбинировавший участок V-D-J считывается одновременно с Сμ-сегментом гена. После удаления интронов при процессинге первичного РНКтранскрипта образуется м. РНК для секретируемой формы Ig. M. В процессе «созревания» иммунного ответа происходит переключающая изотип рекомбинация между участком γ 3 и расположенным ниже С-геном (в данном случае - Сγ 3). Разделяющий их участок ДНК образует петлю, а затем вырезается. В результате происходит утрата генов Сμ и Сδ, а два участка переключения соединяются.
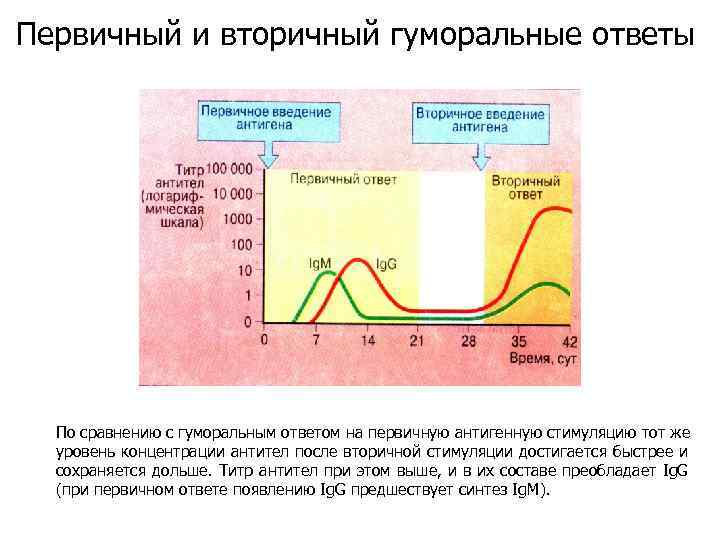
Первичный и вторичный гуморальные ответы По сравнению с гуморальным ответом на первичную антигенную стимуляцию тот же уровень концентрации антител после вторичной стимуляции достигается быстрее и сохраняется дольше. Титр антител при этом выше, и в их составе преобладает Ig. G (при первичном ответе появлению Ig. G предшествует синтез Ig. M).

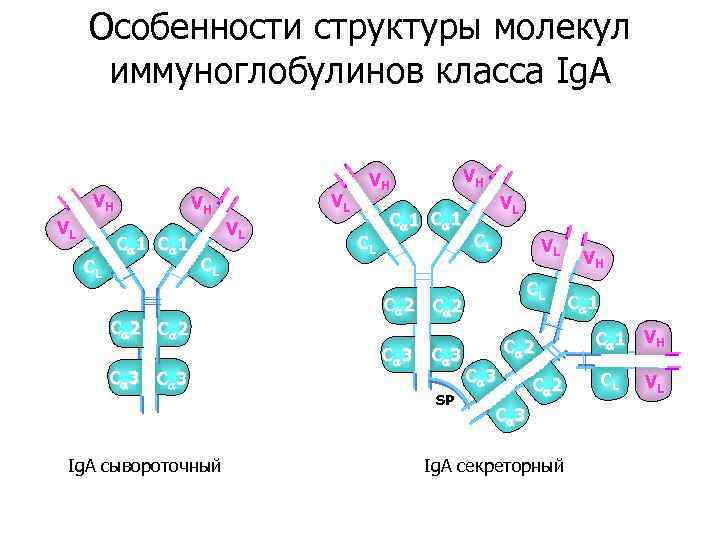
Особенности структуры молекул иммуноглобулинов класса Ig. A VH VL CL VH C 1 CL C 2 C 3 Ig. A сывороточный VL VL VH VH CL C 1 VL CL C 2 C 3 SP C 2 C 3 Ig. A секреторный VH C 1 V H CL VL
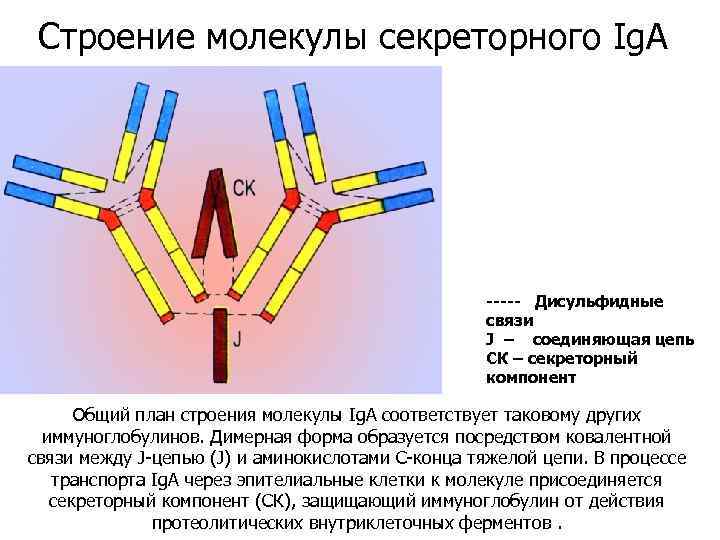
Строение молекулы секреторного Ig. A ----- Дисульфидные связи J – соединяющая цепь СК – секреторный компонент Общий план строения молекулы Ig. A соответствует таковому других иммуноглобулинов. Димерная форма образуется посредством ковалентной связи между J-цепью (J) и аминокислотами С-конца тяжелой цепи. В процессе транспорта Ig. A через эпителиальные клетки к молекуле присоединяется секреторный компонент (СК), защищающий иммуноглобулин от действия протеолитических внутриклеточных ферментов.
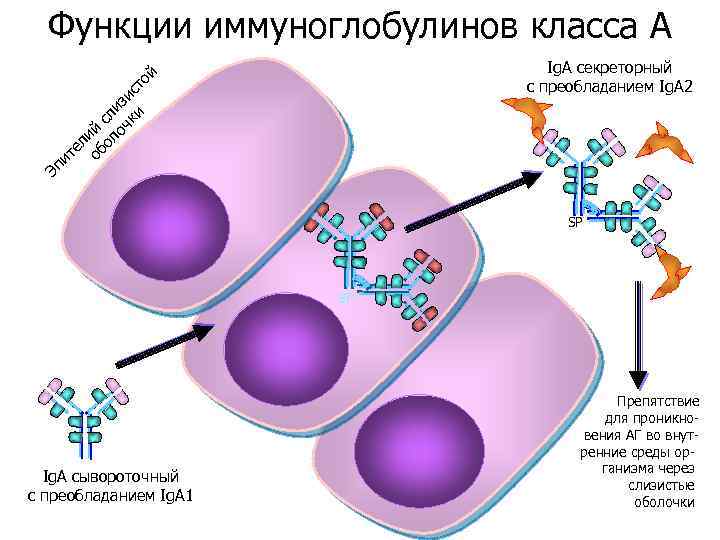
Функции иммуноглобулинов класса A Эп ит ел об ий ол сл оч изи ки ст о й Ig. A секреторный c преобладанием Ig. A 2 SP SP SP Ig. A сывороточный c преобладанием Ig. A 1 Препятствие для проникновения АГ во внутренние среды организма через слизистые оболочки
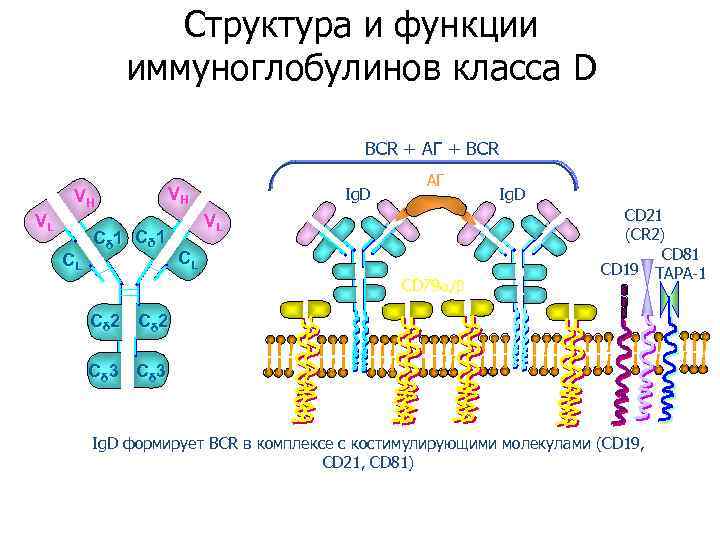
Структура и функции иммуноглобулинов класса D BCR + АГ + BCR VH VL CL VH Cδ 1 Ig. D АГ VL CL CD 79 / Ig. D CD 21 (CR 2) CD 81 CD 19 TAPA-1 Cδ 2 Cδ 3 Ig. D формирует ВСR в комплексе с костимулирующими молекулами (CD 19, CD 21, CD 81)
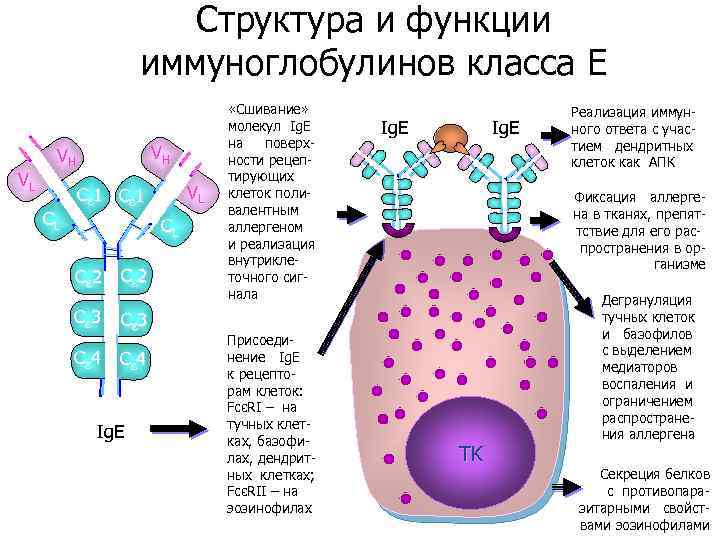
Структура и функции иммуноглобулинов класса E VL VH VH CL VL Cε 1 CL Cε 2 Cε 3 Cε 4 Ig. E «Сшивание» молекул Ig. E на поверхности рецептирующих клеток поливалентным аллергеном и реализация внутриклеточного сигнала Присоединение Ig. E к рецепторам клеток: FcεRI – на тучных клетках, базофилах, дендритных клетках; FcεRII – на эозинофилах Ig. E Реализация иммунного ответа с участием дендритных клеток как АПК Фиксация аллергена в тканях, препяттствие для его распространения в организме TK Дегрануляция тучных клеток и базофилов с выделением медиаторов воспаления и ограничением распространения аллергена Секреция белков с противопаразитарными свойствами эозинофилами
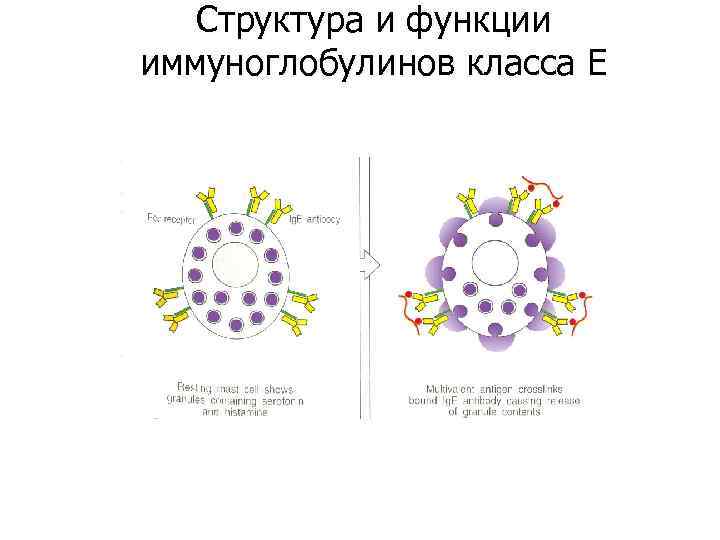
Структура и функции иммуноглобулинов класса E

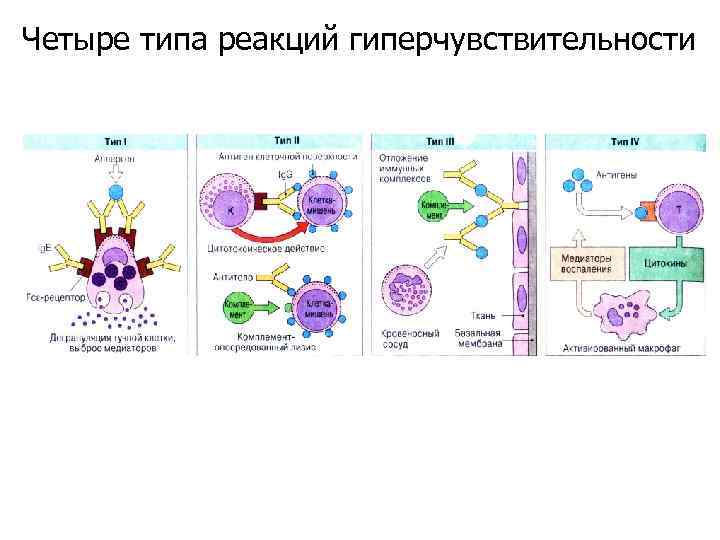
Четыре типа реакций гиперчувствительности
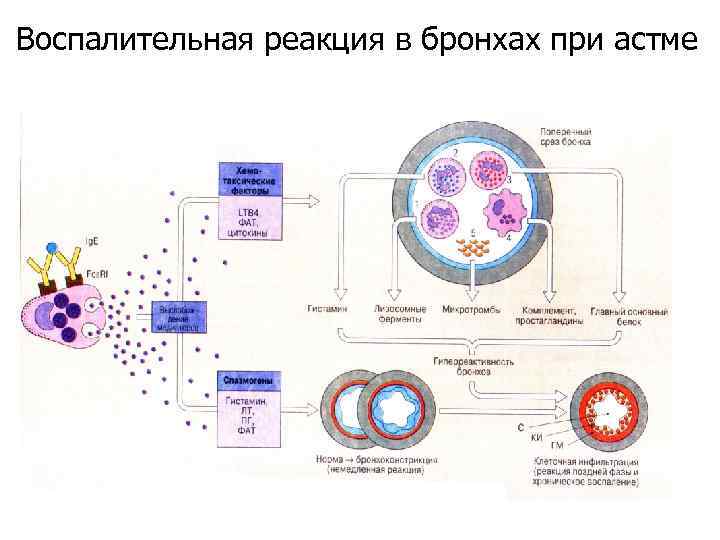
Воспалительная реакция в бронхах при астме
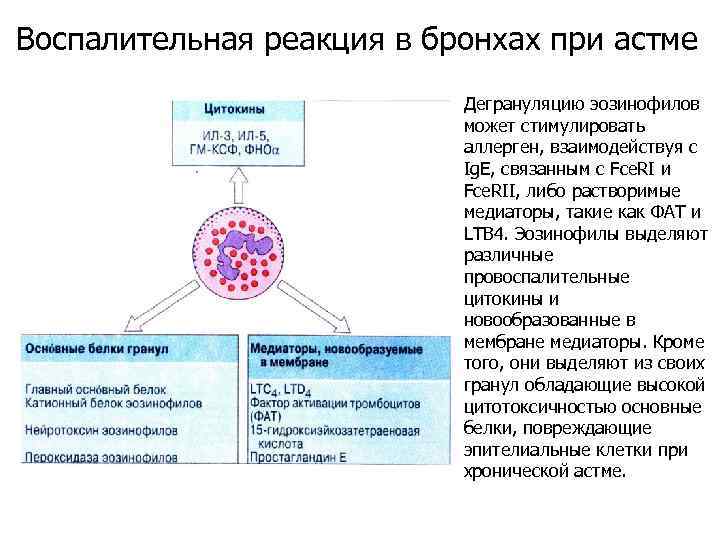
Воспалительная реакция в бронхах при астме Дегрануляцию эозинофилов может стимулировать аллерген, взаимодействуя с Ig. E, связанным с Fce. RI и Fce. RII, либо растворимые медиаторы, такие как ФАТ и LTB 4. Эозинофилы выделяют различные провоспалительные цитокины и новообразованные в мембране медиаторы. Кроме того, они выделяют из своих гранул обладающие высокой цитотоксичностью основные белки, повреждающие эпителиальные клетки при хронической астме.
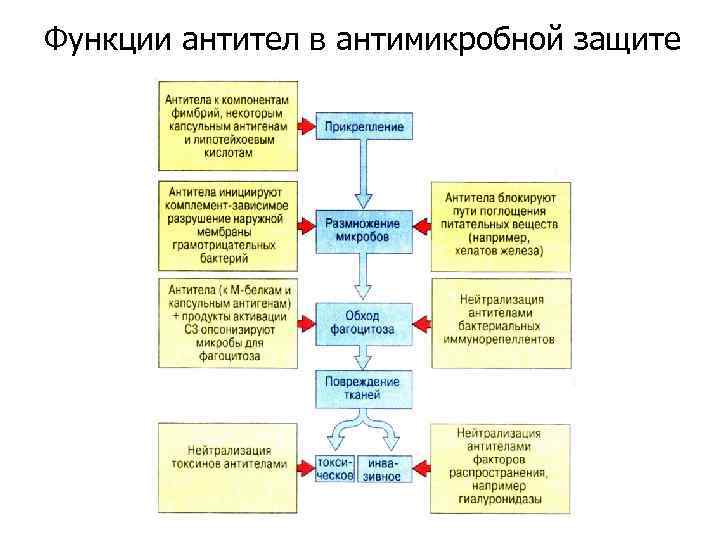
Функции антител в антимикробной защите
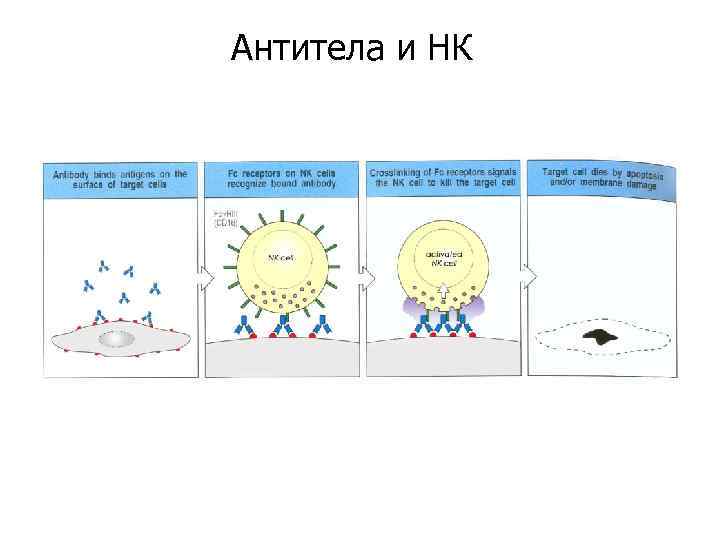
Антитела и НК

Противовирусное действие антител Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
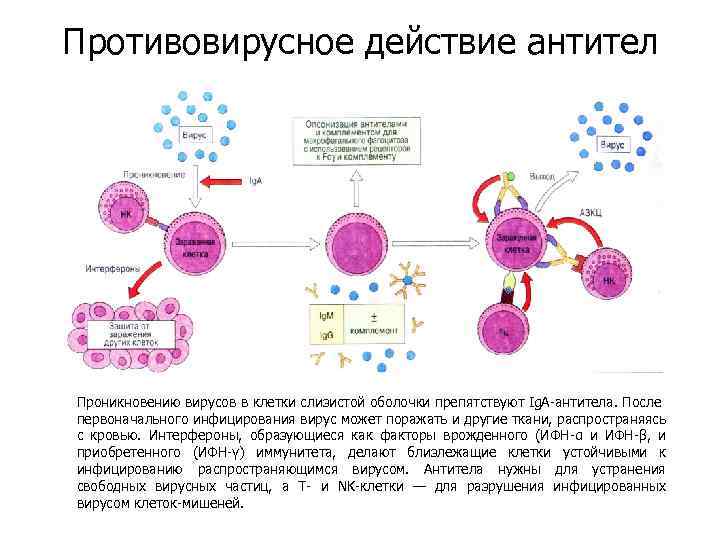
Противовирусное действие антител Проникновению вирусов в клетки слизистой оболочки препятствуют Ig. A-антитела. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФН-α и ИФН-β, и приобретенного (ИФН-γ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и NK-клетки — для разрушения инфицированных вирусом клеток-мишеней.
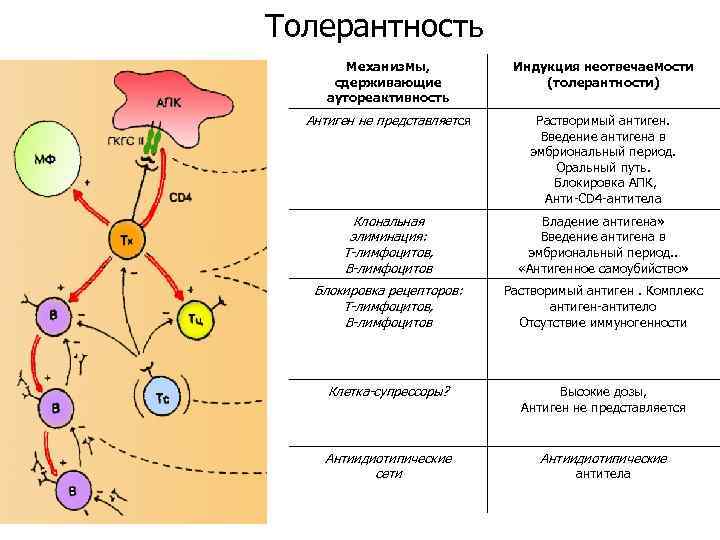
Толерантность Механизмы, сдерживающие аутореактивность Индукция неотвечаемости (толерантности) Антиген не представляется Растворимый антиген. Введение антигена в эмбриональный период. Оральный путь. Блокировка АПК, Анти-СD 4 -антитела Клональная элиминация: Т-лимфоцитов, В-лимфоцитов Владение антигена» Введение антигена в эмбриональный период. . «Антигенное самоубийство» Блокировка рецепторов: Т-лимфоцитов, В-лимфоцитов Растворимый антиген. Комплекс антиген-антитело Отсутствие иммуногенности Клетка-супрессоры? Высокие дозы, Антиген не представляется Антиидиотипические сети Антиидиотипические антитела




Paul Ehrlich 1854 -1915



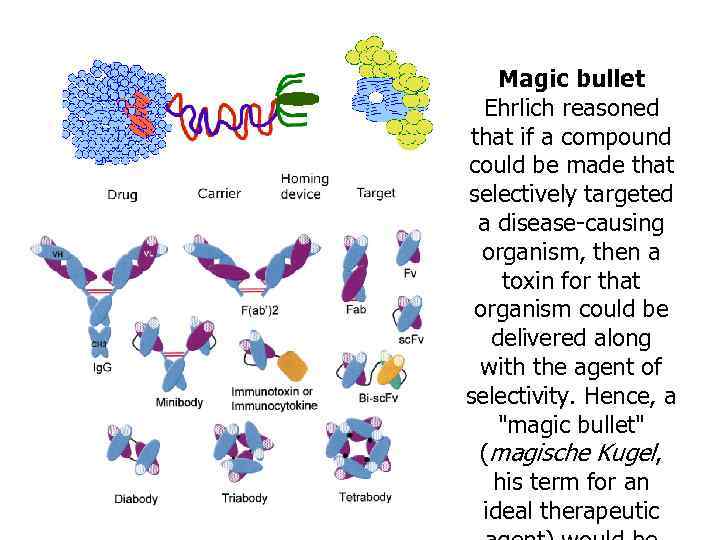
Magic bullet Ehrlich reasoned that if a compound could be made that selectively targeted a disease-causing organism, then a toxin for that organism could be delivered along with the agent of selectivity. Hence, a "magic bullet" (magische Kugel, his term for an ideal therapeutic
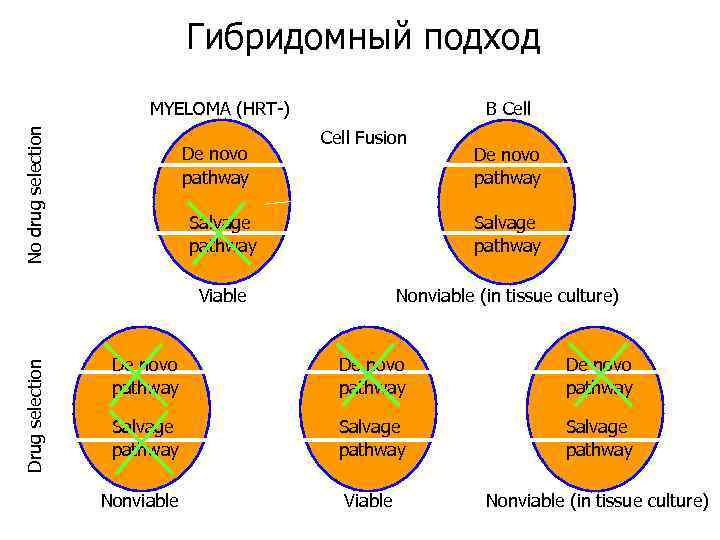
Гибридомный подход No drug selection MYELOMA (HRT-) De novo pathway B Cell Fusion De novo pathway Salvage pathway Viable Drug selection Salvage pathway Nonviable (in tissue culture) De novo pathway Salvage pathway Viable Nonviable (in tissue culture) Nonviable
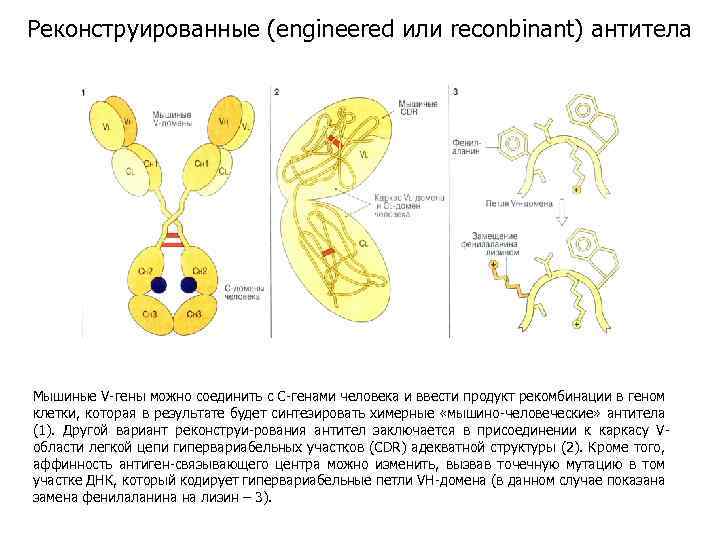
Реконструированные (engineered или reconbinant) антитела Мышиные V-гены можно соединить с С-генами человека и ввести продукт рекомбинации в геном клетки, которая в результате будет синтезировать химерные «мышино-человеческие» антитела (1). Другой вариант реконструи-рования антител заключается в присоединении к каркасу Vобласти легкой цепи гипервариабельных участков (CDR) адекватной структуры (2). Кроме того, аффинность антиген-связывающего центра можно изменить, вызвав точечную мутацию в том участке ДНК, который кодирует гипервариабельные петли VH-домена (в данном случае показана замена фенилаланина на лизин – 3).

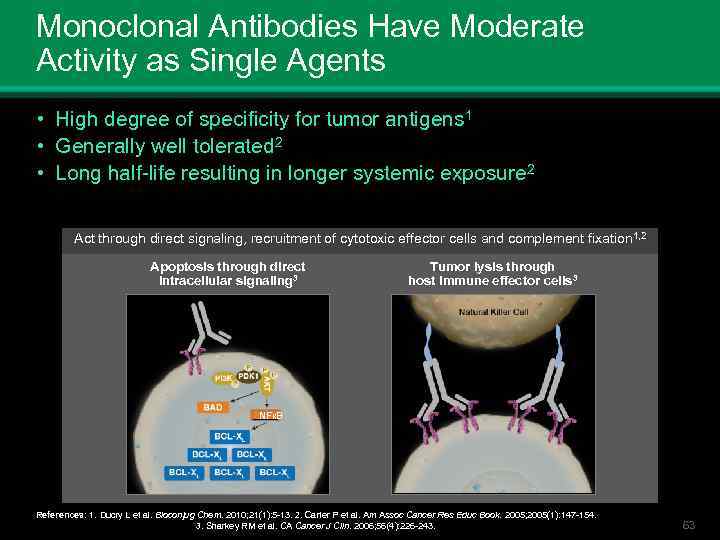
Monoclonal Antibodies Have Moderate Activity as Single Agents • High degree of specificity for tumor antigens 1 • Generally well tolerated 2 • Long half-life resulting in longer systemic exposure 2 Act through direct signaling, recruitment of cytotoxic effector cells and complement fixation 1, 2 Apoptosis through direct intracellular signaling 3 Tumor lysis through host immune effector cells 3 NFКB References: 1. Ducry L et al. Bioconjug Chem. 2010; 21(1): 5 -13. 2. Carter P et al. Am Assoc Cancer Res Educ Book. 2005; 2005(1): 147 -154. 3. Sharkey RM et al. CA Cancer J Clin. 2006; 56(4): 226 -243. 63

Elements of an Antibody-Drug Conjugate (ADC) Antibody Specific for a tumor-associated antigen that has restricted expression on normal cells. 1, 2 Cytotoxic agent Linker Attaches the cytotoxic agent to the antibody. Newer linker systems are designed to be stable in circulation and release the cytotoxic agent inside targeted cells. 1 -3 Designed to kill target cells when internalized and released. 1, 2 References: 1. Carter PJ et al. Cancer J. 2008; 14(3): 154 -169. 2. Senter PD. Curr Opin Chem Biol. 2009; 13(3): 235 -244. 3. Polson AG et al. Cancer Res. 2009; 69(6): 2358 -2364. 64

Rationale for ADCs: to Expand the Therapeutic Window • ADCs are designed to target delivery of a cytotoxic agent − Increase the delivery of a cytotoxic agent to a tumor − Limit tissue exposure to free cytotoxic agent Conventional Chemotherapy Antibody-Drug Conjugates Reference: Carter PJ et al. Cancer J. 2008; 14(3): 154 -169. 65
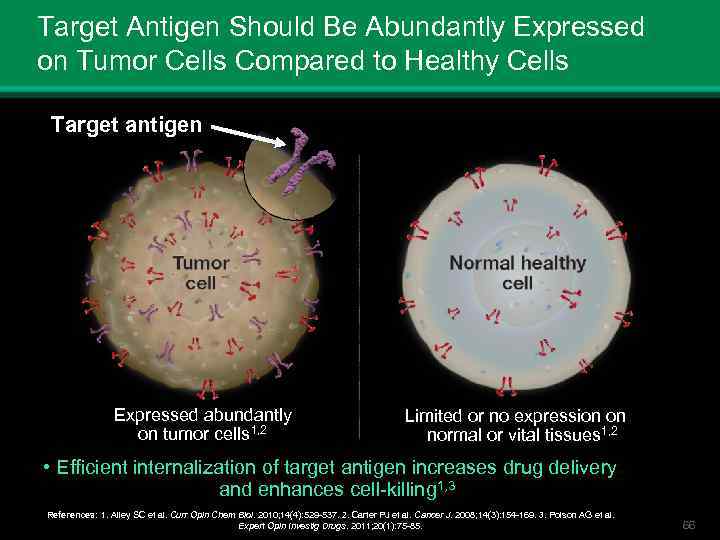
Target Antigen Should Be Abundantly Expressed on Tumor Cells Compared to Healthy Cells Target antigen Expressed abundantly on tumor cells 1, 2 Limited or no expression on normal or vital tissues 1, 2 • Efficient internalization of target antigen increases drug delivery and enhances cell-killing 1, 3 References: 1. Alley SC et al. Curr Opin Chem Biol. 2010; 14(4): 529 -537. 2. Carter PJ et al. Cancer J. 2008; 14(3): 154 -169. 3. Polson AG et al. Expert Opin Investig Drugs. 2011; 20(1): 75 -85. 66
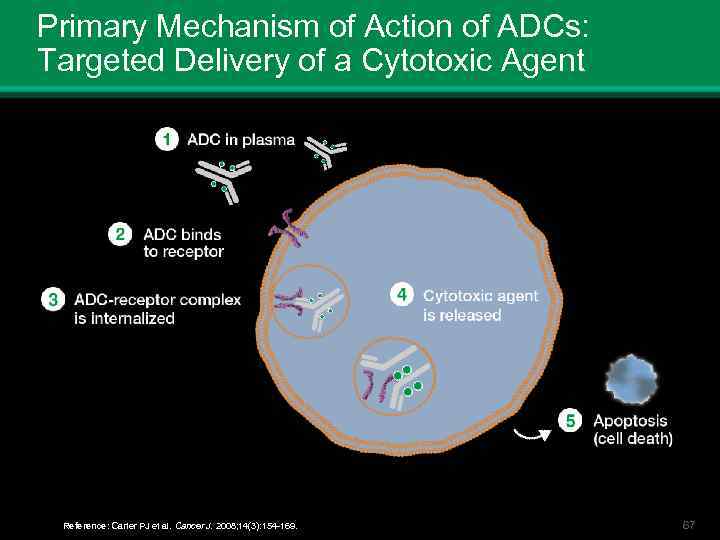
Primary Mechanism of Action of ADCs: Targeted Delivery of a Cytotoxic Agent Reference: Carter PJ et al. Cancer J. 2008; 14(3): 154 -169. 67
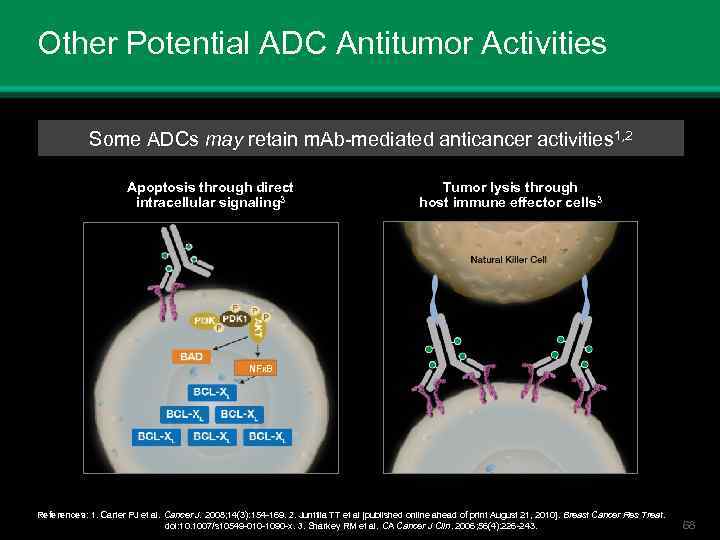
Other Potential ADC Antitumor Activities Some ADCs may retain m. Ab-mediated anticancer activities 1, 2 Apoptosis through direct intracellular signaling 3 Tumor lysis through host immune effector cells 3 NFКB References: 1. Carter PJ et al. Cancer J. 2008; 14(3): 154 -169. 2. Junttila TT et al [published online ahead of print August 21, 2010]. Breast Cancer Res Treat. doi: 10. 1007/s 10549 -010 -1090 -x. 3. Sharkey RM et al. CA Cancer J Clin. 2006; 56(4): 226 -243. 68
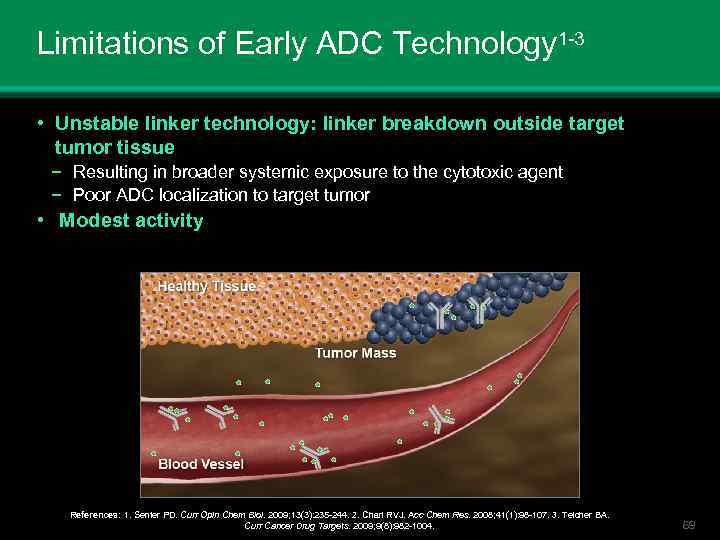
Limitations of Early ADC Technology 1 -3 • Unstable linker technology: linker breakdown outside target tumor tissue − Resulting in broader systemic exposure to the cytotoxic agent − Poor ADC localization to target tumor • Modest activity References: 1. Senter PD. Curr Opin Chem Biol. 2009; 13(3): 235 -244. 2. Chari RVJ. Acc Chem Res. 2008; 41(1): 98 -107. 3. Teicher BA. Curr Cancer Drug Targets. 2009; 9(8): 982 -1004. 69

Next-Generation ADCs: Engineered & Optimized Improved by incorporation of: 1, 2 − A more potent cytotoxic agent* − A more stable linker − Improved conjugation technology − Optimized ratio of cytotoxic agents per antibody * As demonstrated in preclinical models. References: 1. Alley SC et al. Curr Opin Chem Biol. 2010; 14(4): 529 -537. 2. Hamblett KJ et al. Clin Cancer Res. 2004; 10(20): 7063 -7070. 70
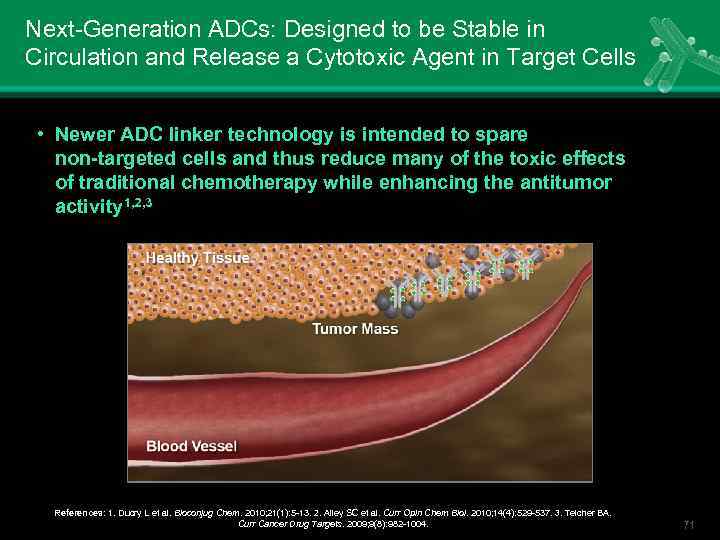
Next-Generation ADCs: Designed to be Stable in Circulation and Release a Cytotoxic Agent in Target Cells • Newer ADC linker technology is intended to spare non-targeted cells and thus reduce many of the toxic effects of traditional chemotherapy while enhancing the antitumor activity 1, 2, 3 References: 1. Ducry L et al. Bioconjug Chem. 2010; 21(1): 5 -13. 2. Alley SC et al. Curr Opin Chem Biol. 2010; 14(4): 529 -537. 3. Teicher BA. Curr Cancer Drug Targets. 2009; 9(8): 982 -1004. 71

As Demonstrated In Preclinical Models, Next-Generation ADCs Link the Proven Selectivity of Monoclonal Antibodies With Potent Cytotoxic Agents Linking individual elements for greater activity • Selective delivery via m. Abs 1 • More potent cytotoxic agents 2 • Stable linkers increase target specificity and reduce toxicity 1, 3 References: 1. Ducry L et al. Bioconjug Chem. 2010; 21(1): 5 -13. 2. Alley SC et al. Curr Opin Chem Biol. 2010; 14(4): 529 -537. 3. Doronina SO et al. Nat Biotechnol. 2003; 21(7): 778 -784. 72

ADC Components • Targeting AB – Choice of target (tumor/normal tissue ratio) – Internalization (must have feature) – Intracellular trafficking (presumed as important but not clearly spelled) • Payload – Highly potent (mostly tubulin active) • Linker – Cleavable vs non-cleavable – Stable in circulation

Лекция 4 Т-клеточный иммунный ответ Габибов А. Г.
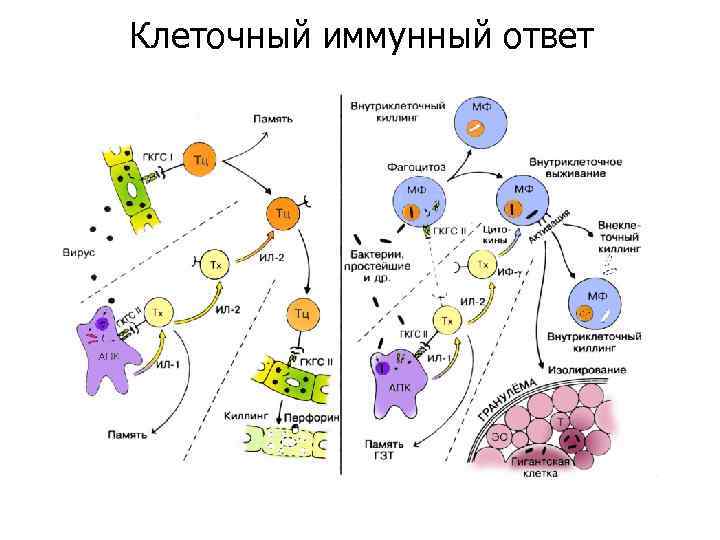
Клеточный иммунный ответ
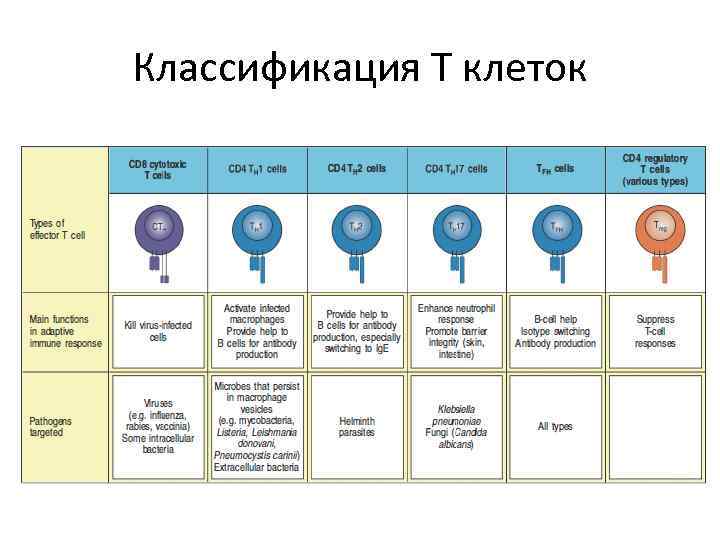
Классификация Т клеток

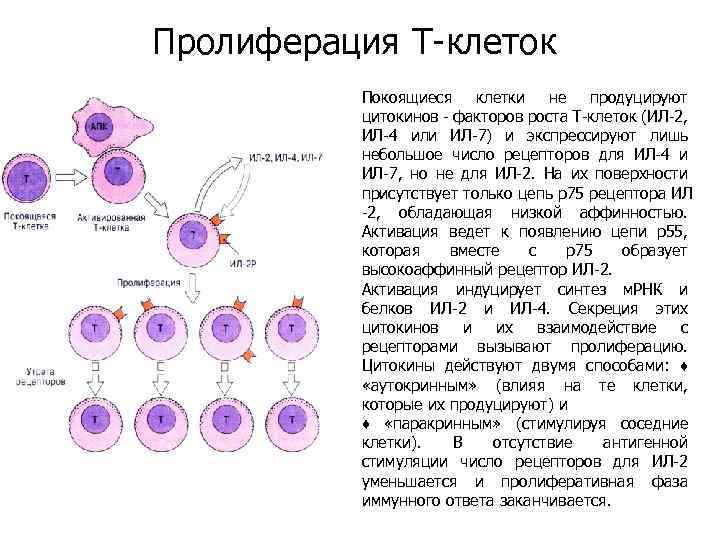
Пролиферация Т-клеток Покоящиеся клетки не продуцируют цитокинов - факторов роста Т-клеток (ИЛ-2, ИЛ-4 или ИЛ-7) и экспрессируют лишь небольшое число рецепторов для ИЛ-4 и ИЛ-7, но не для ИЛ-2. На их поверхности присутствует только цепь р75 рецептора ИЛ -2, обладающая низкой аффинностью. Активация ведет к появлению цепи р55, которая вместе с р75 образует высокоаффинный рецептор ИЛ-2. Активация индуцирует синтез м. РНК и белков ИЛ-2 и ИЛ-4. Секреция этих цитокинов и их взаимодействие с рецепторами вызывают пролиферацию. Цитокины действуют двумя способами: ♦ «аутокринным» (влияя на те клетки, которые их продуцируют) и ♦ «паракринным» (стимулируя соседние клетки). В отсутствие антигенной стимуляции число рецепторов для ИЛ-2 уменьшается и пролиферативная фаза иммунного ответа заканчивается.
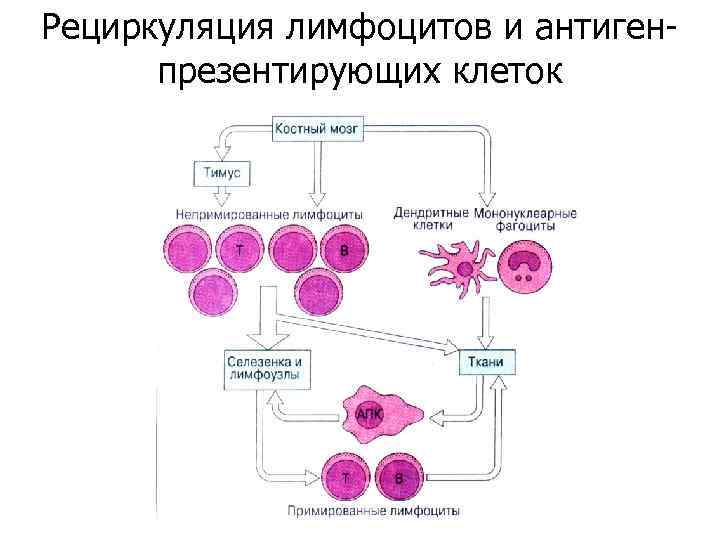
Рециркуляция лимфоцитов и антигенпрезентирующих клеток
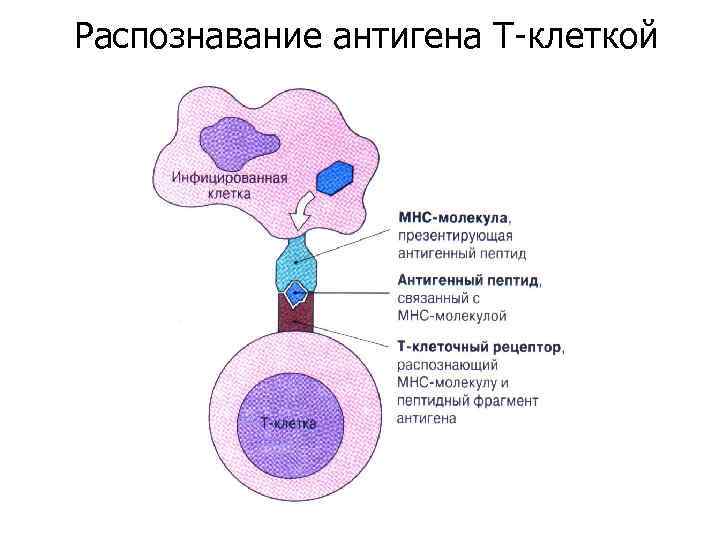
Распознавание антигена Т-клеткой
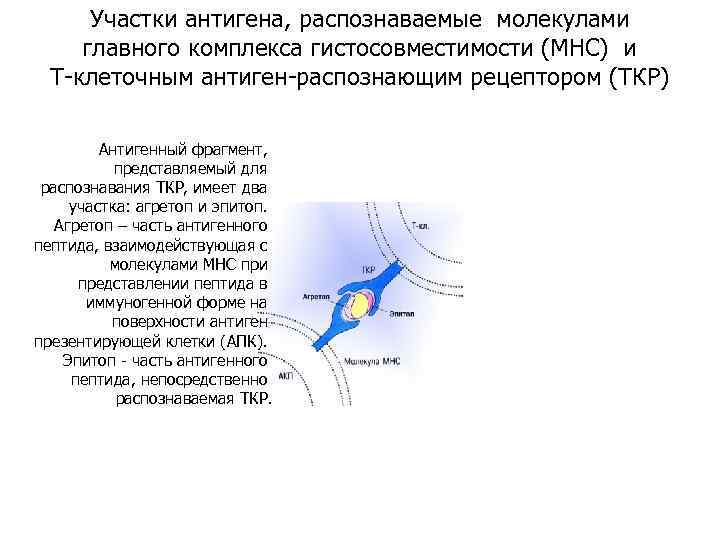
Участки антигена, распознаваемые молекулами главного комплекса гистосовместимости (МНС) и Т-клеточным антиген-распознающим рецептором (ТКР) Антигенный фрагмент, представляемый для распознавания ТКР, имеет два участка: агретоп и эпитоп. Агретоп – часть антигенного пептида, взаимодействующая с молекулами МНС при представлении пептида в иммуногенной форме на поверхности антиген презентирующей клетки (АПК). Эпитоп - часть антигенного пептида, непосредственно распознаваемая ТКР.


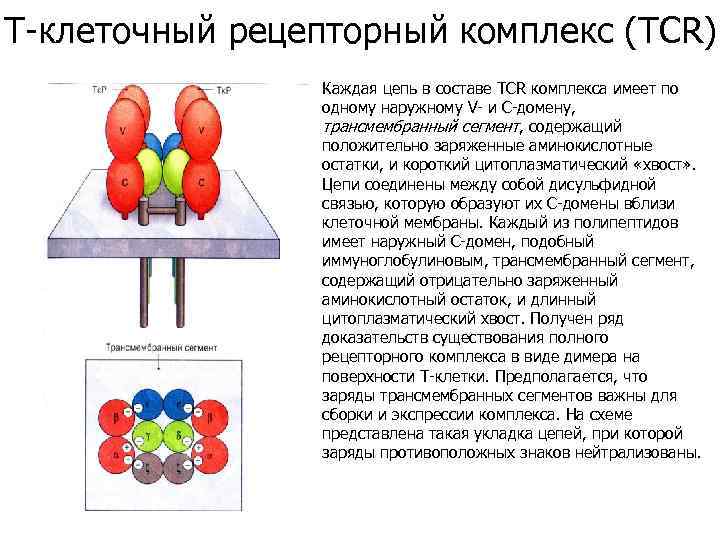
Т-клеточный рецепторный комплекс (TCR) Каждая цепь в составе TCR комплекса имеет по одному наружному V- и С-домену, трансмембранный сегмент, содержащий положительно заряженные аминокислотные остатки, и короткий цитоплазматический «хвост» . Цепи соединены между собой дисульфидной связью, которую образуют их С-домены вблизи клеточной мембраны. Каждый из полипептидов имеет наружный С-домен, подобный иммуноглобулиновым, трансмембранный сегмент, содержащий отрицательно заряженный аминокислотный остаток, и длинный цитоплазматический хвост. Получен ряд доказательств существования полного рецепторного комплекса в виде димера на поверхности Т-клетки. Предполагается, что заряды трансмембранных сегментов важны для сборки и экспрессии комплекса. На схеме представлена такая укладка цепей, при которой заряды противоположных знаков нейтрализованы.
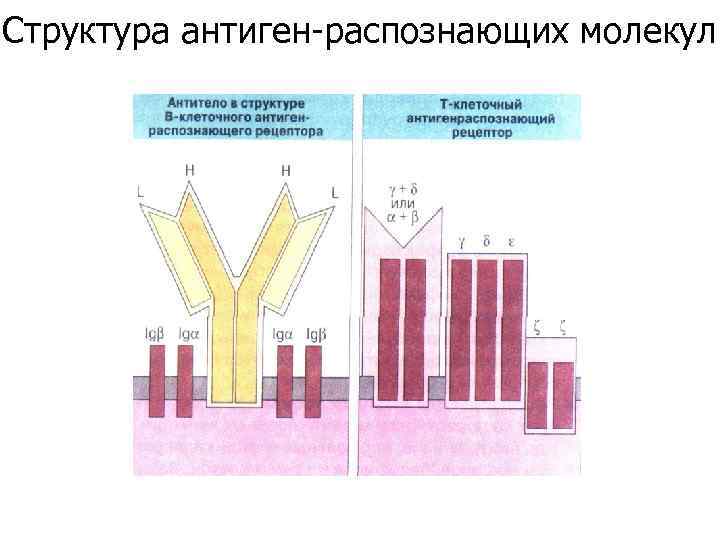
Структура антиген-распознающих молекул
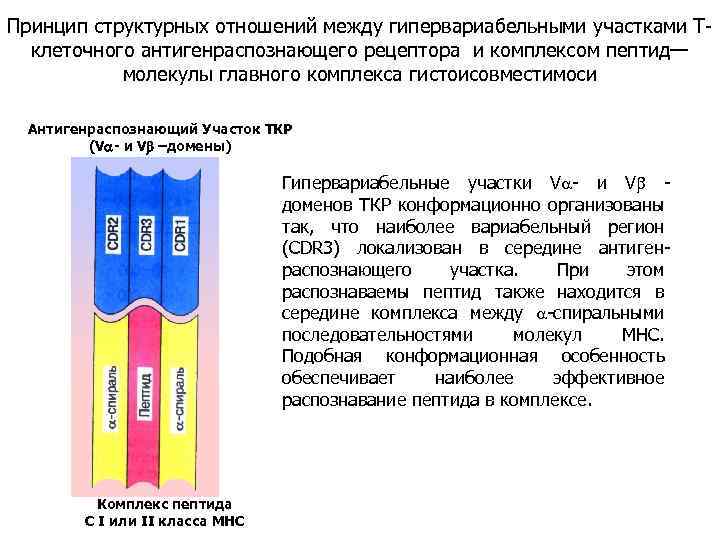
Принцип структурных отношений между гипервариабельными участками Тклеточного антигенраспознающего рецептора и комплексом пептид— молекулы главного комплекса гистоисовместимоси Антигенраспознающий Участок ТКР (V - и Vb –домены) Гипервариабельные участки V - и V доменов ТКР конформационно организованы так, что наиболее вариабельный регион (CDR 3) локализован в середине антигенраспознающего участка. При этом распознаваемы пептид также находится в середине комплекса между -спиральными последовательностями молекул МНС. Подобная конформационная особенность обеспечивает наиболее эффективное распознавание пептида в комплексе. Комплекс пептида С I или II класса МНС
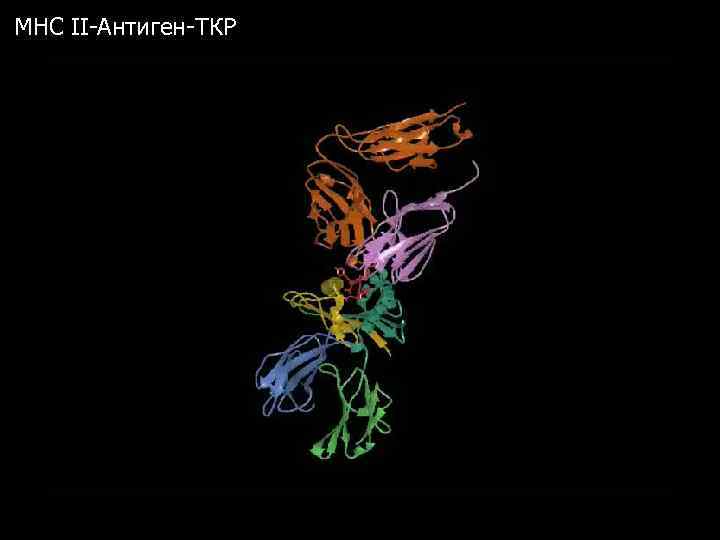
MHC II-Антиген-ТКР



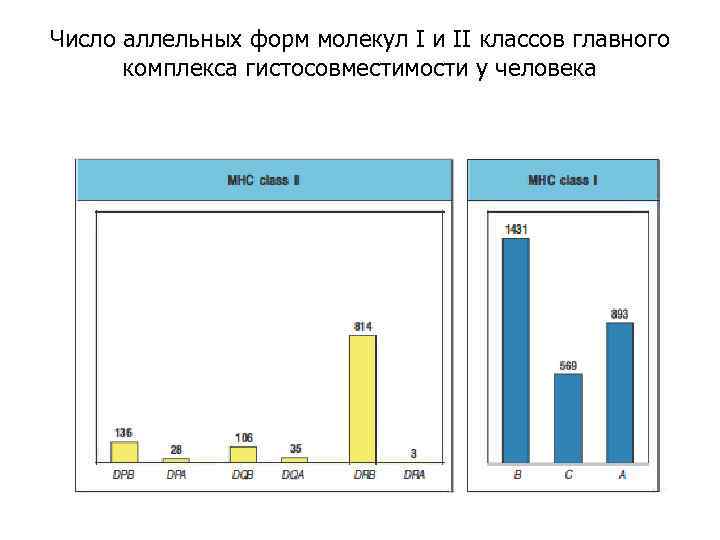
Число аллельных форм молекул I и II классов главного комплекса гистосовместимости у человека
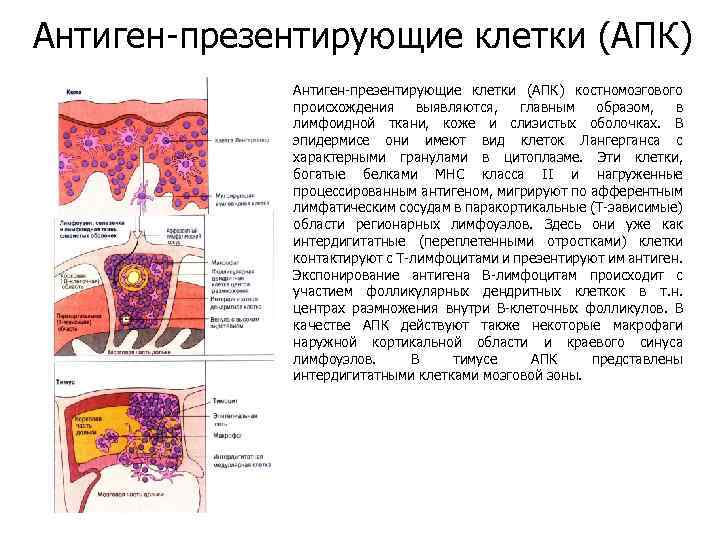
Антиген-презентирующие клетки (АПК) костномозгового происхождения выявляются, главным образом, в лимфоидной ткани, коже и слизистых оболочках. В эпидермисе они имеют вид клеток Лангерганса с характерными гранулами в цитоплазме. Эти клетки, богатые белками МНС класса II и нагруженные процессированным антигеном, мигрируют по афферентным лимфатическим сосудам в паракортикальные (Т-зависимые) области регионарных лимфоузлов. Здесь они уже как интердигитатные (переплетенными отростками) клетки контактируют с Т-лимфоцитами и презентируют им антиген. Экспонирование антигена В-лимфоцитам происходит с участием фолликулярных дендритных клеткок в т. н. центрах размножения внутри В-клеточных фолликулов. В качестве АПК действуют также некоторые макрофаги наружной кортикальной области и краевого синуса лимфоузлов. В тимусе АПК представлены интердигитатными клетками мозговой зоны.
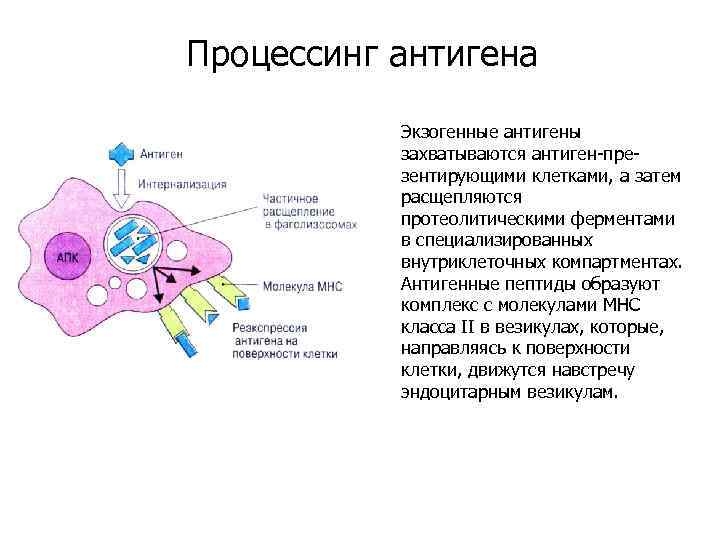
Процессинг антигена Экзогенные антигены захватываются антиген-презентирующими клетками, а затем расщепляются протеолитическими ферментами в специализированных внутриклеточных компартментах. Антигенные пептиды образуют комплекс с молекулами МНС класса II в везикулах, которые, направляясь к поверхности клетки, движутся навстречу эндоцитарным везикулам.

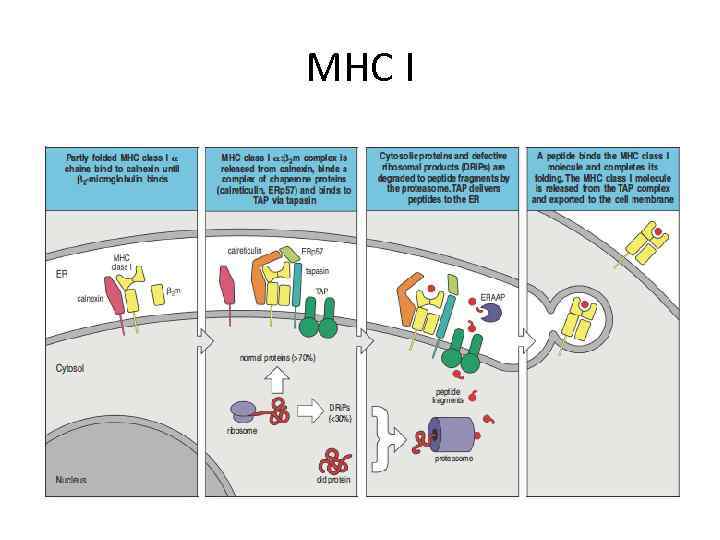
MHC I
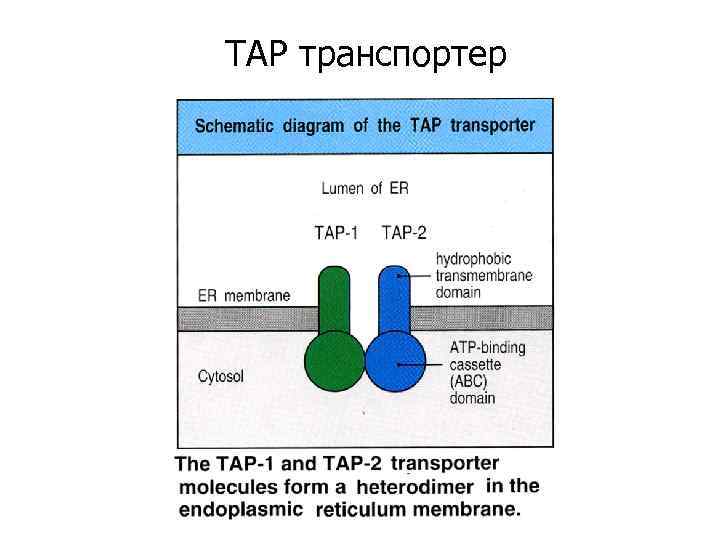
TAP транспортер
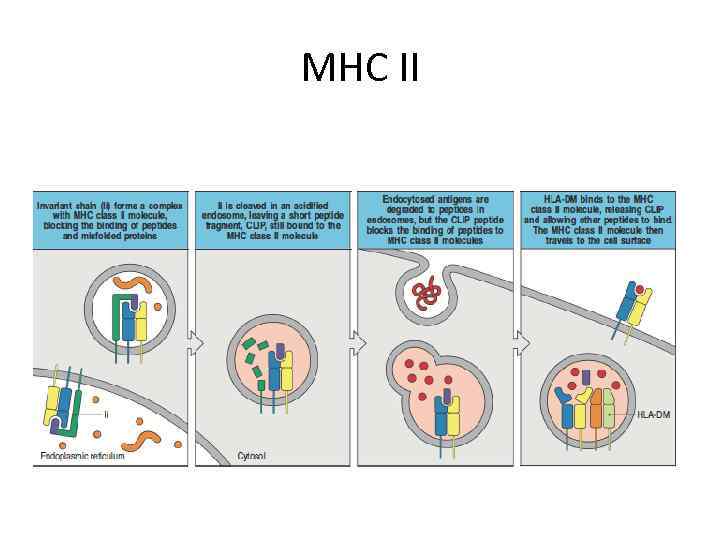
MHC II

Bia. Core T-200 - высочайшая чувствительность - отсутствие метки - количественная характеристика взаимодействия - возможность определить механизм взаимодействия
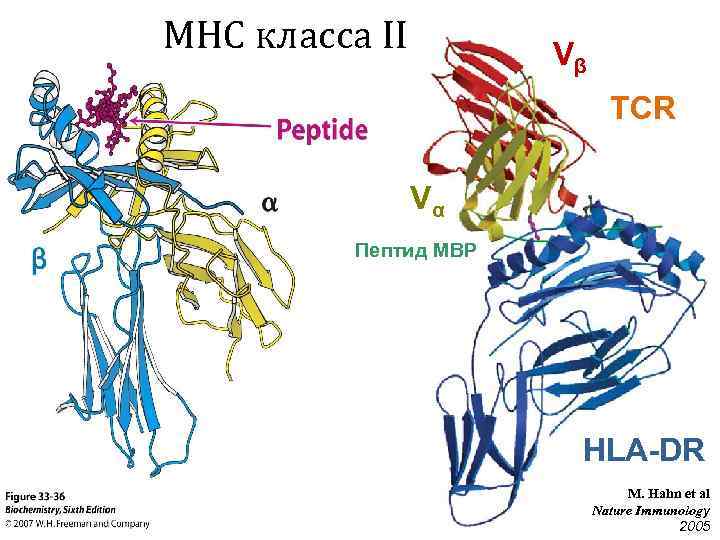
MHC класса II Vβ TCR Vα Пептид MBP HLA-DR M. Hahn et al Nature Immunology 2005
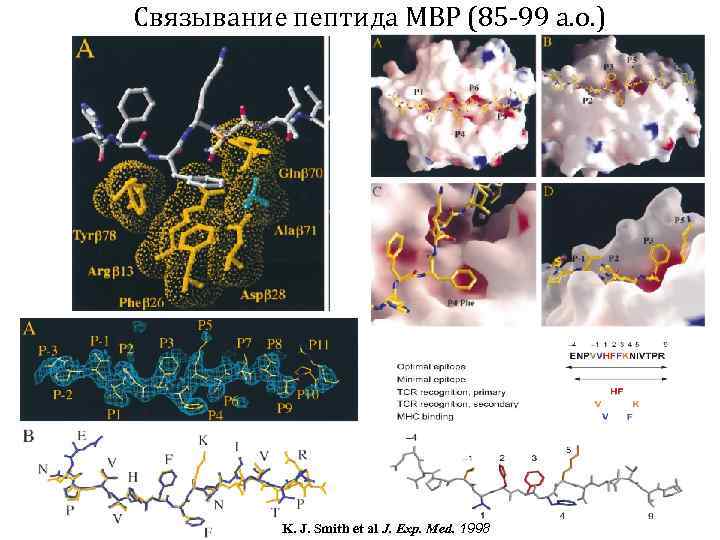
Связывание пептида MBP (85 -99 а. о. ) K. J. Smith et al J. Exp. Med. 1998
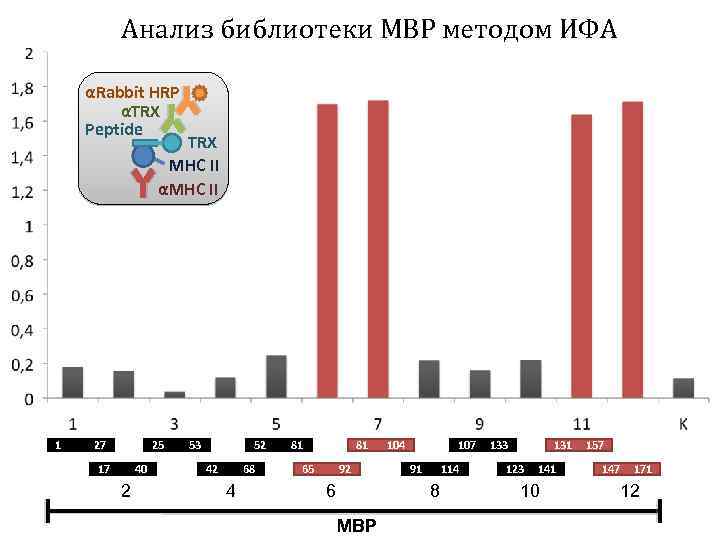
Анализ библиотеки MBP методом ИФА αRabbit HRP αTRX Peptide TRX MHC II αMHC II 1 27 25 17 40 2 53 52 42 68 4 81 81 65 92 6 104 107 91 114 8 MBP 133 131 123 141 10 157 147 171 12
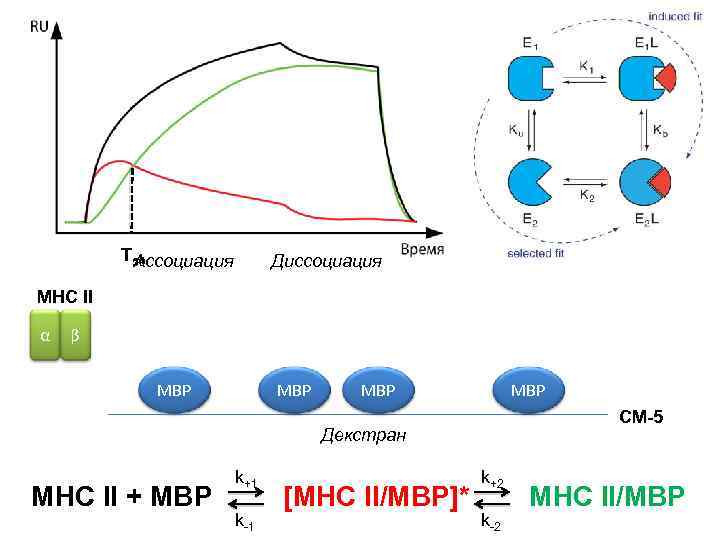
T 50 Ассоциация Диссоциация MHC II α β MBP MBP CM-5 Декстран MHC II + MBP k+1 k-1 [MHC II/MBP]* k+2 k-2 MHC II/MBP
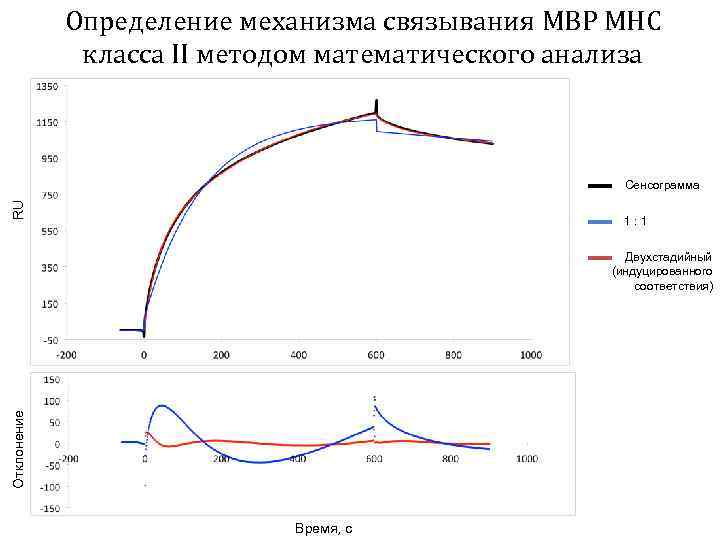
Определение механизма связывания MBP MHC класса II методом математического анализа RU Сенсограмма 1: 1 Отклонение Двухстадийный (индуцированного соответствия) Время, с
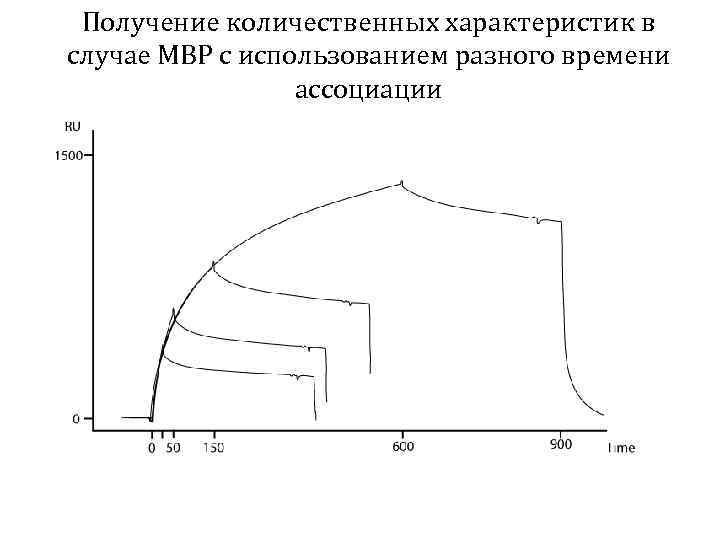
Получение количественных характеристик в случае MBP с использованием разного времени ассоциации
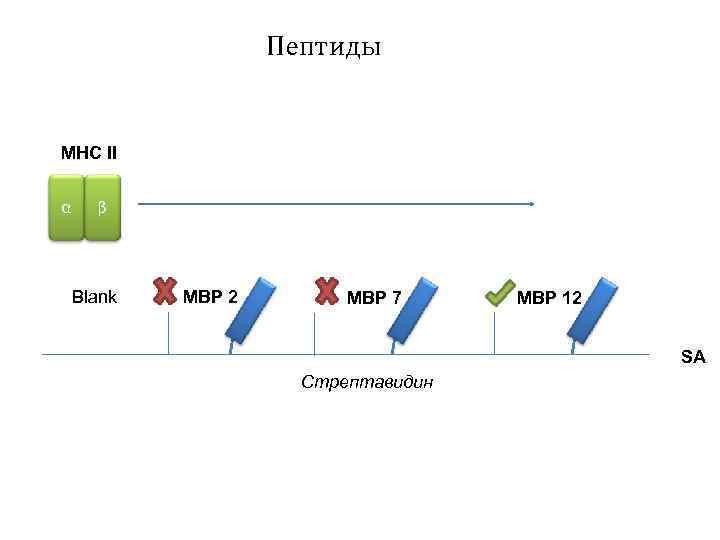
Пептиды MHC II α β Blank MBP 2 MBP 7 MBP 12 SA Стрептавидин
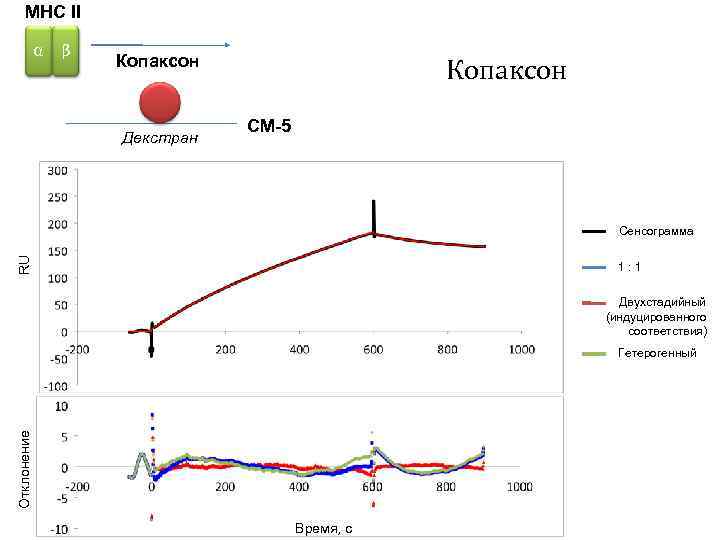
MHC II α β Копаксон Декстран Копаксон CM-5 RU Сенсограмма 1: 1 Двухстадийный (индуцированного соответствия) Отклонение Гетерогенный Время, с
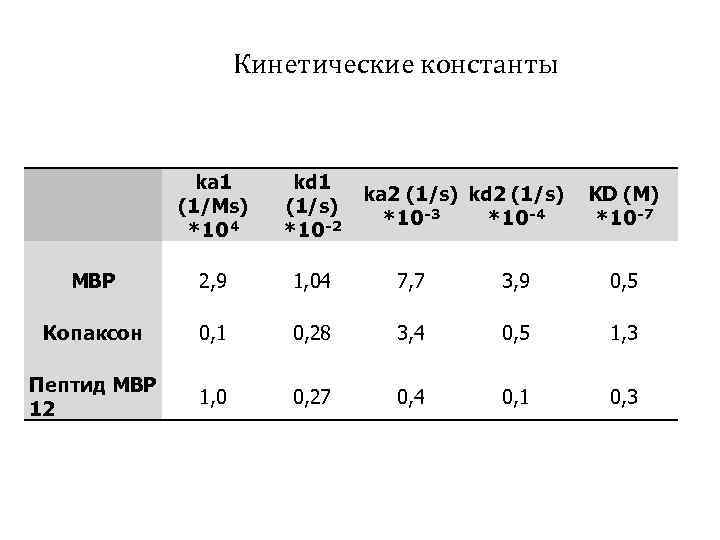
Кинетические константы ka 1 (1/Ms) *104 kd 1 (1/s) *10 -2 MBP 2, 9 1, 04 7, 7 3, 9 0, 5 Копаксон 0, 1 0, 28 3, 4 0, 5 1, 3 Пептид MBP 12 1, 0 0, 27 0, 4 0, 1 0, 3 ka 2 (1/s) kd 2 (1/s) *10 -3 *10 -4 KD (M) *10 -7
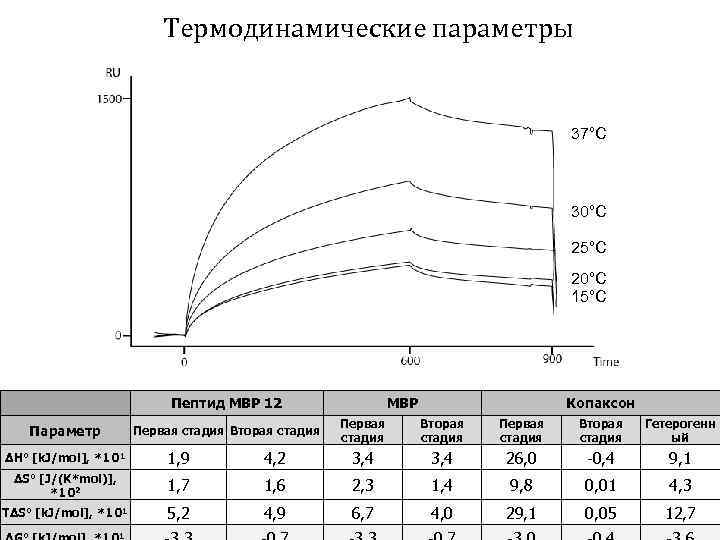
Термодинамические параметры 37°С 30°С 25°С 20°С 15°С Пептид MBP 12 Параметр Первая стадия Вторая стадия MBP Копаксон Первая стадия Вторая стадия Гетерогенн ый ΔH° [k. J/mol], *101 1, 9 4, 2 3, 4 26, 0 -0, 4 9, 1 ΔS° [J/(K*mol)], *102 1, 7 1, 6 2, 3 1, 4 9, 8 0, 01 4, 3 TΔS° [k. J/mol], *101 5, 2 4, 9 6, 7 4, 0 29, 1 0, 05 12, 7 1
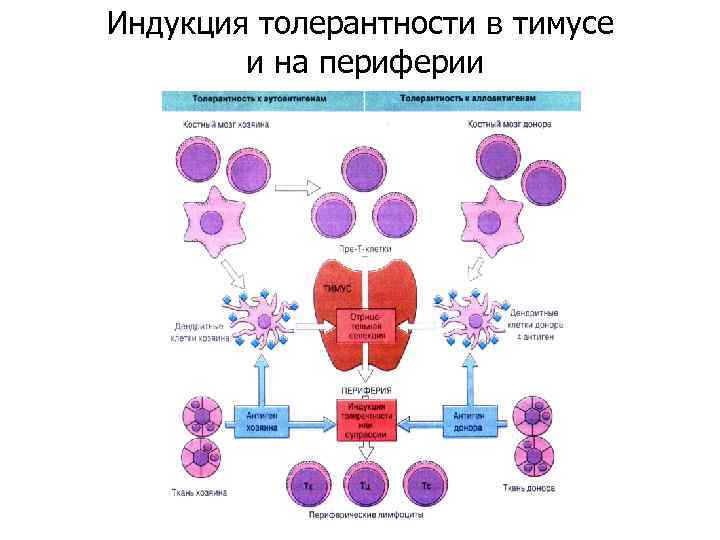
Индукция толерантности в тимусе и на периферии
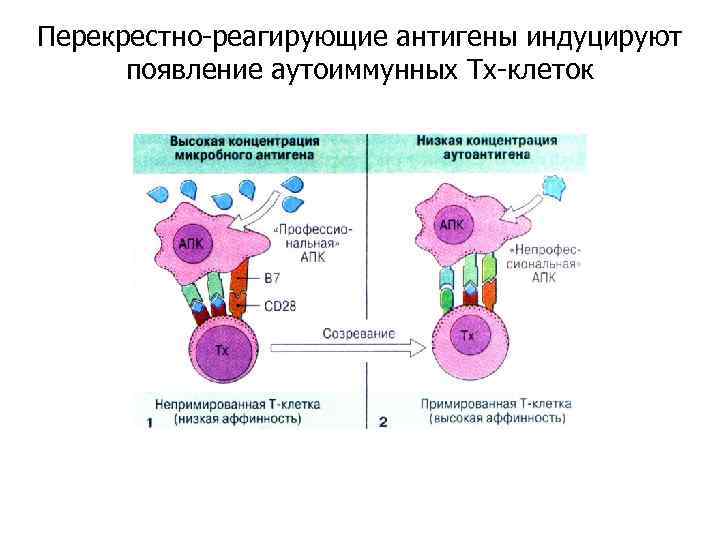
Перекрестно-реагирующие антигены индуцируют появление аутоиммунных Тх-клеток
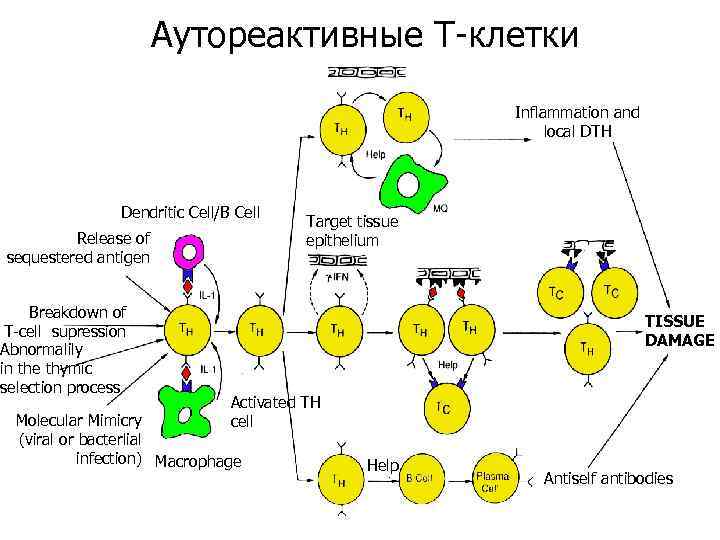
Аутореактивные Т-клетки Inflammation and local DTH Dendritic Cell/B Cell Release of sequestered antigen Breakdown of T-cell supression Abnormalily in the thymic selection process Target tissue epithelium b TISSUE DAMAGE Activated TH cell Molecular Mimicry (viral or bacterlial infection) Macrophage Help Antiself antibodies
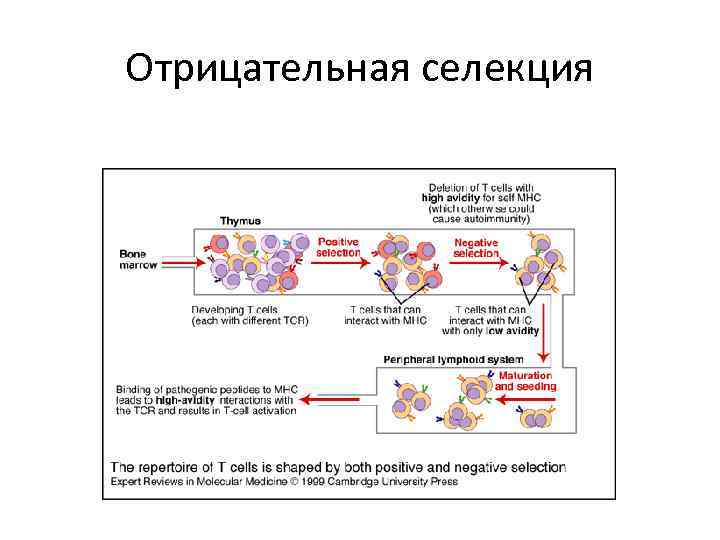
Отрицательная селекция



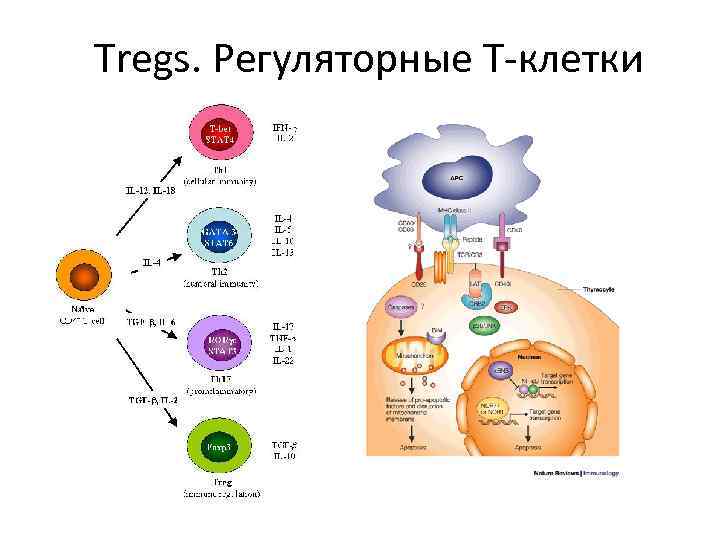
Tregs. Регуляторные Т-клетки
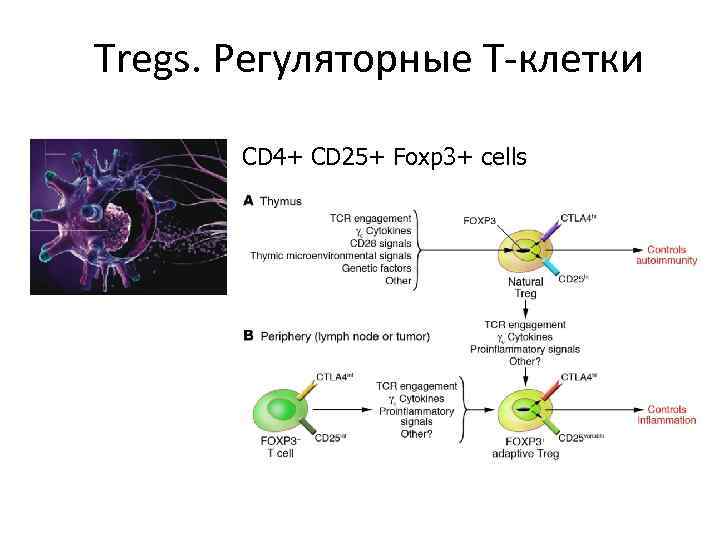
Tregs. Регуляторные Т-клетки CD 4+ CD 25+ Foxp 3+ cells
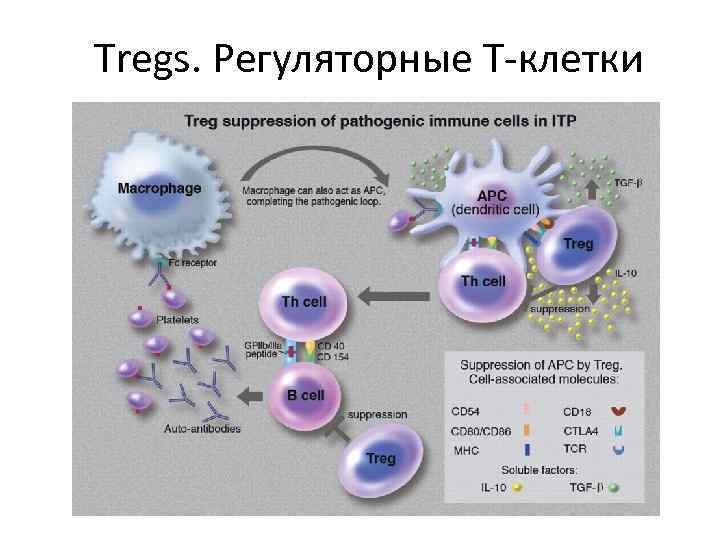
Tregs. Регуляторные Т-клетки


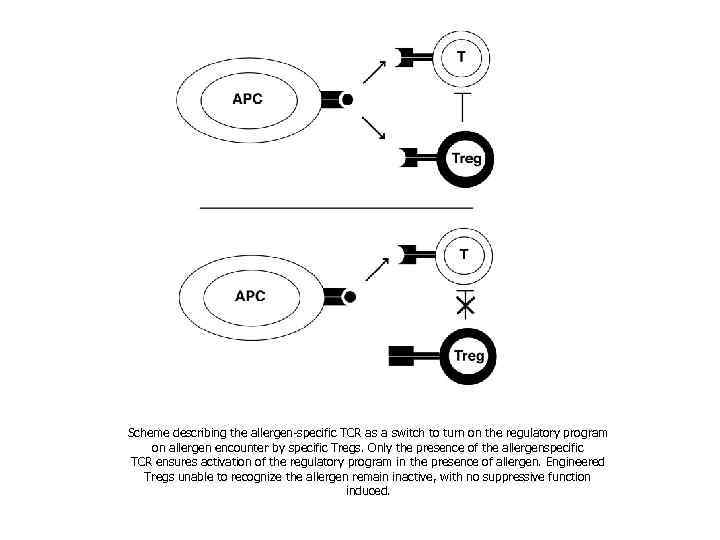
Scheme describing the allergen-specific TCR as a switch to turn on the regulatory program on allergen encounter by specific Tregs. Only the presence of the allergenspecific TCR ensures activation of the regulatory program in the presence of allergen. Engineered Tregs unable to recognize the allergen remain inactive, with no suppressive function induced.
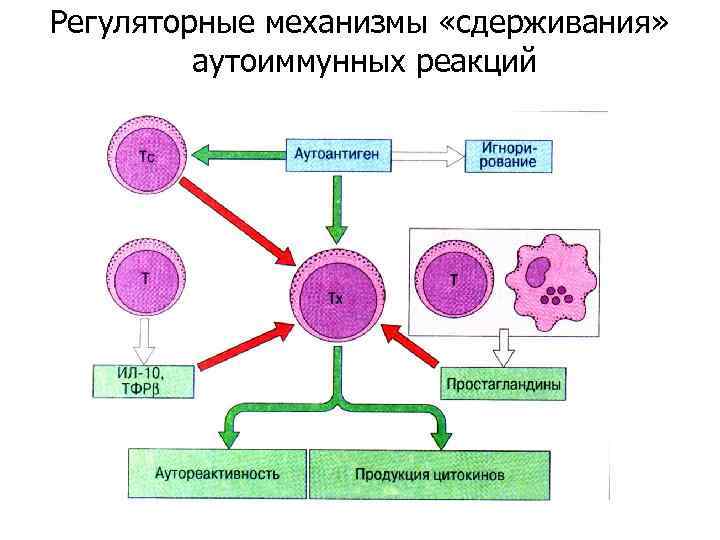
Регуляторные механизмы «сдерживания» аутоиммунных реакций

Способы лечения аутоиммунных заболеваний: сегодня и завтра В тяжелых случаях СКВ или хронического активного гепатита используют антимитотические средства, а при ревматоидном артрите широко применяются противовоспалительные препараты. При органоспецифических заболеваниях (например, при первичной микседеме) можно использовать заместительную терапию (например, тиреоидные гормоны). При необходимости трансплантации иммуносупрессивная терапия может защитить пересаженную ткань от разрушения.
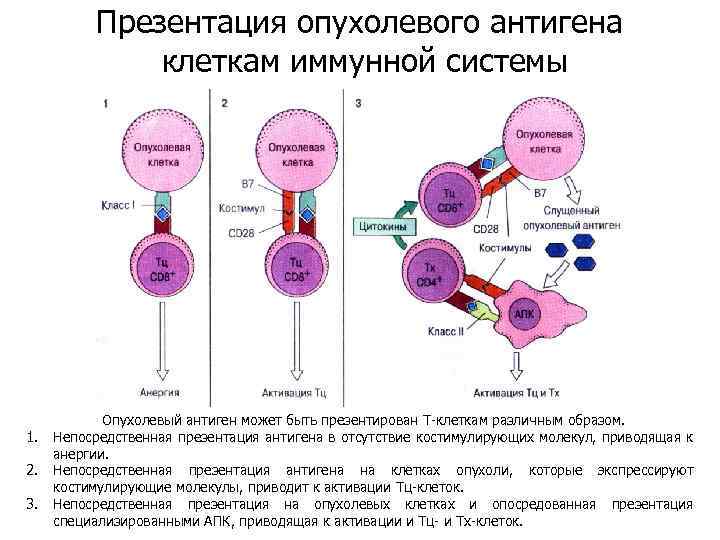
Презентация опухолевого антигена клеткам иммунной системы 1. 2. 3. Опухолевый антиген может быть презентирован Т-клеткам различным образом. Непосредственная презентация антигена в отсутствие костимулирующих молекул, приводящая к анергии. Непосредственная презентация антигена на клетках опухоли, которые экспрессируют костимулирующие молекулы, приводит к активации Тц-клеток. Непосредственная презентация на опухолевых клетках и опосредованная презентация специализированными АПК, приводящая к активации и Тц- и Тх-клеток.
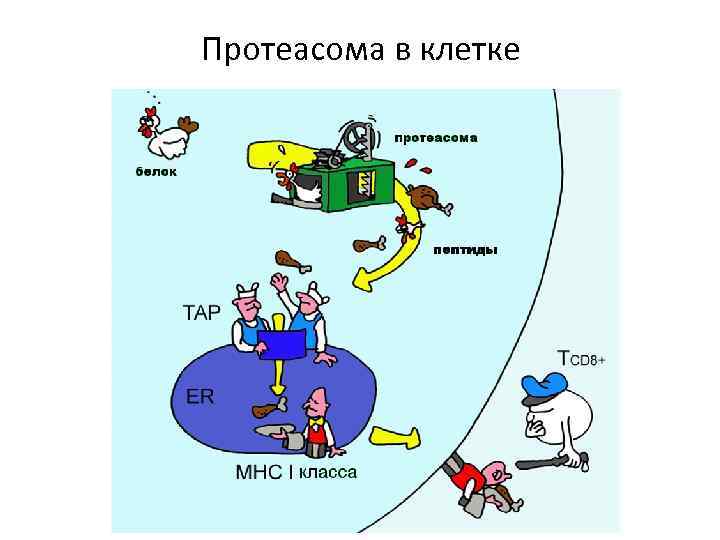
Протеасома в клетке
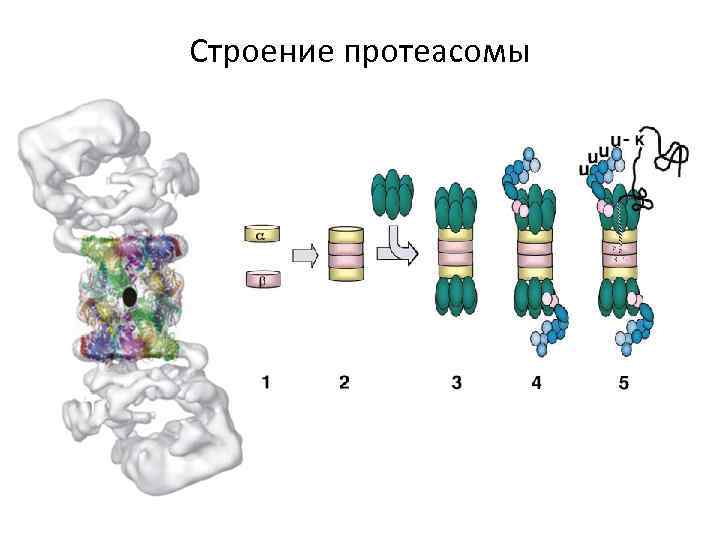
Строение протеасомы
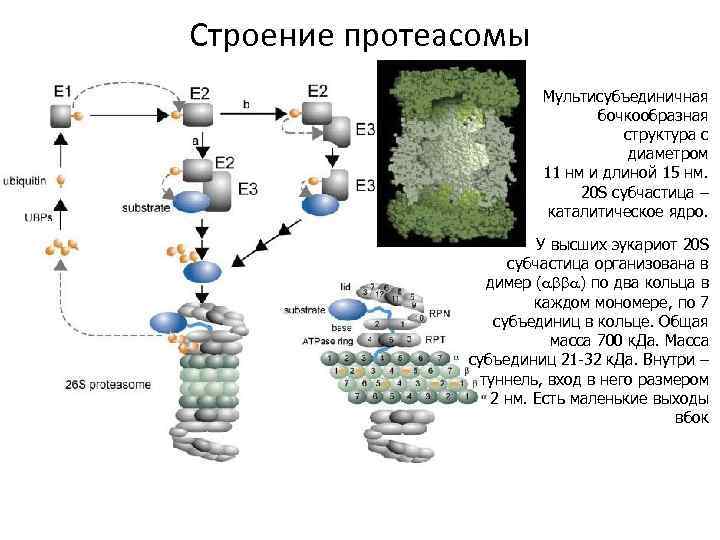
Строение протеасомы Мультисубъединичная бочкообразная структура с диаметром 11 нм и длиной 15 нм. 20 S субчастица – каталитическое ядро. У высших эукариот 20 S субчастица организована в димер ( ) по два кольца в каждом мономере, по 7 субъединиц в кольце. Общая масса 700 к. Да. Масса субъединиц 21 -32 к. Да. Внутри – туннель, вход в него размером 2 нм. Есть маленькие выходы вбок

Строение активных центров • β 1 (Y) субъединица проявляет каспазоподобную (пептидилглутамилпептидгидролазную PGPH) активность, • β 2 (Z)– активность трипсинового типа (T-L)и • β 5 (X) обладает химотрипсиноподобной активностью (Ch. T-L).
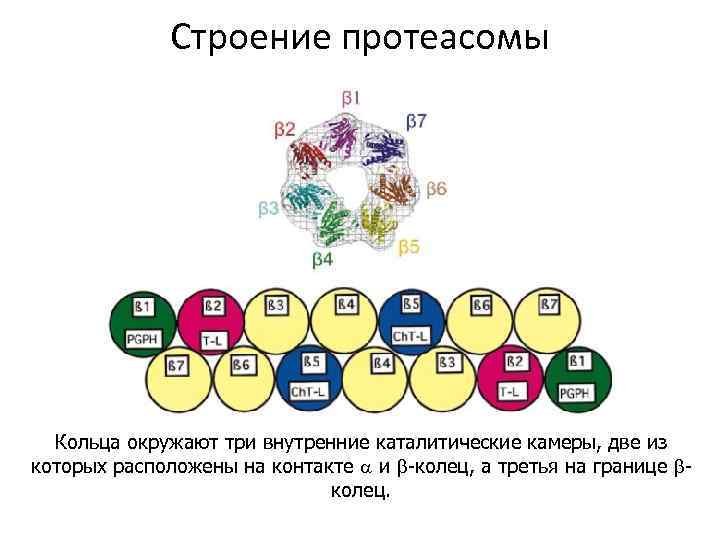
Строение протеасомы Кольца окружают три внутренние каталитические камеры, две из которых расположены на контакте и -колец, а третья на границе колец.
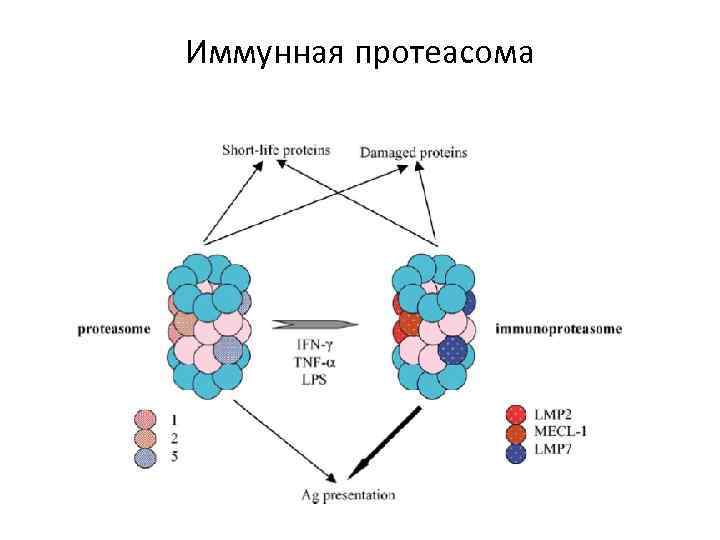
Иммунная протеасома
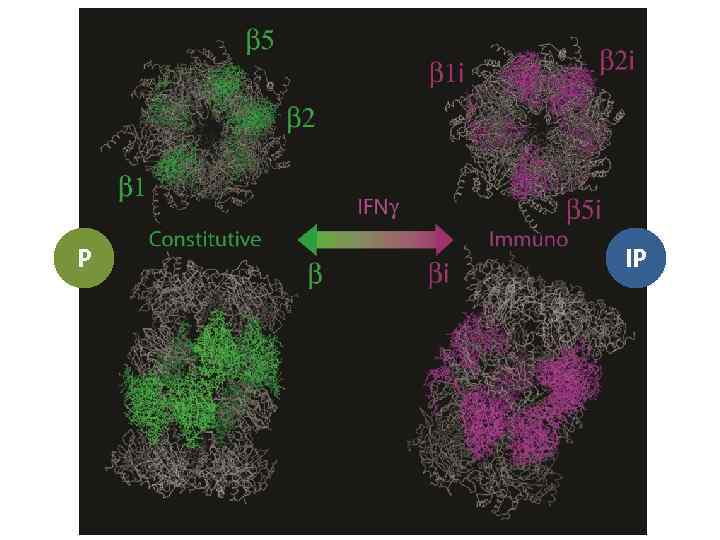
P IP

Brain: near to 100% const proteasome Spleen: 90% immuno proteasome
MULTIPLE SCLEROSIS Is it Immunoproteasome in CNS during MS? Is there any pathogenic role of the Immunoproteasome?
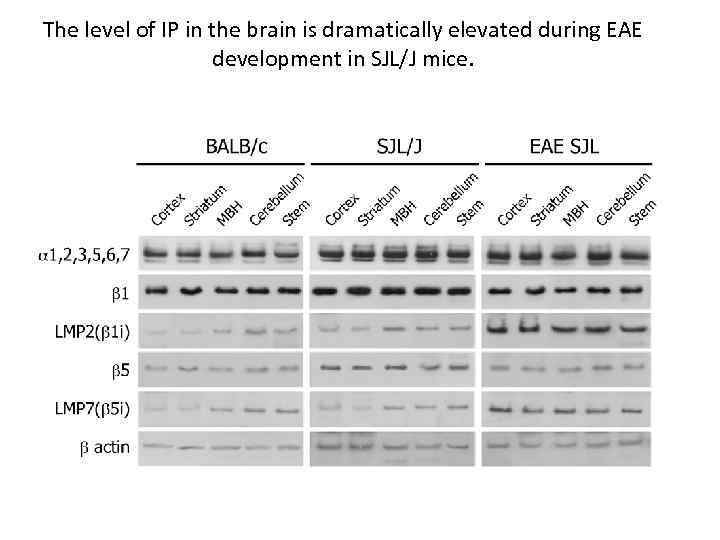
The level of IP in the brain is dramatically elevated during EAE development in SJL/J mice.


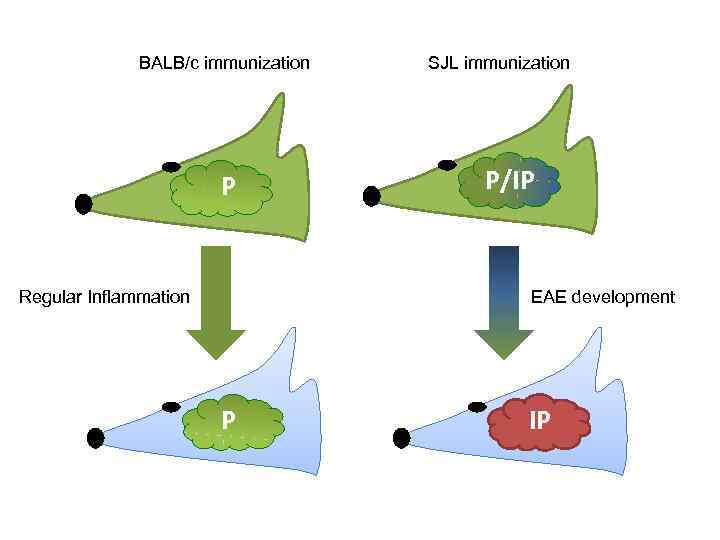
BALB/c immunization P Regular Inflammation SJL immunization P/IP EAE development P IP
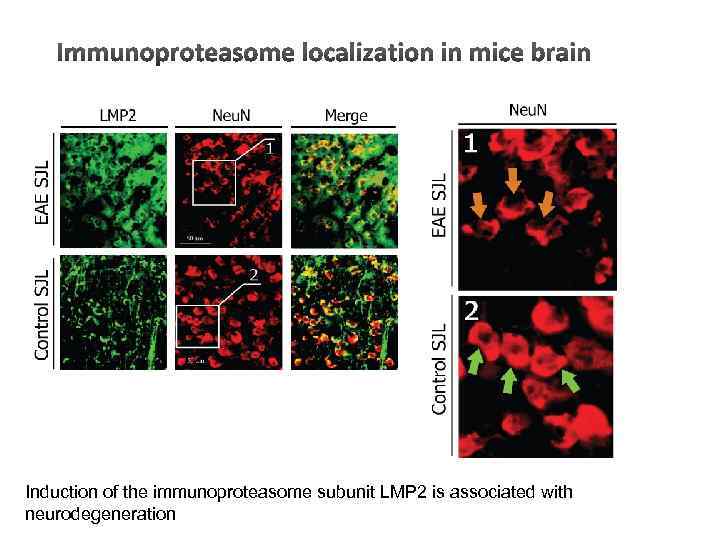
Induction of the immunoproteasome subunit LMP 2 is associated with neurodegeneration

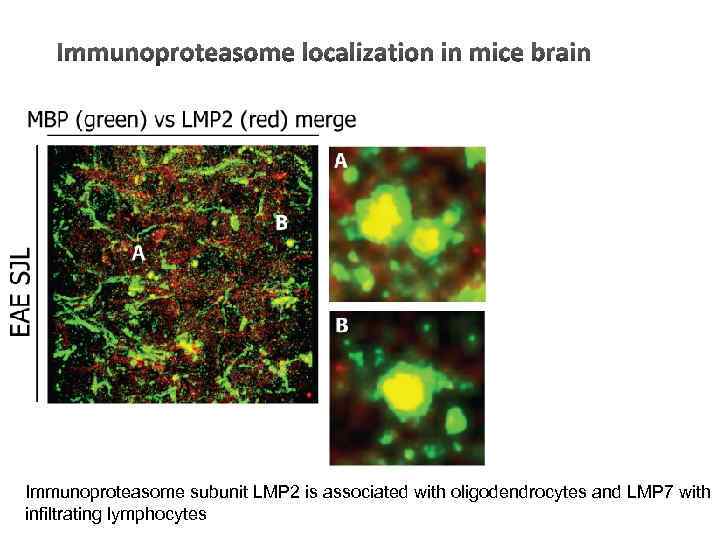
Immunoproteasome subunit LMP 2 is associated with oligodendrocytes and LMP 7 with infiltrating lymphocytes
The source of immune proteasome is SJL/J EAE mice
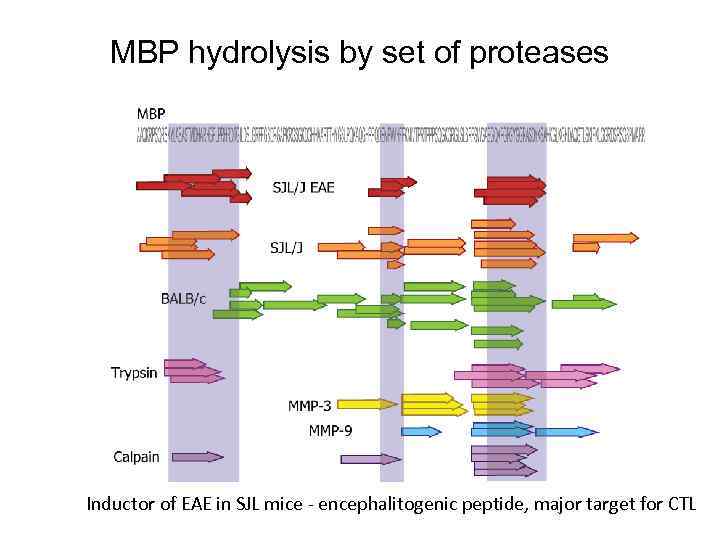
MBP hydrolysis by set of proteases Inductor of EAE in SJL mice - encephalitogenic peptide, major target for CTL
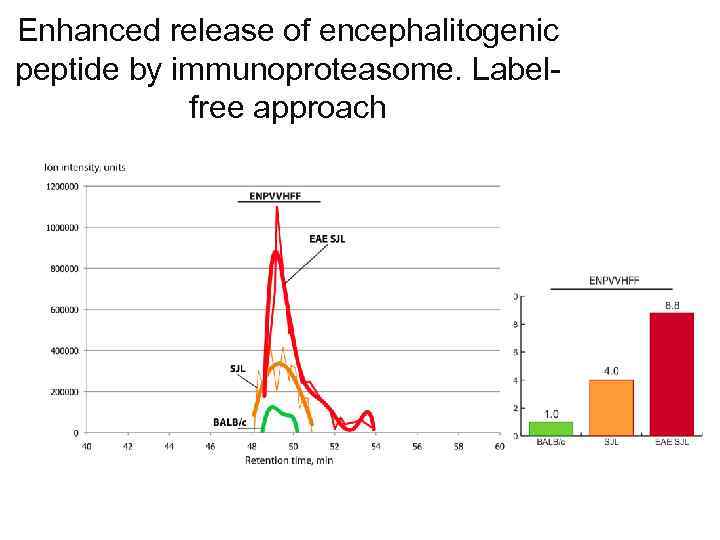
Enhanced release of encephalitogenic peptide by immunoproteasome. Labelfree approach
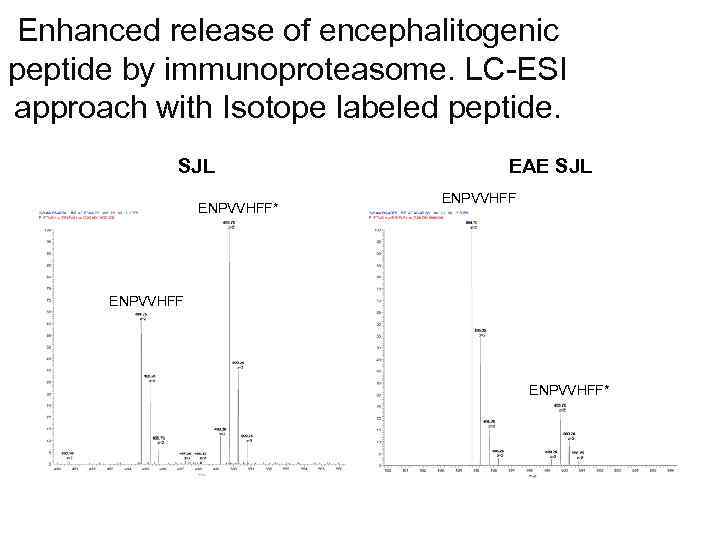
Enhanced release of encephalitogenic peptide by immunoproteasome. LC-ESI approach with Isotope labeled peptide. SJL ENPVVHFF* EAE SJL ENPVVHFF*
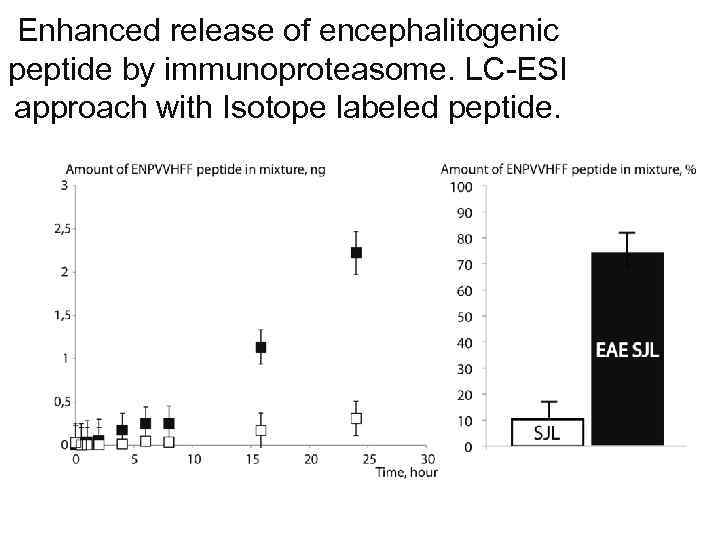
Enhanced release of encephalitogenic peptide by immunoproteasome. LC-ESI approach with Isotope labeled peptide.



IFN CD 4+ Th 1 Oligodendrocyte IFN ? CTLs


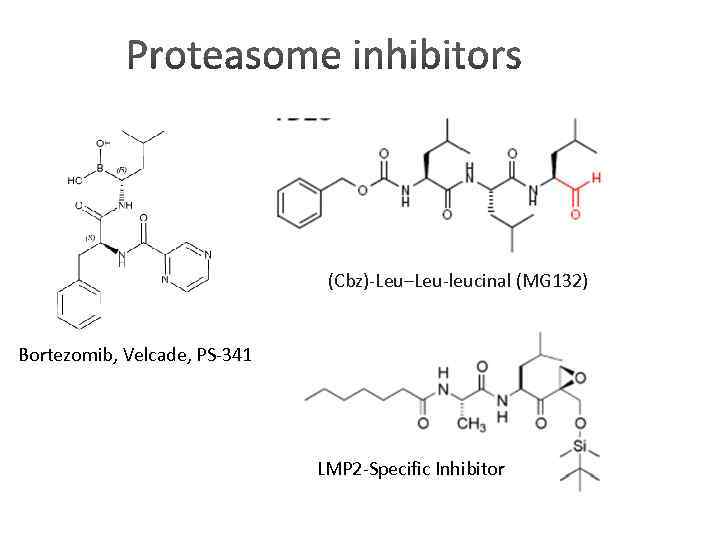
(Cbz)-Leu–Leu-leucinal (MG 132) Bortezomib, Velcade, PS-341 LMP 2 -Specific Inhibitor
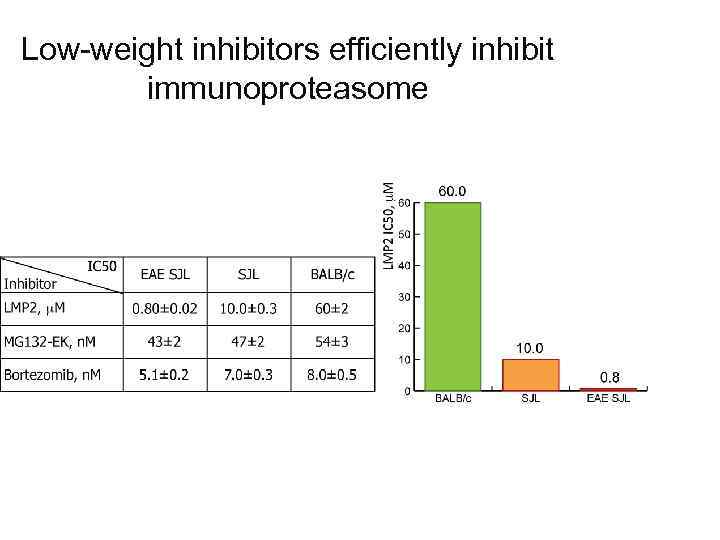
Low-weight inhibitors efficiently inhibit immunoproteasome

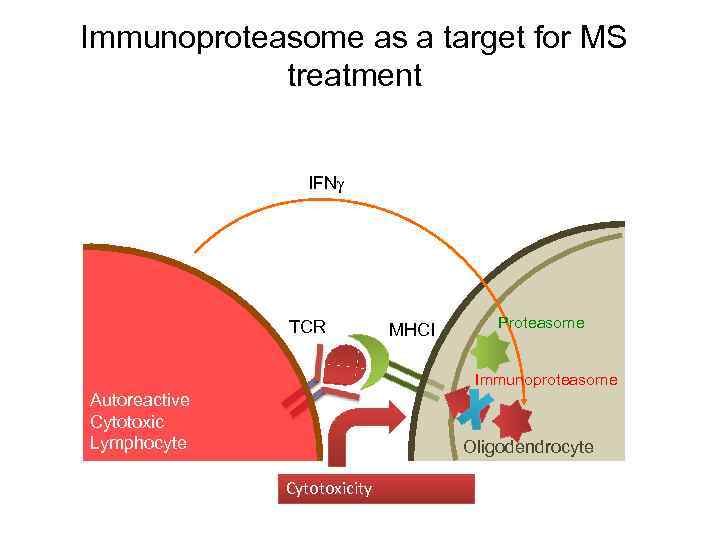
Immunoproteasome as a target for MS treatment IFN TCR MHCI Proteasome Immunoproteasome Autoreactive Cytotoxic Lymphocyte Oligodendrocyte Cytotoxicity

Conclusions
введение в иммунологию(19ноя2014).ppt