Лекция_3_2013.ppt
- Количество слайдов: 48

Лекция 3. Основы термодинамики поверхностных явлений. Избыточные термодинамические функции. Поверхностное натяжение и свободная энергия поверхностей раздела фаз. Связь поверхностного натяжения с объемными свойствами веществ. Термодинамическое уравнение Гиббса для поверхности раздела фаз в однокомпонентных системах. Поверхностная энергия твердых тел. Влияние морфологии, рельефа и адсорбции молекул. Состав поверхности, сегрегация компонентов в приповерхностных слоях. Неустойчивость дисперсных систем. Образование кластеров. Агрегация наночастиц, роль температуры и р. Н среды. Стабилизация наночастиц. Литература: В. И. Ролдугин// Физикохимия поверхности// Интеллект 2008. с 565 1
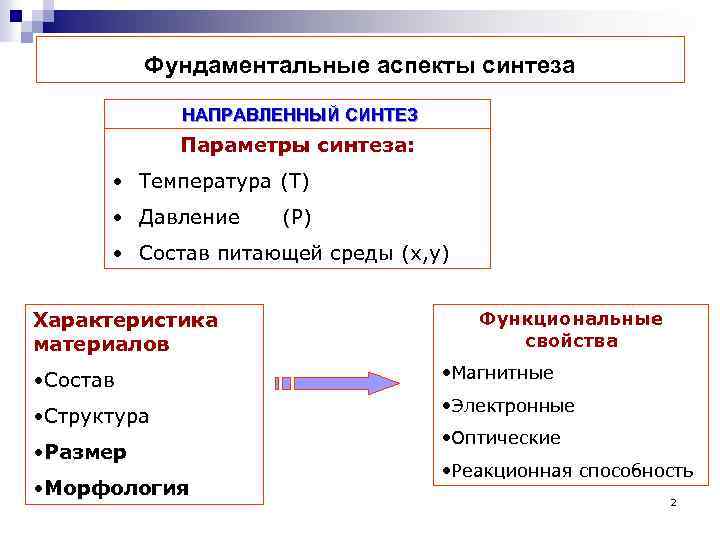
Фундаментальные аспекты синтеза НАПРАВЛЕННЫЙ СИНТЕЗ Параметры синтеза: • Температура (Т) • Давление (Р) • Состав питающей среды (х, у) Характеристика материалов • Состав • Структура • Размер • Морфология Функциональные свойства • Магнитные • Электронные • Оптические • Реакционная способность 2

Синтез высокодисперсных химических соединений 1. Прямой синтез в растворах 2. Реакции термического разложения 3. Химические транспортные реакции 3

4. 5. 6. CVD процесс Ионный обмен в растворах Интеркаляция (внедрение) 7. Золь-гель процесс 4

8. Электрохимические процессы 9. Процессы при высоких температурах, давлениях, энергетическом воздействии 5
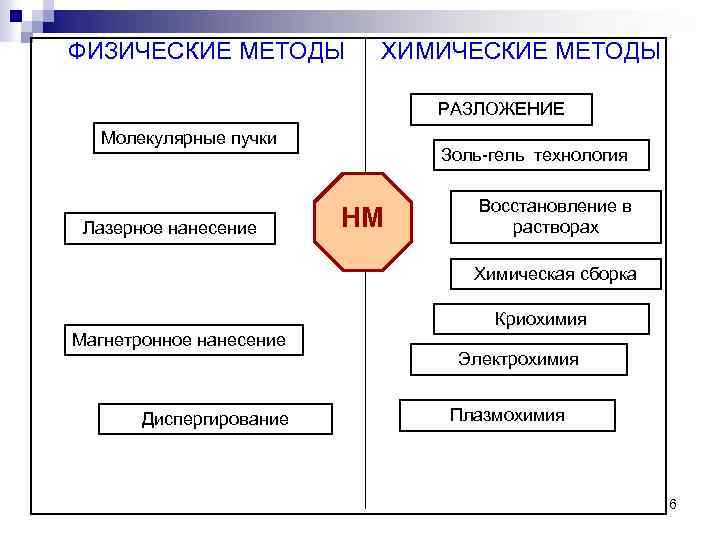
ФИЗИЧЕСКИЕ МЕТОДЫ ХИМИЧЕСКИЕ МЕТОДЫ РАЗЛОЖЕНИЕ Молекулярные пучки Лазерное нанесение Золь-гель технология НМ Восстановление в растворах Химическая сборка Криохимия Магнетронное нанесение Диспергирование Электрохимия Плазмохимия 6
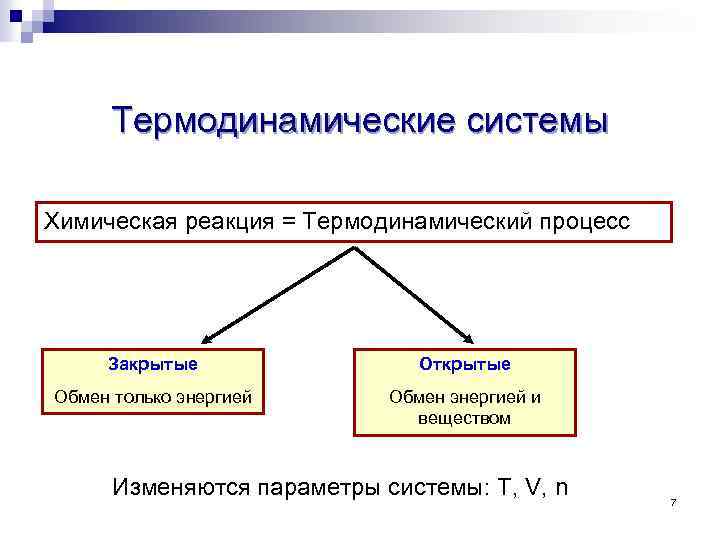
Термодинамические системы Химическая реакция = Термодинамический процесс Закрытые Открытые Обмен только энергией Обмен энергией и веществом Изменяются параметры системы: Т, V, n 7

Условия самопроизвольного протекания реакции Анализ изменения величины свободной энергии ΔG=ΔH-TΔS 8

Расчет изменения величины свободной энергии ΔG 9
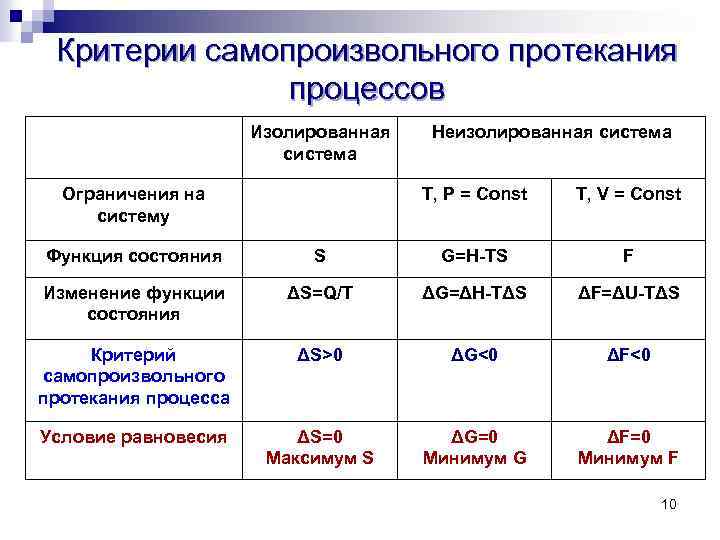
Критерии самопроизвольного протекания процессов Изолированная система Ограничения на систему Неизолированная система T, P = Const T, V = Const Функция состояния S G=H-TS F Изменение функции состояния ΔS=Q/T ΔG=ΔH-TΔS ΔF=ΔU-TΔS Критерий самопроизвольного протекания процесса ΔS>0 ΔG<0 ΔF<0 Условие равновесия ΔS=0 Максимум S ΔG=0 Минимум G ΔF=0 Минимум F 10

Термодинамическая оценка возможности реакции ΔG = ΔH-TΔS Самопроизвольное протекание реакции ΔG<0 ΔH<0 ΔS>0 Начало реакции Т=1108 К 11

Термодинамическая оценка возможности реакции Реакции окисления, Экзотермические реакции 12

Термодинамическая оценка возможности реакции Эндотермическая реакция Начало реакции Т=588 К 13

Химическое равновесие 14

Условия химического равновесия 15

Химический потенциал Часть энергии, которая расходуется на перераспределение масс в системе, т. е. на совершение химической реакции, может быть представлена в виде суммы где Δn – изменение количества данного вещества, μ – химический потенциал. При р, Т = const Химический потенциал некоторого вещества характеризует изменение энергии Гиббса системы при добавлении этого вещества в систему при постоянных давлении, температуре и количестве других веществ
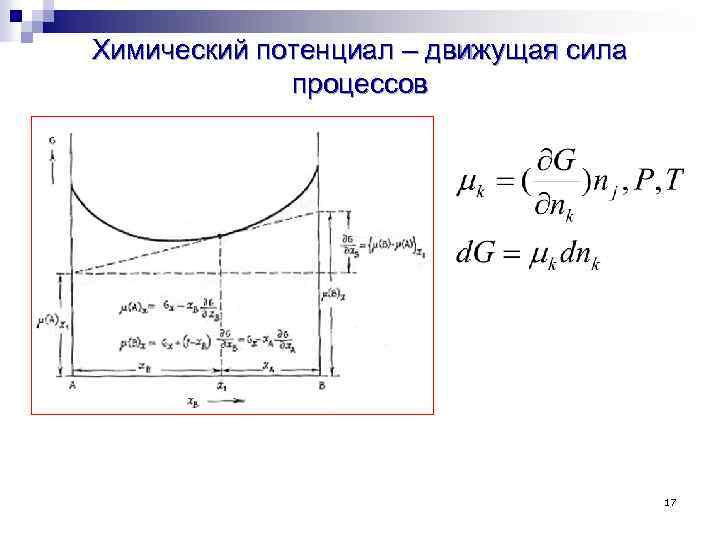
Химический потенциал – движущая сила процессов 17

Гомогенная система, фаза Гомогенная система – система, которая характеризуется непрерывным изменением или одинаковым значением термодинамических свойств при переходе от точки к точке Фаза – гомогенная часть гетерогенной системы (совокупность частей), отделенная от других частей системы поверхностью раздела 18
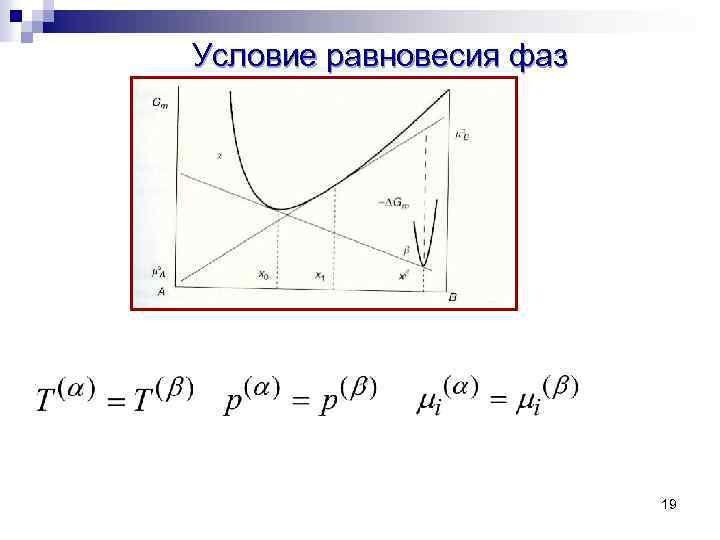
Условие равновесия фаз 19
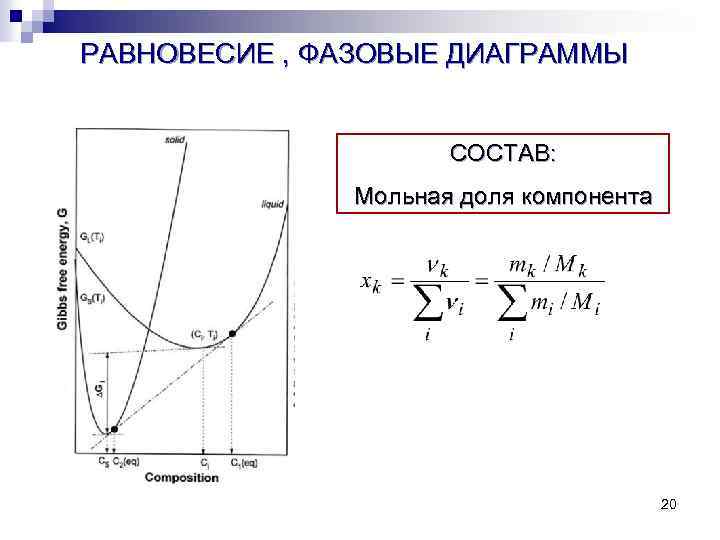
РАВНОВЕСИЕ , ФАЗОВЫЕ ДИАГРАММЫ СОСТАВ: Мольная доля компонента 20

Правило фаз Гиббса С=К–Ф+2–a С- число степеней свободы Ф- число фаз К- число компонентов a – число ограничений, накладываемых на систему 21
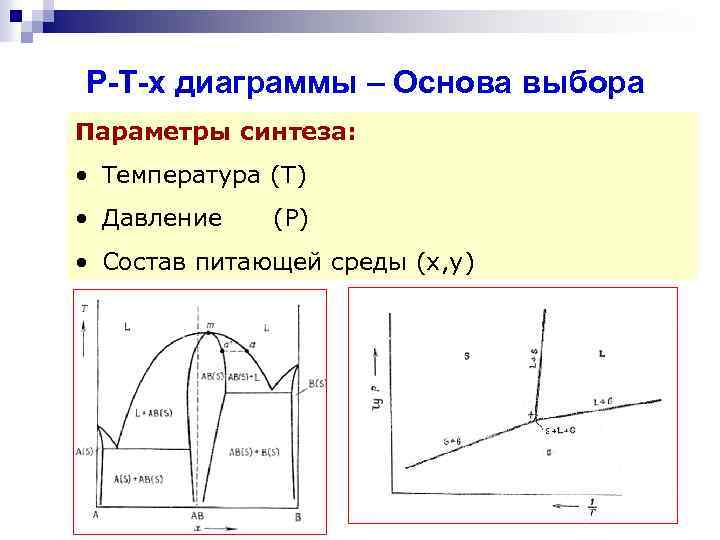
Р-Т-х диаграммы – Основа выбора параметров синтеза Параметры синтеза: • Температура (Т) • Давление (Р) • Состав питающей среды (х, у) 22

Механизмы синтеза твердых веществ 1. Из пара V-S 2. Из раствора L-S 3. Из расплава L-S 4. Пар-жидкость –кристалл V-L-S 5. Твердофазный синтез S(1) – S(2) 23
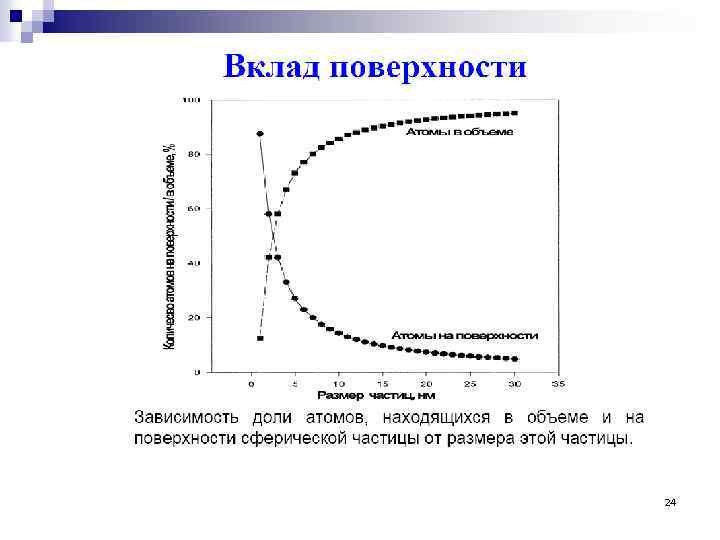
24

Термодинамика поверхности Подход Гиббса Планетарная модель – непрерывный переход от фазы (α) к фазе (β) 25
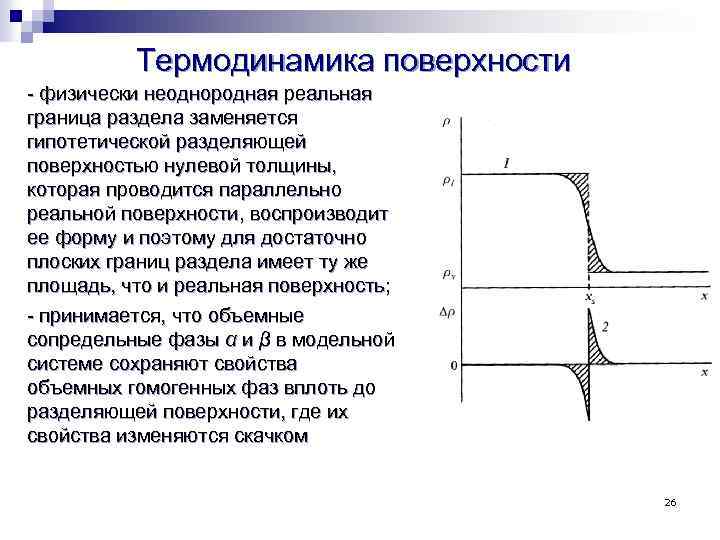
Термодинамика поверхности - физически неоднородная реальная граница раздела заменяется гипотетической разделяющей поверхностью нулевой толщины, которая проводится параллельно реальной поверхности, воспроизводит ее форму и поэтому для достаточно плоских границ раздела имеет ту же площадь, что и реальная поверхность; - принимается, что объемные сопредельные фазы α и β в модельной системе сохраняют свойства объемных гомогенных фаз вплоть до разделяющей поверхности, где их свойства изменяются скачком 26

Избыточные термодинамические функции 27

Свободная энергия поверхности уравнение Гиббса Коэффициент пропорциональности γ является основной характеристикой поверхности и называется коэффициентом поверхностного натяжения. Поверхностное натяжение связано с работой, затрачиваемой на разрыв межмолекулярных связей. 28

уравнение Гиббса-Дюгема Для гомогенной системы Объем Для гетерогенной системы Поверхность - работа в гомогенной системе связана с уменьшением объема, а в гетерогенной системе – с увеличением поверхности; - в самопроизвольных процессах объем растет, а поверхность уменьшается 29
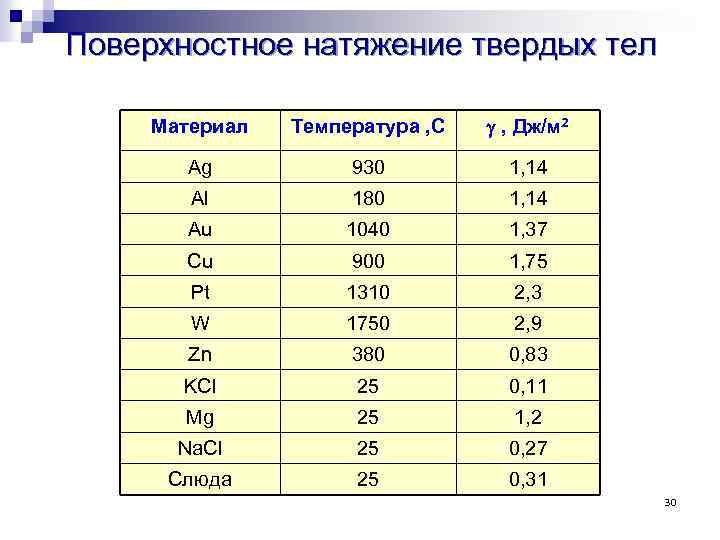
Поверхностное натяжение твердых тел Материал Температура , С g , Дж/м 2 Ag 930 1, 14 Al 180 1, 14 Au 1040 1, 37 Cu 900 1, 75 Pt 1310 2, 3 W 1750 2, 9 Zn 380 0, 83 KCl 25 0, 11 Mg 25 1, 2 Na. Cl 25 0, 27 Слюда 25 0, 31 30

Анизотропия поверхностного натяжения Правило Кюри-Вульфа для разных кристаллографических плоскостей Минимальное значение суммарной поверхностной энергии h - расстояние грани от центра кристалла 31
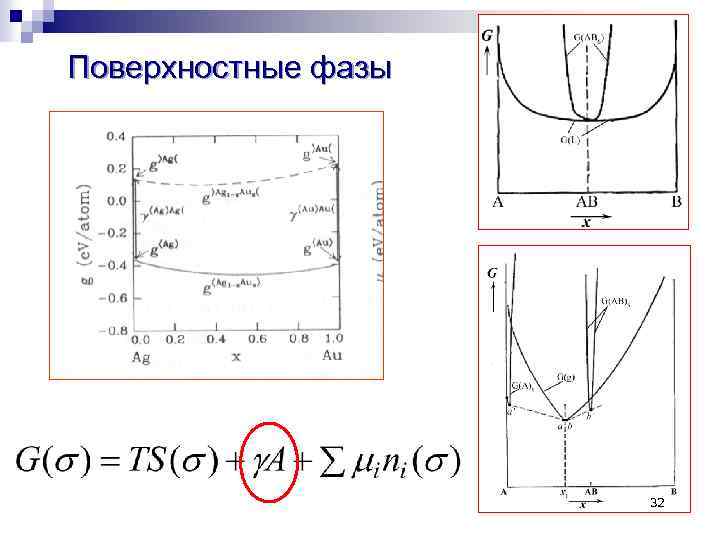
Поверхностные фазы 32
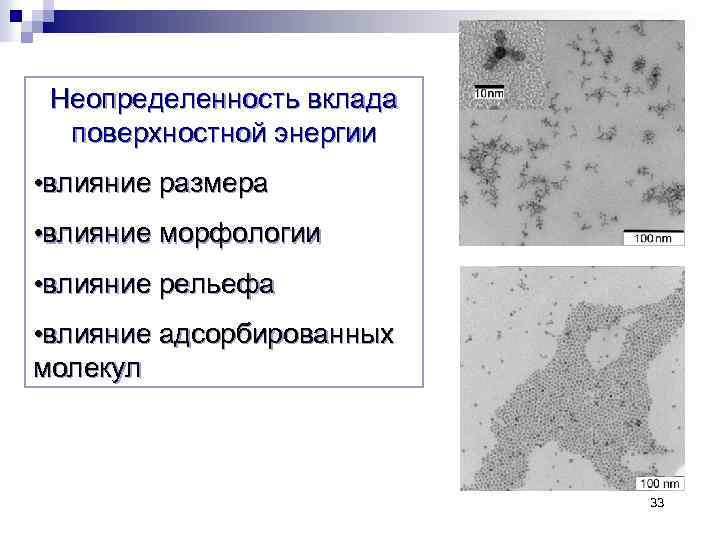
Неопределенность вклада поверхностной энергии • влияние размера • влияние морфологии • влияние рельефа • влияние адсорбированных молекул 33

Состав поверхности Мольная свободная энергия системы: Фаза (β) + поверхность (σ) 34
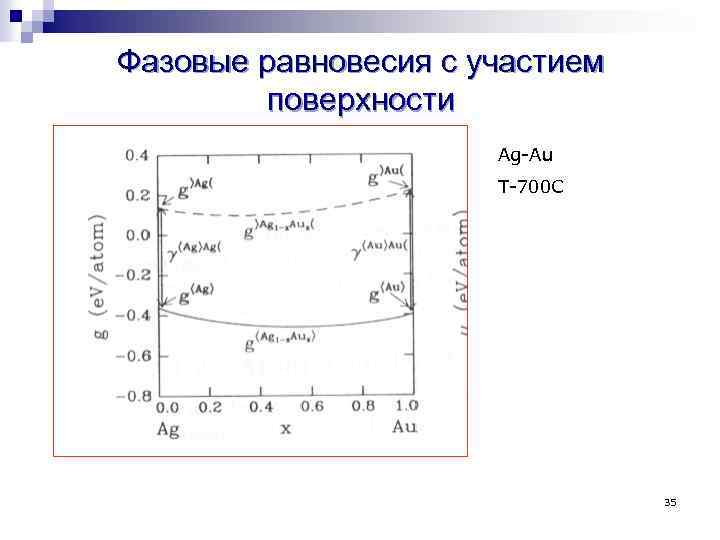
Фазовые равновесия с участием поверхности Ag-Au T-700 С 35
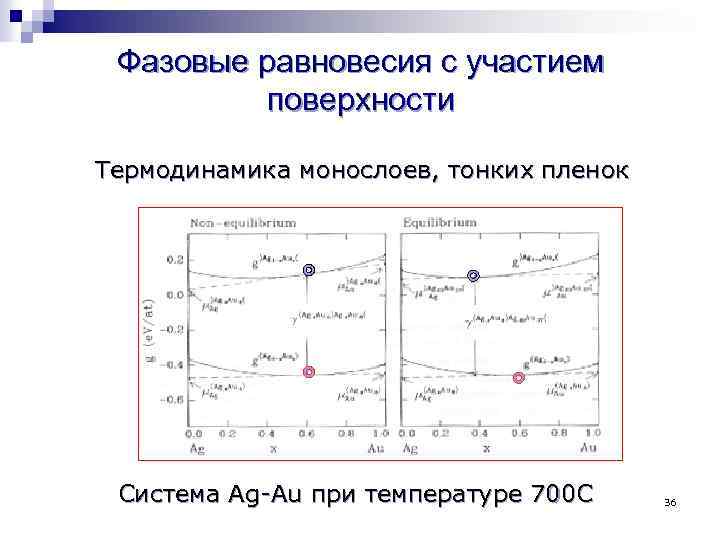
Фазовые равновесия с участием поверхности Термодинамика монослоев, тонких пленок Система Ag-Au при температуре 700 С 36
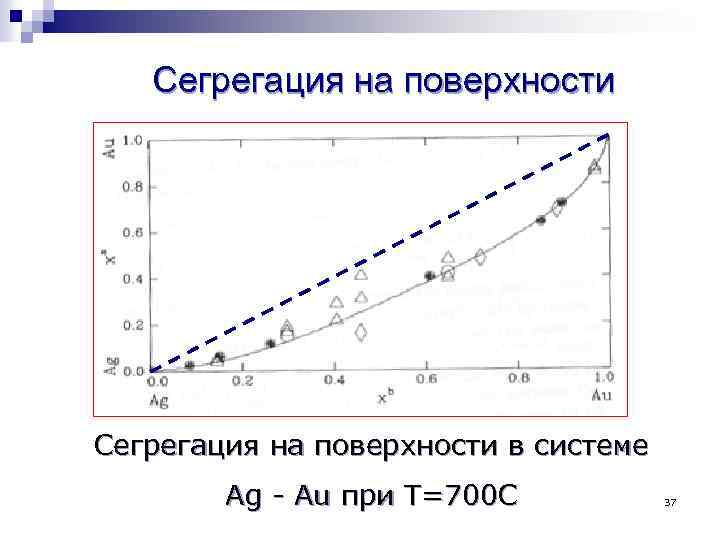
Сегрегация на поверхности в системе Ag - Au при T=700 C 37

Состав поверхности Поверхностная сегрегация 38
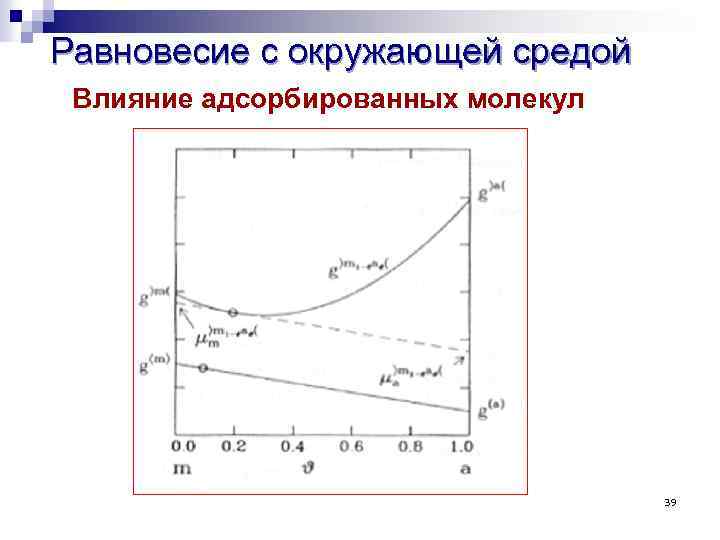
Равновесие с окружающей средой Влияние адсорбированных молекул 39
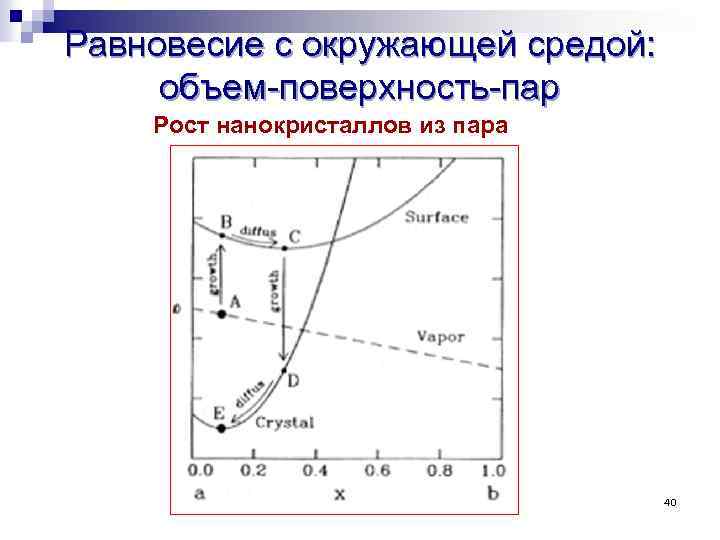
Равновесие с окружающей средой: объем-поверхность-пар Рост нанокристаллов из пара 40

Выводы 1. С уменьшением размера частиц возрастает поверхностная энергия и общая энергия системы 2. Свободная энергия зависит от кривизны поверхности (морфологии) 3. Для наночастиц координаты фазовых полей отличаются от объемных Р-Т-х диаграмм 4. Состав поверхности отличается от состава объема 5. Состав поверхности зависит от метода получения 6. Состав поверхности зависит от состава окружающей среды 7. Наночастицы лабильны их надо стабилизировать 41

42

43
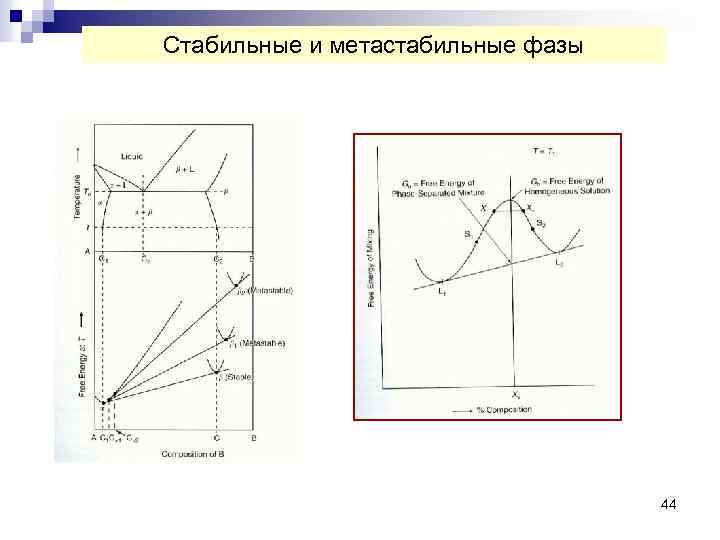
Стабильные и метастабильные фазы 44
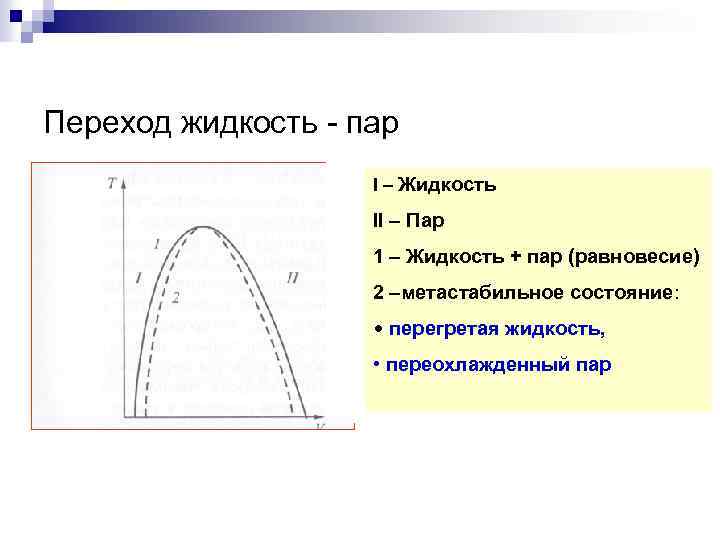
Переход жидкость - пар I – Жидкость II – Пар 1 – Жидкость + пар (равновесие) 2 –метастабильное состояние: • перегретая жидкость, • переохлажденный пар
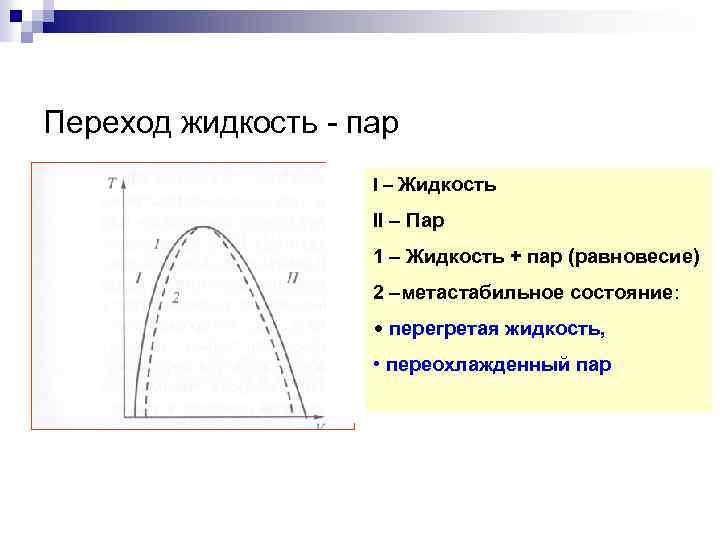
Переход жидкость - пар I – Жидкость II – Пар 1 – Жидкость + пар (равновесие) 2 –метастабильное состояние: • перегретая жидкость, • переохлажденный пар

Сегрегация на поверхности РОЛДУГИН с 148 - рисунок 47

Условия синтеза : параметры взаимодействия фаз Уравнение Ван дер Ваальса 48
Лекция_3_2013.ppt