Лекция_Методы анализа_ 2_заочное.ppt
- Количество слайдов: 51

Лекция 3. Оптические методы анализа в мониторинге объектов ОС Преподаватель кафедры геоэкологии и прикладной геохимии О. С. Решетняк

К оптическим методам анализа относят физико химические методы, основанные на взаимодействии электромагнитного излучения с веществом. Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения излучения, отражения и рассеяния электромагнитного излучения. Фотометрические методы. Спектральные методы Атомно-абсорбционные методы Нефелометрия и турбудиметрия. Люминесцентный анализ.

1. Фотометрические методы анализа Фотометрический анализ относится к абсорбционным методам, т. е. основан на измерении поглощения света веществом. Он включает спектрофотометрию, фотоколориметрию и визуальную фотометрию (колориметрией). Каждое вещество поглощает излучение с определенными (характерные только для него) длинами волн, т. е. длина волны поглощаемого излучения индивидуальна для каждого вещества, и на этом основан качественный анализ по светопоглошению.
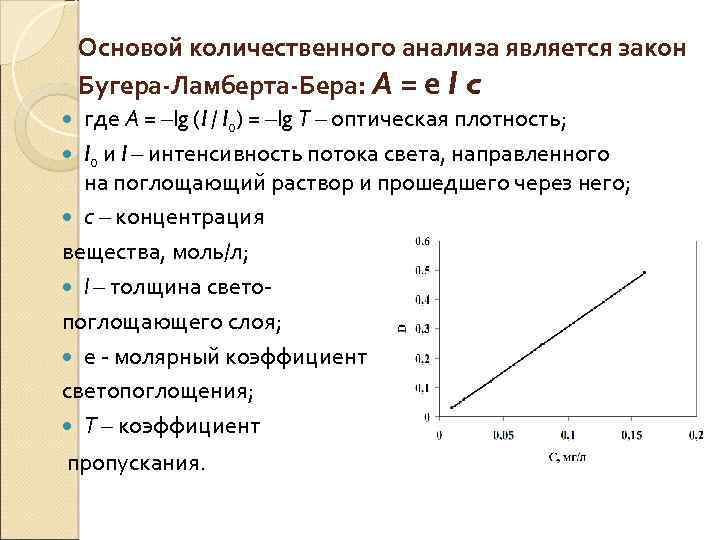
Основой количественного анализа является закон Бугера-Ламберта-Бера: А = e l c где А = –lg (I / I 0) = –lg T – оптическая плотность; I 0 и I – интенсивность потока света, направленного на поглощающий раствор и прошедшего через него; с – концентрация вещества, моль/л; l – толщина светопоглощающего слоя; e - молярный коэффициент светопоглощения; T – коэффициент пропускания.

Для определения концентрации анализируемого вещества наиболее часто используют следующие приёмы (методы): 1) метод молярного коэффициента светопоглощения; 2) метод градуировочного графика; 3) метод добавок; 4) метод дифференциальной фотометрии; 5) метод фотометрического титрования. Метод молярного коэффициента поглощения. Определяют оптическую плотность нескольких стандартных растворов Аст Для каждого раствора рассчитывают e = Аст / (lсст) и полученное значение e усредняют. Измеряют оптическую плотность анализируемого раствора Ах и рассчитывают концентрацию сх по формуле сх = Ах /(el).
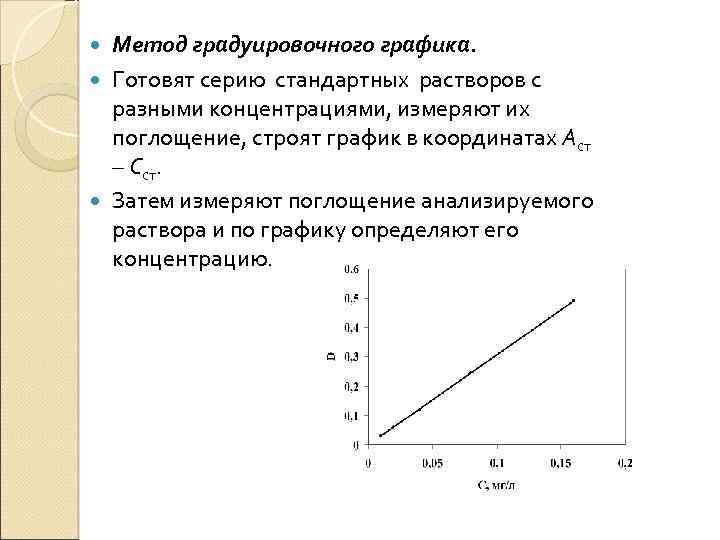
Метод градуировочного графика. Готовят серию стандартных растворов с разными концентрациями, измеряют их поглощение, строят график в координатах Аст – Сст. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию.

Метод добавок. Этот метод применяют при анализе растворов сложного состава (позволяет учесть влияние мешающих компонентов). Сначала определяют оптическую плотность Ах анализируемого раствора, содержащего определяемый компонент неизвестной концентрации сх, а затем в анализируемый раствор добавляют известное количество определяемого компонента (сст) и вновь измеряют оптическую плотность Ах+ст. Оптическая плотность Ах анализируемого раствора равна Ах = e l cх а оптическая плотность анализируемого раствора с добавкой стандартного Ах+ст = e l (cх + сст). Концентрацию анализируемого раствора находим по формуле: сх = сст Ах / (Ах+ст – Ах).

Применение методов фотометрии: для контроля разнообразных производственных процессов; для определения биогенных веществ, тяжелых металлов, СПАВ и др. ; для анализа больших и малых содержаний, но особенно ценной их особенностью является возможность определения примесей (до 10 -5. . . 10 -6%); используют в химической, металлургической, фармацевтической и других отраслях, а также в медицине и сельскохозяйственном производстве.

Приборы для измерения оптической плотности Приборы, которые реализуют данный фотометрический метод определения концентраций вещества, называются (фотоэлектроколориметры (фотометры) (ФЭК и КФК) и спектрофотометры (СФ). Фотоэлектроколориметры и спектрофотометры принципиально отличаются по оптической системе выделения узкого пучка излучения. В фотоэлектроколориметрах выделение определенного спектра излучения осуществляется пропусканием через цветные светофильтры. Поэтому в ФЭКах спектр излучения широкополосный, например, спектр в диапазоне 440 -480 нм. Спектрофотометры снабжены монохроматорами, позволяющими выделять узкополосный свет определенной длины волны. Эти приборы более совершенные и их использование позволяет увеличить чувствительность метода, т. е. позволяет определять более низкие концентрации веществ.

Фотоэлектроколориметр КФК-3 Фото

Достоинства (высокая чувствительность, точность, простота выполнения) и недостатки метода (ограничения): Условия выполнения фотометрических методов анализа веществ Фотометрическое определение выполняют при оптимальных условиях, которые обеспечивают полноту образования аналитической формы вещества и минимальные отклонения от закона Бугера-Ламберта. Бера: - определенный р. Н раствора - достаточный избыток реагента - избирательность аналитической реакции - выбор наилучших условий измерения поглощения При фотометрии необходимо использовать истинные растворы. Они должны быть прозрачными, не содержать взвешенных веществ и опалесценции.

2. Спектральный анализ (спектроскопия) Совокупность методов, основанных на исследовании эмиссионных спектров, которые образуют различные вещества при нагревании их в пламени электрической дуги, искры. Разновидности метода: Эмиссионный спектральный анализ (дуга, искра). Пламенная эмиссионная спектроскопия (пламя). Достоинства метода: автоматизация анализов; прямой анализ твердых проб; высокая чувствительность; определение низких концентраций, примесей. Недостатки метода: сложность приборного оснащения.

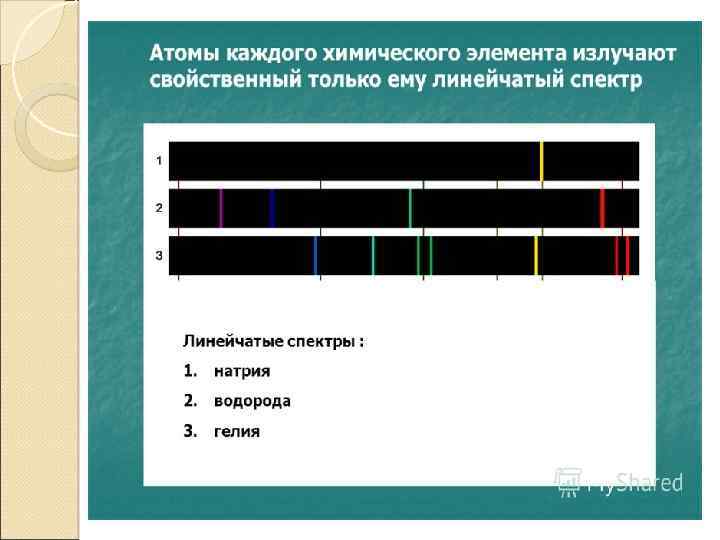
Эмиссионный спектральный анализ Основан на получении и изучении спектров испускания (эмиссионных спектров). По положению и относительной интенсивности отдельных линий в этих спектрах проводят качественный спектральный анализ (основан на индивидуальности эмиссионных спектров каждого элемента). Сравнивая интенсивность специально выбранных спектральных линий в спектре пробы с интенсивностью тех же линий в спектрах эталонов, определяют содержание элемента - количественный спектральный анализ. Расшифровка спектров осуществляется либо на стилоскопе (визуально), либо на спектропроекторе или микроскопе после фотографирования спектров на фотопластинку.
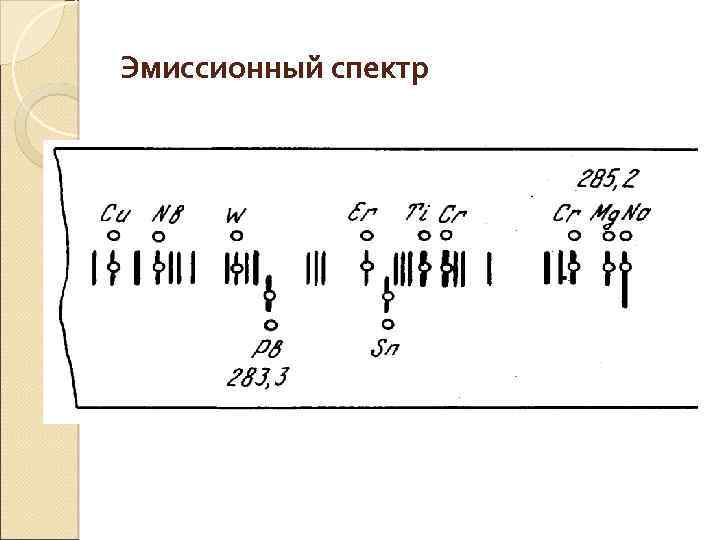
Эмиссионный спектр

Количественный спектральный анализ основан на том, что интенсивность спектральных линий элемента зависит от концентрации этого элемента в пробе. Зависимость интенсивности спектральной линии от концентрации выражается эмпирическим уравнением Б. Б. Ломакина: I = a cb где I - интенсивность спектральной линии; а - постоянная, объединяющая свойства линии (искровая, дуговая линия, узкая, широкая), условия возбуждения (скорость испарения, скорость диффузии) и другие факторы; с - концентрация элемента в пробе; b - коэффициент самопоглощения.

Эмиссионный спектрометр МФС-12 Спектрометр МФС-12 предназначен для анализа черных металлов и сплавов на все легирующие элементы и примеси, за исключением серы и фосфора, а также цветных металлов и сплавов.

Применение методов спектрального анализа Методами эмиссионного спектрального анализа выполняется значительная часть анализов в металлургической промышленности. Анализируется исходное сырье и готовая продукция. Используется для анализа природных и сточных вод, почвы, атмосферы и других объектов окружающей среды, а также в медицине, биологии и т. д. Средний предел обнаружения методами эмиссионной спектроскопии составляет от 10 -3. . . 10 -4 % до 10 -5 %. Погрешность определения характеризуется в среднем величиной 1 -2%.

3. Атомно-абсорбционный анализ Основу атомно-абсорбционной спектроскопии составляет поглощение резонансной частоты атомами в газовой фазе. Если на невозбужденные атомы направить излучение света с резонансной частотой поглощения атомов, то излучение будет поглощаться атомами, а его интенсивность уменьшится. И таким образом, если в эмиссионной спектроскопии концентрация вещества связывалась с интенсивностью излучения, которое было прямо пропорционально числу возбужденных атомов, то в атомноабсорбционной спектроскопии аналитический сигнал (уменьшение интенсивности излучения) связан с количеством невозбужденных атомов.

Уменьшение интенсивности резонансного излучения в условиях атомно-абсорбционной спектроскопии подчиняется экспоненциальному закону убывания интенсивности в зависимости от длины оптического пути и концентрации вещества, аналогичному закону Бугера-Ламберта-Бера. Если I 0 - интенсивность падающего монохроматического света, а I - интенсивность этого света, прошедшего через пламя, то величину lg(I 0/I) можно назвать оптической плотностью. Концентрационная зависимость оптической плотности выражается уравнением lg (I 0/I) = А = k l c , где k - коэффициент поглощения; l - толщина светопоглощаюшего слоя (пламени); с - концентрация.

Применение метода атомно-абсорбционного анализа Методы ААС используются в анализе практически любого технического или природного объекта, особенно там, где необходимо определить небольшие содержания элементов. Методики атомно-абсорбционного определения разработаны более чем для 70 элементов периодической системы Д. И. Менделеева. Предел обнаружения для многих элементов характеризуется величиной порядка 10 -5. . . 10 -6%. Погрешность определения примерно 5% (от 3 до 10%). Метод имеет также ряд ограничений. Атомноабсорбционным методом не определяются элементы, резонансные линии которых лежат в далеком ультрафиолете (углерод, фосфор, галогены и др. ).
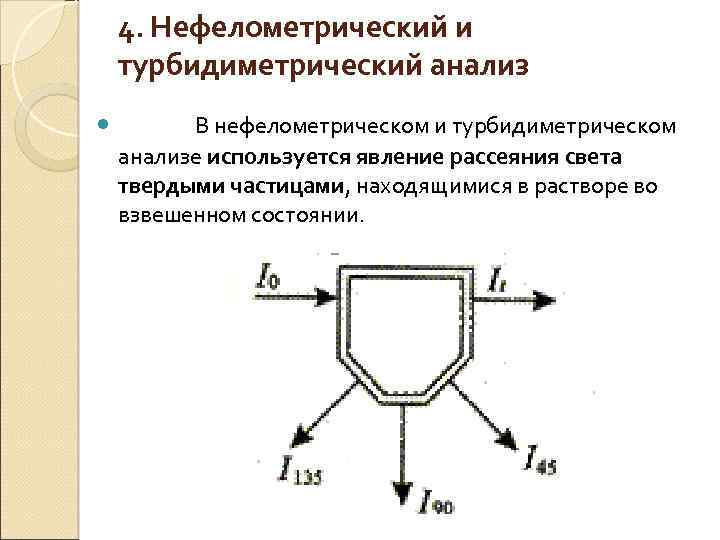
4. Нефелометрический и турбидиметрический анализ В нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии.

Метод, в котором используют интенсивность прошедшего света It, называют турбидиметрией, а метод с измерением под углом 90 о (или какимлибо другим) – нефелометрией. При турбидиметрических измерениях величина, называемая мутностью, соответствует оптической плотности и может быть определена из соотношения, аналогичного основному закону светопоглошения: S = lg (I 0/I) = k b N, где S – мутность; k – коэффициент пропорциональности, называемый коэффициентом мутности; b – длина пути; N – число рассеивающих частиц в единице объема.

Используемое в нефелометрии расчетное соотношение следующее: I = K a c I 0 где Ka - эмпирическая константа системы (a - угол, под которым проводят измерения); с – концентрация. Применение методов, основанных на измерении рассеяния света, достаточно ограничено (на результат сильно влияет размер частиц). Применяют методы для анализа мутных растворов, определения средней молекулярной массы полимеров в растворах. Еще одно направление практического использования таких методов – это применение лазеров для дистанционного определения частиц, содержащихся в воздушном пространстве.

5. Люминесцентный анализ Люминесценция - свечение вещества после поглощения им энергии возбуждения: М* ―> М + h v Переходя в более низкое энергетическое состояние, возбужденные частицы испускают квант света - люминесцируют. Люминесцентные методы основаны на возбуждении электронных спектров испускания молекул определенного вещества при внешнем ультрафиолетовом облучении и измерении интенсивности свечения (люминесценции). Интенсивность люминесценции прямо пропорциональна концентрации вещества.

Качественный люминесцентный анализ основан на возникновении или исчезновении люминесцентного излучения, т. е. использует сам факт люминесценции исследуемого вещества. Различают: Флуоресценцию, когда свечение прекращается сразу после прекращения действия источника возбуждения (длительность послесвечения 10 -6 -10 -9 сек). Фосфоресценцию, когда свечение продолжается некоторое время после прекращения действия источника возбуждения (длительность послесвечения 10 -2 -10 -3 сек).

Количественный люминесцентный анализ основан на использовании соотношения, связывающего интенсивность флуоресценции Iл с концентрацией флуоресцирующего вещества с: Iл = k c В практике количественного люминесцентного анализа обычно применяют метод градуировочного графика.

Возможности люминесцентных методов анализа Флуоресценция свойственна в основном органическим веществам. Из неорганических соединений способностью к флуоресценции обладают редкоземельные элементы и уран, фосфоресценции - фосфор. Люминесцентные методы – одни из наиболее чувствительных методов химического анализа. Предел обнаружения составляет 10 -15 % (массовая доля). Относительная погрешность 5 -10%. Эти методы используются для определения концентраций нефтепродуктов, органических кислот, синтетических поверхностно-активных веществ СПАВ, полициклических ароматических углеводородов ПАУ.

«ФЛЮОРАТ®-02 -3 М» Анализатор жидкости «ФЛЮОРАТ®-02 -3 М» предназначен для измерения массовой концентрации неорганических и органических примесей в воде, а также воздухе, почве, технических материалах, пищевых продуктах после переведения примесей в раствор. Применяется для аналитического контроля объектов окружающей среды, санитарного контроля и контроля технологических процессов. Отличительные особенности: • низкие пределы определения; • высокая селективность; • широкая номенклатура определяемых показателей

4. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА В МОНИТОРИНГЕ объектов ОС Преподаватель, к. г. н. О. С. Решетняк
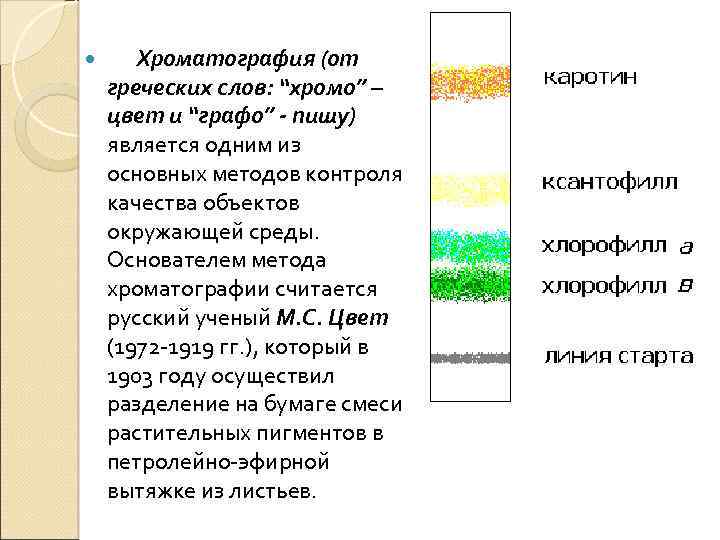
Хроматография (от греческих слов: “хромо” – цвет и “графо” - пишу) является одним из основных методов контроля качества объектов окружающей среды. Основателем метода хроматографии считается русский ученый М. С. Цвет (1972 -1919 гг. ), который в 1903 году осуществил разделение на бумаге смеси растительных пигментов в петролейно-эфирной вытяжке из листьев.

В основе хроматографических методов лежит принцип разделения веществ между подвижной и неподвижной фазами в динамических условиях. Хроматография основана на явлении сорбции (поглощение газов, жидкостей и растворенных веществ твердыми или жидкими или твердыми поглотителями (сорбентами)). Неподвижная фаза (сорбент) – слой жидкости или твердого вещества с большой поверхностью раздела фаз, подвижная фаза – смесь жидкостей или газов (то, что надо разделить и определить количественно).
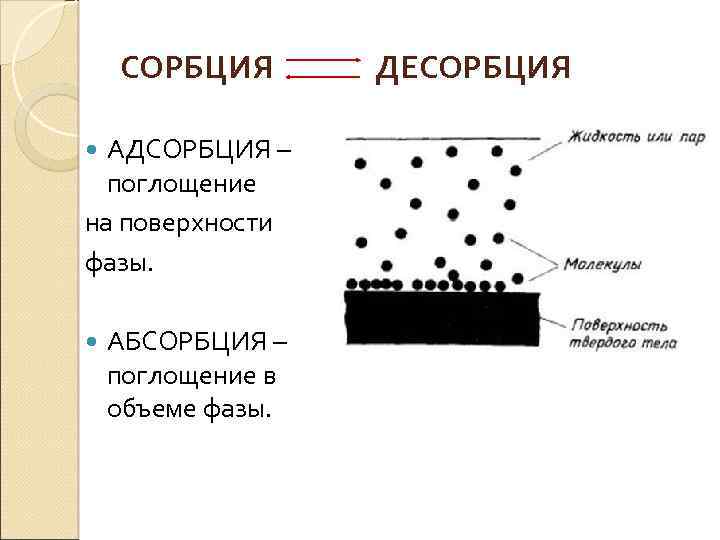
СОРБЦИЯ АДСОРБЦИЯ – поглощение на поверхности фазы. АБСОРБЦИЯ – поглощение в объеме фазы. ДЕСОРБЦИЯ
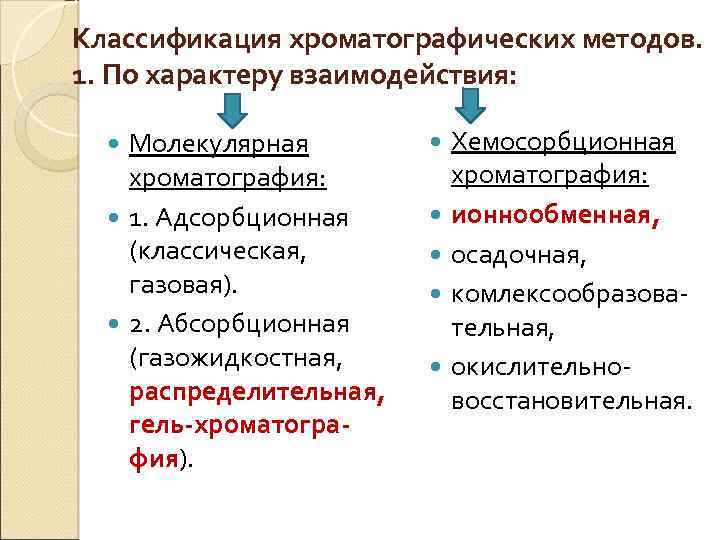
Классификация хроматографических методов. 1. По характеру взаимодействия: Молекулярная хроматография: 1. Адсорбционная (классическая, газовая). 2. Абсорбционная (газожидкостная, распределительная, гель-хроматография). Хемосорбционная хроматография: ионнообменная, осадочная, комлексообразовательная, окислительновосстановительная.

Классификация хроматографических методов. 2. По способу осуществления: ПЛОСКОСТНЫЕ (тонкослойные): Бумажная хр-я (сорбент – фильтровальная бумага), Тонкослойная хр-я (сорбент на пластинке из стекла). 3. По состоянию фаз: Газовая и жидкостная КОЛОНЧАТЫЕ (сорбент помещен в колонку): Фронтальная хр-я, Элюентная хр-я, Вытеснительная хр -я.

Разделение смеси веществ в жидкостно-жидкостной хроматографии основываются на различии коэффициентов распределения вещества между несмешивающимися растворителями. Коэффициент распределения вещества равен: Кп/н = сп / сн Где сп и сн – концентрация вещества в подвижной и неподвижной фазах. Тонкослойная хроматография. Под действием капиллярных сил растворитель движется вдоль слоя сорбента и с разной скоростью переносит компоненты смеси, что приводит к их разделению. Сорбционные свойства системы в ТСХ характеризуются подвижностью, т. е. величиной Rf, : Rf = Хi / Xf где Хi - расстояние от стартовой линии до центра зоны iго компонента; Xf - расстояние, пройденное за это же время растворителем.
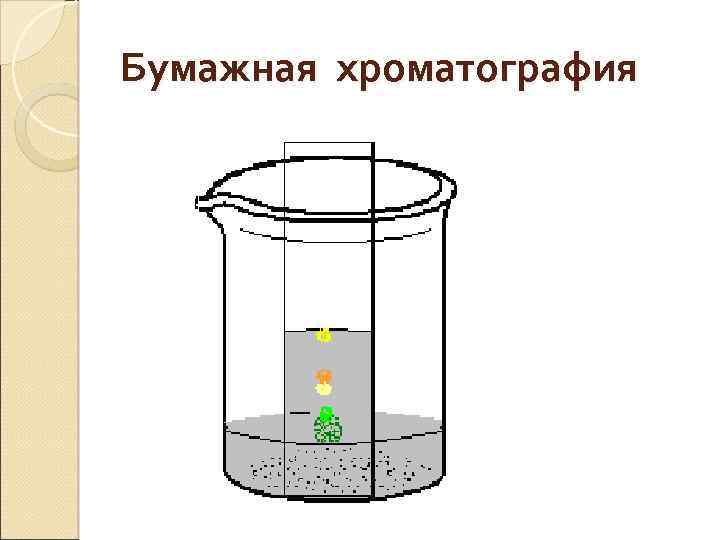
Бумажная хроматография
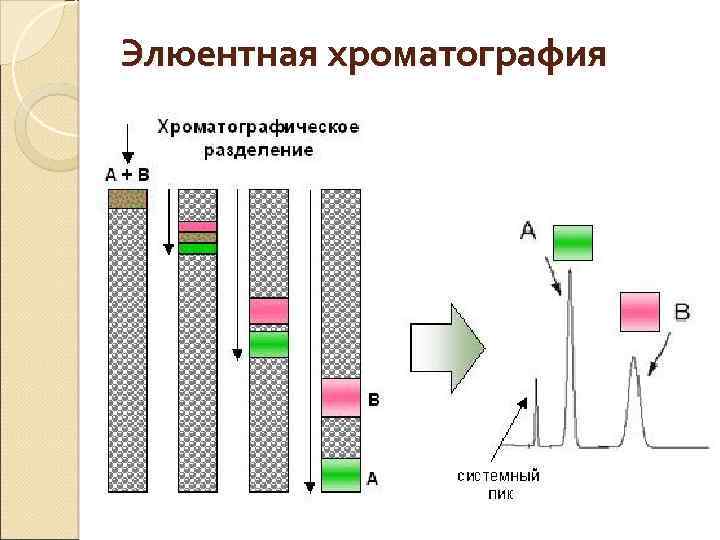
Элюентная хроматография
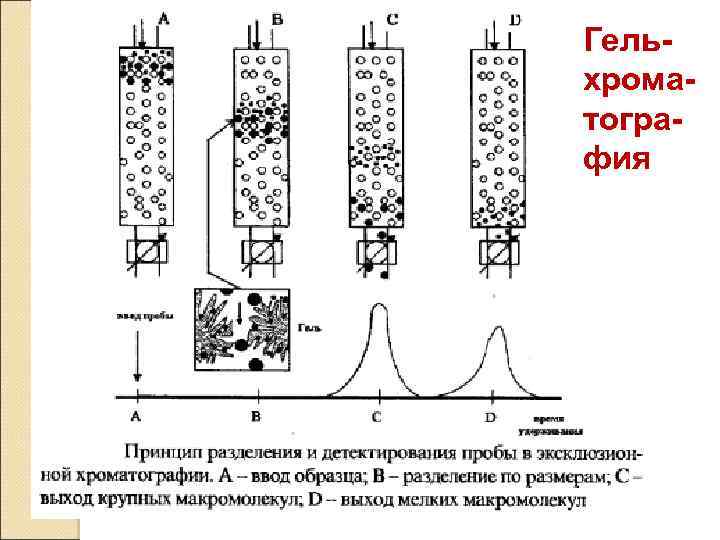
Гельхроматография
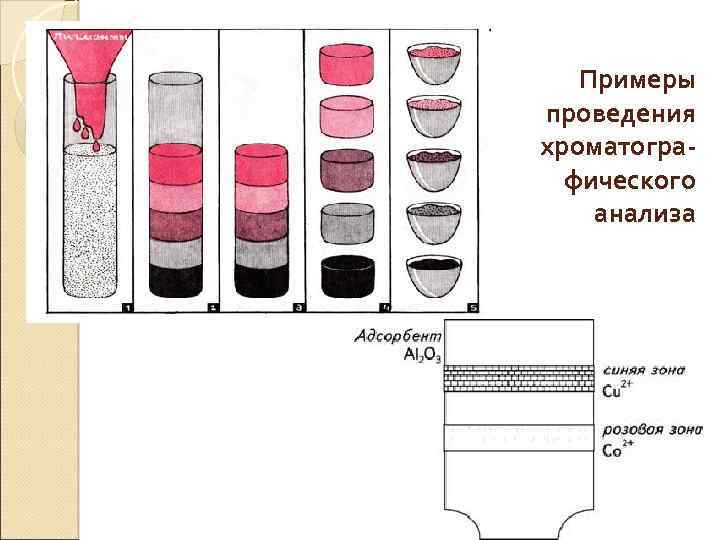
Примеры проведения хроматографического анализа
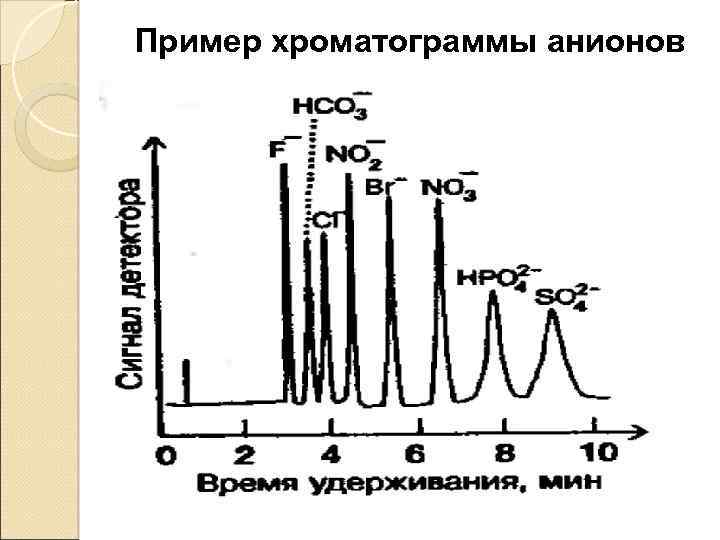
Пример хроматограммы анионов
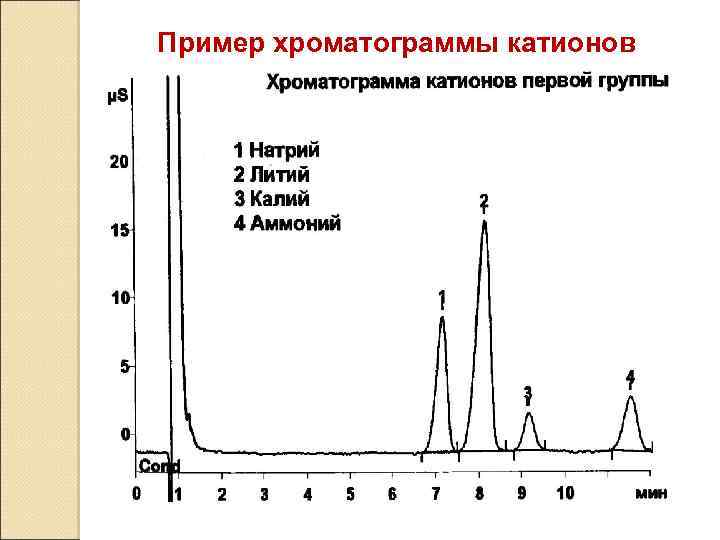
Пример хроматограммы катионов
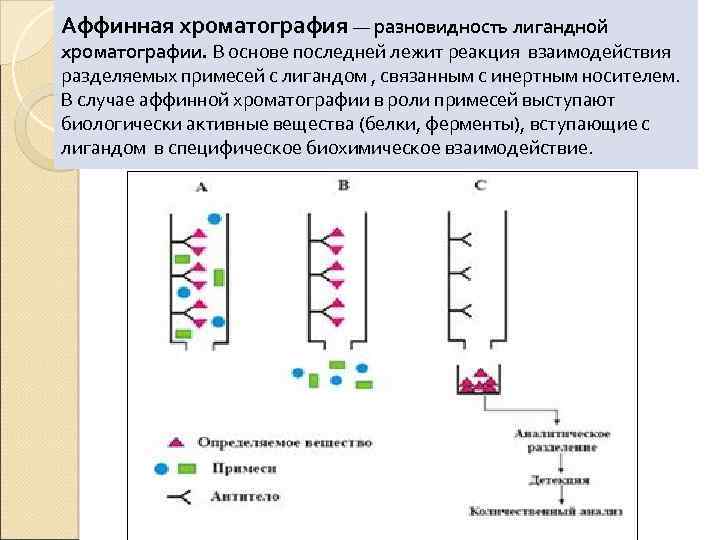
Аффинная хроматография — разновидность лигандной хроматографии. В основе последней лежит реакция взаимодействия разделяемых примесей с лигандом , связанным с инертным носителем. В случае аффинной хроматографии в роли примесей выступают биологически активные вещества (белки, ферменты), вступающие с лигандом в специфическое биохимическое взаимодействие.

Хроматография используется при: • анализе разнообразных жидкостей и газообразных вещества и их смесей (более 1000), • разделении смеси веществ, • в медицине, фармакологии (более 2000 белков в биологических объектах), • анализе компонентов в объектах окружающей среды, • очистке воды, • определении изотопов, микрочастиц, • анализе полимеров и макромолекул.

ДОСТОИНСТВА ХМА • • • высокая эффективность, простота, селективность, экспрессность, возможности автоматизации, • универсальность, т. е. возможность использования для разделения и определения твердых, жидких и газообразных неорганических и органических веществ в широком интервале концентраций. • Эти методы особенно ценны тем, что позволяют эффективно разделять смеси веществ с близкими свойствами за счет использования большого числа типов межмолекулярных взаимодействий: от чисто силовых межмолекулярных взаимодействий к физической сорбции и далее к хемосорбции.

Хроматография – это динамический сорбционный способ разделения смесей веществ, основанный на распределении вещества между двумя фазами, одна из которых подвижная, а другая неподвижная, и связанный с многократным повторением сорбционных и десорбционных актов

Некоторые термины Колонка — содержит хроматографический сорбент, выполняет функцию разделения смеси на индивидуальные компоненты. Элюент — подвижная фаза (растворитель или смесь растворителей): газ, жидкость. Неподвижная фаза — твердая фаза или жидкость, связанная на инертном носителе. Хроматограмма — результат регистрирования зависимости концентрации компонентов на выходе из колонки от времени. Детектор — устройство для регистрации концентрации компонентов смеси на выходе из колонки. Хроматограф — прибор для проведения хроматографии.

СПАСИБО ЗА ВНИМАНИЕ!

Серия градуировочных растворов нитритного азота перед измерением оптической плотности

Кюветы для измерения оптической плотности растворов
Лекция_Методы анализа_ 2_заочное.ppt