eae7e6c518716f6d29df5856fcebff65.ppt
- Количество слайдов: 22
 Лекция 3. Методика изучения раздела “ Растворы. ТЭД”. ( VШ класс-тема 3. Растворы -15 часов; Х класс- тема 6. Химия растворов-8 часов). Зенькова М. В. План лекции. 1. Задачи изучения темы. 2. Планирование. 3. Взаимосвязь учебного материала данной темы с ранее рассмотренными знаниями о веществах и смесях. Формирование знаний учащихся о растворах и растворении как физико-химическом процессе. 3. Подготовка учащихся к рассмотрению знаний о процессе электролитической диссоциации (ЭД) веществ. 4. Формирование знаний учащихся о механизме ЭД веществ с ковалентным полярным и ионным типами химической связи. 5. Изучение реакций ионного обмена. Формирование умений составлять уравнения реакций ионного обмена. 6. Обобщение знаний о растворах и ЭД веществ.
Лекция 3. Методика изучения раздела “ Растворы. ТЭД”. ( VШ класс-тема 3. Растворы -15 часов; Х класс- тема 6. Химия растворов-8 часов). Зенькова М. В. План лекции. 1. Задачи изучения темы. 2. Планирование. 3. Взаимосвязь учебного материала данной темы с ранее рассмотренными знаниями о веществах и смесях. Формирование знаний учащихся о растворах и растворении как физико-химическом процессе. 3. Подготовка учащихся к рассмотрению знаний о процессе электролитической диссоциации (ЭД) веществ. 4. Формирование знаний учащихся о механизме ЭД веществ с ковалентным полярным и ионным типами химической связи. 5. Изучение реакций ионного обмена. Формирование умений составлять уравнения реакций ионного обмена. 6. Обобщение знаний о растворах и ЭД веществ.
 • • • Задачи изучения темы “Растворы”: Образовательные: 1. Развить знания учащихся о смесях веществ. Обеспечить преемственность знаний о веществах, полученных в разные сроки обучения химии. 2. Дать понятие о растворах, как однородных устойчивых системах, состоящих из растворителя (дисперсионной среды) и растворённого вещества ( дисперсной фазы). 3. Закрепить знания о строении молекул воды и её роли при растворении веществ. 4. Доказать, что растворение - это физико-химический процесс. Указать на зависимость растворимости веществ от температуры. 5. Дать понятие о качественных и количественных характеристиках растворов, факторах, влияющих на процесс растворимости веществ в воде. Ввести понятие о концентрированных и разбавленных растворах, о массовой доле вещества в растворе. Формировать умение учащихся решать задачи на вычисление w(в-ва) и m(в-ва) в растворе.
• • • Задачи изучения темы “Растворы”: Образовательные: 1. Развить знания учащихся о смесях веществ. Обеспечить преемственность знаний о веществах, полученных в разные сроки обучения химии. 2. Дать понятие о растворах, как однородных устойчивых системах, состоящих из растворителя (дисперсионной среды) и растворённого вещества ( дисперсной фазы). 3. Закрепить знания о строении молекул воды и её роли при растворении веществ. 4. Доказать, что растворение - это физико-химический процесс. Указать на зависимость растворимости веществ от температуры. 5. Дать понятие о качественных и количественных характеристиках растворов, факторах, влияющих на процесс растворимости веществ в воде. Ввести понятие о концентрированных и разбавленных растворах, о массовой доле вещества в растворе. Формировать умение учащихся решать задачи на вычисление w(в-ва) и m(в-ва) в растворе.
 • • продолжение 6. Сформировать понятие об ЭД веществ. Познакомить с механизмом ЭД веществ с ионным и ковалентным полярным типом химической связи. Подчеркнуть, что процесс ЭД идёт при растворении кислот, оснований, солей в воде и при расплавлении этих веществ. Уточнить классификацию сложных веществ (электролиты и неэлектролиты). Развить понятие о свойствах веществ на электронно-ионном уровне теории строения вещества. 7. Выявить различие в строении атомов и ионов. Научить практически определять наличие в растворах катионов водорода (протонов) и гидроксид-анионов. Дать понятие о реакциях ионного обмена. . Рассмотреть свойства кислот, , солей в свете ТЭД. Сформировать умения составлять молекулярные, полные и сокращённые ионные уравнения химических реакций. 8. Отметить роль воды в жизни человека, в природных системах. 9. Дать понятие о жёсткости воды и простейших способах её устранения.
• • продолжение 6. Сформировать понятие об ЭД веществ. Познакомить с механизмом ЭД веществ с ионным и ковалентным полярным типом химической связи. Подчеркнуть, что процесс ЭД идёт при растворении кислот, оснований, солей в воде и при расплавлении этих веществ. Уточнить классификацию сложных веществ (электролиты и неэлектролиты). Развить понятие о свойствах веществ на электронно-ионном уровне теории строения вещества. 7. Выявить различие в строении атомов и ионов. Научить практически определять наличие в растворах катионов водорода (протонов) и гидроксид-анионов. Дать понятие о реакциях ионного обмена. . Рассмотреть свойства кислот, , солей в свете ТЭД. Сформировать умения составлять молекулярные, полные и сокращённые ионные уравнения химических реакций. 8. Отметить роль воды в жизни человека, в природных системах. 9. Дать понятие о жёсткости воды и простейших способах её устранения.
 • • • Воспитательные: 1. Формировать научное мировоззрение учащихся путём: : - введения общих философских понятий и представлений: противоположности ( противоположные процессы – диссоциация и ассоциация, электролиты и неэлектролиты); взаимосвязь противоположностей; скачок как способ разрешения противоречия во взаимосвязи противоположностей, как результат – образование нового качества (реакции ионного обмена); - изучения истории ТЭД, дающей учащимся представление об изменяемости наших знаний об окружающем мире; - изучения жизни и деятельности учёных, которые внесли свой вклад в изучение теории растворов и ТЭД- Фарадея, Cв. Аррениуса, Д. И. Менделеева, Каблукова и др. 2. Решать задачу политехнизации знаний путём рассмотрения знаний о применении растворов в жизни человека ( cсельском хозяйстве, промышленности, быту), знакомства с содержанием профессий, требующих знаний о растворах и ТЭД.
• • • Воспитательные: 1. Формировать научное мировоззрение учащихся путём: : - введения общих философских понятий и представлений: противоположности ( противоположные процессы – диссоциация и ассоциация, электролиты и неэлектролиты); взаимосвязь противоположностей; скачок как способ разрешения противоречия во взаимосвязи противоположностей, как результат – образование нового качества (реакции ионного обмена); - изучения истории ТЭД, дающей учащимся представление об изменяемости наших знаний об окружающем мире; - изучения жизни и деятельности учёных, которые внесли свой вклад в изучение теории растворов и ТЭД- Фарадея, Cв. Аррениуса, Д. И. Менделеева, Каблукова и др. 2. Решать задачу политехнизации знаний путём рассмотрения знаний о применении растворов в жизни человека ( cсельском хозяйстве, промышленности, быту), знакомства с содержанием профессий, требующих знаний о растворах и ТЭД.
 Развивающие: • Развивать мышление учащихся путём: • - использования активизирующих методов обучения (репродуктивных, частичнопоисковых); • - применения современных технологий обучения; • - реализации дифференцированного подхода к учащимся в обучении; • - обучения учащихся умению использовать в процессе приобретения знаний приёмы умственных действий и учебной работы; • - организации самостоятельной поисковой деятельности учащихся в учебной работе. .
Развивающие: • Развивать мышление учащихся путём: • - использования активизирующих методов обучения (репродуктивных, частичнопоисковых); • - применения современных технологий обучения; • - реализации дифференцированного подхода к учащимся в обучении; • - обучения учащихся умению использовать в процессе приобретения знаний приёмы умственных действий и учебной работы; • - организации самостоятельной поисковой деятельности учащихся в учебной работе. .
 Планирование: • • • 1 урок: Cмеси веществ (cуспензии, эмульсии, аэрозоли, растворы, пена). 2 урок: Растворы ( вода – универсальный растворитель; молекула воды – диполь; растворение – физико-химический процесс). 3 урок: Растворимость веществ в воде ( насыщенные и ненасыщенные растворы, растворимость). 4 – 5 уроки: Качественные и количественные характеристики состава растворов (концентрированные и разбавленные растворы, массовая доля вещества в растворе). 6 урок: Решение расчётных задач. Подготовка к практической работе. 7 урок: Практическая работа 1: Приготовление раствора с заданной массовой долей растворённого вещества. 8 урок: Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. 9 урок: Диссоциация кислот, оснований, cолей. 10 урок: Растворы электролитов (нейтральный, кислый, щелочной). 11 - 12 уроки: Реакции ионного обмена. 13 урок: Практическая работа 2. Реакции ионного обмена между растворами электролитов. 14 урок: Вода и растворы в жизнедеятельности человека. Обобщение.
Планирование: • • • 1 урок: Cмеси веществ (cуспензии, эмульсии, аэрозоли, растворы, пена). 2 урок: Растворы ( вода – универсальный растворитель; молекула воды – диполь; растворение – физико-химический процесс). 3 урок: Растворимость веществ в воде ( насыщенные и ненасыщенные растворы, растворимость). 4 – 5 уроки: Качественные и количественные характеристики состава растворов (концентрированные и разбавленные растворы, массовая доля вещества в растворе). 6 урок: Решение расчётных задач. Подготовка к практической работе. 7 урок: Практическая работа 1: Приготовление раствора с заданной массовой долей растворённого вещества. 8 урок: Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. 9 урок: Диссоциация кислот, оснований, cолей. 10 урок: Растворы электролитов (нейтральный, кислый, щелочной). 11 - 12 уроки: Реакции ионного обмена. 13 урок: Практическая работа 2. Реакции ионного обмена между растворами электролитов. 14 урок: Вода и растворы в жизнедеятельности человека. Обобщение.
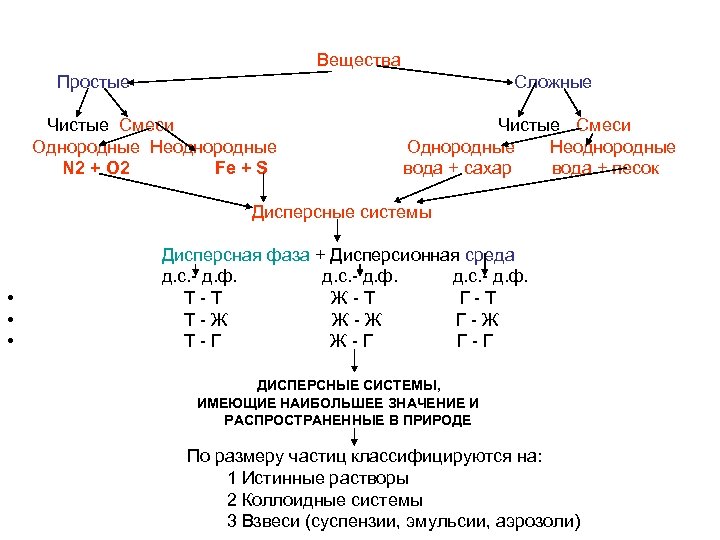 Вещества Простые Сложные Чистые Смеси Однородные Неоднородные N 2 + O 2 Fе + S Чистые Смеси Однородные Неоднородные вода + сахар вода + песок Дисперсные системы • • • Дисперсная фаза + Дисперсионная среда д. с. - д. ф. Т-Т Ж-Т Г-Т Т-Ж Ж-Ж Г-Ж Т-Г Ж-Г Г-Г ДИСПЕРСНЫЕ СИСТЕМЫ, ИМЕЮЩИЕ НАИБОЛЬШЕЕ ЗНАЧЕНИЕ И РАСПРОСТРАНЕННЫЕ В ПРИРОДЕ По размеру частиц классифицируются на: 1 Истинные растворы 2 Коллоидные системы 3 Взвеси (суспензии, эмульсии, аэрозоли)
Вещества Простые Сложные Чистые Смеси Однородные Неоднородные N 2 + O 2 Fе + S Чистые Смеси Однородные Неоднородные вода + сахар вода + песок Дисперсные системы • • • Дисперсная фаза + Дисперсионная среда д. с. - д. ф. Т-Т Ж-Т Г-Т Т-Ж Ж-Ж Г-Ж Т-Г Ж-Г Г-Г ДИСПЕРСНЫЕ СИСТЕМЫ, ИМЕЮЩИЕ НАИБОЛЬШЕЕ ЗНАЧЕНИЕ И РАСПРОСТРАНЕННЫЕ В ПРИРОДЕ По размеру частиц классифицируются на: 1 Истинные растворы 2 Коллоидные системы 3 Взвеси (суспензии, эмульсии, аэрозоли)
 Электролитическая диссоциация
Электролитическая диссоциация
 елятся на динения д еские сое Химич • Оксиды • Кислоты • Основании • Соли • и др.
елятся на динения д еские сое Химич • Оксиды • Кислоты • Основании • Соли • и др.

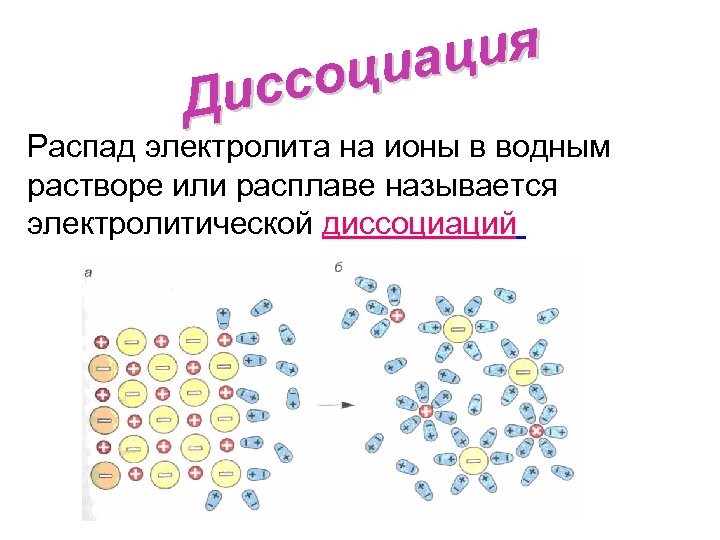 ция циа ссо Ди Распад электролита на ионы в водным растворе или расплаве называется электролитической диссоциаций
ция циа ссо Ди Распад электролита на ионы в водным растворе или расплаве называется электролитической диссоциаций
 Электролиты в растворах и расплавах распадаются (диссоциируют)на разноимённо заряженные частицы — ионы. ионным ковалентн
Электролиты в растворах и расплавах распадаются (диссоциируют)на разноимённо заряженные частицы — ионы. ионным ковалентн
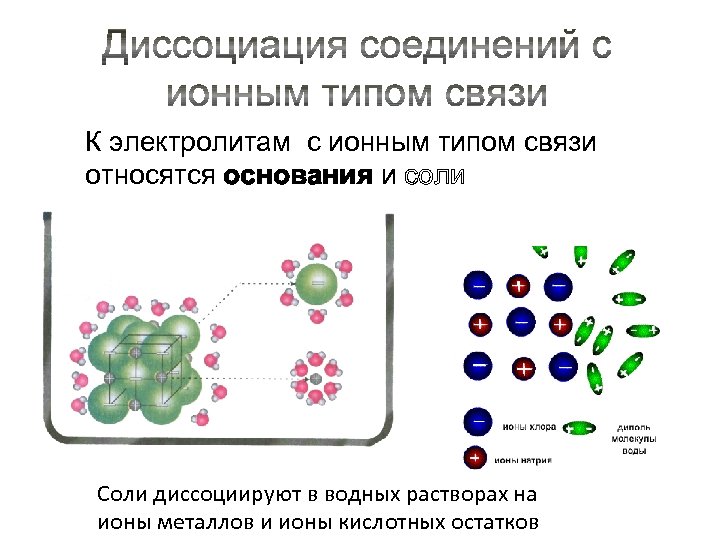 К электролитам с ионным типом связи относятся основания и соли Соли диссоциируют в водных растворах на ионы металлов и ионы кислотных остатков
К электролитам с ионным типом связи относятся основания и соли Соли диссоциируют в водных растворах на ионы металлов и ионы кислотных остатков
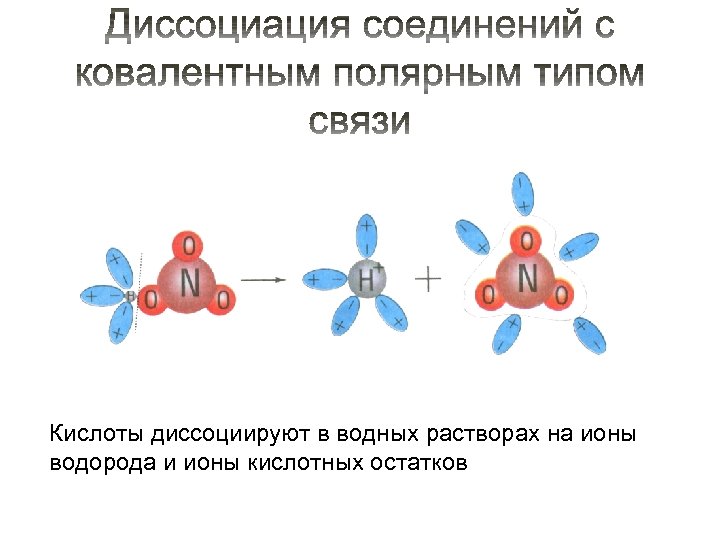 Кислоты диссоциируют в водных растворах на ионы водорода и ионы кислотных остатков
Кислоты диссоциируют в водных растворах на ионы водорода и ионы кислотных остатков
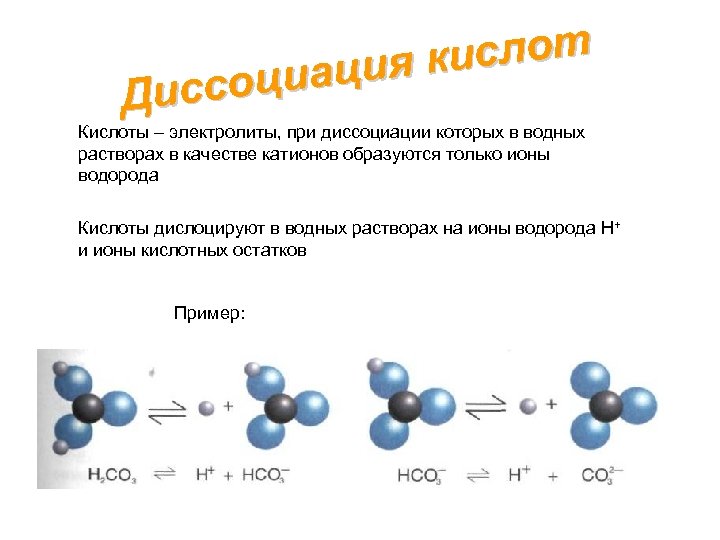 ислот ация к ссоци Ди Кислоты – электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода Кислоты дислоцируют в водных растворах на ионы водорода H+ и ионы кислотных остатков Пример:
ислот ация к ссоци Ди Кислоты – электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода Кислоты дислоцируют в водных растворах на ионы водорода H+ и ионы кислотных остатков Пример:
 олей ция с циа иссо Д Соли в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
олей ция с циа иссо Д Соли в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
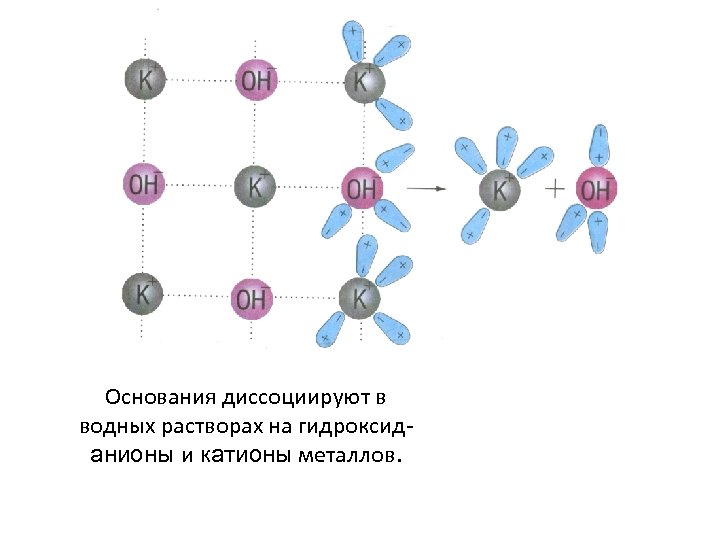 Основания диссоциируют в водных растворах на гидроксиданионы и катионы металлов.
Основания диссоциируют в водных растворах на гидроксиданионы и катионы металлов.
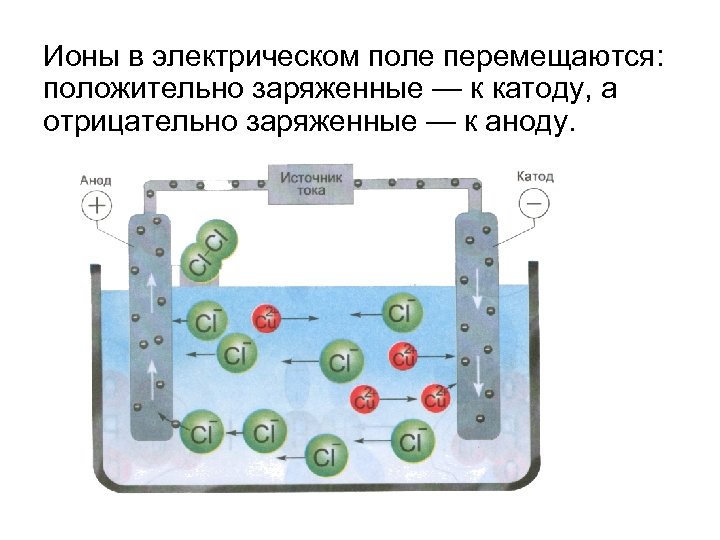 Ионы в электрическом поле перемещаются: положительно заряженные — к катоду, а отрицательно заряженные — к аноду.
Ионы в электрическом поле перемещаются: положительно заряженные — к катоду, а отрицательно заряженные — к аноду.
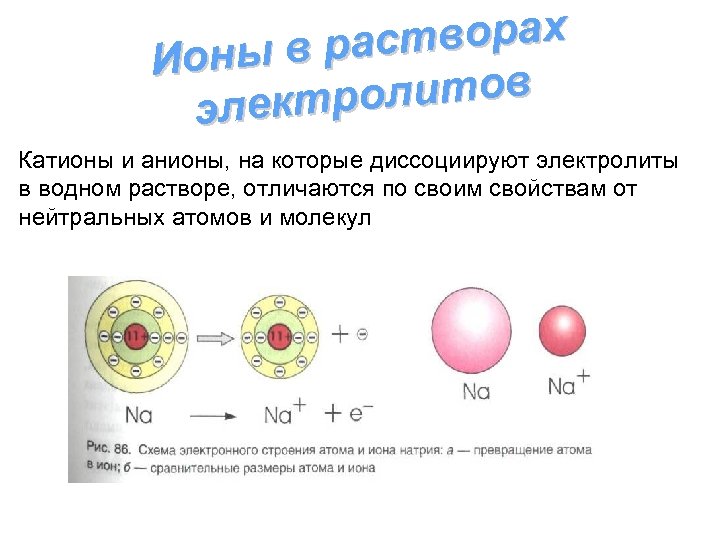 створах ны в ра Ио олитов электр Катионы и анионы, на которые диссоциируют электролиты в водном растворе, отличаются по своим свойствам от нейтральных атомов и молекул
створах ны в ра Ио олитов электр Катионы и анионы, на которые диссоциируют электролиты в водном растворе, отличаются по своим свойствам от нейтральных атомов и молекул
 • Полные ионные уравнения – это запись всех веществ в ионной форме, кроме веществ, вышедших из сферы деятельности реакции. • Сокращенное ионное уравнение – уравнение, в котором не указываются ионы, не принимающие участие в реакции.
• Полные ионные уравнения – это запись всех веществ в ионной форме, кроме веществ, вышедших из сферы деятельности реакции. • Сокращенное ионное уравнение – уравнение, в котором не указываются ионы, не принимающие участие в реакции.
 1. Если образовался осадок. 2. Если выделяется газообразное вещество. 3. Если образуется малодиссоциированное вещество (например: вода)
1. Если образовался осадок. 2. Если выделяется газообразное вещество. 3. Если образуется малодиссоциированное вещество (например: вода)
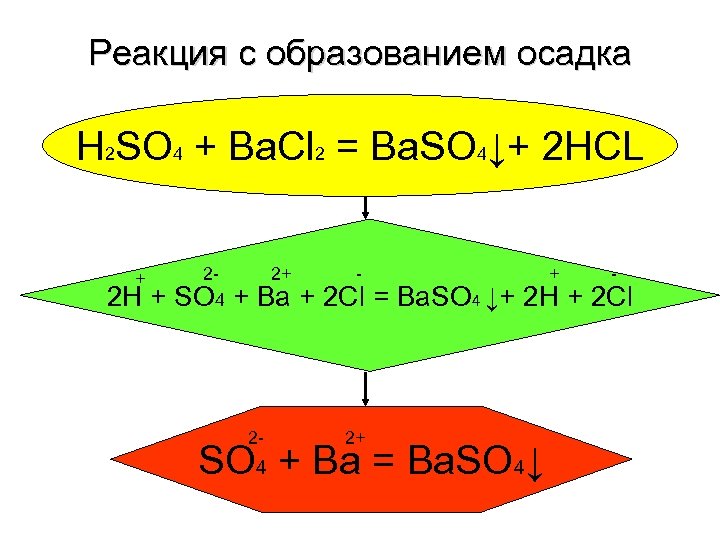 Реакция с образованием осадка H 2 SO 4 + Ba. Cl 2 = Ba. SO 4↓+ 2 HCL + 2 H + 2 SO 4 2+ - + Ba + 2 Cl = Ba. SO 4 ↓+ 2 H + 2 Cl 2 - 2+ SO 4 + Ba = Ba. SO 4↓
Реакция с образованием осадка H 2 SO 4 + Ba. Cl 2 = Ba. SO 4↓+ 2 HCL + 2 H + 2 SO 4 2+ - + Ba + 2 Cl = Ba. SO 4 ↓+ 2 H + 2 Cl 2 - 2+ SO 4 + Ba = Ba. SO 4↓


