Лекция 3-а Классификация нанообъектов.ppt
- Количество слайдов: 22

Лекция № 3 Классификация нанообъектов при размерах менее 100 нм - радикальное изменение свойств квантовая яма (двумерный нанообъект) - размеры образца в одном измерении лежат в нанометровом диапазоне, а в двух других остаются большими относятся 1. тонкие пленки, 2. адсорбционные моно- и полислои на 3. поверхности раздела фаз (в том числе пленки Ленгмюра-Блоджетт) метод молекулярных орбиталей позволяет конструировать химические связи и образовывать из атомов молекулы, нанокластеры и 1 наночастицы, а также и массивное твердое тело
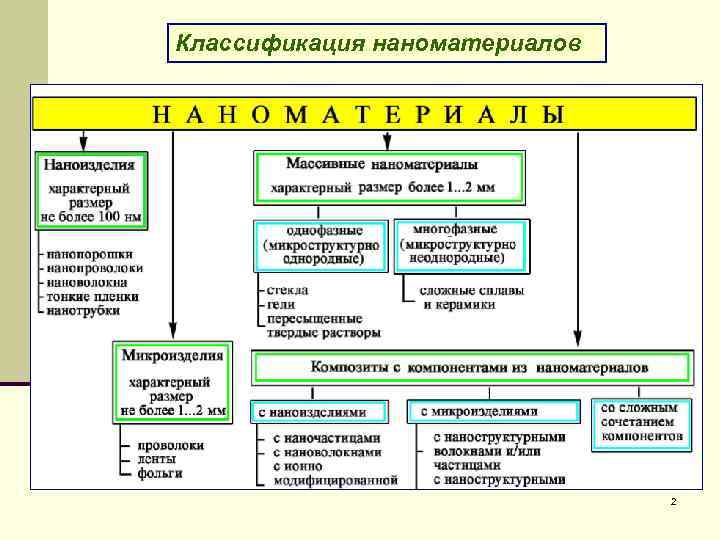
Классификация наноматериалов 2
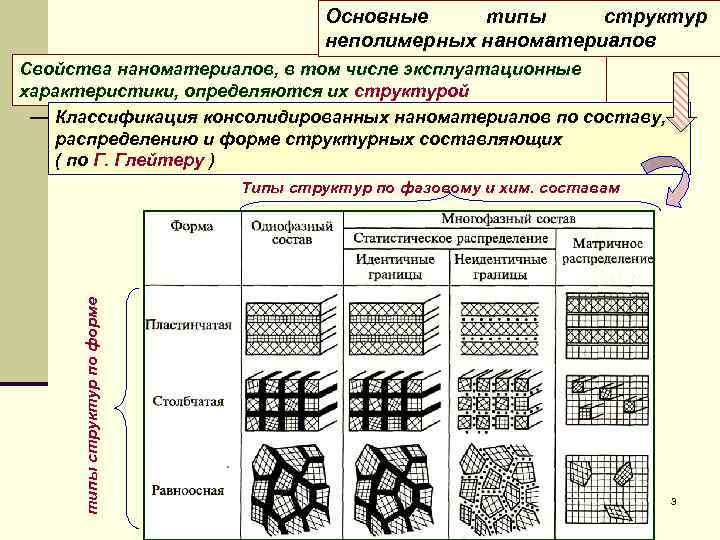
Основные типы структур неполимерных наноматериалов Свойства наноматериалов, в том числе эксплуатационные характеристики, определяются их структурой Классификация консолидированных наноматериалов по составу, распределению и форме структурных составляющих ( по Г. Глейтеру ) Типы структур по фазовому и хим. составам типы структур по форме 3
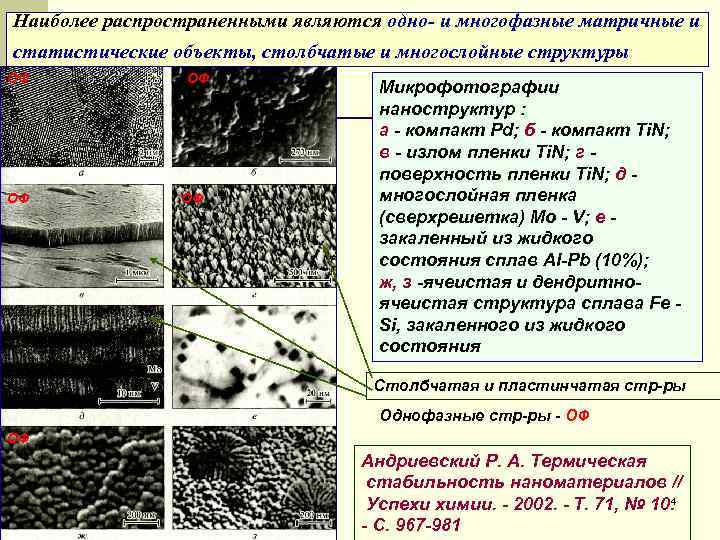
Наиболее распространенными являются одно- и многофазные матричные и статистические объекты, столбчатые и многослойные структуры ОФ Микрофотографии наноструктур : а - компакт Pd; б - компакт Ti. N; в - излом пленки Ti. N; г - поверхность пленки Ti. N; д - ОФ многослойная пленка (сверхрешетка) Mo - V; e - закаленный из жидкого состояния сплав Аl-Рb (10%); ж, з -ячеистая и дендритно- ячеистая структура сплава Fe - Si, закаленного из жидкого состояния Столбчатая и пластинчатая стр-ры Однофазные стр-ры - ОФ ОФ Андриевский Р. А. Термическая стабильность наноматериалов // Успехи химии. - 2002. - Т. 71, № 10. 4 - С. 967 -981
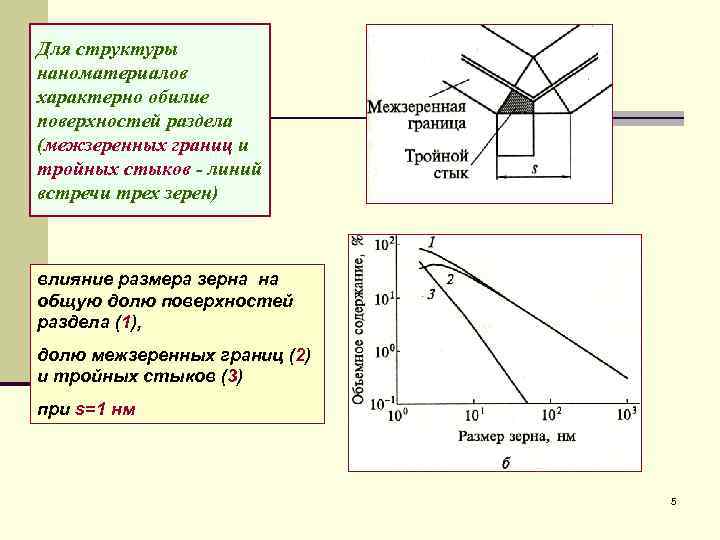
Для структуры наноматериалов характерно обилие поверхностей раздела (межзеренных границ и тройных стыков - линий встречи трех зерен) влияние размера зерна на общую долю поверхностей раздела (1), долю межзеренных границ (2) и тройных стыков (3) при s=1 нм 5

общая доля поверхностей раздела составляет доля собственно межзеренных границ и соответственно доля тройных стыков Здесь L - размер зерна; s - ширина границы (приграничной зоны). существенная доля поверхностей раздела (несколько %) отвечает размеру зерен L < 100 нм; при L < 10 нм доля Vп. р. составляет уже несколько десятков %, причем доля тройных стыков стремительно растет. Доля поверхностей раздела в общем объеме материала приблизительно равна 3 s/L, где при s ≈ 1 нм доля Vп. р. = 50 % достигается при L ≈ 6 нм Таким образом, если твердое тело состоит из кристаллитов размером <10 нм, то доля поверхностей раздела или доля областей с разупорядоченной структурой весьма велика 6
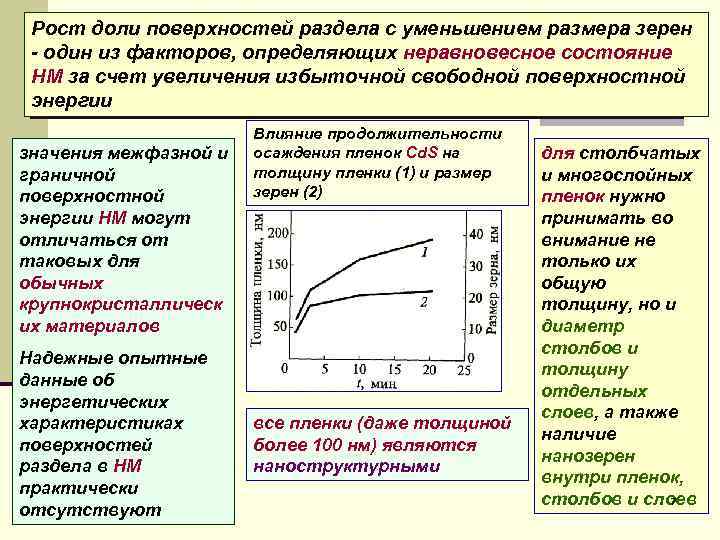
Рост доли поверхностей раздела с уменьшением размера зерен - один из факторов, определяющих неравновесное состояние НМ за счет увеличения избыточной свободной поверхностной энергии Влияние продолжительности значения межфазной и осаждения пленок Cd. S на для столбчатых граничной толщину пленки (1) и размер и многослойных поверхностной зерен (2) пленок нужно энергии НМ могут принимать во отличаться от внимание не таковых для только их обычных общую крупнокристаллическ толщину, но и их материалов диаметр столбов и Надежные опытные толщину данные об отдельных энергетических слоев, а также характеристиках все пленки (даже толщиной наличие поверхностей более 100 нм) являются нанозерен раздела в НМ наноструктурными внутри пленок, практически столбов и слоев 7 отсутствуют
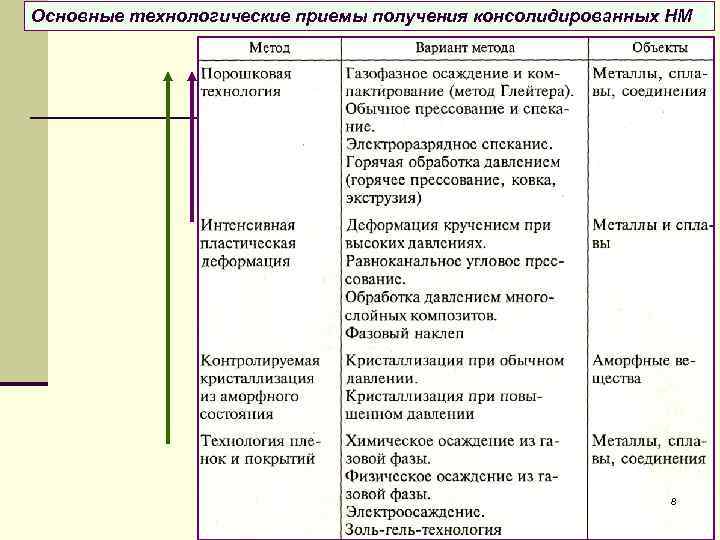
Основные технологические приемы получения консолидированных НМ 8

Зерна, слои, включения и поры в консолидированных НМ Основной элемент структуры консолидированных НМ — зерно или кристаллит (далее –синонимы) По существу, это области когерентного рассеяния рентгеновских лучей или нейтронов Рентгенограммы меди: а - исходное крупнокристаллическое состояние; б, в - после интенсивной пластической деформации соответственно кручением при высоком давлении и равноканальным прессованием Интегральная ширина пиков где χ - длина волны; θ - угол Вульфа- Брэгга; <ε 2>1/2 - среднеквадратичная деформация кристаллической решетки (микроискажения) для однофазных систем такой метод дает информацию о размерах 9 кристаллов вплоть до 2 - 3 нм
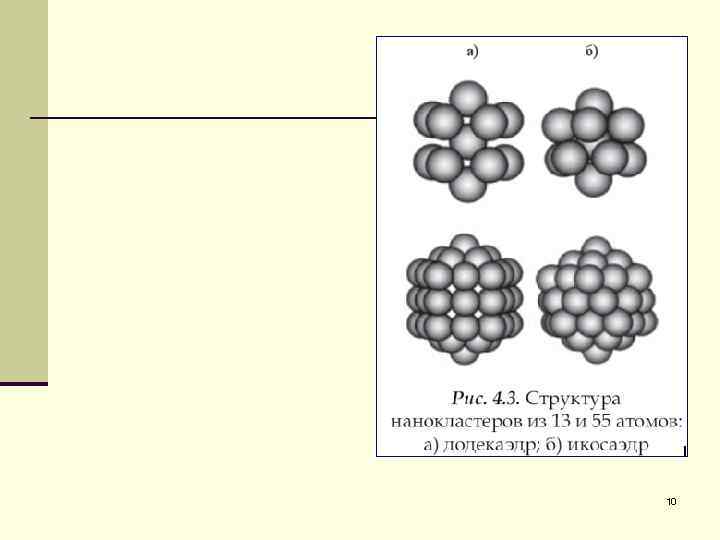
10
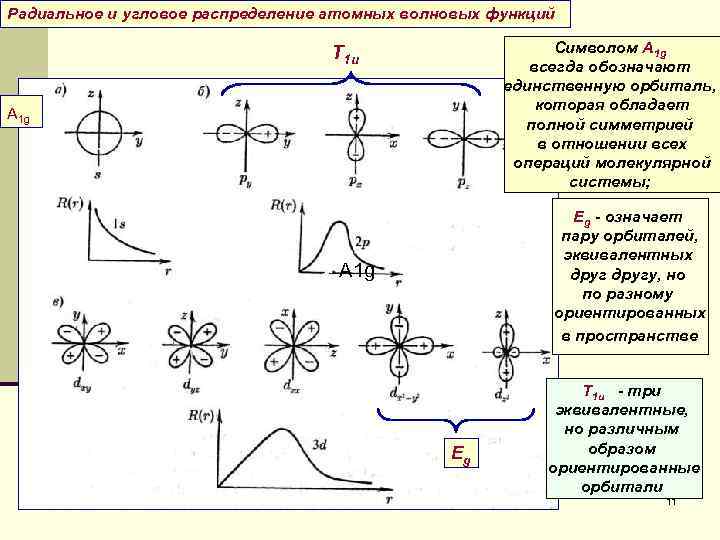
Радиальное и угловое распределение атомных волновых функций Т 1 u Символом A 1 g всегда обозначают единственную орбиталь, которая обладает A 1 g полной симметрией в отношении всех операций молекулярной системы; Eg - означает пару орбиталей, эквивалентных A 1 g другу, но по разному ориентированных в пространстве Т 1 u - три эквивалентные, но различным Eg образом ориентированные орбитали 11
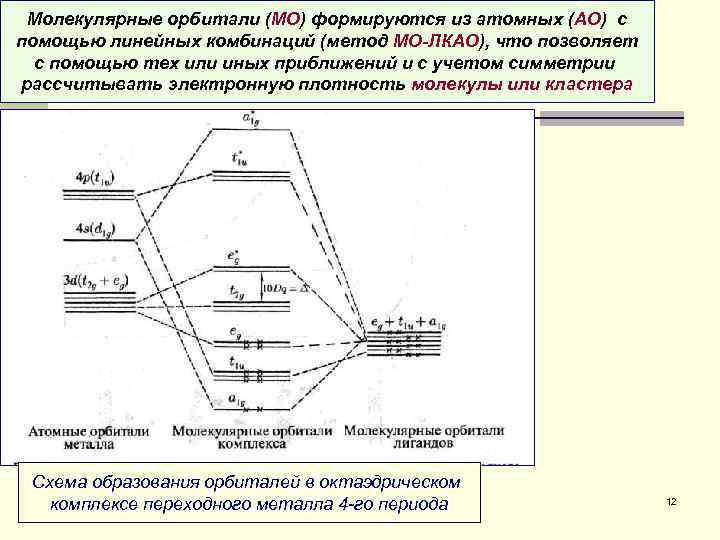
Молекулярные орбитали (МО) формируются из атомных (АО) с помощью линейных комбинаций (метод МО-ЛКАО), что позволяет с помощью тех или иных приближений и с учетом симметрии рассчитывать электронную плотность молекулы или кластера Схема образования орбиталей в октаэдрическом комплексе переходного металла 4 -го периода 12
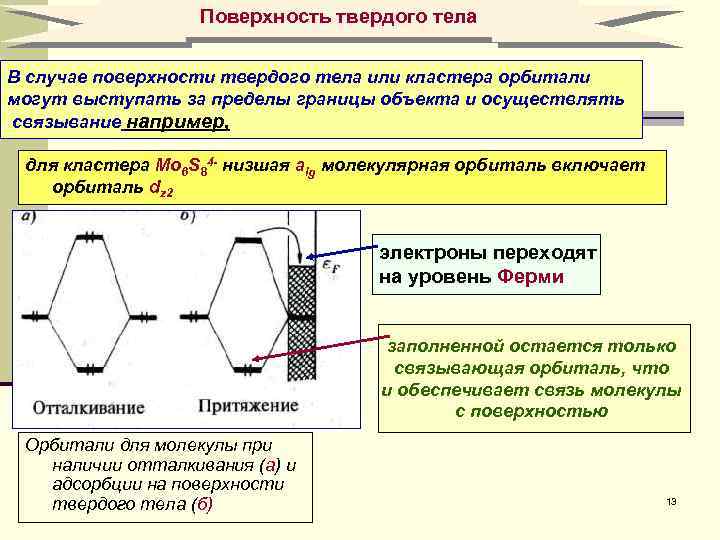
Поверхность твердого тела В случае поверхности твердого тела или кластера орбитали могут выступать за пределы границы объекта и осуществлять связывание например, ! для кластера Mo 6 S 84 - низшая аlg молекулярная орбиталь включает орбиталь dz 2 электроны переходят на уровень Ферми заполненной остается только связывающая орбиталь, что и обеспечивает связь молекулы с поверхностью Орбитали для молекулы при наличии отталкивания (а) и адсорбции на поверхности твердого тела (б) 13
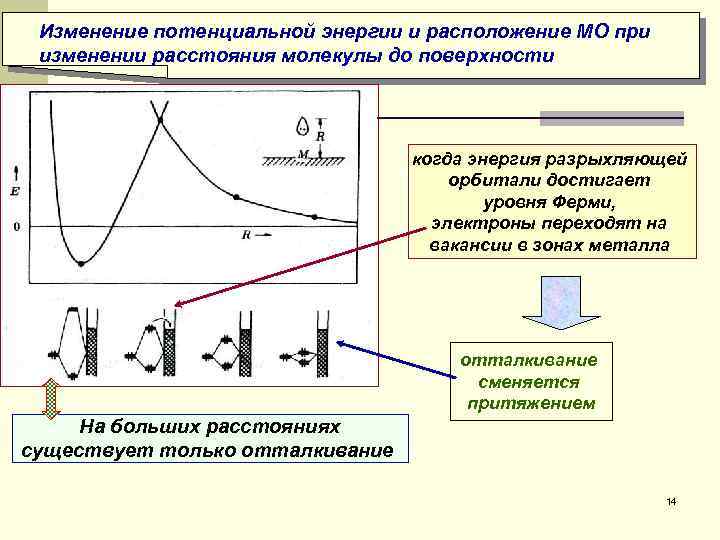
Изменение потенциальной энергии и расположение МО при изменении расстояния молекулы до поверхности когда энергия разрыхляющей орбитали достигает уровня Ферми, электроны переходят на вакансии в зонах металла отталкивание сменяется притяжением На больших расстояниях существует только отталкивание 14
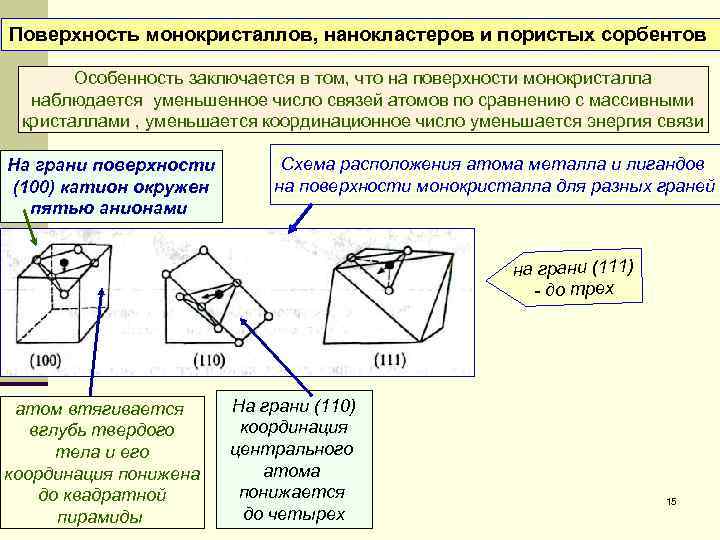
Поверхность монокристаллов, нанокластеров и пористых сорбентов Особенность заключается в том, что на поверхности монокристалла наблюдается уменьшенное число связей атомов по сравнению с массивными кристаллами , уменьшается координационное число уменьшается энергия связи На грани поверхности Схема расположения атома металла и лигандов (100) катион окружен на поверхности монокристалла для разных граней пятью анионами на грани (111) - до трех атом втягивается На грани (110) вглубь твердого координация тела и его центрального координация понижена атома до квадратной понижается 15 пирамиды до четырех
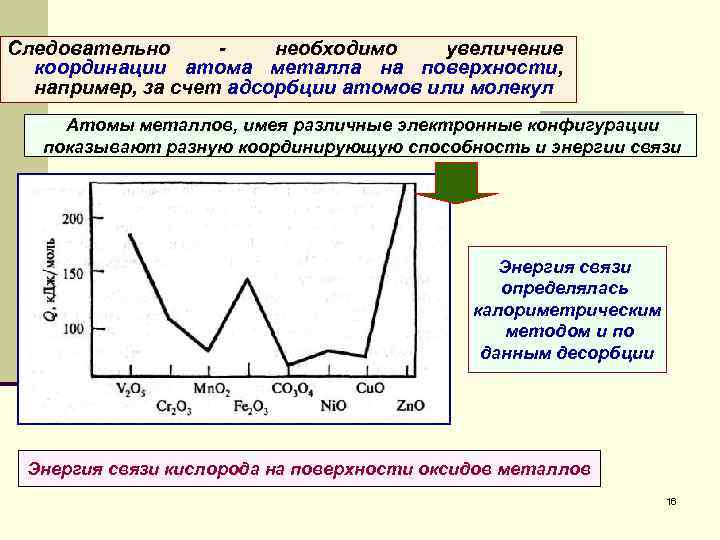
Следовательно - необходимо увеличение координации атома металла на поверхности, например, за счет адсорбции атомов или молекул Атомы металлов, имея различные электронные конфигурации показывают разную координирующую способность и энергии связи Энергия связи определялась калориметрическим методом и по данным десорбции Энергия связи кислорода на поверхности оксидов металлов 16
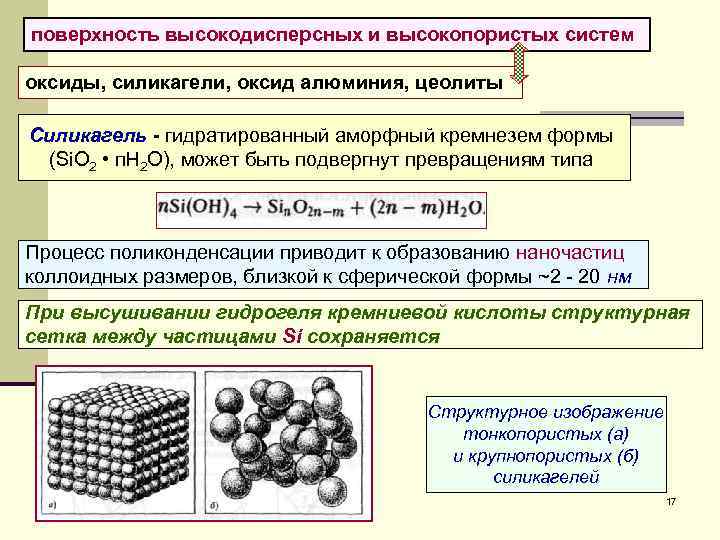
поверхность высокодисперсных и высокопористых систем оксиды, силикагели, оксид алюминия, цеолиты Силикагель - гидратированный аморфный кремнезем формы (Si. O 2 • п. Н 2 О), может быть подвергнут превращениям типа Процесс поликонденсации приводит к образованию наночастиц коллоидных размеров, близкой к сферической формы ~2 - 20 нм При высушивании гидрогеля кремниевой кислоты структурная сетка между частицами Si сохраняется Структурное изображение тонкопористых (а) и крупнопористых (б) силикагелей 17
Силикагели Поверхность силикагеля покрыта силанольными группами с концентрацией ОН 1, 7 12 мкмоль/м 2 или l, 0 7, 2 групп ОН на 1 нм 2. Структура поверхности может включать • изолированные силанольные группы –Si-ОН, • двойные силанольные группы -Si=(OH)2 и • соседние (вицинальные) группы -(Si-ОН)2. И еще Поверхность силикагеля модифицируется и может обладать как гидрофильными, так и гидрофобными свойствами 18

Оксид алюминия получают прокаливанием гидроксидов алюминия - тригидратов и моногидратов Различают следующие типы оксидов алюминия: • Низкотемпературные оксиды (Аl 2 О 3 • n. Н 2 О), в которых 0 < n < 0. 6, получаются при Т не выше 600° С в виде γ-, ρ-, χ- и -модификаций • Высокотемпературные оксиды (почти безводные) получают при 900 1000° С в виде δ-, - и θ-модификаций • Корунд ( -Al 2 O 3) получают при Т = 1000°С и выше γ-Аl 2 О 3 обладает дефектной структурой, которая стабилизирована небольшим количеством молекул воды. Первичные нанокристаллиты 3 8 нм упакованы так, что поры образуют либо щелевую, либо бутылочную форму Поверхность гидроксилирована и легко модифицируется ионами металлов, что играет важную роль в оптике, электронике, магнитных 19 свойствах, а также в таких известных процессах, как адсорбция и катализ

Цеолиты Это регулярные пористые структуры, заполненные в обычных условиях водой При нагревании цеолитов вода выделяется, цеолиты «кипят» , что и дало им греческое название от слов цео (кипение) и литос (камень). Цеолиты представляют собой алюмосиликаты, в которых для компенсации отрицательного заряда, возникающего при замещении Si 4+ на Аl 3+ вводятся щелочные катионы или водород Общая химическая формула цеолитов: Ме 2/n. О • Аl 2 О 3 • x. Si. O 2 • 4 Н 2 О, где Me - щелочной металл или водород, n - валентность Кристаллическая структура включает тетраэдры Si. O 4 и АIO 4. Катионы должны компенсировать избыточный заряд [Аl. О 4]-. 20
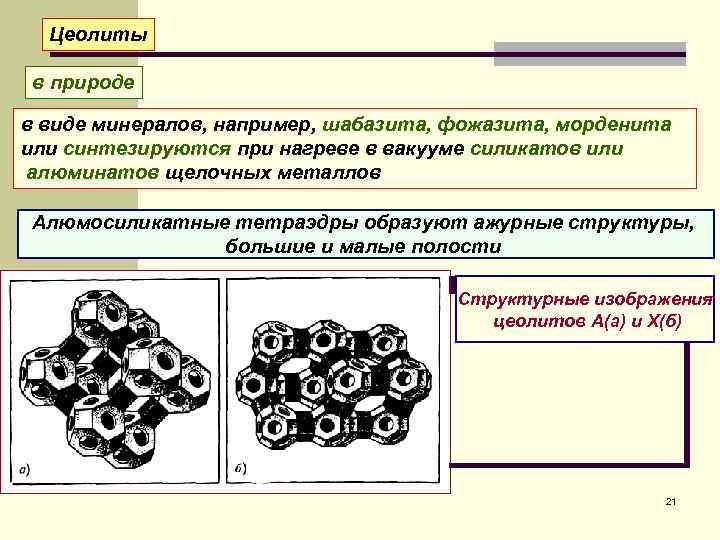
Цеолиты в природе в виде минералов, например, шабазита, фожазита, морденита или синтезируются при нагреве в вакууме силикатов или алюминатов щелочных металлов Алюмосиликатные тетраэдры образуют ажурные структуры, большие и малые полости Структурные изображения цеолитов А(а) и Х(б) 21
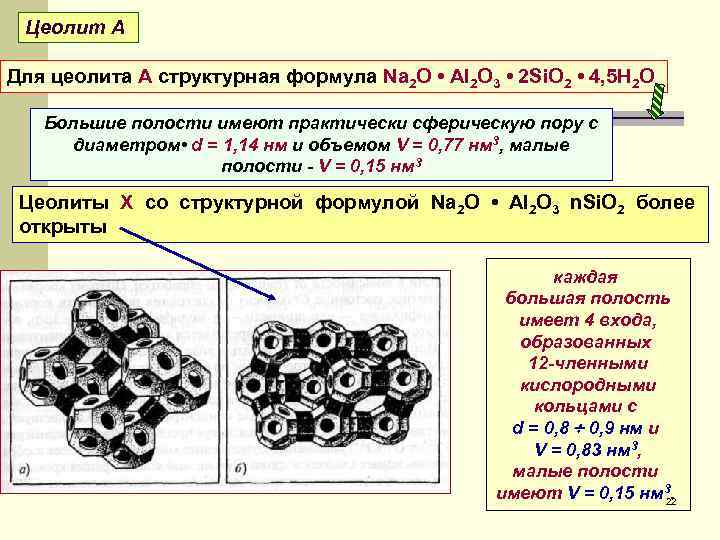
Цеолит А Для цеолита А структурная формула Na 2 O • Аl 2 О 3 • 2 Si. O 2 • 4, 5 Н 2 О Большие полости имеют практически сферическую пору с диаметром • d = 1, 14 нм и объемом V = 0, 77 нм 3, малые полости - V = 0, 15 нм 3 Цеолиты X со структурной формулой Na 2 O • Аl 2 О 3 n. Si. O 2 более открыты каждая большая полость имеет 4 входа, образованных 12 -членными кислородными кольцами с d = 0, 8 0, 9 нм и V = 0, 83 нм 3, малые полости имеют V = 0, 15 нм 3. 22
Лекция 3-а Классификация нанообъектов.ppt