
Лекция 3

Ионы находятся на больших расстояниях и взаимодействие электростатическое При увеличении концентрации электростатическое взаимодействие осложняется ион-дипольным Наличие ассоциации ионов Все виды взаимодействия описывает активность ионов в условиях наличия равновесия ассоциат-диссоциат

Всю совокупность взаимодействий, возникающих в растворах электролитов, можно формально описать, используя вместо концентраций ионов С i – активности ионов ai. Предполагается, что все термодинамические соотношения, записанные в форме уравнений для идеальных растворов, но содержащие активности, строго согласуются с результатами экспериментальных измерений. Все виды взаимодействий (за исключением изменения состава раствора) без учета их физической природы сводятся к отклонению активностей от соответствующих концентраций.






Li. Cl: L = 1 Ca. S: L = 1 Al. PO 4: L = 1 K 2 SO 4: L =1, 587 Fe(NO 3)2: L =1, 587 Fe(NO 3)3: L =2, 280 Al. Cl 3: L =2, 280 K 4[Fe(CN)6]: L =3, 031 Fe 2(SO 4)3: L =2, 551

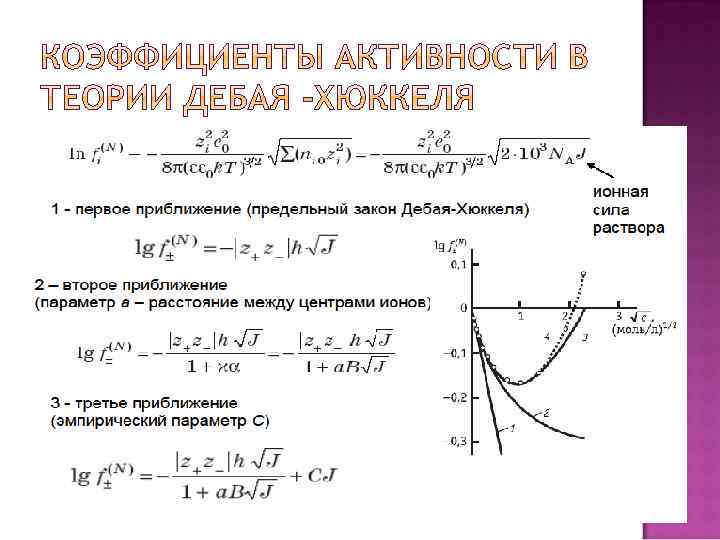
Основные положения: 1) Электролит всегда полностью диссоциирован (α = 1). 2) Растворитель – это континуум с диэлектрической проницаемостью ε. 3) Ионы участвуют ТОЛЬКО в 2 процессах: хаотическом тепловом движении и электростатическом (кулоновском) взаимодействии друг с другом. Никакие другие процессы и взаимодействия не учитываются. Это возможно в достаточно разбавленных растворах, близких по свойствам к идеальным. 4) Ионы энергетически распределены в растворе согласно закону Больцмана.
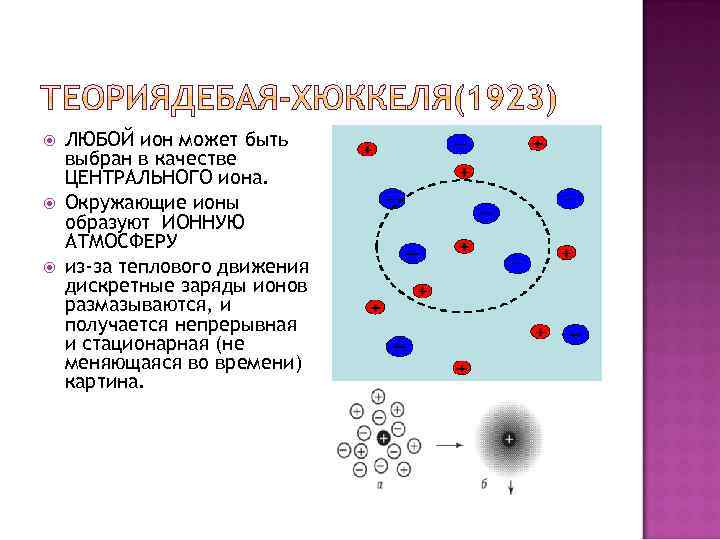
ЛЮБОЙ ион может быть выбран в качестве ЦЕНТРАЛЬНОГО иона. Окружающие ионы образуют ИОННУЮ АТМОСФЕРУ из-за теплового движения дискретные заряды ионов размазываются, и получается непрерывная и стационарная (не меняющаяся во времени) картина.

непрерывная и стационарная (не меняющаяся во времени) картина позволяет использовать континуальное (непрерывное) уравнение Пуассона – фундаментальное уравнение электростатики, связывающее электрический потенциал и плотность заряда


Ионы имеют точечные размеры и могут сближаться неограниченно В каждой точке пространства в пределах ионной атмосферы локальная концентрация каждого сорта ионов ni отличаются от его равновесной объемной концентрации ni 0. Это и определяет величину объемного заряда в этой точке













При низких концентрациях ионная сила • Для водных растворов при 250 C A = 0. 509 Ионы считают точечными • Взаимодействие между ионами только электростатическое • Электролит диссоциирует полностью



1) Использование континуального уравнения Пуассона означает, что никак не учитывается молекулярная структура растворителя. 2) Ионы считаются математическими точками (могут сближаться неограниченно), что неверно. 3) Игнорирование изменения ε раствора по сравнению с растворителем. 4) Игнорирование всех других возможных взаимодействий (ион-дипольное, сольватация, образование водородных связей, ассоциатов, комплексов и т. д. ).



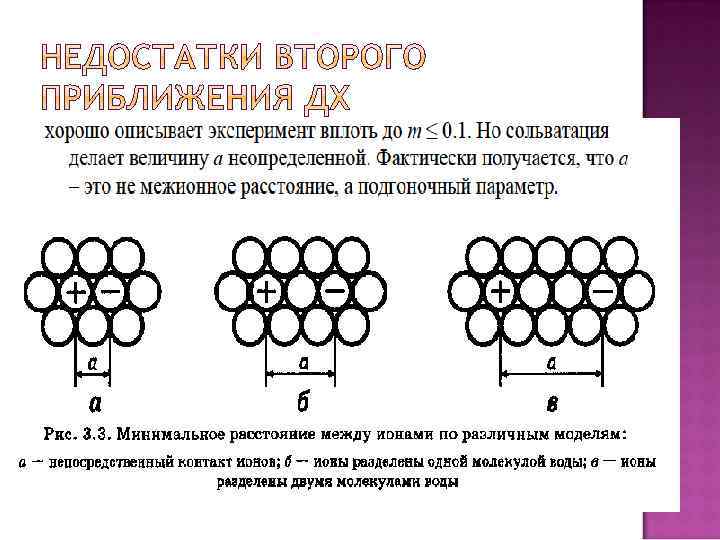
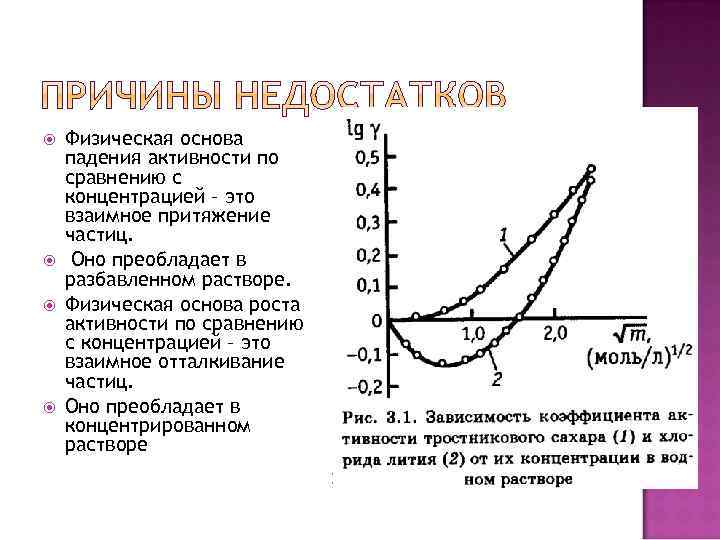
Физическая основа падения активности по сравнению с концентрацией – это взаимное притяжение частиц. Оно преобладает в разбавленном растворе. Физическая основа роста активности по сравнению с концентрацией – это взаимное отталкивание частиц. Оно преобладает в концентрированном растворе
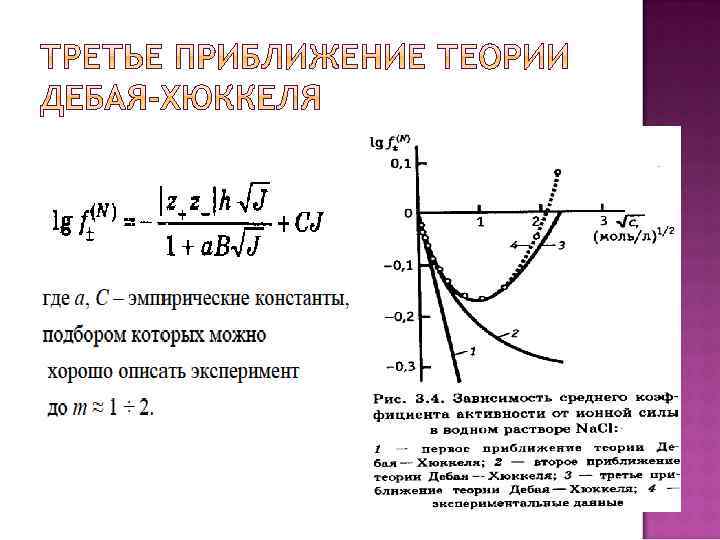

Что такое ионофоры и ионогены? Из каких энергий складывается энергия кристаллической решетки? Чему равна энергия сольватации 1 моля иона Что такое реальная энергия сольватации?