Лекция 3 — I Биологически важные реакции карбонильных





















3.1._biovaghnye_r-i.ppt
- Размер: 10.5 Мб
- Автор:
- Количество слайдов: 86
Описание презентации Лекция 3 — I Биологически важные реакции карбонильных по слайдам
 Лекция 3 — I Биологически важные реакции карбонильных соединений. Масс-спектрометрия. Кафедра общей и медицинской химии
Лекция 3 — I Биологически важные реакции карбонильных соединений. Масс-спектрометрия. Кафедра общей и медицинской химии
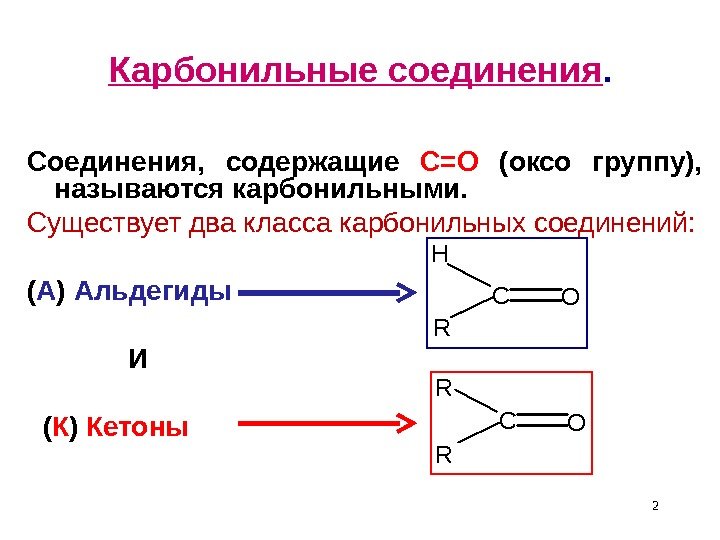
 2 Карбонильные соединения. Соединения, содержащие С=О (оксо группу), называются карбонильными. Существует два класса карбонильных соединений: ( А ) Альдегиды И ( К ) Кетоны CO H R CO R R
2 Карбонильные соединения. Соединения, содержащие С=О (оксо группу), называются карбонильными. Существует два класса карбонильных соединений: ( А ) Альдегиды И ( К ) Кетоны CO H R CO R R

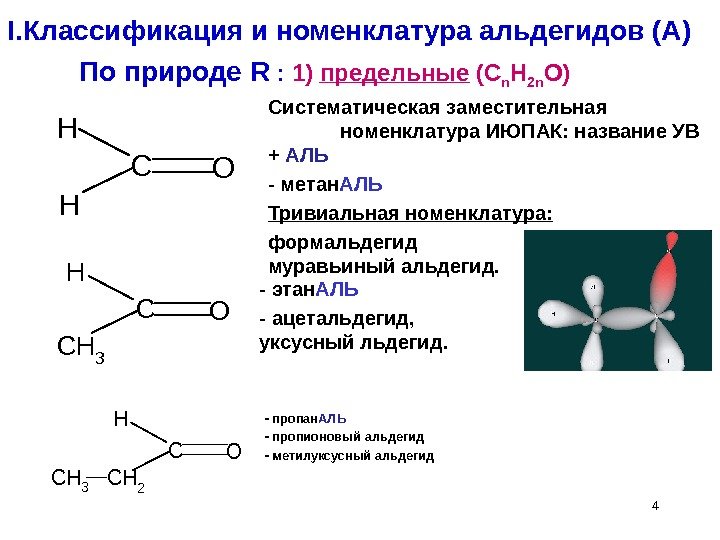
 4 I. Классификация и номенклатура альдегидов ( А ) — пропан АЛЬ — пропионовый альдегид — метилуксусный альдегид CO H H CO H CH 2 CH 3 CO H CH 3 По природе R : 1 ) предельные ( C n H 2 n O ) Систематическая заместительная номенклатура ИЮПАК: название УВ + АЛЬ — метан АЛЬ Тривиальная номенклатура: латура формальдегид муравьиный альдегид. — этан АЛЬ — ацетальдегид, уксусный льдегид.
4 I. Классификация и номенклатура альдегидов ( А ) — пропан АЛЬ — пропионовый альдегид — метилуксусный альдегид CO H H CO H CH 2 CH 3 CO H CH 3 По природе R : 1 ) предельные ( C n H 2 n O ) Систематическая заместительная номенклатура ИЮПАК: название УВ + АЛЬ — метан АЛЬ Тривиальная номенклатура: латура формальдегид муравьиный альдегид. — этан АЛЬ — ацетальдегид, уксусный льдегид.
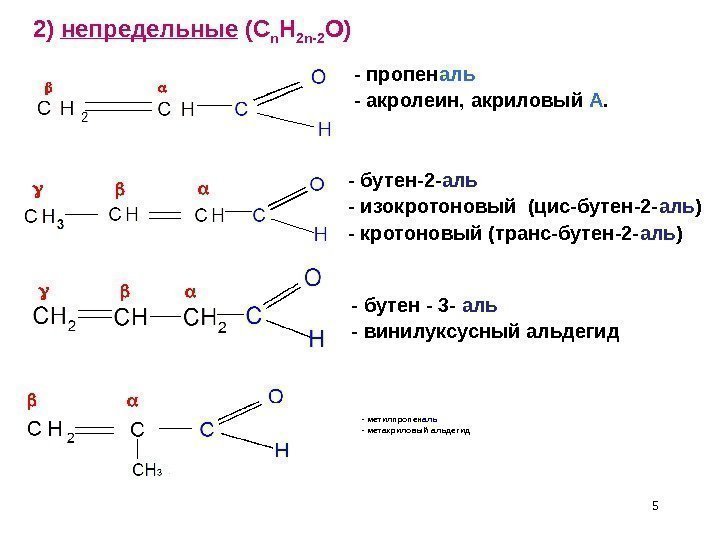
 5 — метилпропен аль — метакриловый альдегид 2) непредельные ( C n H 2 n-2 O ) — пропен аль — акролеин, акриловый А. — бутен-2 — аль — изокротоновый (цис-бутен-2 — аль ) — кротоновый (транс-бутен-2 — аль ) — бутен — 3 — аль — винилуксусный альдегид
5 — метилпропен аль — метакриловый альдегид 2) непредельные ( C n H 2 n-2 O ) — пропен аль — акролеин, акриловый А. — бутен-2 — аль — изокротоновый (цис-бутен-2 — аль ) — кротоновый (транс-бутен-2 — аль ) — бутен — 3 — аль — винилуксусный альдегид
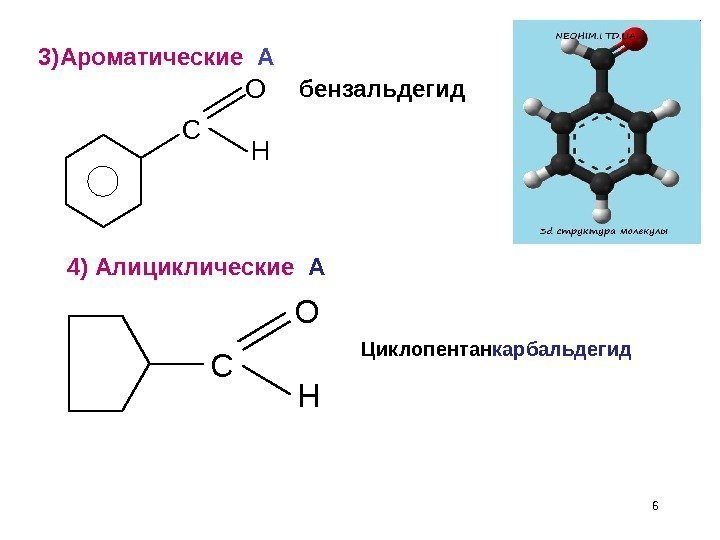
 6 C O Hбензальдегид C O H Циклопентан карбальдегид 4) Алициклические А 3) Ароматические А
6 C O Hбензальдегид C O H Циклопентан карбальдегид 4) Алициклические А 3) Ароматические А

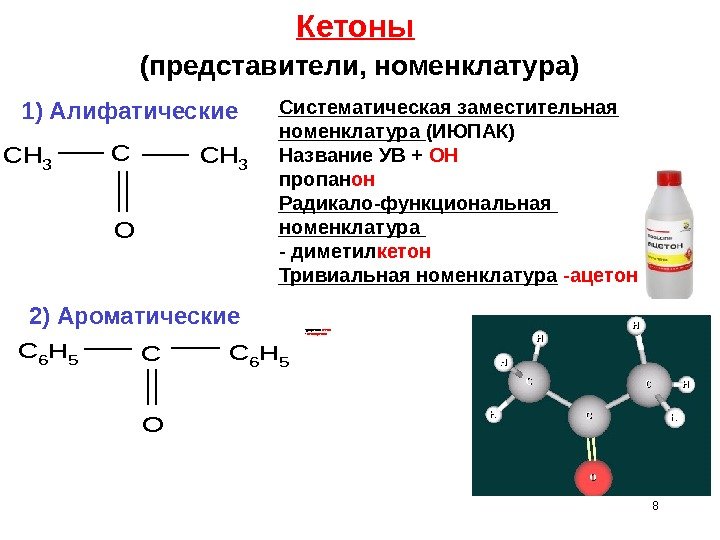
 8 Кетоны (представители, номенклатура) -дифенил к етон — бензофенон CH 3 CCH 3 O C 6 H 5 CC 6 H 5 O 1) Алифатические Систематическая заместительная номенклатура (ИЮПАК) Название УВ + ОН пропан он Радикало-функциональная номенклатура — диметил кетон Тривиальная номенклатура -ацетон 2) Ароматические
8 Кетоны (представители, номенклатура) -дифенил к етон — бензофенон CH 3 CCH 3 O C 6 H 5 CC 6 H 5 O 1) Алифатические Систематическая заместительная номенклатура (ИЮПАК) Название УВ + ОН пропан он Радикало-функциональная номенклатура — диметил кетон Тривиальная номенклатура -ацетон 2) Ароматические
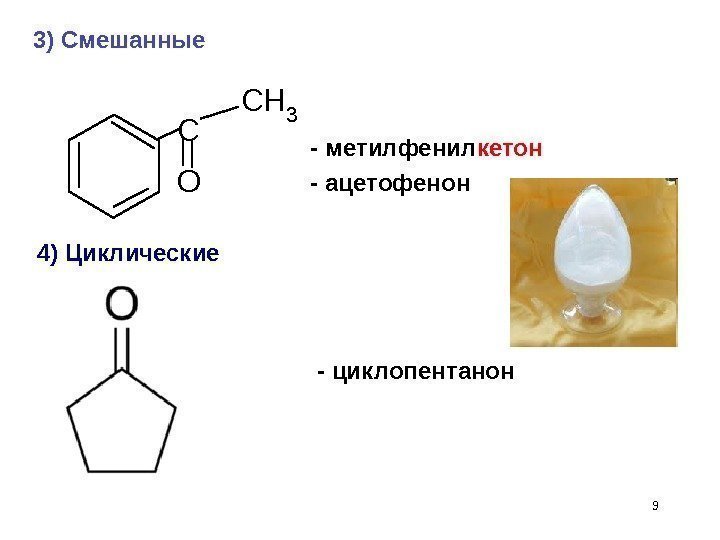
 — метилфенил кетон — ацетофенон 9 C O CH 3 4) Циклические 3) Смешанные — циклопентанон
— метилфенил кетон — ацетофенон 9 C O CH 3 4) Циклические 3) Смешанные — циклопентанон
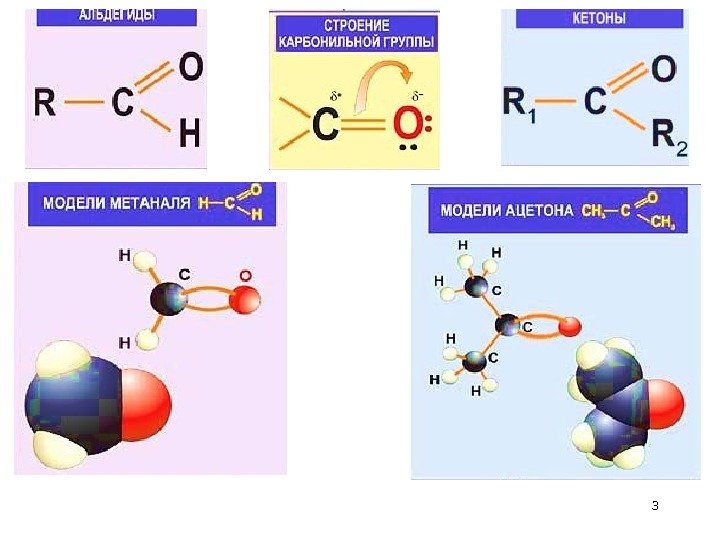
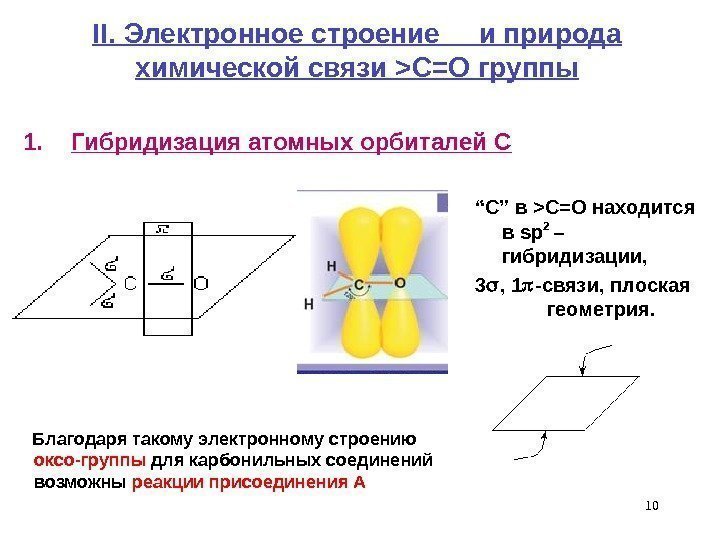
 10 II. Электронное строение и природа химической связи >C=O группы 1. Гибридизация атомных орбиталей С Благодаря такому электронному строению оксо-группы для карбонильных соединений возможны реакции присоединения А “ С ” в >C=O находится в sp 2 – гибридизации, 3 , 1 -связи, плоская геометрия.
10 II. Электронное строение и природа химической связи >C=O группы 1. Гибридизация атомных орбиталей С Благодаря такому электронному строению оксо-группы для карбонильных соединений возможны реакции присоединения А “ С ” в >C=O находится в sp 2 – гибридизации, 3 , 1 -связи, плоская геометрия.
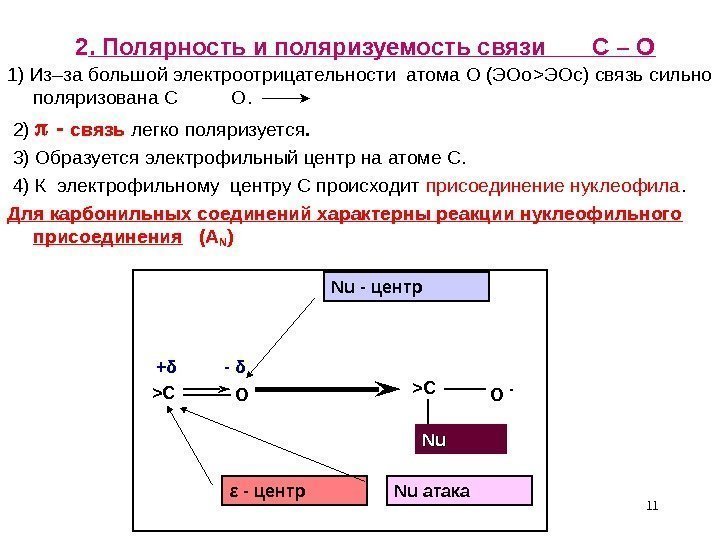
 112. Полярность и поляризуемость связи С – О 1) Из–за большой электроотрицательности атома О (ЭОо > ЭОс) связь сильно поляризована С О. 2) — связь легко поляризуется. 3) Образуется электрофильный центр на атоме С. 4) К электрофильному центру С происходит присоединение нуклеофила. Для карбонильных соединений характерны реакции нуклеофильного присоединения (А N ) > С О — ε — центр Nu атака. Nu — центр Nu. Nu+ δ — δ
112. Полярность и поляризуемость связи С – О 1) Из–за большой электроотрицательности атома О (ЭОо > ЭОс) связь сильно поляризована С О. 2) — связь легко поляризуется. 3) Образуется электрофильный центр на атоме С. 4) К электрофильному центру С происходит присоединение нуклеофила. Для карбонильных соединений характерны реакции нуклеофильного присоединения (А N ) > С О — ε — центр Nu атака. Nu — центр Nu. Nu+ δ — δ
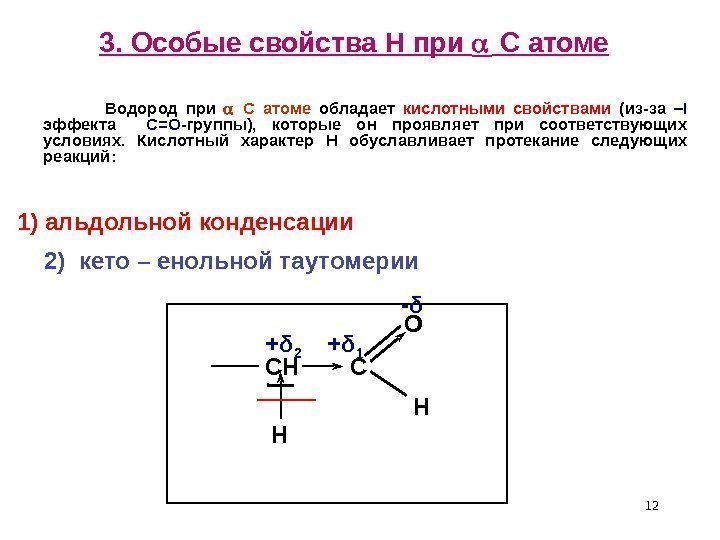
 123. Особые свойства Н при С атоме Водород при С атоме обладает кислотными свойствами (из-за – I эффекта С= O -группы), которые он проявляет при соответствующих условиях. Кислотный характер H обуславливает протекание следующих реакций: СН С О Н Н+ δ 2 + δ 1 — δ 1) альдольной конденсации 2) кето – енольной таутомерии
123. Особые свойства Н при С атоме Водород при С атоме обладает кислотными свойствами (из-за – I эффекта С= O -группы), которые он проявляет при соответствующих условиях. Кислотный характер H обуславливает протекание следующих реакций: СН С О Н Н+ δ 2 + δ 1 — δ 1) альдольной конденсации 2) кето – енольной таутомерии
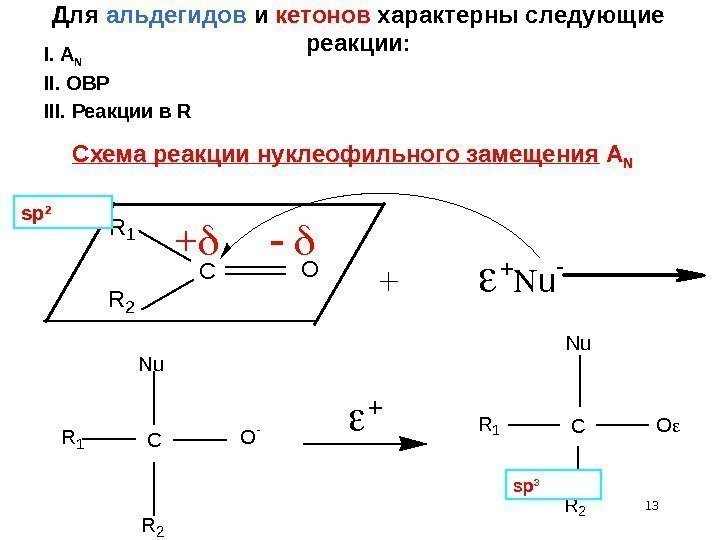
 13 Для альдегидов и кетонов характерны следующие реакции: + u — R 1 CN u R 2 O -CR 1 R 2 O CR 1 R 2 N u O Схема реакции нуклеофильного замещения A N sp 2 sp 3 III. Реакции в RII. ОВРI. A N
13 Для альдегидов и кетонов характерны следующие реакции: + u — R 1 CN u R 2 O -CR 1 R 2 O CR 1 R 2 N u O Схема реакции нуклеофильного замещения A N sp 2 sp 3 III. Реакции в RII. ОВРI. A N
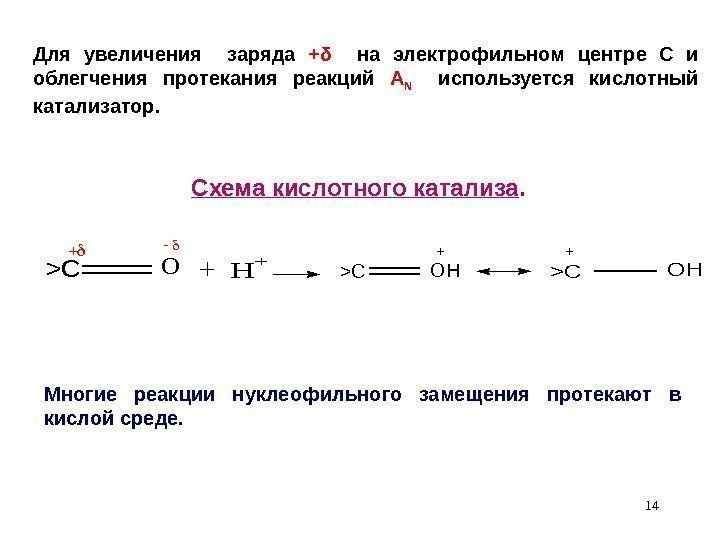
 14 Для увеличения заряда + δ на электрофильном центре С и облегчения протекания реакций А N используется кислотный катализатор. C хема кислотного катализа. >COH + > C O H+ >COH + Многие реакции нуклеофильного замещения протекают в кислой среде.
14 Для увеличения заряда + δ на электрофильном центре С и облегчения протекания реакций А N используется кислотный катализатор. C хема кислотного катализа. >COH + > C O H+ >COH + Многие реакции нуклеофильного замещения протекают в кислой среде.
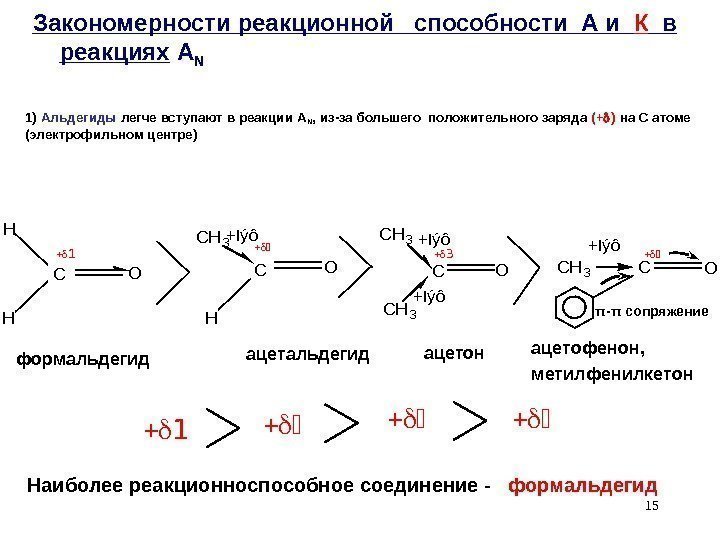
 151) Альдегиды легче вступают в реакции A N , из-за большего положительного заряда (+ ) на С атоме (электрофильном центре)CO H H COC CH 3 O CH 3 H CH 3 CO +Iýô+Iýô Закономерности реакционной способности А и К в реакциях A N формальдегид ацетон +Iýô ацетофенон, метилфенилкетон Наиболее реакционноспособное соединение — формальдегид π — π сопряжение
151) Альдегиды легче вступают в реакции A N , из-за большего положительного заряда (+ ) на С атоме (электрофильном центре)CO H H COC CH 3 O CH 3 H CH 3 CO +Iýô+Iýô Закономерности реакционной способности А и К в реакциях A N формальдегид ацетон +Iýô ацетофенон, метилфенилкетон Наиболее реакционноспособное соединение — формальдегид π — π сопряжение
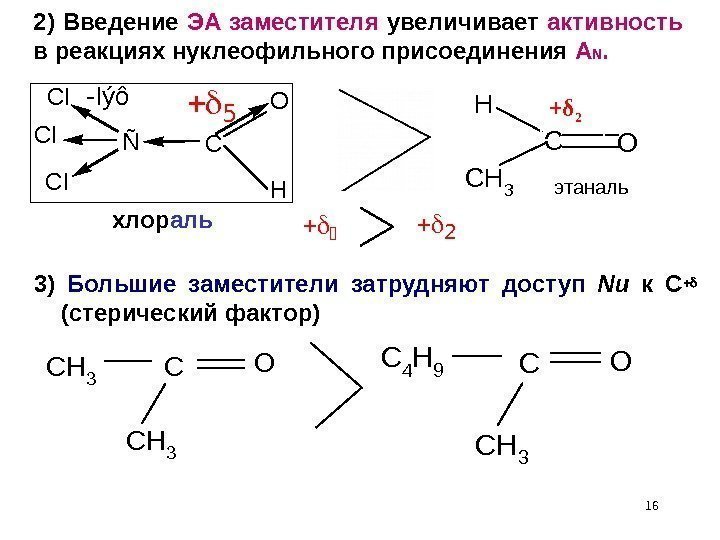
 163) Большие заместители затрудняют доступ Nu к С+ (стерический фактор) CH 3 C CH 3 OC 4 H 9 C CH 3 O Ñ CI CI CI C O H — I ý ô CO H CH 3 + δ 2 этаналь2) Введение ЭА заместителя увеличивает активность в реакциях нуклеофильного присоединения A N. хлор аль
163) Большие заместители затрудняют доступ Nu к С+ (стерический фактор) CH 3 C CH 3 OC 4 H 9 C CH 3 O Ñ CI CI CI C O H — I ý ô CO H CH 3 + δ 2 этаналь2) Введение ЭА заместителя увеличивает активность в реакциях нуклеофильного присоединения A N. хлор аль
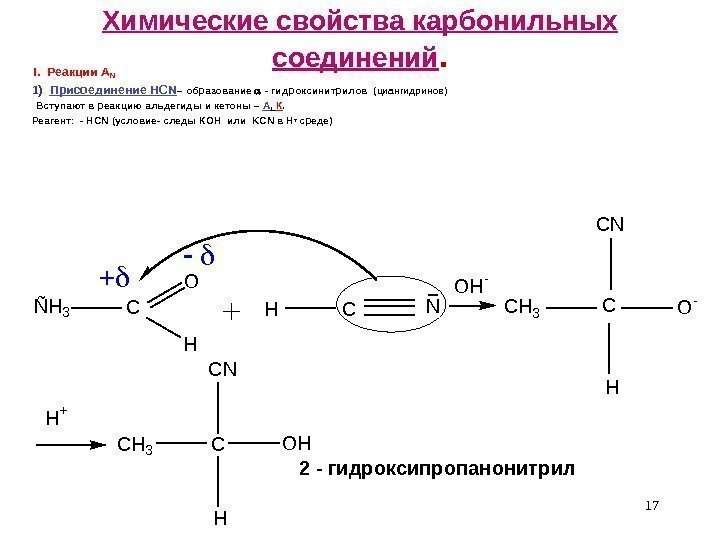
 ÑH 3 C O H HCN OH- CH 3 CO- CN H H+ CH 3 C CN OH H 17 Химические свойства карбонильных соединений. I. Реакции A N 1) Присоединение HCN – образование — гидроксинитрилов ( циангидринов) Вступают в реакцию альдегиды и кетоны – А , К. Реагент: — HCN (условие- следы КОН или KCN в Н + среде) 2 — гидроксипропанонитрил
ÑH 3 C O H HCN OH- CH 3 CO- CN H H+ CH 3 C CN OH H 17 Химические свойства карбонильных соединений. I. Реакции A N 1) Присоединение HCN – образование — гидроксинитрилов ( циангидринов) Вступают в реакцию альдегиды и кетоны – А , К. Реагент: — HCN (условие- следы КОН или KCN в Н + среде) 2 — гидроксипропанонитрил
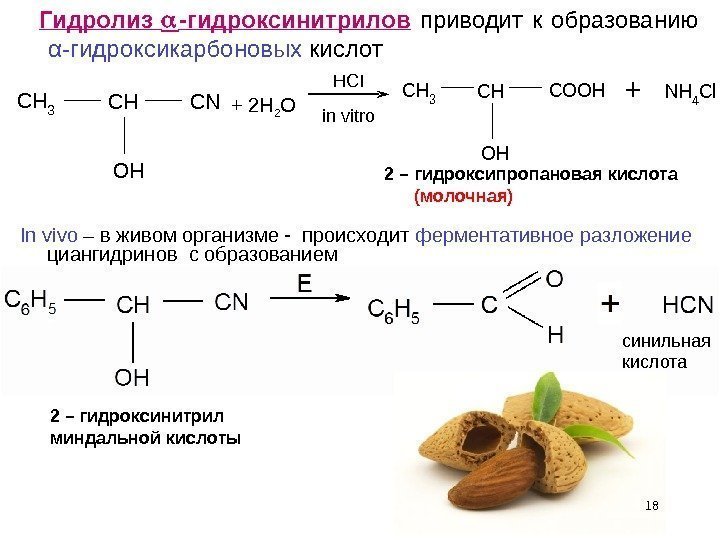
 18 Гидролиз -гидроксинитрилов приводит к образованию α -гидроксикарбоновых кислот. CH 3 CH OH CN CH 3 CH OH COOHNH 4 Cl+ + 2 H 2 O 2 – гидроксипропановая кислота (молочная) In vivo – в живом организме — происходит ферментативное разложение циангидринов с образованием 2 – гидроксинитрил миндальной кислоты HCI in vitro синильная кислота
18 Гидролиз -гидроксинитрилов приводит к образованию α -гидроксикарбоновых кислот. CH 3 CH OH CN CH 3 CH OH COOHNH 4 Cl+ + 2 H 2 O 2 – гидроксипропановая кислота (молочная) In vivo – в живом организме — происходит ферментативное разложение циангидринов с образованием 2 – гидроксинитрил миндальной кислоты HCI in vitro синильная кислота
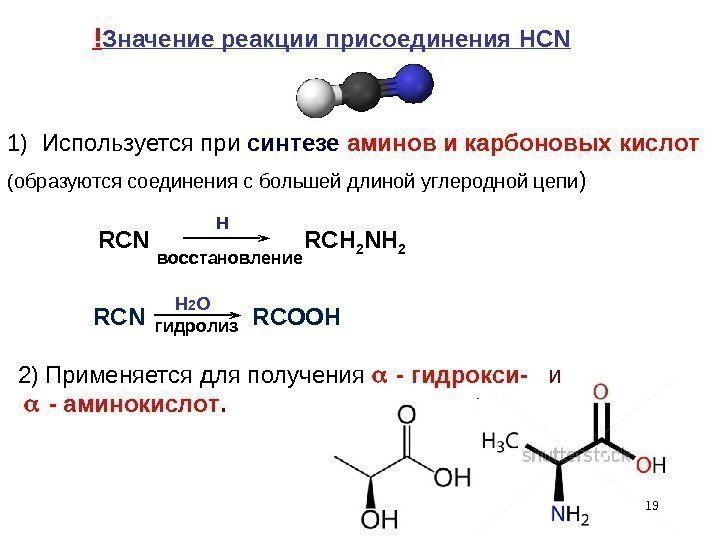
 H 192) Применяется для получения — гидрокси- и — аминокислот. н 2 овосстановление гидролиз ! Значение реакции присоединения HCN 1) Используется при синтезе аминов и карбоновых кислот ( образуются соединения с большей длиной углеродной цепи ) RCN RCH 2 NH 2 RCN RCOOH
H 192) Применяется для получения — гидрокси- и — аминокислот. н 2 овосстановление гидролиз ! Значение реакции присоединения HCN 1) Используется при синтезе аминов и карбоновых кислот ( образуются соединения с большей длиной углеродной цепи ) RCN RCH 2 NH 2 RCN RCOOH
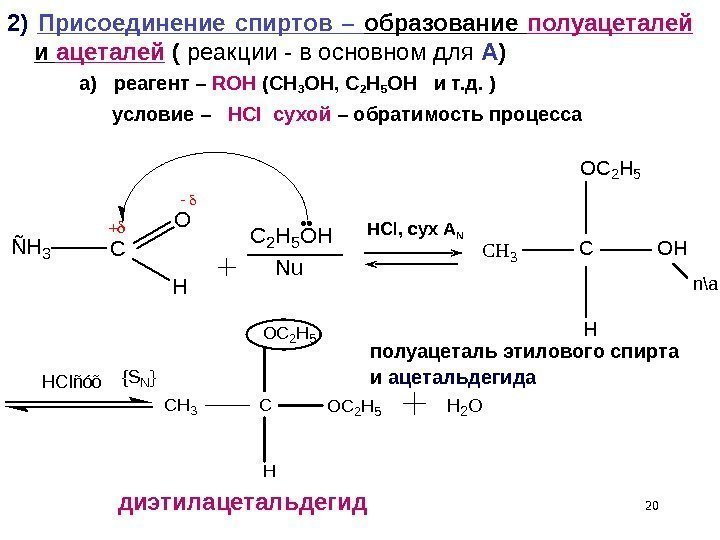
 202) Присоединение спиртов – образование полуацеталей и ацеталей ( реакции — в основном для А ) а) реагент – ROH ( CH 3 OH , С 2 H 5 OH и т. д. ) условие – HCl сухой – обратимость процесса. C 2 H 5 OH Nu CH 3 C OC 2 H 5 H OC 2 H 5 H 2 O C H 3 C O C 2 H 5 H O H H C I ñ ó õ { S N } n \ a. HCl, сух А N полуацеталь этилового спирта и ацетальдегида диэтилацетальдегид ÑH 3 C O H
202) Присоединение спиртов – образование полуацеталей и ацеталей ( реакции — в основном для А ) а) реагент – ROH ( CH 3 OH , С 2 H 5 OH и т. д. ) условие – HCl сухой – обратимость процесса. C 2 H 5 OH Nu CH 3 C OC 2 H 5 H OC 2 H 5 H 2 O C H 3 C O C 2 H 5 H O H H C I ñ ó õ { S N } n \ a. HCl, сух А N полуацеталь этилового спирта и ацетальдегида диэтилацетальдегид ÑH 3 C O H
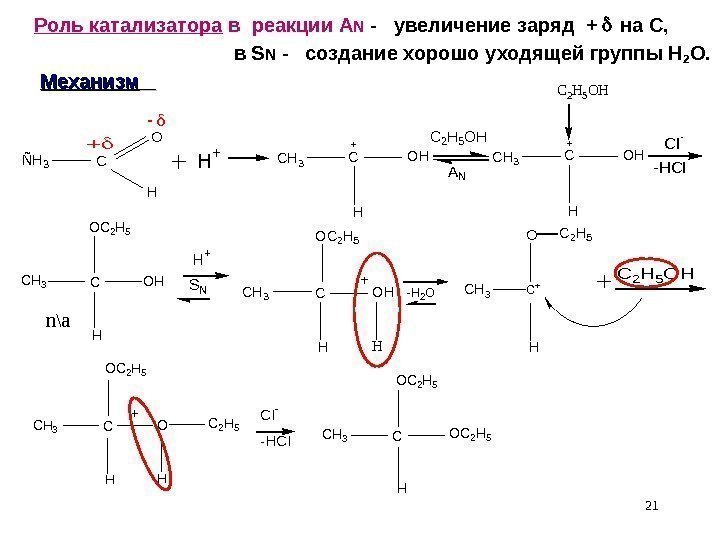
 21 Роль катализатора в реакции A N — увеличение заряд + на С, в S N — создание хорошо уходящей группы Н 2 О. Механизм Ñ H 3 C O HH + C H 3 C + O H H C 2 H 5 O H A N C I — — H C I C H 3 CO C 2 H 5 O H H n\a H+ SNCH 3 C OC 2 H 5 OH HH +C 2 H 5 OH C H 3 C O C 2 H 5 HC I — — H C I -H 2 O C H 3 C O C 2 H 5 O H H C 2 H 5+ CH 3 C + O H C 2 H 5 C H 3 C + O H HC 2 H 5 O H
21 Роль катализатора в реакции A N — увеличение заряд + на С, в S N — создание хорошо уходящей группы Н 2 О. Механизм Ñ H 3 C O HH + C H 3 C + O H H C 2 H 5 O H A N C I — — H C I C H 3 CO C 2 H 5 O H H n\a H+ SNCH 3 C OC 2 H 5 OH HH +C 2 H 5 OH C H 3 C O C 2 H 5 HC I — — H C I -H 2 O C H 3 C O C 2 H 5 O H H C 2 H 5+ CH 3 C + O H C 2 H 5 C H 3 C + O H HC 2 H 5 O H
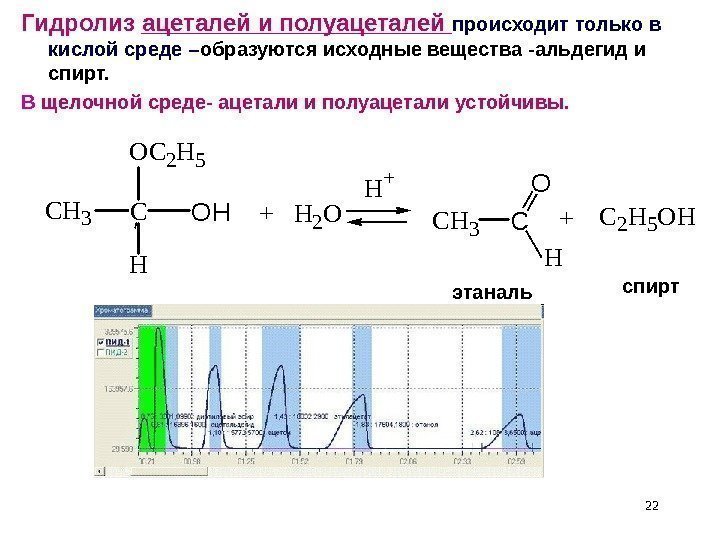
 22 COH OC 2 H 5 CH 3 H + H 2 O H + CH 3 C O H +C 2 H 5 OHэтаналь. Гидролиз ацеталей и полуацеталей происходит только в кислой среде – образуются исходные вещества -альдегид и спирт. В щелочной среде- ацетали и полуацетали устойчивы. спирт
22 COH OC 2 H 5 CH 3 H + H 2 O H + CH 3 C O H +C 2 H 5 OHэтаналь. Гидролиз ацеталей и полуацеталей происходит только в кислой среде – образуются исходные вещества -альдегид и спирт. В щелочной среде- ацетали и полуацетали устойчивы. спирт
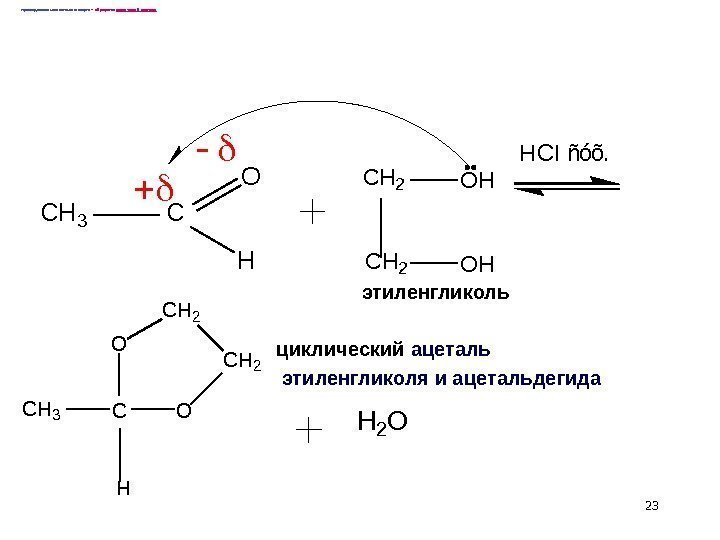
 23 Присоединение многоатомного спирта – образуется циклический ацеталь: CH 3 C O H C H 2 O H HCI ñóõ. C H 3 C OO H C H 2 H 2 O циклический ацеталь этиленгликоля и ацетальдегида этиленгликоль
23 Присоединение многоатомного спирта – образуется циклический ацеталь: CH 3 C O H C H 2 O H HCI ñóõ. C H 3 C OO H C H 2 H 2 O циклический ацеталь этиленгликоля и ацетальдегида этиленгликоль
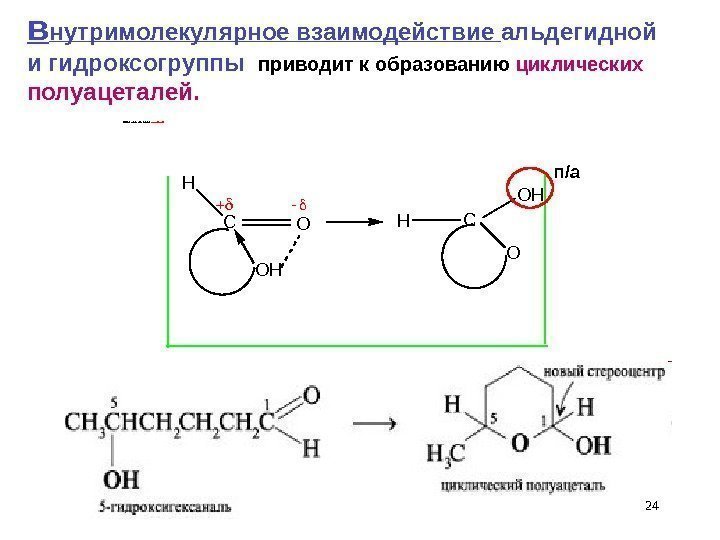
 24 Общая схема образова ния полуцеталей H C O O H H C O H O п/ав нутримолекулярное взаимодействие альдегидной и гидроксогруппы приводит к образованию циклических полуацеталей.
24 Общая схема образова ния полуцеталей H C O O H H C O H O п/ав нутримолекулярное взаимодействие альдегидной и гидроксогруппы приводит к образованию циклических полуацеталей.
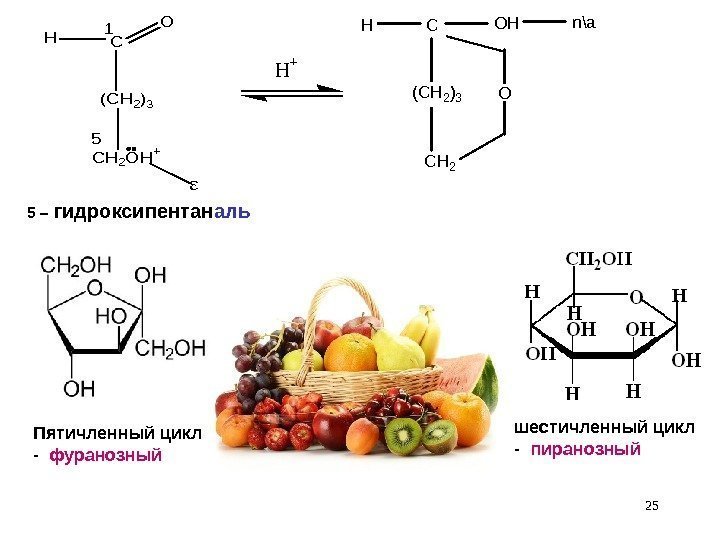
 25 C O (CH 2)3 H CH 2 OH+ 5 1 H + H C O H ( C H 2 )3 C H 2 O n \ a 5 – гидроксипентан аль Пятичленный цикл — фуранозный шестичленный цикл — пиранозный
25 C O (CH 2)3 H CH 2 OH+ 5 1 H + H C O H ( C H 2 )3 C H 2 O n \ a 5 – гидроксипентан аль Пятичленный цикл — фуранозный шестичленный цикл — пиранозный
 26 Значение реакции ацетализации 1 ). Реакция лежит в основе получения природных полисахаридов (полиацеталей) – целлюлозы, крахмала и т. д. (гетерополисахаридов – хондроитинсульфатов ).
26 Значение реакции ацетализации 1 ). Реакция лежит в основе получения природных полисахаридов (полиацеталей) – целлюлозы, крахмала и т. д. (гетерополисахаридов – хондроитинсульфатов ).
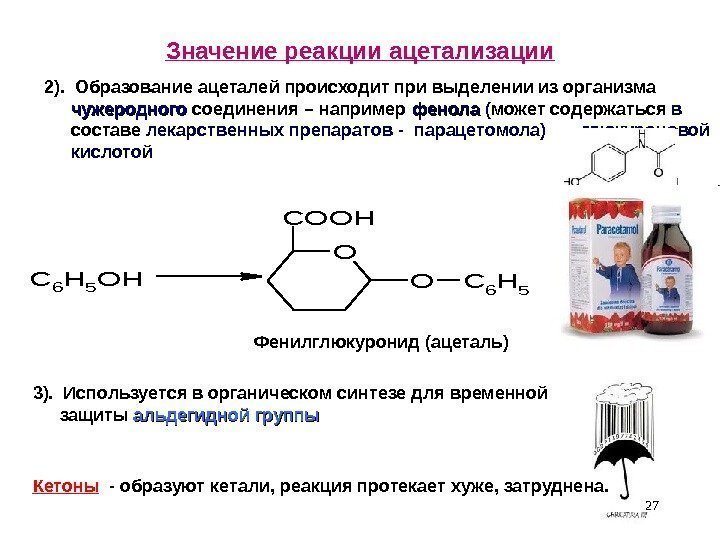
 27 Значение реакции ацетализации. C 6 H 5 OH O COOH OC 6 H 5 Кетоны — образуют кетали, реакция протекает хуже, затруднена. 3). Используется в органическом синтезе для временной защиты альдегидной группы2). Образование ацеталей происходит при выделении из организма чужеродного соединения – например фенола ( может содержаться в составе лекарственных препаратов — парацетомола) глюкуроновой кислотой Фенилглюкуронид (ацеталь)
27 Значение реакции ацетализации. C 6 H 5 OH O COOH OC 6 H 5 Кетоны — образуют кетали, реакция протекает хуже, затруднена. 3). Используется в органическом синтезе для временной защиты альдегидной группы2). Образование ацеталей происходит при выделении из организма чужеродного соединения – например фенола ( может содержаться в составе лекарственных препаратов — парацетомола) глюкуроновой кислотой Фенилглюкуронид (ацеталь)
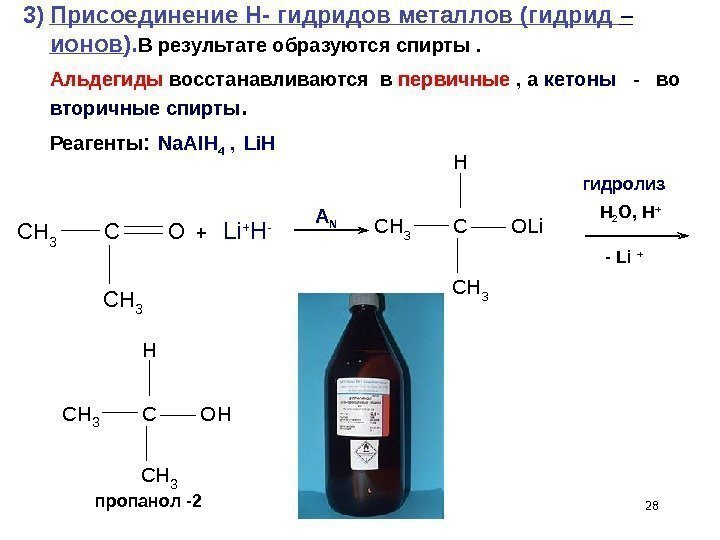
 28 C H 3 C O L i C H 3 H + Li + H — H 2 O, H + — Li + C H 3 C O H C H 3 H 3) Присоединение H — гидридов металлов (гидрид – ионов ). В результате образуются спирты. Альдегиды восстанавливаются в первичные , а кетоны — во вторичные спирты. Реагенты : пропанол -2 Na. Al. H 4 , Li. H А N гидролиз
28 C H 3 C O L i C H 3 H + Li + H — H 2 O, H + — Li + C H 3 C O H C H 3 H 3) Присоединение H — гидридов металлов (гидрид – ионов ). В результате образуются спирты. Альдегиды восстанавливаются в первичные , а кетоны — во вторичные спирты. Реагенты : пропанол -2 Na. Al. H 4 , Li. H А N гидролиз
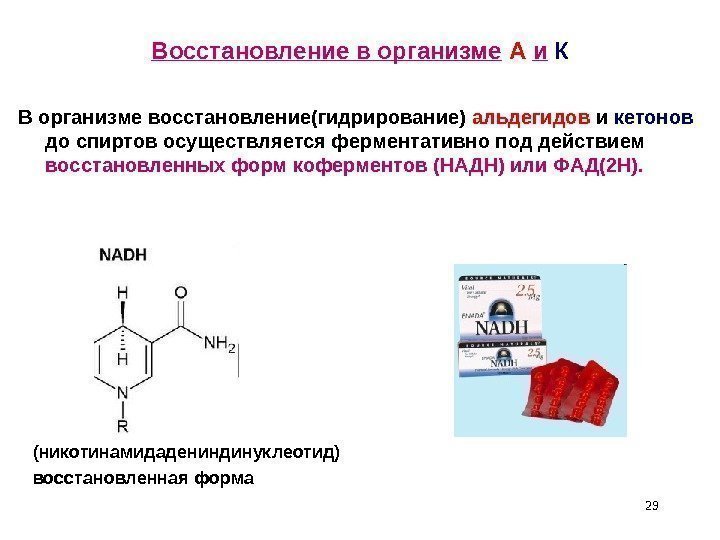
 Восстановление в организме А и К В организме восстановление(гидрирование) альдегидов и кетонов до спиртов осуществляется ферментативно под действием восстановленных форм коферментов (НАДН) или ФАД(2 Н). (никотинамидадениндинуклеотид) восстановленная форма
Восстановление в организме А и К В организме восстановление(гидрирование) альдегидов и кетонов до спиртов осуществляется ферментативно под действием восстановленных форм коферментов (НАДН) или ФАД(2 Н). (никотинамидадениндинуклеотид) восстановленная форма
 30 CH 3 CO CH 3 + C 2 H 5 NH 2 A N –E — H 2 O CH 3 CN CH 3 C 2 H 54) Взаимодействие с аминами и их производными (NH 2 X) — образуются имины — ( основания Шиффа ). В реакцию вступают и альдегиды и кетоны , процесс протекает в два этапа: -нуклеофильное присоединение NH 2 X — первичных аминов или аммиака NH 3 — отщепление Н 2 О классифицируется как реакция A N –E (присоединения-отщепления) этилимин ацетона Рассматриваются 2 механизма этой реакции : 1) с Н+ катализатором; 2)через образование биполярного иона
30 CH 3 CO CH 3 + C 2 H 5 NH 2 A N –E — H 2 O CH 3 CN CH 3 C 2 H 54) Взаимодействие с аминами и их производными (NH 2 X) — образуются имины — ( основания Шиффа ). В реакцию вступают и альдегиды и кетоны , процесс протекает в два этапа: -нуклеофильное присоединение NH 2 X — первичных аминов или аммиака NH 3 — отщепление Н 2 О классифицируется как реакция A N –E (присоединения-отщепления) этилимин ацетона Рассматриваются 2 механизма этой реакции : 1) с Н+ катализатором; 2)через образование биполярного иона
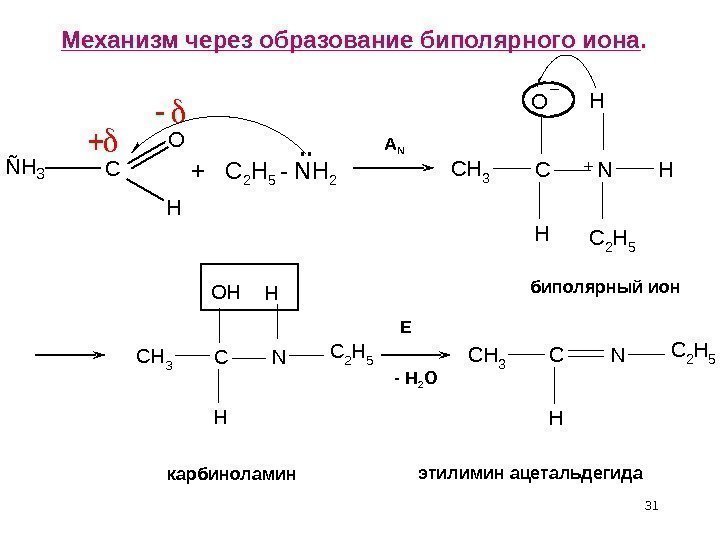
 ÑH 3 C O H 31 Механизм через образование биполярного иона. + C 2 H 5 — NH 2. . A N CH 3 CN H H OH C 2 H 5 CH 3 CN H H C 2 H 5 OH CH 3 CN H C 2 H 5 E — H 2 O биполярный ион карбиноламин этилимин ацетальдегида +
ÑH 3 C O H 31 Механизм через образование биполярного иона. + C 2 H 5 — NH 2. . A N CH 3 CN H H OH C 2 H 5 CH 3 CN H H C 2 H 5 OH CH 3 CN H C 2 H 5 E — H 2 O биполярный ион карбиноламин этилимин ацетальдегида +
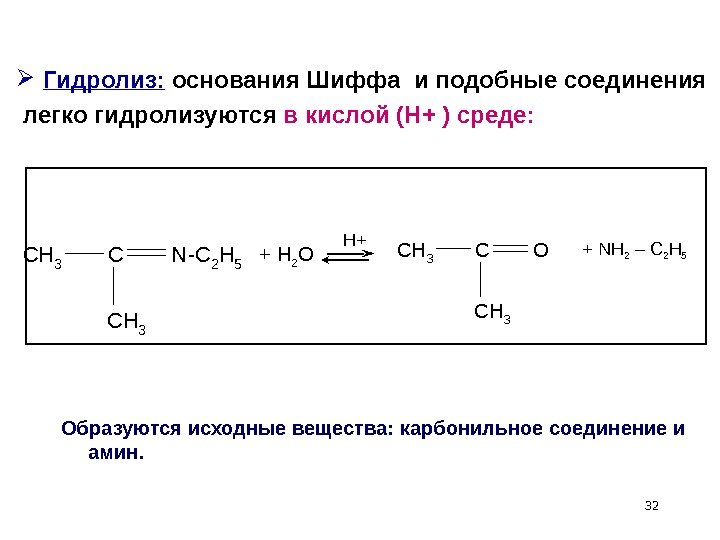
 32 Гидролиз: основания Шиффа и подобные соединения легко гидролизуются в кислой (Н+ ) среде: CH 3 CN-C 2 H 5 CH 3 + H 2 O H+ CH 3 CO CH 3 + NH 2 – C 2 H 5 Образуются исходные вещества: карбонильное соединение и амин.
32 Гидролиз: основания Шиффа и подобные соединения легко гидролизуются в кислой (Н+ ) среде: CH 3 CN-C 2 H 5 CH 3 + H 2 O H+ CH 3 CO CH 3 + NH 2 – C 2 H 5 Образуются исходные вещества: карбонильное соединение и амин.
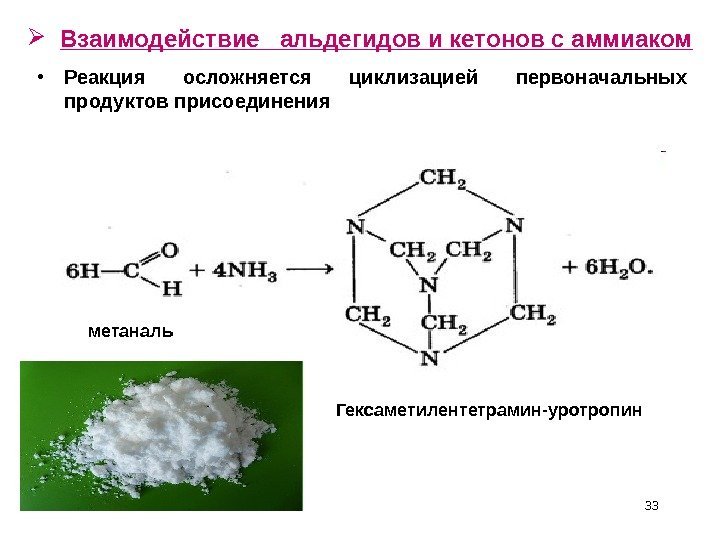
 Взаимодействие альдегидов и кетонов с аммиаком • Реакция осложняется циклизацией первоначальных продуктов присоединения метаналь Гексаметилентетрамин-уротропин
Взаимодействие альдегидов и кетонов с аммиаком • Реакция осложняется циклизацией первоначальных продуктов присоединения метаналь Гексаметилентетрамин-уротропин
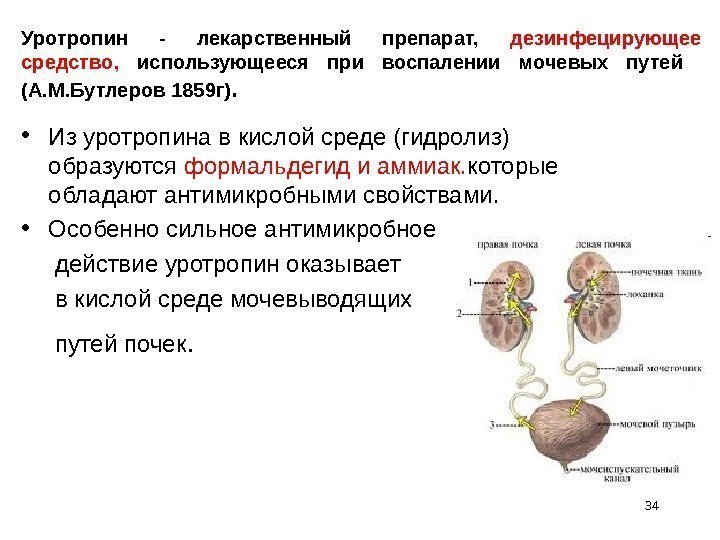
 Уротропин — лекарственный препарат, дезинфецирующее средство, использующееся при воспалении мочевых путей (А. М. Бутлеров 1859 г). • Из уротропина в кислой среде (гидролиз) образуются формальдегид и аммиак. которые обладают антимикробными свойствами. • Особенно сильное антимикробное действие уротропин оказывает в кислой среде мочевыводящих путей почек.
Уротропин — лекарственный препарат, дезинфецирующее средство, использующееся при воспалении мочевых путей (А. М. Бутлеров 1859 г). • Из уротропина в кислой среде (гидролиз) образуются формальдегид и аммиак. которые обладают антимикробными свойствами. • Особенно сильное антимикробное действие уротропин оказывает в кислой среде мочевыводящих путей почек.
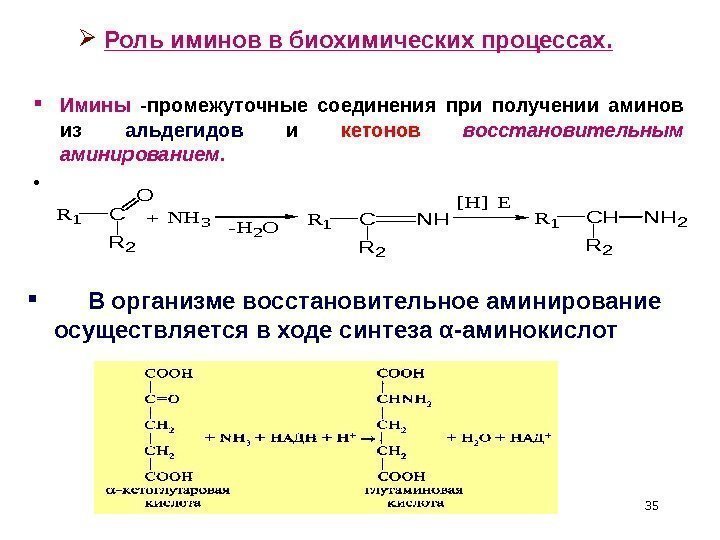
 Роль иминов в биохимических процессах. Имины -промежуточные соединения при получении аминов из альдегидов и кетонов восстановительным аминированием. • R 1 C O R 2 +NH 3 -H 2 OR 1 C R 2 NH [H] E R 1 CHNH 2 R 2 В организме восстановительное аминирование осуществляется в ходе синтеза α -аминокислот
Роль иминов в биохимических процессах. Имины -промежуточные соединения при получении аминов из альдегидов и кетонов восстановительным аминированием. • R 1 C O R 2 +NH 3 -H 2 OR 1 C R 2 NH [H] E R 1 CHNH 2 R 2 В организме восстановительное аминирование осуществляется в ходе синтеза α -аминокислот
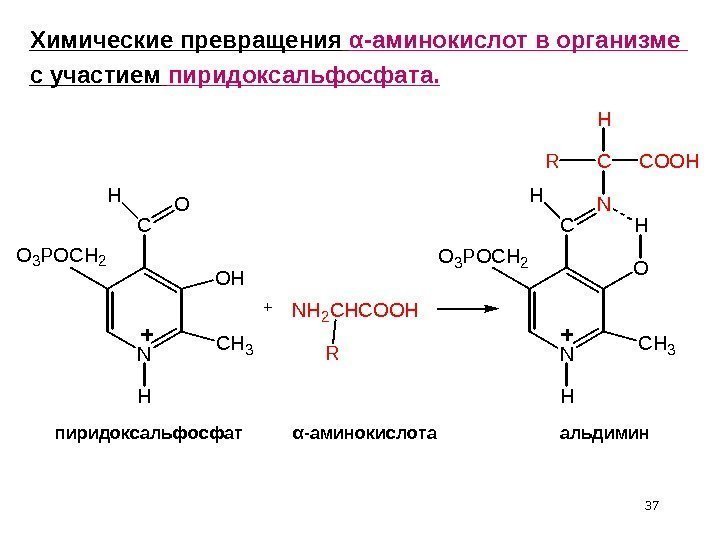
 362 метил – 3 гидрокси, 5 гидрокси – пиридин – 4 карб альдегидфосфат. Процесс образования — аминокислот из — оксокислот называется переаминированием или трансаминированием. Он протекает через стадию получения иминов. В процессе трансаминирования участвует кофермент пиридоксальфосфат. Пиридоксальфосфат выполняет функцию переносчика аминогруппы т. е. временно хранит NH 2 -группу, являясь «камерой хранения» )
362 метил – 3 гидрокси, 5 гидрокси – пиридин – 4 карб альдегидфосфат. Процесс образования — аминокислот из — оксокислот называется переаминированием или трансаминированием. Он протекает через стадию получения иминов. В процессе трансаминирования участвует кофермент пиридоксальфосфат. Пиридоксальфосфат выполняет функцию переносчика аминогруппы т. е. временно хранит NH 2 -группу, являясь «камерой хранения» )
 37 NC OH O H C H 3 HO 3 P O C H 2 + N H 2 C H C O O H R NC NH C H 3 HO 3 P O C H 2 O HC C O O HR HХимические превращения α -аминокислот в организме с участием пиридоксальфосфата. пиридоксальфосфат α -аминокислота альдимин+ +
37 NC OH O H C H 3 HO 3 P O C H 2 + N H 2 C H C O O H R NC NH C H 3 HO 3 P O C H 2 O HC C O O HR HХимические превращения α -аминокислот в организме с участием пиридоксальфосфата. пиридоксальфосфат α -аминокислота альдимин+ +
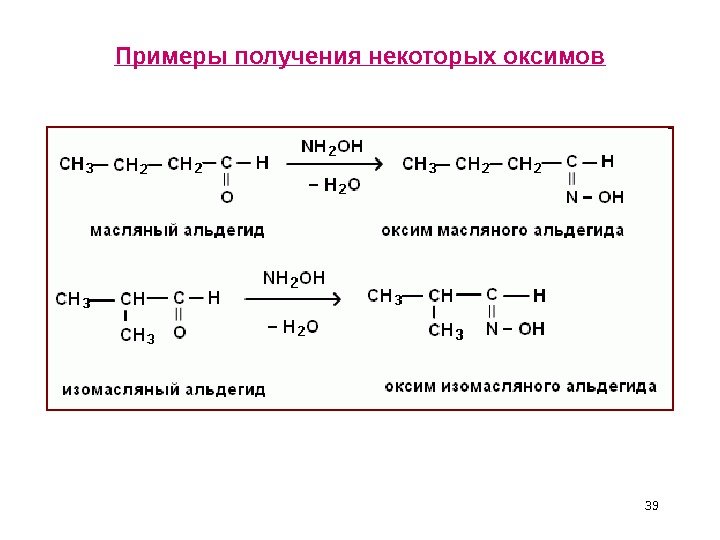
 Аналитические реакции иминов • Используя производные NH 3 и аминов, можно выделить А и К из реакционной смеси и идентифицировать их по температурам плавления. • Оксимы — продукты реакции А и К с гидроксиламином NH 2 OH , механизм реакции A N —
Аналитические реакции иминов • Используя производные NH 3 и аминов, можно выделить А и К из реакционной смеси и идентифицировать их по температурам плавления. • Оксимы — продукты реакции А и К с гидроксиламином NH 2 OH , механизм реакции A N —
 Примеры получения некоторых оксимов
Примеры получения некоторых оксимов
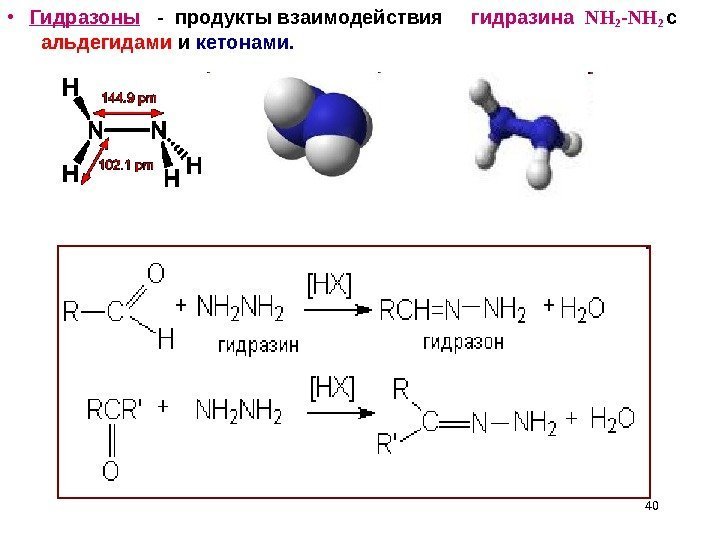
 • Гидразоны — продукты взаимодействия гидразина NH 2 -NH 2 с альдегидами и кетонами.
• Гидразоны — продукты взаимодействия гидразина NH 2 -NH 2 с альдегидами и кетонами.
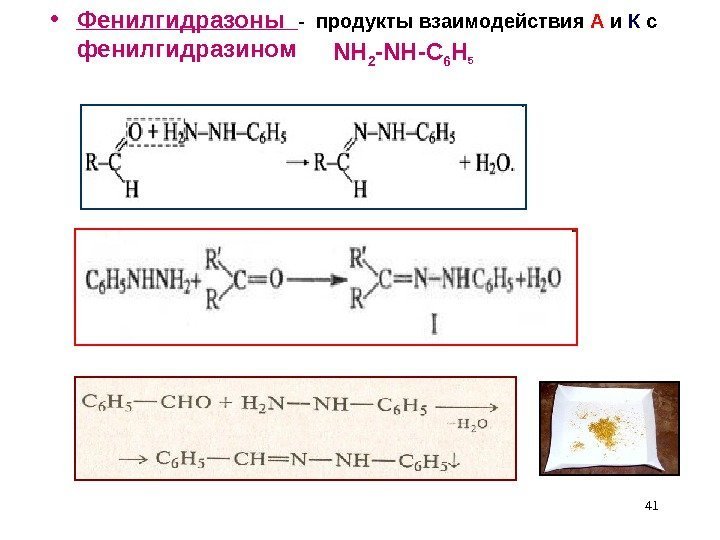
 • Фенилгидразоны — продукты взаимодействия А и К с фенилгидразином NH 2 -NH-C 6 H
• Фенилгидразоны — продукты взаимодействия А и К с фенилгидразином NH 2 -NH-C 6 H
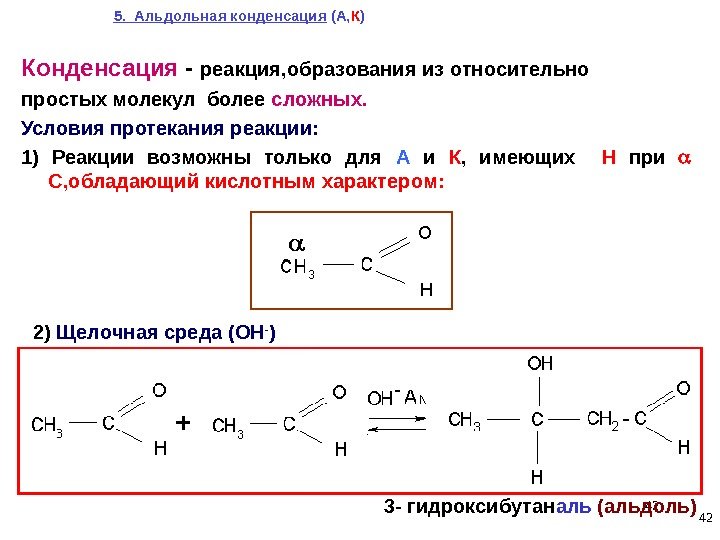
 42 5. Альдольная конденсация (А, К ) 3 — гидроксибутан аль (альдоль)2) Щелочная среда (ОН — )Конденсация — реакция, образования из относительно простых молекул более сложных. Условия протекания реакции: 1) Реакции возможны только для А и К , имеющих Н при С, обладающий кислотным характером:
42 5. Альдольная конденсация (А, К ) 3 — гидроксибутан аль (альдоль)2) Щелочная среда (ОН — )Конденсация — реакция, образования из относительно простых молекул более сложных. Условия протекания реакции: 1) Реакции возможны только для А и К , имеющих Н при С, обладающий кислотным характером:
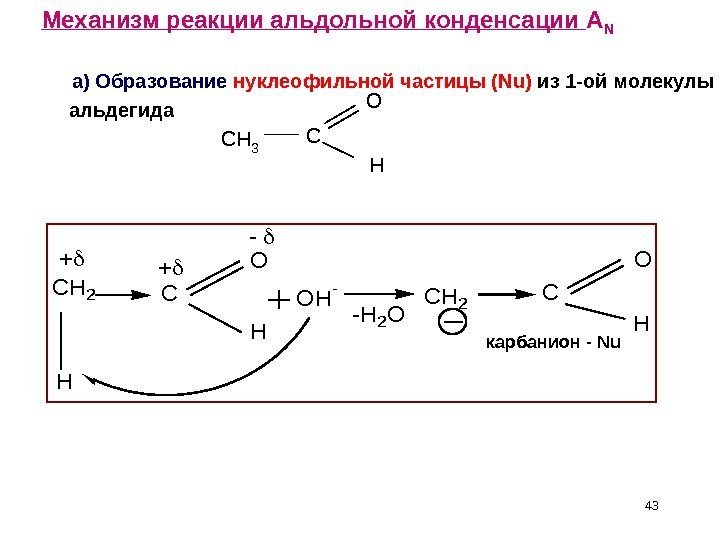
 43 C O H OH — -H 2 O CH 2 C O H H CH 2 Механизм реакции альдольной конденсации A N а) Образование нуклеофильной частицы ( Nu ) из 1 -ой молекулы альдегида CCH 3 O H карбанион — Nu
43 C O H OH — -H 2 O CH 2 C O H H CH 2 Механизм реакции альдольной конденсации A N а) Образование нуклеофильной частицы ( Nu ) из 1 -ой молекулы альдегида CCH 3 O H карбанион — Nu
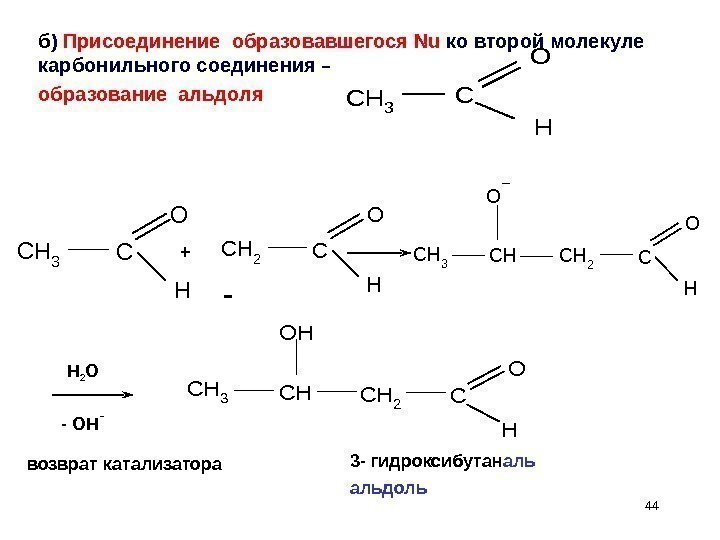
 44 CCH 3 O H CH 3 CHCH 2 C OH O Hб ) Присоединение образовавшегося Nu ко второй молекуле карбонильного соединения – образование альдоля C H 2 C O H CH 3 C H O CH 2 C O H CHCH 3 O H 2 O + возврат катализатора 3 — гидроксибутан альдоль- — OH —
44 CCH 3 O H CH 3 CHCH 2 C OH O Hб ) Присоединение образовавшегося Nu ко второй молекуле карбонильного соединения – образование альдоля C H 2 C O H CH 3 C H O CH 2 C O H CHCH 3 O H 2 O + возврат катализатора 3 — гидроксибутан альдоль- — OH —
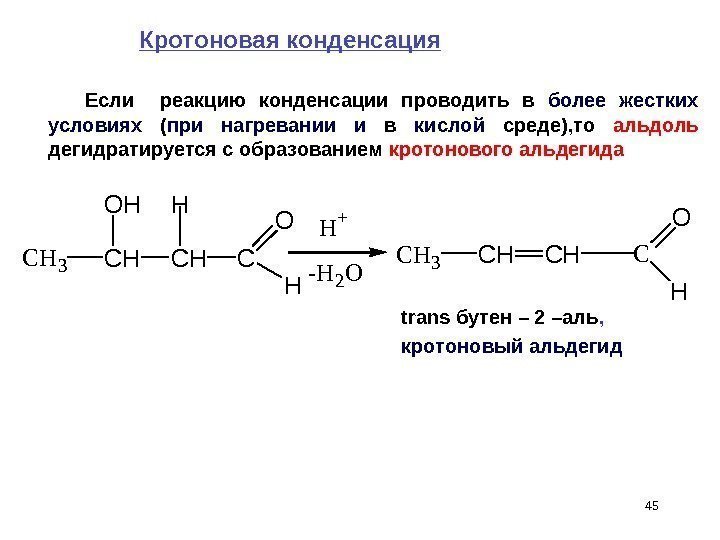
 45 Кротоновая конденсация Если реакцию конденсации проводить в более жестких условиях ( при нагревании и в кислой среде), то альдоль дегидратируется с образованием кротонового альдегида trans бутен – 2 –аль , кротоновый альдегид. CH 3 CH OH CH H C O H H + -H 2 O CH 3 CHCHC O H
45 Кротоновая конденсация Если реакцию конденсации проводить в более жестких условиях ( при нагревании и в кислой среде), то альдоль дегидратируется с образованием кротонового альдегида trans бутен – 2 –аль , кротоновый альдегид. CH 3 CH OH CH H C O H H + -H 2 O CH 3 CHCHC O H
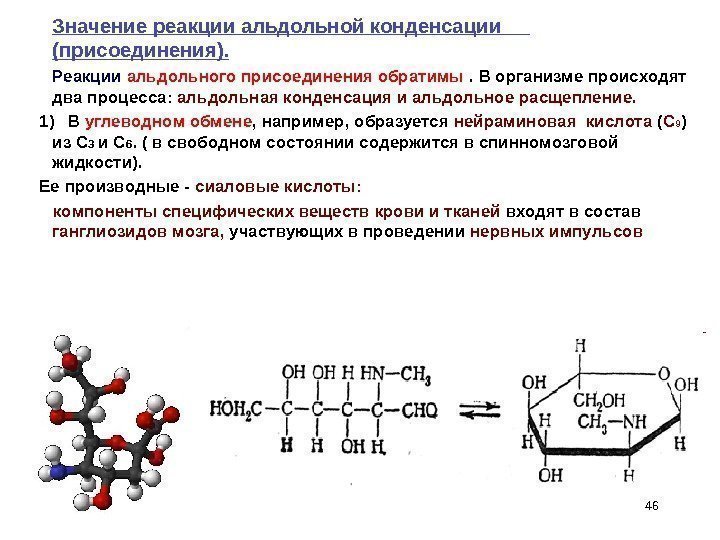
 46 Значение реакции альдольной конденсации (присоединения). Реакции альдольного присоединения обратимы . В организме происходят два процесса: альдольная конденсация и альдольное расщепление. 1) В углеводном обмене , например, образуется нейраминовая кислота ( С 9 ) из С 3 и С 6. ( в свободном состоянии содержится в спинномозговой жидкости). Ее производные — сиаловые кислоты: компоненты специфических веществ крови и тканей входят в состав ганглиозидов мозга, участвующих в проведении нервных импульсов
46 Значение реакции альдольной конденсации (присоединения). Реакции альдольного присоединения обратимы . В организме происходят два процесса: альдольная конденсация и альдольное расщепление. 1) В углеводном обмене , например, образуется нейраминовая кислота ( С 9 ) из С 3 и С 6. ( в свободном состоянии содержится в спинномозговой жидкости). Ее производные — сиаловые кислоты: компоненты специфических веществ крови и тканей входят в состав ганглиозидов мозга, участвующих в проведении нервных импульсов
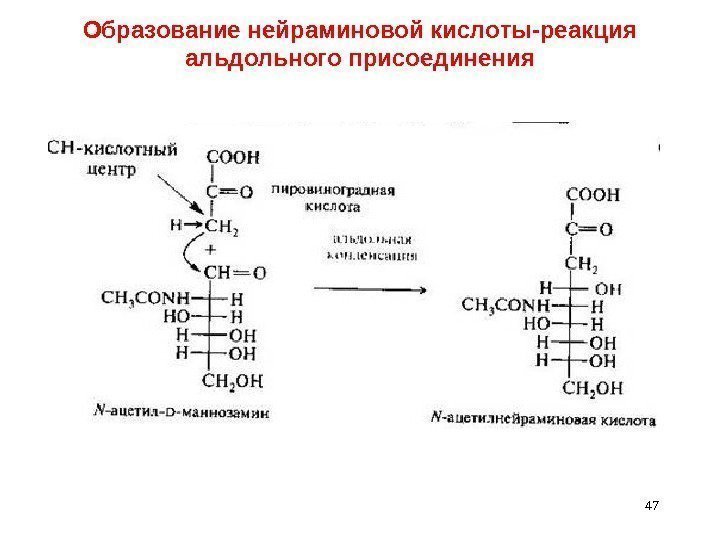
 Образование нейраминовой кислоты-реакция альдольного присоединения
Образование нейраминовой кислоты-реакция альдольного присоединения
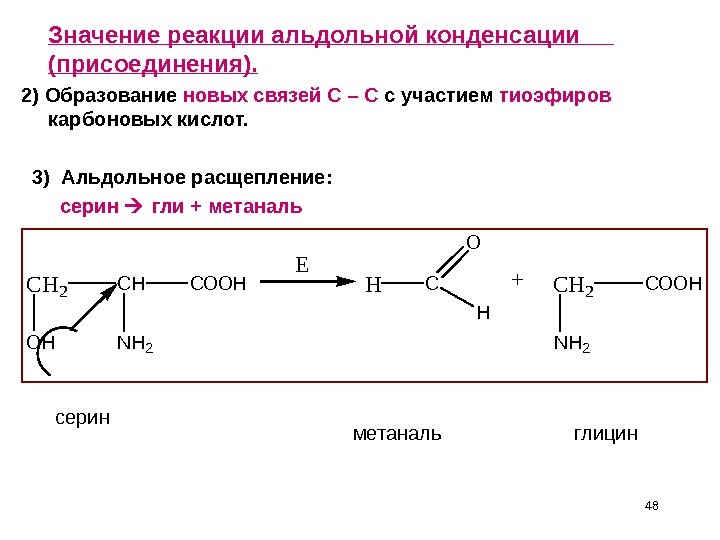
 48 Значение реакции альдольной конденсации (присоединения). 2) Образование новых связей С – С с участием тиоэфиров карбоновых кислот. 3) Альдольное расщепление: серин гли + метаналь CH 2 OH CH NH 2 COOH E HC O H +CH 2 NH 2 COOH 48 серин метаналь глицин
48 Значение реакции альдольной конденсации (присоединения). 2) Образование новых связей С – С с участием тиоэфиров карбоновых кислот. 3) Альдольное расщепление: серин гли + метаналь CH 2 OH CH NH 2 COOH E HC O H +CH 2 NH 2 COOH 48 серин метаналь глицин
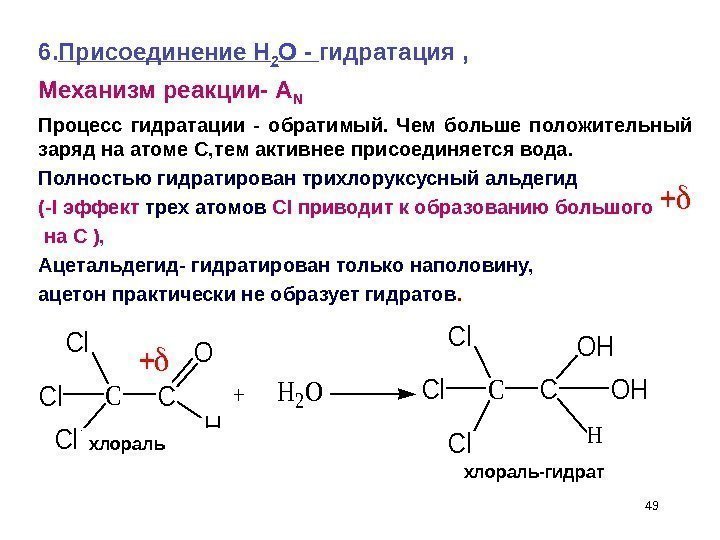
 496. Присоединение Н 2 О — гидратация , Механизм реакции- A N Процесс гидратации — обратимый. Чем больше положительный заряд на атоме С, тем активнее присоединяется вода. Полностью гидратирован трихлоруксусный альдегид (- I эффект трех атомов CI приводит к образованию большого на С ), Ацетальдегид- гидратирован только наполовину, ацетон практически не образует гидратов. C Cl Cl Cl C O H +H 2 OC Cl Cl Cl C OH OH H хлораль-гидрат
496. Присоединение Н 2 О — гидратация , Механизм реакции- A N Процесс гидратации — обратимый. Чем больше положительный заряд на атоме С, тем активнее присоединяется вода. Полностью гидратирован трихлоруксусный альдегид (- I эффект трех атомов CI приводит к образованию большого на С ), Ацетальдегид- гидратирован только наполовину, ацетон практически не образует гидратов. C Cl Cl Cl C O H +H 2 OC Cl Cl Cl C OH OH H хлораль-гидрат
 50 Хлоральгидрат применяется в медицине как успокаивающее и снотворное средство. В основе его фармакологического эффекта лежит наркотическое действие на организм альдегидной группы.
50 Хлоральгидрат применяется в медицине как успокаивающее и снотворное средство. В основе его фармакологического эффекта лежит наркотическое действие на организм альдегидной группы.
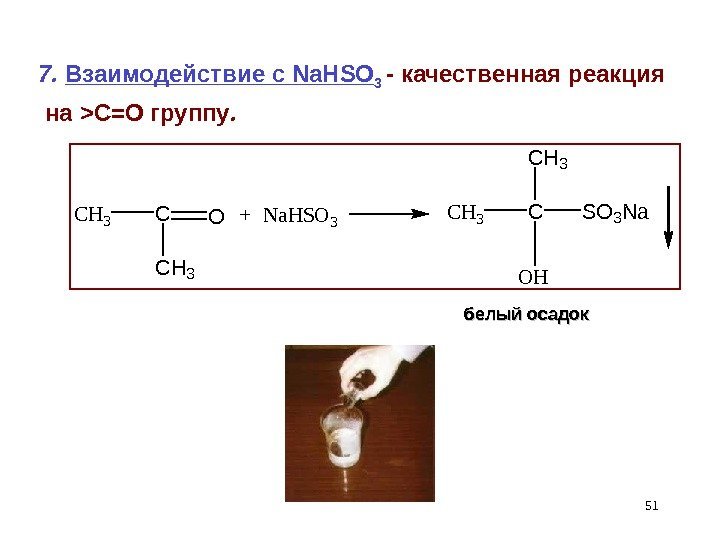
 517. Взаимодействие с Na. HSO 3 — качественная реакция на > С=О группу. CH 3 CO CH 3 +Na. HSO 3 CH 3 C CH 3 SO 3 Na OH белый осадок
517. Взаимодействие с Na. HSO 3 — качественная реакция на > С=О группу. CH 3 CO CH 3 +Na. HSO 3 CH 3 C CH 3 SO 3 Na OH белый осадок
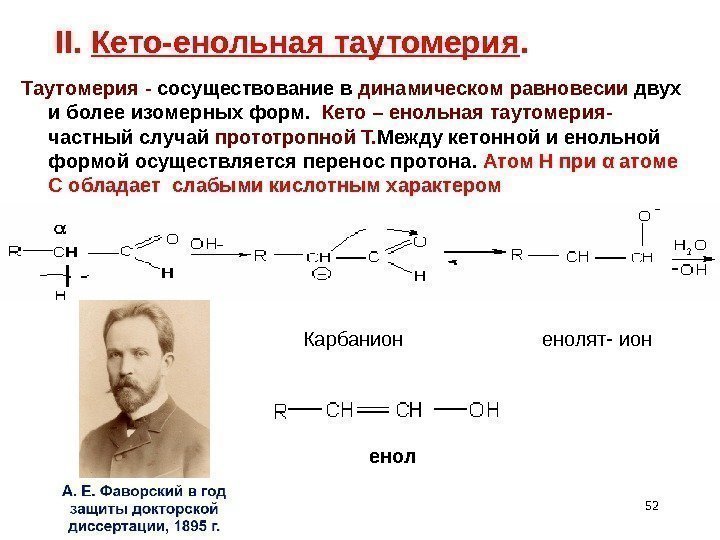
 52 II. Кето-енольная таутомерия. Таутомерия — сосуществование в динамическом равновесии двух и более изомерных форм. Кето – енольная таутомерия- частный случай прототропной Т. Между кетонной и енольной формой осуществляется перенос протона. Атом Н при α атоме С обладает слабыми кислотным характером Карбанион енолят- ион енол
52 II. Кето-енольная таутомерия. Таутомерия — сосуществование в динамическом равновесии двух и более изомерных форм. Кето – енольная таутомерия- частный случай прототропной Т. Между кетонной и енольной формой осуществляется перенос протона. Атом Н при α атоме С обладает слабыми кислотным характером Карбанион енолят- ион енол
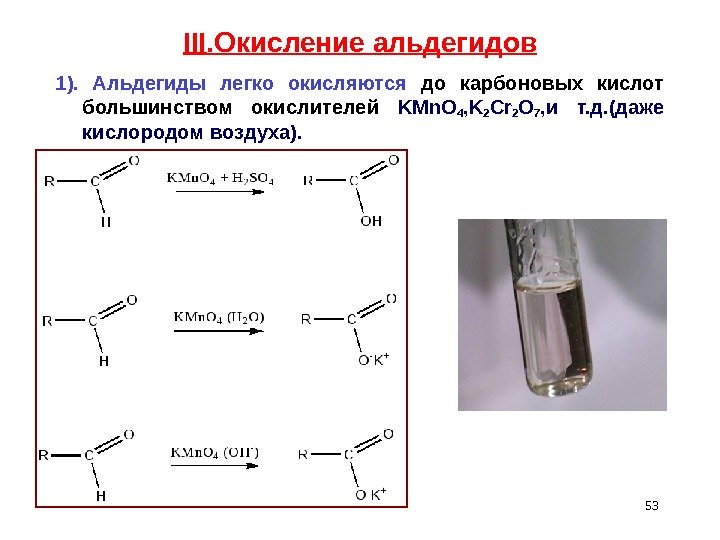
 III. Окисление альдегидов 1). Альдегиды легко окисляются до карбоновых кислот большинством окислителей KMn. O 4 , K 2 Cr 2 O 7 , и т. д. (даже кислородом воздуха).
III. Окисление альдегидов 1). Альдегиды легко окисляются до карбоновых кислот большинством окислителей KMn. O 4 , K 2 Cr 2 O 7 , и т. д. (даже кислородом воздуха).
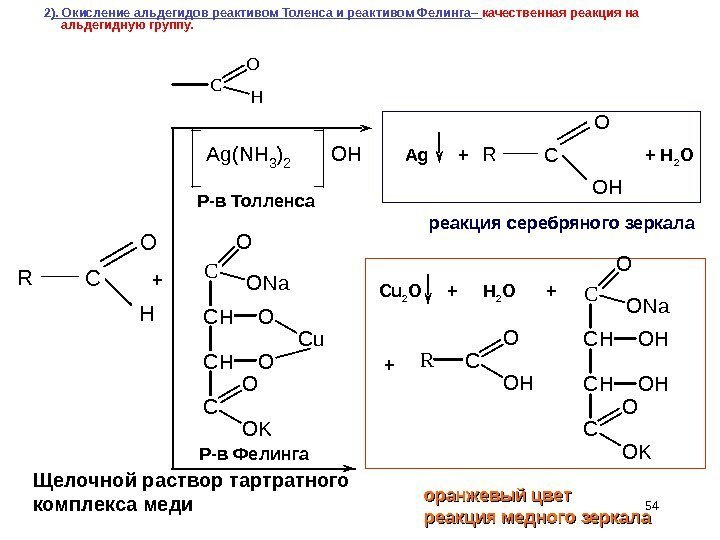
 542 ). Окисление альдегидов реактивом Толенса и реактивом Фелинга– качественная реакция на альдегидную группу. Ag(NH 3)2 OH Р-в Толленса Р-в Фелинга C O H R+ реакция серебряного зеркала оранжевый цвет реакция медного зеркала C O OH RAg + + H 2 O Cu 2 O + H 2 O + C O O N a C H O C u C O O K RC O OHC O H Щелочной раствор тартратного комплекса меди C O ONa CHOH C O OK +
542 ). Окисление альдегидов реактивом Толенса и реактивом Фелинга– качественная реакция на альдегидную группу. Ag(NH 3)2 OH Р-в Толленса Р-в Фелинга C O H R+ реакция серебряного зеркала оранжевый цвет реакция медного зеркала C O OH RAg + + H 2 O Cu 2 O + H 2 O + C O O N a C H O C u C O O K RC O OHC O H Щелочной раствор тартратного комплекса меди C O ONa CHOH C O OK +
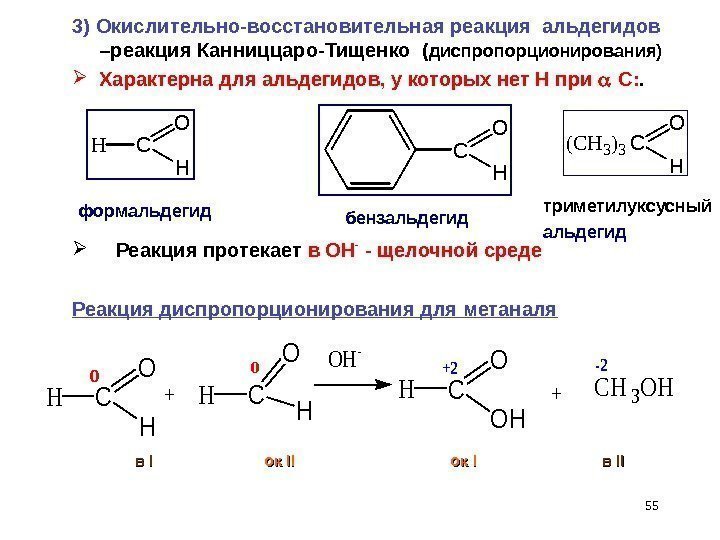
 55 вв I I ок ок IIII ок II в в IIII HC O H ( C H 3 ) 3 C O H HC O H o +HC O H o. OH — HC O OH +2 +CH 3 OH -2 Реакция протекает в ОН — — щелочной среде Реакция диспропорционирования для метаналя триметилуксусный альдегидбензальдегидформальдегид 3) Окислительно-восстановительная реакция альдегидов –реакция Канниццаро-Тищенко ( диспропорционирования) Характерна для альдегидов, у которых нет Н при С: .
55 вв I I ок ок IIII ок II в в IIII HC O H ( C H 3 ) 3 C O H HC O H o +HC O H o. OH — HC O OH +2 +CH 3 OH -2 Реакция протекает в ОН — — щелочной среде Реакция диспропорционирования для метаналя триметилуксусный альдегидбензальдегидформальдегид 3) Окислительно-восстановительная реакция альдегидов –реакция Канниццаро-Тищенко ( диспропорционирования) Характерна для альдегидов, у которых нет Н при С: .
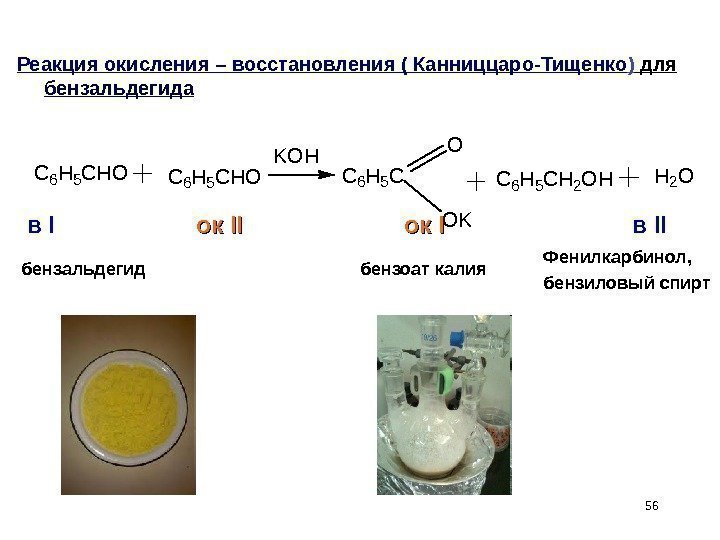
 56 Реакция окисления – восстановления ( Канниццаро-Тищенко ) для бензальдегида. C 6 H 5 CHO KOH C 6 H 5 C O OK C 6 H 5 CH 2 OHH 2 O бензальдегид Фенилкарбинол, бензиловый спиртбензоат калия в I ок ок IIII ок ок II в II
56 Реакция окисления – восстановления ( Канниццаро-Тищенко ) для бензальдегида. C 6 H 5 CHO KOH C 6 H 5 C O OK C 6 H 5 CH 2 OHH 2 O бензальдегид Фенилкарбинол, бензиловый спиртбензоат калия в I ок ок IIII ок ок II в II
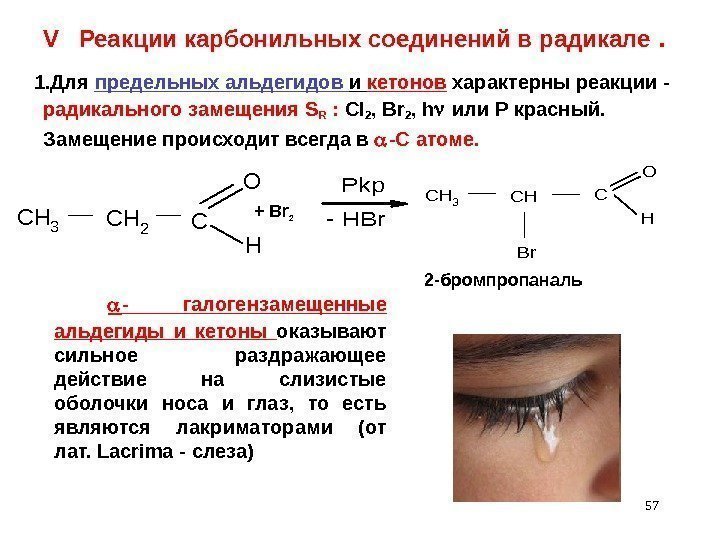
 57 V Реакции карбонильных соединений в радикале . 1. Для предельных альдегидов и кетонов характерны реакции — радикального замещения S R : Cl 2 , Br 2 , h или Р красный. Замещение происходит всегда в -С атоме. CH 3 CH 2 C O H — HBr Pkp. CH 3 CH Br C H O + Br 2 2 -бромпропаналь — галогензамещенные альдегиды и кетоны оказывают сильное раздражающее действие на слизистые оболочки носа и глаз, то есть являются лакриматорами (от лат. Lacrima — слеза)
57 V Реакции карбонильных соединений в радикале . 1. Для предельных альдегидов и кетонов характерны реакции — радикального замещения S R : Cl 2 , Br 2 , h или Р красный. Замещение происходит всегда в -С атоме. CH 3 CH 2 C O H — HBr Pkp. CH 3 CH Br C H O + Br 2 2 -бромпропаналь — галогензамещенные альдегиды и кетоны оказывают сильное раздражающее действие на слизистые оболочки носа и глаз, то есть являются лакриматорами (от лат. Lacrima — слеза)
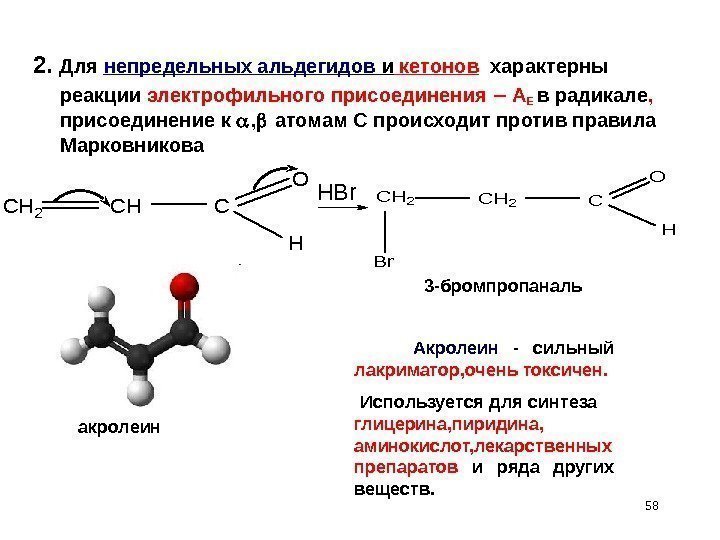
 582. Для непредельных альдегидов и кетонов характерны реакции электрофильного присоединения – A Е в радикале , присоединение к , атомам С происходит против правила Марковникова CH 2 CHC O H HBr. CH 2 Br C O H 3 -бромпропаналь акролеин Акролеин — сильный лакриматор, очень токсичен. Используется для синтеза глицерина, пиридина, аминокислот, лекарственных препаратов и ряда других веществ.
582. Для непредельных альдегидов и кетонов характерны реакции электрофильного присоединения – A Е в радикале , присоединение к , атомам С происходит против правила Марковникова CH 2 CHC O H HBr. CH 2 Br C O H 3 -бромпропаналь акролеин Акролеин — сильный лакриматор, очень токсичен. Используется для синтеза глицерина, пиридина, аминокислот, лекарственных препаратов и ряда других веществ.
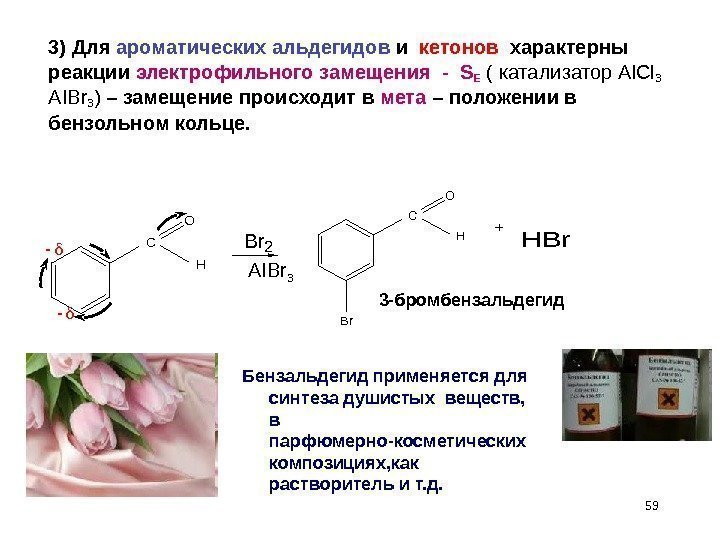
 593) Для ароматических альдегидов и кетонов характерны реакции электрофильного замещения — S Е ( катализатор Al. Cl 3 AIBr 3 ) – замещение происходит в мета – положении в бензольном кольце. C O HBr 2 C O H Br HBr 3 -бромбензальдегид Бензальдегид применяется для синтеза душистых веществ, в парфюмерно-косметических композициях, как растворитель и т. д. AIBr
593) Для ароматических альдегидов и кетонов характерны реакции электрофильного замещения — S Е ( катализатор Al. Cl 3 AIBr 3 ) – замещение происходит в мета – положении в бензольном кольце. C O HBr 2 C O H Br HBr 3 -бромбензальдегид Бензальдегид применяется для синтеза душистых веществ, в парфюмерно-косметических композициях, как растворитель и т. д. AIBr
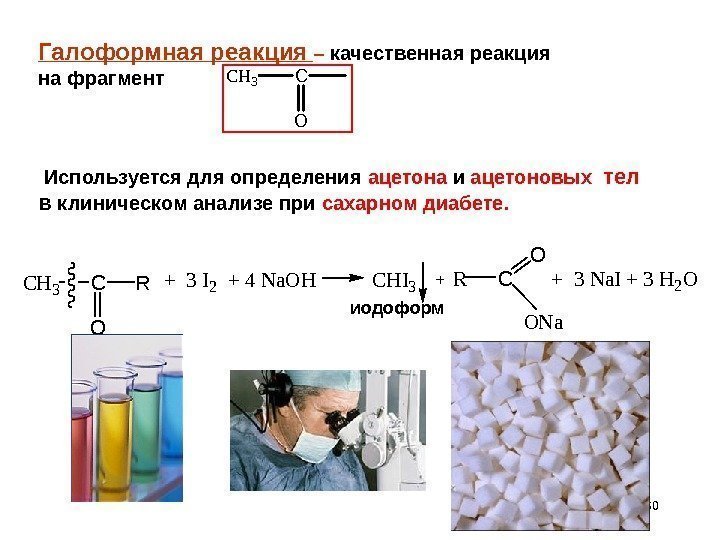
 60 Галоформная реакция – качественная реакция на фрагмент Используется для определения ацетона и ацетоновых тел в клиническом анализе при сахарном диабете. CH 3 C O R+ 3 I 2 + 4 Na. OHCHI 3+RC O ONa + 3 Na. I + 3 H 2 O иодоформ
60 Галоформная реакция – качественная реакция на фрагмент Используется для определения ацетона и ацетоновых тел в клиническом анализе при сахарном диабете. CH 3 C O R+ 3 I 2 + 4 Na. OHCHI 3+RC O ONa + 3 Na. I + 3 H 2 O иодоформ
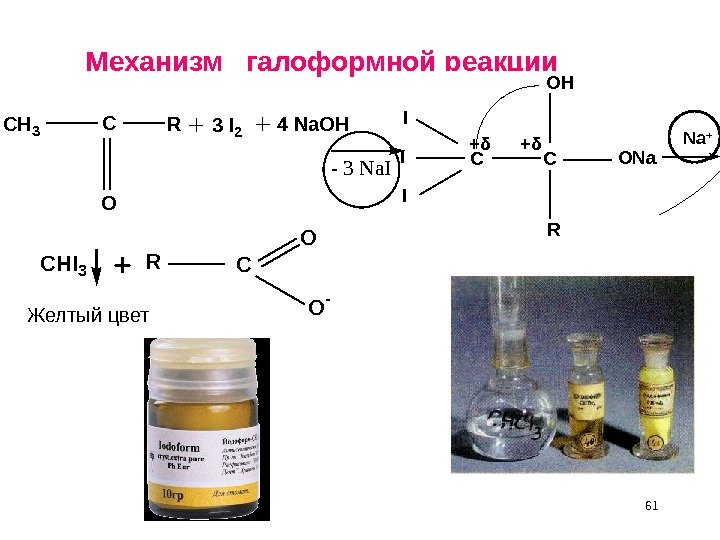
 61 Механизм галоформной реакции. CH 3 CR O 3 I 24 Na. OH I I I CC OH R ONa — 3 Na. I + δ+ δ Na + CHI 3 RC O O — Желтый цвет
61 Механизм галоформной реакции. CH 3 CR O 3 I 24 Na. OH I I I CC OH R ONa — 3 Na. I + δ+ δ Na + CHI 3 RC O O — Желтый цвет
 62 Биологическое значение.
62 Биологическое значение.
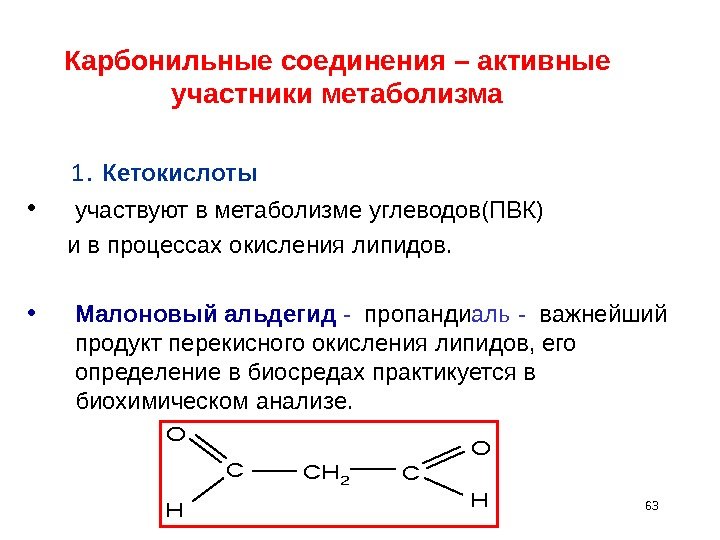
 63 Карбонильные соединения – активные участники метаболизма 1. Кетокислоты • участвуют в метаболизме углеводов(ПВК) и в процессах окисления липидов. • Малоновый альдегид — пропанди аль — важнейший продукт перекисного окисления липидов, его определение в биосредах практикуется в биохимическом анализе. C O H CH 2 C O H
63 Карбонильные соединения – активные участники метаболизма 1. Кетокислоты • участвуют в метаболизме углеводов(ПВК) и в процессах окисления липидов. • Малоновый альдегид — пропанди аль — важнейший продукт перекисного окисления липидов, его определение в биосредах практикуется в биохимическом анализе. C O H CH 2 C O H
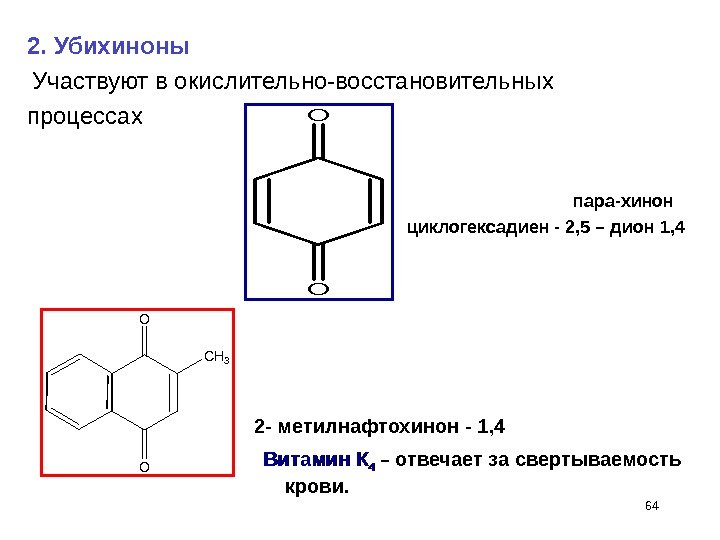
 642 — метилнафтохинон — 1, 4 O O C H 3 Витамин К 44 – отвечает за свертываемость крови. 2. Убихиноны Участвуют в окислительно-восстановительных процессах O O пара-хинон циклогексадиен — 2, 5 – дион 1,
642 — метилнафтохинон — 1, 4 O O C H 3 Витамин К 44 – отвечает за свертываемость крови. 2. Убихиноны Участвуют в окислительно-восстановительных процессах O O пара-хинон циклогексадиен — 2, 5 – дион 1,
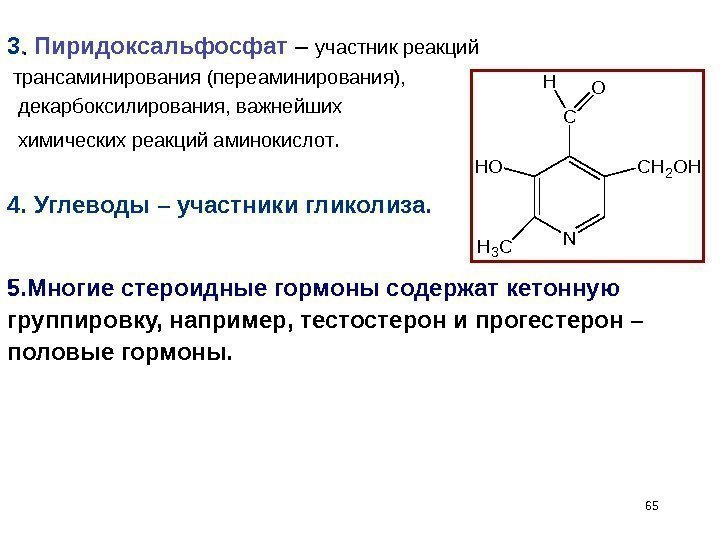
 653. . Пиридоксальфосфат – участник реакций трансаминирования (переаминирования), декарбоксилирования, важнейших химических реакций аминокислот. 4. Углеводы – участники гликолиза. 5. Многие стероидные гормоны содержат кетонную группировку, например, тестостерон и прогестерон – половые гормоны. N C H 2 O HH O H 3 C C OH
653. . Пиридоксальфосфат – участник реакций трансаминирования (переаминирования), декарбоксилирования, важнейших химических реакций аминокислот. 4. Углеводы – участники гликолиза. 5. Многие стероидные гормоны содержат кетонную группировку, например, тестостерон и прогестерон – половые гормоны. N C H 2 O HH O H 3 C C OH
 66 Карбонильные соединения как лекарственные средства ( некоторые примеры ) 1. Производные бутиферона обладают успокаивающим действием (нейролептики). C 6 H 5 COCH 2 CH 2 NR
66 Карбонильные соединения как лекарственные средства ( некоторые примеры ) 1. Производные бутиферона обладают успокаивающим действием (нейролептики). C 6 H 5 COCH 2 CH 2 NR
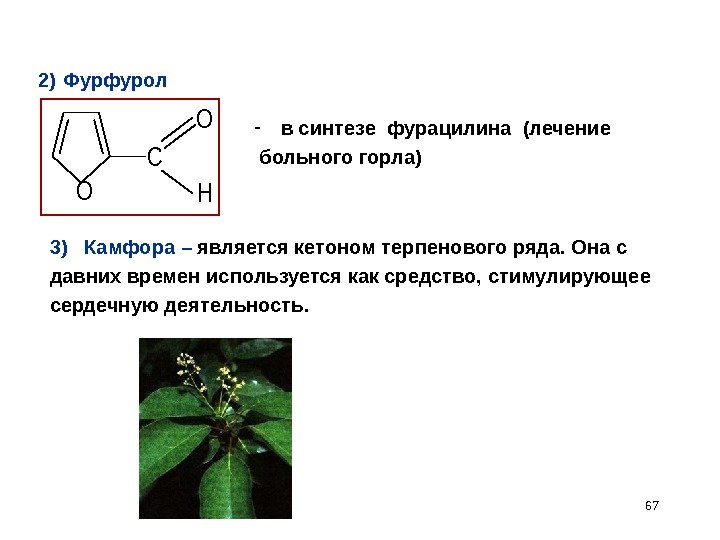
 672) Фурфурол O C O H — в синтезе фурацилина (лечение больного горла) 3) Камфора – является кетоном терпенового ряда. Она с давних времен используется как средство, стимулирующее сердечную деятельность.
672) Фурфурол O C O H — в синтезе фурацилина (лечение больного горла) 3) Камфора – является кетоном терпенового ряда. Она с давних времен используется как средство, стимулирующее сердечную деятельность.
 Масс-спектрометрия • Метод масс — спектрометрии основан на регистрации ионов , возникающих при ионизации нейтральных молекул 68 Масс-спектрометрия позволяет определять: 1. Молекулярную массу вещества. 2. Молекулярную формулу вещества. 3. Строение вещества. Масс-спектрометрия включает совокупность трёх отдельных процессов: 1. Ионизация молекулы. 2. Разделение ионов по массам. 3. Детектирование ионов.
Масс-спектрометрия • Метод масс — спектрометрии основан на регистрации ионов , возникающих при ионизации нейтральных молекул 68 Масс-спектрометрия позволяет определять: 1. Молекулярную массу вещества. 2. Молекулярную формулу вещества. 3. Строение вещества. Масс-спектрометрия включает совокупность трёх отдельных процессов: 1. Ионизация молекулы. 2. Разделение ионов по массам. 3. Детектирование ионов.
 Масс-спектрометрия Ионизация нейтральных молекул. Существует несколько способов ионизации молекул: электронный удар ( ЭУ), химическая ионизация, фотоионизация , э лектроспрей, м атричная лазерная десорбционная ионизация. Распространённым способом ионизации является электронный удар. Ионизация происходит при бомбардировке электронами с высокой энергией паров вещества при давлении 10 -5 – 10 -8 мм рт. ст. При соударении молекула вещества теряет электрон и образует возбуждённый катион –радикал, называемый молекулярным ионом.
Масс-спектрометрия Ионизация нейтральных молекул. Существует несколько способов ионизации молекул: электронный удар ( ЭУ), химическая ионизация, фотоионизация , э лектроспрей, м атричная лазерная десорбционная ионизация. Распространённым способом ионизации является электронный удар. Ионизация происходит при бомбардировке электронами с высокой энергией паров вещества при давлении 10 -5 – 10 -8 мм рт. ст. При соударении молекула вещества теряет электрон и образует возбуждённый катион –радикал, называемый молекулярным ионом.
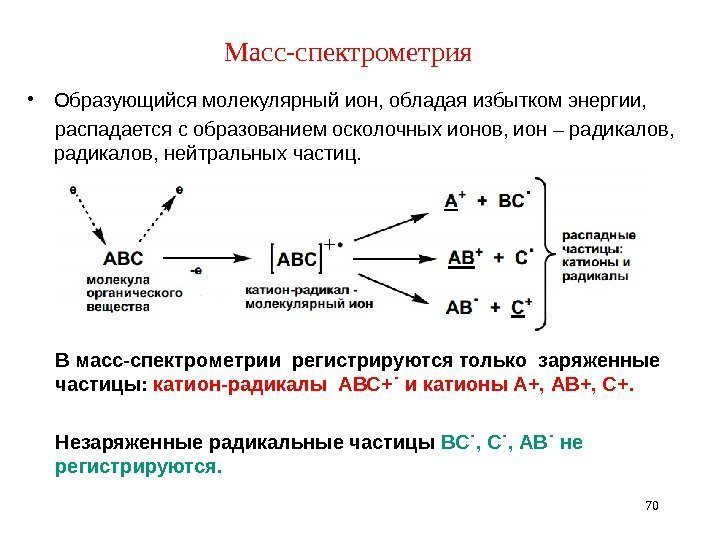
 Масс-спектрометрия • Образующийся молекулярный ион, обладая избытком энергии, распадается с образованием осколочных ионов, ион – радикалов, нейтральных частиц. 70 В масс-спектрометрии регистрируются только заряженные частицы: катион-радикалы АВС+˙ и катионы А+, АВ+, С+. Незаряженные радикальные частицы ВС˙, АВ˙ не регистрируются.
Масс-спектрометрия • Образующийся молекулярный ион, обладая избытком энергии, распадается с образованием осколочных ионов, ион – радикалов, нейтральных частиц. 70 В масс-спектрометрии регистрируются только заряженные частицы: катион-радикалы АВС+˙ и катионы А+, АВ+, С+. Незаряженные радикальные частицы ВС˙, АВ˙ не регистрируются.
 Масс-спектрометрия Разделение ионов. • Разделение ионов основано на различии в траекториях их движения в магнитном и (или ) электростатическом полях. • Положительно заряженные ионы разделяются в зависимости от отношения массы к заряду ( m/z ), детектируются и регистрируются. 71 Для разделения ионов в соответствии с отношение ми m/z используют устройство, называемое масс- анализатором. Существует более 10 типов динамических анализаторов. Основные типы масс- анализаторов: Магнитные Квадрупольные Времяпролётные «Ионная ловушка»
Масс-спектрометрия Разделение ионов. • Разделение ионов основано на различии в траекториях их движения в магнитном и (или ) электростатическом полях. • Положительно заряженные ионы разделяются в зависимости от отношения массы к заряду ( m/z ), детектируются и регистрируются. 71 Для разделения ионов в соответствии с отношение ми m/z используют устройство, называемое масс- анализатором. Существует более 10 типов динамических анализаторов. Основные типы масс- анализаторов: Магнитные Квадрупольные Времяпролётные «Ионная ловушка»
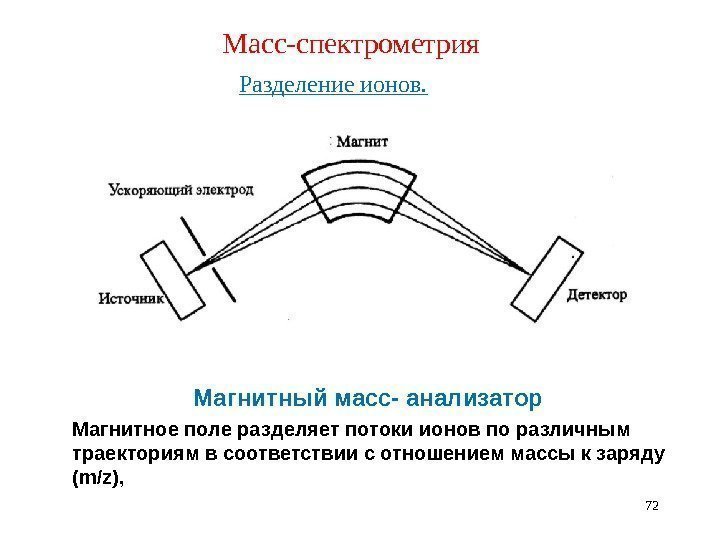
 Масс-спектрометрия Разделение ионов. 72 Магнитный масс- анализатор Магнитное поле разделяет потоки ионов по различным траекториям в соответствии с отношением массы к заряду ( m/z ),
Масс-спектрометрия Разделение ионов. 72 Магнитный масс- анализатор Магнитное поле разделяет потоки ионов по различным траекториям в соответствии с отношением массы к заряду ( m/z ),
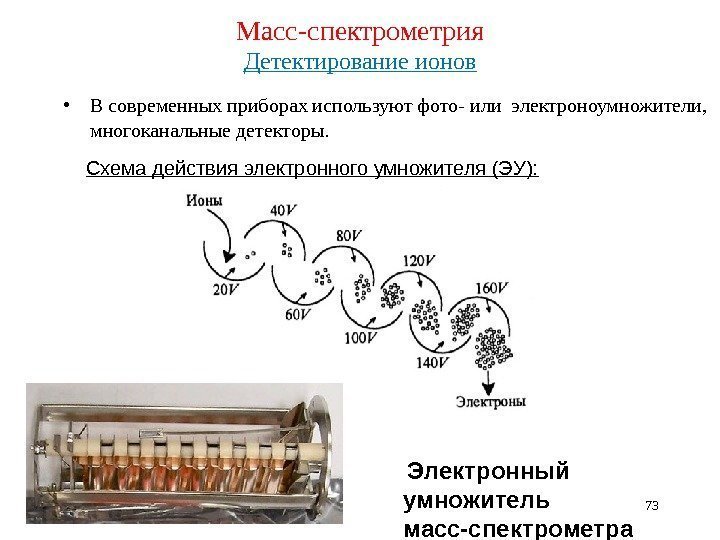
 Масс-спектрометрия Детектирование ионов • В современных приборах используют фото- или электроноумножители, многоканальные детекторы. 73 Схема действия электронного умножителя (ЭУ): Электронный умножитель масс-спектрометра Thermo Electron DFS :
Масс-спектрометрия Детектирование ионов • В современных приборах используют фото- или электроноумножители, многоканальные детекторы. 73 Схема действия электронного умножителя (ЭУ): Электронный умножитель масс-спектрометра Thermo Electron DFS :
 Масс-спектрометрия • Масс- спектры представляют в виде таблицы или графика. При графическом изображении на оси абсцисс приводят значения m/z , совпадающие с массой иона , так как в основном они однозарядны. На оси ординат- относительную интенсивность. (Интенсивность максимального пика принимают за 100%). • Полные масс-спектры могут использоваться как «отпечатки пальцев » соединений. Масс- спектр любого соединения индивидуален и с его помощью можно идентифицировать вещество, если известен его масс-спектр.
Масс-спектрометрия • Масс- спектры представляют в виде таблицы или графика. При графическом изображении на оси абсцисс приводят значения m/z , совпадающие с массой иона , так как в основном они однозарядны. На оси ординат- относительную интенсивность. (Интенсивность максимального пика принимают за 100%). • Полные масс-спектры могут использоваться как «отпечатки пальцев » соединений. Масс- спектр любого соединения индивидуален и с его помощью можно идентифицировать вещество, если известен его масс-спектр.
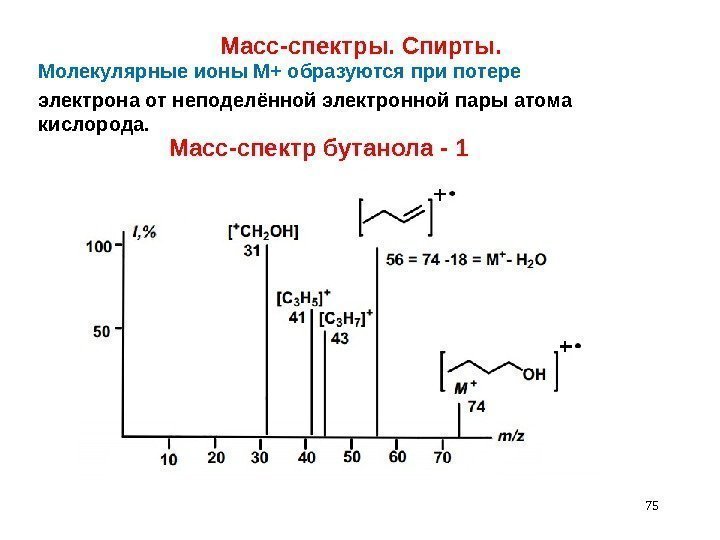
 Молекулярные ионы М+ образуются при потере электрона от неподелённой электронной пары атома кислорода. 75 Масс-спектры. Спирты. Масс-спектр бутанола —
Молекулярные ионы М+ образуются при потере электрона от неподелённой электронной пары атома кислорода. 75 Масс-спектры. Спирты. Масс-спектр бутанола —
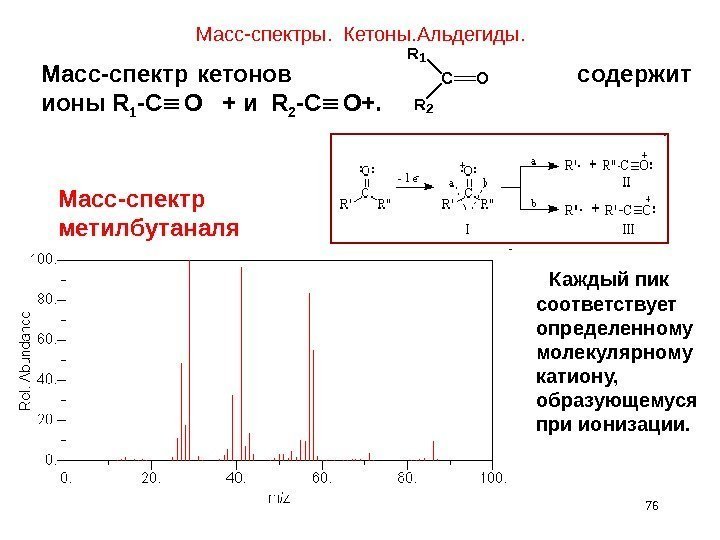
 Масс-спектры. Кетоны. Альдегиды. 76 Масс-спектр кетонов содержит ионы R 1 -C O + и R 2 -C O+. R 1 C R 2 O Масс-спектр метилбутаналя Каждый пик соответствует определенному молекулярному катиону, образующемуся при ионизации.
Масс-спектры. Кетоны. Альдегиды. 76 Масс-спектр кетонов содержит ионы R 1 -C O + и R 2 -C O+. R 1 C R 2 O Масс-спектр метилбутаналя Каждый пик соответствует определенному молекулярному катиону, образующемуся при ионизации.
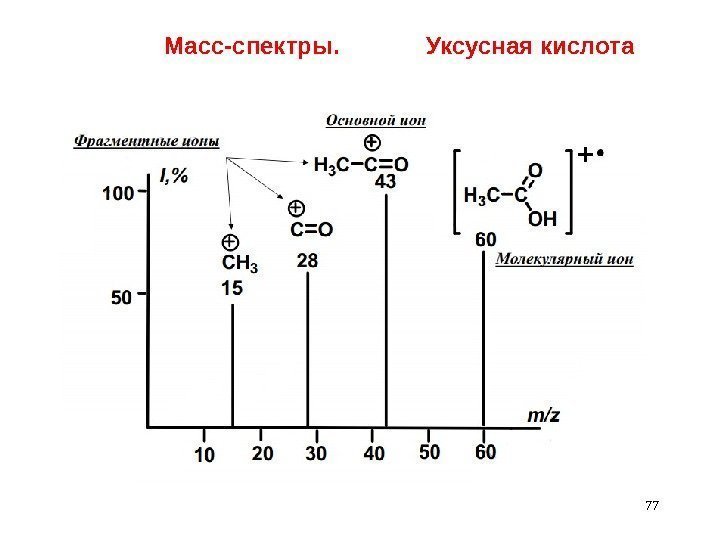
 77 Масс-спектры. Уксусная кислота
77 Масс-спектры. Уксусная кислота
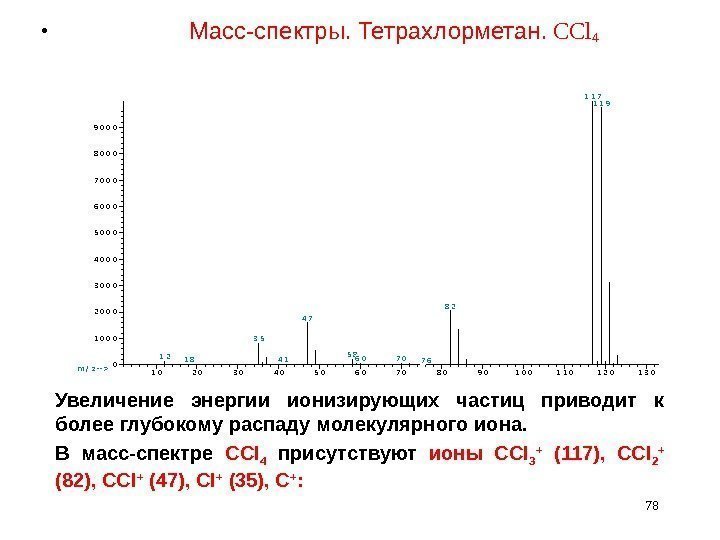
 • Масс-спектры. Тетрахлорметан. CCl 4 78 1 02 03 04 05 06 07 08 09 01 0 01 1 01 2 01 3 00 1 0 0 0 2 0 0 0 3 0 0 0 4 0 0 0 5 0 0 0 6 0 0 0 7 0 0 0 8 0 0 0 9 0 0 0 m / z — — > A b u n d a n c e# 2 4 3 8 4 1 : C a rb o n T e t ra c h lo rid e $ $ M e t h a n e , te t ra c h lo ro — $ $ B e ( * ) 1 21 8 3 5 4 1 4 7 5 86 07 07 6 8 2 1 1 71 1 9 Увеличение энергии ионизирующих частиц приводит к более глубокому распаду молекулярного иона. В масс-спектре CCl 4 присутствуют ионы CCl 3 + (117), CCl 2 + (82), CCl + (47), Cl + (35), C + :
• Масс-спектры. Тетрахлорметан. CCl 4 78 1 02 03 04 05 06 07 08 09 01 0 01 1 01 2 01 3 00 1 0 0 0 2 0 0 0 3 0 0 0 4 0 0 0 5 0 0 0 6 0 0 0 7 0 0 0 8 0 0 0 9 0 0 0 m / z — — > A b u n d a n c e# 2 4 3 8 4 1 : C a rb o n T e t ra c h lo rid e $ $ M e t h a n e , te t ra c h lo ro — $ $ B e ( * ) 1 21 8 3 5 4 1 4 7 5 86 07 07 6 8 2 1 1 71 1 9 Увеличение энергии ионизирующих частиц приводит к более глубокому распаду молекулярного иона. В масс-спектре CCl 4 присутствуют ионы CCl 3 + (117), CCl 2 + (82), CCl + (47), Cl + (35), C + :
 Области применения масс-спектрометрии 1. Установление строения соединений. 2. Определение молекулярной массы и молекулярной формулы органи-ческих соединений. 3. Химический анализ вещества 4. Элементный анализ неорганических веществ (одновременно определяются до 70 элементов). 5. Кинетические исследования: • Определение механизмов химических процессов (в том числе по изотопным меткам). • Определение констант скоростей химических процессов. • Определение порядка и молекулярности реакции. 6. Термодинамические исследования: • Определение потенциалов ионизации молекул и появления ионов. • Определение парциального давления паров вещества. • Определение теплоты сублимации. • Определение константы равновесия химической реакции и теплоты химической реакции. • Ион-молекулярные равновесия.
Области применения масс-спектрометрии 1. Установление строения соединений. 2. Определение молекулярной массы и молекулярной формулы органи-ческих соединений. 3. Химический анализ вещества 4. Элементный анализ неорганических веществ (одновременно определяются до 70 элементов). 5. Кинетические исследования: • Определение механизмов химических процессов (в том числе по изотопным меткам). • Определение констант скоростей химических процессов. • Определение порядка и молекулярности реакции. 6. Термодинамические исследования: • Определение потенциалов ионизации молекул и появления ионов. • Определение парциального давления паров вещества. • Определение теплоты сублимации. • Определение константы равновесия химической реакции и теплоты химической реакции. • Ион-молекулярные равновесия.
 Применение масс-спектрометрии в медицине • 1. Разработка новых лекарственных средств для спасения человека от ранее неизлечимых болезней . • 2. Кон троль производства лекарств, • 3. Г енная инженерия и биохимия, протеомика. • 4. К онтроль над незаконным распространением наркотических и психотропных средств, • 5. К риминалистический и клинический анализ токсичных препаратов, анализ взрывчатых веществ.
Применение масс-спектрометрии в медицине • 1. Разработка новых лекарственных средств для спасения человека от ранее неизлечимых болезней . • 2. Кон троль производства лекарств, • 3. Г енная инженерия и биохимия, протеомика. • 4. К онтроль над незаконным распространением наркотических и психотропных средств, • 5. К риминалистический и клинический анализ токсичных препаратов, анализ взрывчатых веществ.
 ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ • В настоящее время для идентификации и структурного исследования лекарственных веществ и их метаболитов применяют масс-спектрометры, представляющие собой комбинацию хроматографа и масс-спектрометра
ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ • В настоящее время для идентификации и структурного исследования лекарственных веществ и их метаболитов применяют масс-спектрометры, представляющие собой комбинацию хроматографа и масс-спектрометра
 ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 82 ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ — метод анализа смесей органических веществ (главным образом) и определения следовых количеств веществ в объеме жидкости. Метод основан на комбинации двух самостоятельных методов — хроматографии и масс-спектрометрии. С помощью первого осуществляют разделение смеси на компоненты, с помощью второго — идентификацию и определение строения вещества, количественный анализ. Газовый хромато-масс-спектрометр – GCMS-QP 2010 Ultra
ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 82 ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ — метод анализа смесей органических веществ (главным образом) и определения следовых количеств веществ в объеме жидкости. Метод основан на комбинации двух самостоятельных методов — хроматографии и масс-спектрометрии. С помощью первого осуществляют разделение смеси на компоненты, с помощью второго — идентификацию и определение строения вещества, количественный анализ. Газовый хромато-масс-спектрометр – GCMS-QP 2010 Ultra
 ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 83 Хромато-масс-спектрометр (другими словами — хромас), представляет собой комбинацию газового хроматографа и масс-спектрометра Область применения хромаса – химический и структурный анализ веществ и соединений • в органической химии, • медицине, • судебно-медицинской экспертизе, криминалистике, токсикологии,
ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 83 Хромато-масс-спектрометр (другими словами — хромас), представляет собой комбинацию газового хроматографа и масс-спектрометра Область применения хромаса – химический и структурный анализ веществ и соединений • в органической химии, • медицине, • судебно-медицинской экспертизе, криминалистике, токсикологии,
 Применение масс-спектрометрии • В настоящее время для идентификации и структурного исследования лекарственных веществ и их метаболитов применяют масс-спектрометры, представляющие собой комбинацию хроматографа и масс-спектрометра
Применение масс-спектрометрии • В настоящее время для идентификации и структурного исследования лекарственных веществ и их метаболитов применяют масс-спектрометры, представляющие собой комбинацию хроматографа и масс-спектрометра
 ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 85 • при производстве и контроле качества различных видов пищевой, парфюмерной, фармацевтической, промышленной и сельскохозяйственной продукции, • при наркотическом и экологическом контроле, • также в учебных, научно-исследовательских учреждениях и центрах санэпиднадзора Министерства Здравоохранения РФ. Область применения хромаса –
ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 85 • при производстве и контроле качества различных видов пищевой, парфюмерной, фармацевтической, промышленной и сельскохозяйственной продукции, • при наркотическом и экологическом контроле, • также в учебных, научно-исследовательских учреждениях и центрах санэпиднадзора Министерства Здравоохранения РФ. Область применения хромаса –
 86 СПАСИБО ЗА ВНИМАНИЕ!
86 СПАСИБО ЗА ВНИМАНИЕ!

